|
© Borgis - Postępy Nauk Medycznych 7-8, s. 315-321
*Jolanta Woźniak1, Agnieszka Krzywdzińska1, Anna Ejduk2, Grażyna Pałynyczko3
Wykrywanie choroby resztkowej w ostrej białaczce limfoblastycznej dorosłych metodą cytometrii przepływowej tzw. „pustych pól”*
Detection of minimal residual disease in adult acute lymphoblastic leukemia by flow cytometry method so-called ´empty spaces´
1Zakład Cytobiologii Hematologicznej Instytutu Hematologii i Transfuzjologii w Warszawie
Kierownik Zakładu: prof. dr hab. n. med. Joanna Kopeć-Szlęzak 2Klinika Hematologii Instytutu Hematologii i Transfuzjologii w Warszawie Kierownik Kliniki: prof. dr hab. n. med. Krzysztof Warzocha 3Klinika Chorób Wewnętrznych i Hematologii Instytutu Hematologii i Transfuzjologii w Warszawie Kierownik Kliniki: prof. dr hab. n. med. Lech Konopka Streszczenie
Wstęp i cel pracy. W niniejszej pracy przedstawiono wyniki zastosowania cytometrycznej metody tzw. „pustych pól” (empty spaces-ES) w rozpoznawaniu oraz monitorowaniu choroby resztkowej u dorosłych pacjentów z ostrą białaczką limfoblastyczną B. Materiał i metody. Materiał do badań stanowiły aspiraty szpików 5 zdrowych dawców oraz 20 pacjentów z OBL-B. Komórki identyfikowano poprzez barwienie trójkolorowymi zestawami przeciwciał: CD10/CD20/CD19, CD34/CD22/CD19, CD34/CD38/CD19, CD45/CD34/CD19, TdT/CD10/CD19. W wykrywaniu choroby resztkowej wykorzystywano różnice w intensywności ekspresji powyższych antygenów pomiędzy komórkami prawidłowymi i białaczkowymi, które powodowały lokowanie się blastów w „pustych polach” na wykresach cytometrycznych dot plot. Dodatkowo blasty CD19+ charakteryzowano poprzez określenie na nich poziomu ekspresji antygenów mieloidalnych: CD13, CD15, CD33, CD65, CD66 oraz nadekspresji CD58. Wyniki. Zastosowana metoda pozwoliła na określenie nietypowych immunofenotypów blastów u 90% chorych z OBL-B. Przy użyciu poszczególnych złożeń przeciwciał aberrantne fenotypy wykrywano z następującą częstością: TdT/CD10/CD19 – 61%, CD10/CD20/CD19 – 60%, CD45/CD34/CD19 – 40%, CD34/CD38/CD19 – 35%, CD34/CD22/CD19 – 25%. Antygeny mieloidalne pojawiły się na blastach 55% badanych chorych, były to głównie CD66, CD13 i CD33. Z podobną częstością wykryto nadekspresję CD58 (47%). U 6 z 17 badanych pacjentów wykryto chorobę resztkową, która u czterech poprzedziła wznowę choroby. Wnioski. Wyniki naszych badań wskazują, iż cytometryczna metoda „pustych pól” może być z powodzeniem zastosowana do większości przypadków OBL-B i jest wiarygodnym narzędziem w ocenie choroby resztkowej u pacjentów z OBL-B. Słowa kluczowe: ostra białaczka limfoblastyczna, choroba resztkowa, metoda pustych pól
Summary
Introduction. This study presents the effects of using the so-called ´empty spaces´ for the detection of tumor cells at diagnosis and in monitoring minimal residual disease (MRD) in adult patients with acute B-cell lymphoblastic leukemia. Material and methods. Bone marrow samples from 5 healthy donors and 20 patients with B-ALL were investigated. Populations of B-cell precursors and leukemic blasts were identified by triple-staining panel of antibodies: CD10/CD20/CD19, CD34/CD22/CD19, CD34/CD38/CD19, CD45/CD34/CD19 and TdT/CD10/CD19. In the detection of MRD we took advantage of the differences in intensity of antigen expression on blasts and on normal B-cell precursors, responsible for localization in ´empty spaces´ on cytometric dot plots. Additional stainings were performed to investigate the expression myeloid markers: CD13, CD15, CD33, CD65, CD66. Overexpression of CD58 on CD19+ blasts was also investigated. Results. This method allowed to identify aberrant phenotypes in 90% of tested cases. Frequencies of phenotypic aberration detected with antibody combinations were: 61% for TdT/CD10/CD19, 60% for CD10/CD20/CD19, 40% for CD45/CD34/CD19, 35% for CD34/CD38/CD19 and 25% for CD34/CD22/CD19. The myeloid antigen expression on blasts was detected in 55% of cases; mainly the coexpression of CD66, CD13 and CD33. The CD58 marker was overexpressed in 47% patients. MRD was detected in 6 out of 17 patients. Relapses occurred in 4. Conclusion. Our study shows that flow cytometric method is applicable to most of ALL cases and is a reliable tool in monitoring MRD in B-ALL patients. Key words: acute lymphoblastic leukemia, minimal residual disease, empty spaces
WSTĘP
Wykrywanie choroby resztkowej (MRD), z klinicznego punktu widzenia, jest jednym z najważniejszych wskaźników prognostycznych w ocenie przebiegu leczenia i ryzyka nawrotu choroby w ostrych białaczkach. Monitorowanie choroby resztkowej u pacjentów z ostrą białaczką limfoblastyczną (OBL), zwłaszcza w początkowym etapie terapii indukującym remisję, jest szczególnie użyteczne w ocenie odpowiedzi na leczenie. Utrzymywanie się populacji komórek białaczkowych w szpiku, może decydować o ewentualnym zmodyfikowaniu terapii, a regularne kontrole szpiku pacjentów, pozwalają na wcześniejsze wykrycie wznowy choroby (1, 2). Udowodniono również istotne znaczenie nasilenia choroby resztkowej, zarówno u pacjentów przygotowywanych do, jak i po allogenicznym przeszczepie szpiku, jako istotnego czynnika wpływającego na wynik transplantacji (3, 4). Obecnie najbardziej swoistymi i najczulszymi metodami w ocenie MRD są techniki molekularne – ilościowa analiza real-time PCR (RQ-PCR) transkryptów genów fuzyjnych i rearanżacji genów immunoglobulin i/lub receptorów komórek T, oraz wykrywanie specyficznego immunofenotypu komórek rozrostowych metodą wieloparametrowej cytometrii przepływowej. Użyteczność tych technik, zwłaszcza w odniesieniu do badania choroby resztkowej u dzieci z OBL, była wielokrotnie opisywana w literaturze (5-7).
Cytometria przepływowa w związku z intensywnym rozwojem w ostatnich latach, stała się doskonałym narzędziem w diagnostyce i monitorowaniu przebiegu terapii w schorzeniach układu krwiotwórczego. Technika ta umożliwia opis populacji komórek na podstawie ich wielkości, ziarnistości, odsetka komórek wykazujących ekspresję powierzchniowych lub cytoplazmatycznych determinant oraz określenie poziomu ich ekspresji, na podstawie intensywności fluorescencji (8). Metodą cytometrii przepływowej można wykryć resztkowe komórki blastyczne u pacjentów, którzy pod względem morfologicznych kryteriów (<5% blastów w szpiku), wydają się być w remisji całkowitej. Na podstawie immunofenotypu ustalonego podczas rozpoznania metodą tą można rozróżnić 1 komórkę blastyczną wśród 103-104 komórkach jądrzastych szpiku (9).
Ostre białaczki limfoblastyczne B charakteryzują się występowaniem w szpiku i krwi chorego komórek z linii B, których rozwój zatrzymany został na wczesnym etapie dojrzewania. Jest to ekspansja klonu komórek i nagromadzenie się prekursorów limfocytów, które utraciły zdolność dalszego różnicowania, o fenotypie charakterystycznym dla komórek młodych, z możliwością ekspresji antygenów z innych linii różnicowania. Jednak w części przypadków OBL, zwłaszcza z prekursorowych komórek B, komórki blastyczne nie wykazują ekspresji dodatkowych antygenów nieliniowych takich jak np. markery mieloidalne, a ich immunofenotyp, pod względem jakościowym, często jest bardzo zbliżony do prawidłowych hematopoetycznych komórek progenitorowych. Limfoblasty białaczkowe, pod względem immunofenotypowym, zwłaszcza w ekspresji CD34, CD10 i TdT, przypominają prawidłowe prekursory komórek B (10, 11). Stanowi to poważną przeszkodę w oszacowaniu MRD po chemioterapii, czy we wczesnej fazie regeneracji szpiku po przeszczepie, kiedy to następuje często ekspansja prawidłowych prekursorów (odnowa szpiku). Co więcej, jak donoszą van Lochem i wsp. (12), odsetek poszczególnych subpopulacji prekursorowych komórek B, w zależności od zastosowanej terapii, może być różny. W takich przypadkach, przy użyciu standardowych metod analizy, poszukiwanie choroby resztkowej i monitorowanie leczenia jest utrudnione i niewiarygodne.
W detekcji MRD metodą immunofenotypowania, stosuje się dwie strategie: poszukiwanie na blastach białaczkowych markerów właściwych dla innych linii komórkowych – różnicowanie jakościowe (13) oraz wykorzystanie ilościowej różnicy w intensywności ekspresji antygenów liniowych, w tym poszukiwanie komórek o fenotypach asynchronicznych (równoczesne występowanie na blastach białaczkowych antygenów o sile ekspresji właściwej dla różnych stadiów dojrzewania komórki). Ilościowe różnice w ekspresji antygenów na komórkach nowotworowych w detekcji MRD, wykorzystuje cytometryczna metoda tzw. „pustych pól” (empty spaces – ES). Charakterystyczne aberrantne immunofenotypy limfoblastów, wykrywa się w niej za pomocą znakowania odpowiednimi, trój- lub czterokolorowymi, zestawami przeciwciał monoklonalnych. Podstawą wprowadzenia metody „pustych pól”, była identyfikacja immunofenotypu wszystkich subpopulacji limfoblastów B, występujących w szpiku zdrowych dawców. Poprzez barwienie trójkolorowymi zestawami przeciwciał, można wyodrębnić trzy główne populacje prawidłowych limfoblastów, różniących się ekspresją poszczególnych antygenów (14). Fenotyp aberrantny jest definiowany poprzez bezpośrednie porównanie intensywności ekspresji poszczególnych antygenów na komórkach pacjenta, z komórkami prawidłowymi. Na wykresie cytometrycznym typu dot plot, otrzymujemy obraz populacji blastów, o zmienionej intensywności świecenia. Lokuje się ona wówczas w tzw. „pustym polu”, czyli poza bramką referencyjną, w miejscu, w którym w prawidłowym szpiku komórki nie występują (14, 15). Taka porównawcza analiza, pozwala w momencie rozpoznania na stworzenie dla każdego pacjenta odpowiedniego protokołu, który następnie służy do monitorowania choroby resztkowej.
MATERIAŁ I METODY
Materiał do badań stanowiły aspiraty szpiku kostnego 20 dorosłych pacjentów (11 kobiet i 9 mężczyzn), w przedziale wiekowym 18-67 lat (średni 41 lat) z ostrą białaczką limfoblastyczną z linii B. Badania wykonywano podczas rozpoznania choroby (u 20 chorych) oraz w kolejnych etapach leczenia: indukcji, konsolidacji i kontroli po przeszczepie szpiku (u 17 chorych). Do zdefiniowania subpopulacji limfocytów występujących w prawidłowym szpiku, posłużyły próbki szpiku 5 zdrowych dawców. Immunofenotypowanie komórek przeprowadzano metodą trójkolorowej cytometrii przepływowej (Aparat Canto – Becton Dickinson) z zastosowaniem przeciwciał monoklonalnych sprzężonych z fluorochromami: FITC, PE oraz PE-Cy5. Poddawano je standardowej procedurze bezpośredniego barwienia opisanej wcześniej m.in. przez Lucio i wsp. (16). Stosowano następujące zestawy przeciwciał: CD10/CD20/CD19, CD34/CD22/CD19, CD34/CD38/CD19, CD45/CD34/CD19, TdT/CD10/CD19. W poszukiwaniu fenotypów aberrantnych posługiwano się również przeciwciałami przeciwko antygenom mieloidalnym: CD13, CD15, CD33, CD65, CD66. Sprawdzano także znaczenie obecności nadekspresji antygenu CD58 na limfoblastach B, jako czynnika różnicującego je z prawidłowymi komórkami szpiku.
Akwizycję i analizę uzyskanych danych przeprowadzono przy pomocy programu FacsDiva. Każdorazowo analizowano co najmniej 10 000 komórek, przy określaniu nasilenia choroby resztkowej – 50 000 komórek. Ekspresję zastosowanych antygenów analizowano z bramki ustawionej na komórkach CD19+. Otrzymane dane o gęstości poszczególnych antygenów oraz o profilach antygenowych prawidłowych komórek CD19+, uwidocznione zostały na cytometrycznych wykresach typu dot plot. Miejsca, zajmowane przez występujące w prawidłowym szpiku komórki, wykorzystano jako bramki referencyjne. Populacje blastów pacjentów były charakteryzowane w każdym z zastosowanych zestawów przeciwciał, poprzez porównanie ich poziomu fluorescencji z obrazem otrzymanym dla komórek prawidłowych. Do monitorowania choroby resztkowej wybierano fenotypy aberrantne, występujące podczas rozpoznania, na ponad 50% komórek blastycznych CD19+. MRD przyjmowano za dodatnie, gdy w badanym materiale wykryte zostały komórki nieprawidłowe na poziomie ponad 0,1% komórek jądrzastych szpiku.
WYNIKI
Zastosowanie metody „pustych pól” w charakterystyce populacji komórek rozrostowych podczas rozpoznania choroby, pozwoliło na identyfikację aberrantnych fenotypów u 18 pacjentów z OBL-B (90%), z czego przynajmniej dwa fenotypy aberrantne wykryto u 15 pacjentów (75%).
U dwóch chorych komórki blastyczne były najbardziej zbliżone immunofenotypowo do komórek prawidłowych. Nie lokowały się one poza referencyjnymi bramkami, stąd do poszukiwania choroby resztkowej wykorzystywano głównie, wykrytą podczas diagnozy, obecność antygenów mieloidalnych. Częstości wykrywania nietypowych fenotypów blastów, w momencie rozpoznania choroby, w poszczególnych złożeniach przeciwciał, przedstawia tabela 1.
Tabela 1. Częstość występowania blastów o nietypowych fenotypach, stwierdzona w rozpoznaniu OBL-B, przy zastosowaniu poszczególnych zestawów przeciwciał.
Zestawem przeciwciał, z użyciem którego najczęściej wykrywano fenotypy aberrantne było złożenie TdT/CD10/CD19. Pozwoliło ono na wykrycie charakterystycznych białaczkowych fenotypów u 11 z 18 przebadanych chorych (61%). Lokowanie się blastów w „pustym polu”, związane było przede wszystkim ze słabą ekspresją cytoplazmatycznego TdT, w połączeniu z brakiem ekspresji (6 przypadków) (ryc. 1.V.B) lub nadekspresją molekuły powierzchniowej CD10 (3 przypadki). U dwóch chorych stwierdzono nadekspresję TdT na komórkach CD19+CD10+. Przy zastosowaniu zestawu CD10/CD20/CD19 wyodrębniono nietypowe populacje blastów u 12 chorych. Komórki CD19+ wykazywały 3 profile antygenowe: CD10-CD20- (6 pacjentów), nadekspresja molekuły powierzchniowej CD10 bez obecności antygenu CD20 (2 pacjentów) i z heterogenną ekspresją CD20 (4 pacjentów) (ryc. 1.I.B). Stosując zestaw antygenów CD45/CD34/CD19, na wykresie cytometrycznym, obserwowano lokowanie się blastów w miejscach, wskazujących na słabą lub ujemną ekspresję antygenu panleukocytarnego CD45, w porównaniu z limfoblastami B występującymi fizjologicznie w prawidłowym szpiku. Były to trzy przypadki z typową ekspresją CD34 (ryc. 1.IV.B) oraz jeden z brakiem CD34. Inną cechą charakteryzowanych blastów było mocniejsze wiązanie przeciwciał anty-CD34 przy typowej ekspresji CD45 (4 przypadki). Potrójne barwienie CD34/CD38/CD19 pozwoliło na wyodrębnienie 2 profili antygenowych populacji blastów: o słabej, heterogennej ekspresji molekuły CD38 na komórkach CD19+CD34+ (5 przypadków) (ryc. 1.III.B) oraz populacji komórek o asynchronicznym fenotypie CD19+CD34++CD38- (2 przypadki). U pięciu pacjentów blasty odróżniały się swoim fenotypem przy znakowaniu komórek zestawem przeciwciał CD34/CD22/CD19. Były to komórki CD19+CD22+ z mocniejszą ekspresją CD34 (3 przypadki) (ryc. 1.II.B) oraz takie, które przy normalnej ekspresji CD34, słabiej wiązały przeciwciało anty-CD22 (2 przypadki).
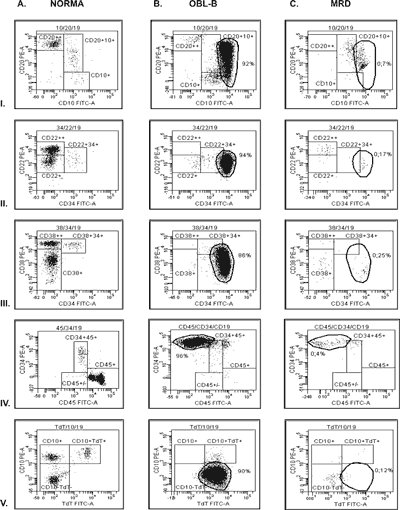 Ryc. 1. Rozmieszczenie komórek CD19+ na cytometrycznych wykresach dot plot w zestawach przeciwciał: I. CD10/CD20/CD19, II. CD34/CD22/CD19, III. CD34/CD38/CD19, IV.CD45/CD34/CD19, V. TdT/CD10/CD19, Kolumna A. Komórki CD19+ w prawidłowym szpiku, Kolumna B. Blasty CD19+ lokujące poza bramkami referencyjnymi (%CD19+), Kolumna C. Resztkowe komórki białaczkowe CD19+ (%WBC).
W tabeli 2. przedstawione zostały najczęściej pojawiające się nietypowe cechy fenotypu limfoblastów białaczkowych, wykryte podczas typizacji komórek blastycznych. Koekspresję antygenów mieloidalnych na limfoblastch B stwierdzono u 55% pacjentów, z czego najczęściej (8 przypadków) był to pojedynczy marker linii mieloidalnej. Dwukrotnie odnotowano obecność na limfoblastach CD19+ dwóch antygenów CD33 i CD66 oraz w jednym przypadku limfoblastów CD19+CD15+CD65+.
Tabela 2. Najczęściej stwierdzane aberracje fenotypowe na blastach CD19+.
Chorobę resztkową monitorowano u 17 z 20 pacjentów z OBL-B. Po kolejnych etapach leczenia: indukcji, konsolidacji, leczeniu podtrzymującym i po przeszczepie szpiku, badano próbki szpiku pod kątem występowania komórek o charakterystycznych, ustalonych w czasie rozpoznania fenotypach. U sześciu chorych wykryto chorobę resztkową. W pięciu przypadkach komórki resztkowe stanowiły>0,1% kom. jądrzastych szpiku (zakres 0,15-12,0%). W jednym przypadku pomimo, iż komórki nieprawidłowe w szpiku wykryto na poziomie zaledwie 0,03-0,07%, to jednocześnie stanowiły one od 15,5 do 38,2% komórek CD19+. Wśród chorych z MRD, u czterech osób odnotowano nawrót choroby. Komórki nowotworowe we wznowie wykazywały ten sam immunofenotyp w dwóch przypadkach. W pozostałych stwierdzono zanik ekspresji antygenu CD34 oraz antygenu linii mieloidalnej - CD13.
Dodatkowe barwienie komórek przeciwciałem anty-CD58 wykonywano przy rozpoznaniu u 15 chorych na OBL-B. Posłużyło ono podczas kolejnych kontrolnych badań, do wykrywania komórek nowotworowych u ośmiu pacjentów (53%), u których podczas diagnozy nadekspresję tego antygenu wykryto na>50% komórek (57,3-99,5%). W badaniach MRD, wyższy odsetek komórek CD58++ (0,15-0,3%) odnotowano we wszystkich przypadkach, które na podstawie analizy metodą „pustych pól” uznano, że wykazują cechy MRD.
DYSKUSJA
W niniejszej pracy, posługując się metodą „pustych pól”, z zastosowaniem pięciu potrójnych zestawów przeciwciał, przynajmniej jeden fenotyp aberrantny blastów, wykryto u 90% badanych pacjentów z OBL-B. Nasze wyniki potwierdzają wysoką użyteczność tej metody w poszukiwaniu fenotypów aberrantnych, co na znacznie większej grupie pacjentów, udowodnili wcześniej Lucio i wsp. wykrywając charakterystyczne fenotypy blastów u 98% badanych chorych (16) czy Kampera i wsp. (17), którzy używając innych zestawów przeciwciał wykryli fenotypy aberrantne w ponad 95% diagnozowanych przypadkach OBL-B.
Jak wynika z naszych obserwacji najczęstszymi aberracjami w fenotypie blastów, powodującymi ich lokowanie się w „pustych polach”, były zmiany ekspresji wczesnych markerów dojrzewania komórek B – CD10, TdT i CD34. Najczęściej wykrywane one były przy zastosowaniu zestawów przeciwciał TdT/CD10/CD19 (61%), CD10/CD20/CD19 (60%) oraz CD45/CD34/CD19 (40%). Przeciwciała przeciwko tym antygenom, pojawiają się w większości spotykanych w piśmiennictwie paneli przeciwciał, coraz częściej w kombinacjach czterech fluorochromów (17, 18).
Monitorując chorobę resztkową z zastosowaniem odpowiednich kombinacji przeciwciał, obecność komórek o nieprawidłowym fenotypie, na poziomie>0,1% WBC, odnotowano u sześciu pacjentów (od 0,15 do 12% komórek jądrzastych szpiku). Metoda „pustych pól” wydaje się być szczególnie użyteczna w przypadkach, gdy trzeba zdefiniować bardzo niewielką pulę komórek. Po intensywnym leczeniu cytostatycznym, zwłaszcza w przypadkach OBL z prekursorów limfocytów B, bardzo często w szpiku pozostaje niewielka populacja komórek CD19+. Określenie ich immunofenotypu jest wówczas znacznie utrudnione. Używając protokołów z bramkami, w których lokowały się blasty poszczególnych pacjentów, można wychwycić nawet pojedyńcze komórki odbiegające swoim fenotypem od prawidłowych prekursorów. W ten sposób komórki resztkowe wykryto u pacjenta z liczbą komórek CD19+ na poziomie 0,2%. Chociaż komórki blastyczne wykryto na mniej niż 0,1% komórek jądrzastych szpiku, to wśród komórek CD19+ stanowiły one nawet ponad 38%.
Pacjenci, u których nie wykryto choroby resztkowej (MRD<0,1%) pozostają w całkowitej remisji. W badaniach oceny ryzyka nawrotu choroby, niektórzy autorzy sugerują zastosowanie niższego progu dopuszczalnej ilości komórek blastycznych. Vidriales i wsp. (19) oceniając MRD w pierwszym, indukującym remisję, etapie leczenia, wyodrębnili dwie grupy pacjentów: z MRD>0,05% i krótszym czasem wystąpienia nawrotu choroby, oraz grupę z MRD<0,05% z dłuższym okresem remisji (śr. 16 m-cy vs 42 m-ce). Być może dłuższy czas obserwacji pozwoli nam na ocenę przydatności tego podziału. Ci sami autorzy podkreślają, że we wszystkich przypadkach z MRD> 0,1% nawrót choroby nastąpił w przeciągu dwóch lat od rozpoznania choroby. Potwierdzają to również nasze wyniki. Wśród chorych z MRD wznowę choroby odnotowaliśmy w czterech przypadkach. U dwóch pacjentów porównawcza analiza immunofenotypu blastów przy rozpoznaniu i wznowie choroby, wykazała zmianę ich fenotypu. Dotyczyła ona w jednym przypadku zaniku na blastach ekspresji antygenu CD34, a w drugim wyróżniającego je podczas diagnozy antygenu CD13. Analizę immunofenotypu blastów pojawiających się we wznowie u chorych z OBL-B przeprowadzili Guglielmi i wsp. (20). Badając grupę 103 pacjentów z nawrotem ostrej białaczki limfoblastycznej B u 38% stwierdzili oni zmianę fenotypu. Dotyczyła ona intensywności ekspresji zarówno antygenów liniowych CD10 czy CD20, antygenu dojrzewania CD34, jak również antygenów nieliniowych CD13 i CD33. Wyniki te potwierdzają konieczność jak najbardziej dokładnego opisu komórek białaczkowych przy rozpoznaniu oraz uważnej weryfikacji fenotypu blastów we wznowie choroby.
Obecność antygenów mieloidalnych na limfoblastach białaczkowych jest wykrywana rzadziej w porównaniu z aberracjami stwierdzanymi metodą „pustych pól”. Według różnych autorów może to być od 10 do 40% przypadków OBL (21, 22). Niemniej jednak koekspresja tych antygenów pozostaje ważnym czynnikiem różnicującym komórki blastyczne. W naszym przypadku u 11 z 20 (55%) badanych pacjentów stwierdziliśmy obecność antygenu mieloidalnego na poziomie pozwalającym na zastosowanie go przy wykrywaniu MRD (>50% kom. dodatnich). Nasze badania potwierdzają wcześniejsze doniesienia, że oprócz najczęściej stosowanych antygenów CD13 i CD33, dobrym markerem, stosunkowo często występującym na blastach CD19+, jest antygen CD66 (23).
Jednym z celów cytometrii przepływowej jest poszukiwanie nowych markerów, za pomocą których detekcja komórek rozrostowych byłaby bardziej dokładna (24). W niniejszej pracy u 15 pacjentów dodatkowym markerem w typizacji blastów było przeciwciało anty-CD58. Jak wynika z literatury (25, 26) większość białaczkowych limfoblastów z linii B wykazuje znacznie mocniejszą ekspresję tego antygenu, w porównaniu z prawidłowymi komórkami prekursorowymi. W naszym przypadku, w czasie diagnozy, nadekspresję CD58 na blastach odnotowano u 7 z 15 badanych pacjentów (47%). W tych przypadkach, w których pojawiła się choroba resztkowa, znalazło to swoje odbicie również w zwiększonym odsetku komórek CD19+CD58++.
WNIOSKI
Wyniki naszych badań, pomimo ograniczonej liczby analizowanych przypadków, potwierdzają zasadność i użyteczność zastosowania cytometrii przepływowej w rozpoznawaniu i monitorowaniu leczenia ostrych białaczek limfoblastycznych u dorosłych. Cytometryczna metoda „pustych pól”, z zastosowaniem zestawów potrójnych barwień, jest dokładną i wiarygodną techniką w ocenianiu choroby resztkowej u chorych z ostrymi rozrostami z linii B. Może ona być zastosowana niemal u wszystkich chorych z OBL-B. Jest metodą szybką, tańszą w porównaniu z metodami molekularnymi i progiem czułości niewiele niższym od techniki PCR (10-4 vs 10-5).
*Praca wykonana w ramach projektu KBN 2 P05B00726 – Kierownik projektu Prof. dr hab. n. med. Jerzy Hołowiecki, Katedra i Klinika Hematologii i Transplantacji Szpiku Śląskiej Akademii Medycznej. Zawarte dane dotyczą chorych z Instytutu Hematologii i Transfuzjologii. Piśmiennictwo
1. Ciudad J., et al.: Prognostic value of immunophenotypic detection of minimal residual disease in acute lymphoblastic leukemia. J. Clin. Oncol., 1998; 16: 3774-81.
2. Cortes J., et al.: Persistence of periferal blood and bone marrow blasts during remission induction in adult acute lymphoblastic leukemia confers poor prognosis depending on treatment intensity. Clin. Cancer. Res., 1999; 5: 2491-7.
3. Knechtli C.J., et al.: Minimal residual disease status before allogeneic bone marrow transplatation is an important determinant of successful outcome for children and adolescents with acute lymphoblastic leukemia. Blood 1998; 92: 4072-9.
4. Sanchez J., et al.: Clinical value of immunological monitoring of minimal residual disease in acute lymphoblastic leukemia after allogeneic transplantation. Br. J. Haematol .,2002; 116: 686-94.
5. Pawłowska A.B.: Detection of minimal residual disease in childhood acute lymphoblastic leukemia: technology and applications. Współczesna Onkologia 2006; 9: 178-82.
6. van Dongen J.J., et al.: Detection of minimal residual disease in acute leukemia patients. Cytokines Mol. Ther., 1996; 2: 121-33.
7. Kerst G., et al.: Concurrent detection of minimal residual disease (MRD) in childhood acute lymphoblastic leukaemia by flow cytometry and real-time PCR. Br. J. Haematol., 2005; 128: 774-82.
8. Kaczmarek A., et al.: Rola i miejsce cytometrii przepływowej w diagnostyce klinicznej. Współczesna Onkologia 2002; 6: 366-73.
9. Jennings C.D., Foon K.A.: Recent advances in flow cytometry: application to the diagnosis of hematologic malignancy. Blood 1997; 90: 2863-85.
10. Dworzak M.N., et al.: Multiparameter phenotype mapping of normal and post-chemotherapy B lymphopoiesis in pediatric bone marrow. Leukemia 1997; 11: 1266-73.
11. van Wering E.R., et al.: Regenetrating normal B-cell precursors during and after treatment of acute lymphoblastic leukaemia: implications for monitoring of minimal residual disease. Br. J. Haematol., 2000; 110: 139-46.
12. van Lochem E.G., et al.: Regeneration pattern of precursor-B-cells in bone marrow of acute lymphoblastic leukemia patients depends on the type of preceding chemotherapy. Leukemia 2000; 14: 688-95.
13. Campana D., Coustan-Smith E.: Detection of minimal residual disease in acute leukemia by flow cytometry. Cytometry 1999; 38: 139-52.
14. Lucio P., et al.: Flow cytometric analysis of normal B cell differentiation: a frame of reference for the detection of minimal residual disease in precursor-B-ALL. Leukemia 1999; 13: 419-27.
15. Weir E.G., et al.: A limited antibody panel can distinquish B-precursor acute lymphoblastic leukemia from normal B precursors with four color flow cytometry: implications for residual disease detection. Leukemia 1999; 13: 558-67.
16. Lucio P., et al.: BIOMED-I concerted action report: flow cytometric immunophenotyping of precursor B-ALL with standarized triple-stanings. Leukemia 2001; 15: 1185-92.
17. Krampera M., et al.: Methodological approach to minimal residual disease detection by flow cytometry in adult B-lineage acute lymphoblastic leukemia. Haematologica 2006; 91: 1109-12.
18. Cousan-Smith E., et al.: Prognostic importance of measuring early clearance of leukemic cells by flow cytometry in childhood acute lymphoblastic leukemia. Blood 2002; 100: 52-8.
19. Vidriales M.B., et al.: Minimal residual disease in adolescent (older than 14 years) and adult lymphoblastic leukemias: early immunophenotypic evaluation has high clinical value. Blood 2003; 101: 4695-4700.
20. Guglielmi C., et al.: Immunophenotype of adult and childhood acute lymphoblastic leukemia: changes at first relapse and clinico-prognostic implications. Leukemia 1997; 11: 1501-07.
21. Boldt D.H., et al.: Expression of myeloid antigen by blast cell in acute lymphoblastic leukemia of adults. The South West Oncology Group experience. Leukemia 1994; 8: 2118-26.
22. Preti H.A., et al.: Myeloid markers in adult acute lymphocytic leukemia. Correlations with patient and disease characteristic and with prognosis. Cancer 1995; 76: 1564-70.
23. Carrasco M., et al.: CD66 expression in acute leukemia. Ann Hematol. 2000;79:299-303.
24. Chen J.S., et al.: Identification of novel markers for monitoring minimal residual disease in acute lymphoblastic leukemia. Blood 2001; 97: 2115-20.
25. Veltroni M., et al.: Expression of CD58 in normal, regenerating and leukemic bone marrow B cells: implications for the detection of minima residua disease in acute lymphocytic leukemia. Haematologica 2003; 88: 1245-52.
26. Lee R.V., et al.: CD58 expression decreases as nonmalignant B cells mature in bone marrow and is frequently overexpressed in adult and pediatric precursor B-cell acute lymphoblastic leukemia. Am. J. Clin. Pathol., 2005; 123: 119-24.
otrzymano/received: 2007-01-29 zaakceptowano/accepted: 2007-05-07 Adres/address: *Jolanta Woźniak Zakład Cytobiologii Hematologicznej Instytut Hematologii i Transfuzjologii ul. Indiry Gandhi 14, 02-776 Warszawa tel. (0-22) 349-61-66, fax: (0-22) 349-64-55 e-mail: facsiht@ihit.waw.pl Pełna wersja artykułu Wykrywanie choroby resztkowej w ostrej białaczce limfoblastycznej dorosłych metodą cytometrii przepływowej tzw. „pustych pól”* dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








