|
© Borgis - Postępy Nauk Medycznych 6, s. 248-256
*Bartłomiej Kordasiewicz
Leczenie złamań końca dalszego kości promieniowej
Operative treatment of the distal radius fractures
Klinika Chirurgii Urazowej Narządu Ruchu i Ortopedii CMKP SPSK im. Prof. A. Grucy
Kierownik Kliniki: prof. dr hab. med. Stanisław Pomianowski Streszczenie
Złamania końca dalszego kości promieniowej, mimo znacznego postępu w ortopedii i traumatologii, stanowią wciąż bardzo poważny problem kliniczny, a także społeczny i ekonomiczny. Istnieje wiele kontrowersji dotyczących sposobów leczenia, co oznacza, że wciąż brak jest „konsensusu” oraz jasnych algorytmów postępowania. W niniejszym opracowaniu przedstawiono „próbę” usystematyzowania klasyfikacji oraz leczenia tych złamań. Algorytm ten powstał na podstawie przeglądu literatury oraz własnych doświadczeń. Jak zawsze przy próbie stworzenia „schematu” postępowania nie należy jednak zapominać, że każdy przypadek należy rozpatrywać indywidualnie, a leczenie powinno być stosowne do potrzeb chorego i własnego doświadczenia chirurga. Słowa kluczowe: złamanie, kość promieniowa, nadgarstek, artroskopia
Summary
Distal radius fractures, though huge progress in trauma and orthopedics, still remain an important clinical, social and economic problem. There are many controversies concerning treatment, which means there is no "consensus” and clear algorithm. In this article we try to clarify the classifications and treatment of these fractures. Suggested attitude is based on our own experience and a literature review. As always, whilst proposing any "clear way”, we can not forget that each case should be treated individually, and treatment must be appropriate for patient needs and surgeon own experience. Key words: fracture, distal radius, wrist, arthroscopy
Wstęp
Złamania końca dalszego kości promieniowej stanowią około 20% złamań leczonych „na ostro” w USA. Dotyczą najczęściej 2 grup chorych: tzw. „młodzi dorastający” oraz osoby starsze (1, 2).
Według Owena 264 złamania „typu Colles´a” przypadają na 100 tys. mieszkańców rocznie, zaś według Frykmana złamania pozastawowe stanowią 36,3% wszystkich złamań końca dalszego kości promieniowej (1, 3). Złamania wewnątrzstawowe dotyczą przede wszystkim ludzi młodych, w przeciwieństwie do złamań pozastawowych w „miejscu typowym” dotyczących ludzi starszych o zmienionej osteoporotycznie kości (4, 5, 6, 7, 8). Urazy powodujące złamania śródstawowe charakteryzują się dużą energią, są więc związane z wypadkami komunikacyjnymi, upadkami z wysokości, urazami sportowymi. Złamania pozastawowe są zwykle wynikiem upadku o stosunkowo niskiej energii, która jednak przewyższa wytrzymałość osłabionej kości (4, 5). Leczenie tych złamań wymaga odtworzenia prawidłowych stosunków anatomicznych kości promieniowej, a w przypadku złamań wewnątrzstawowych anatomicznej repozycji powierzchni stawowej. W chwili obecnej wiadomo, że teoria Abrahama Collesa z 1814 roku: „po pewnym czasie od uzyskania zrostu, mimo przetrwałego zniekształcenia, nastąpi całkowity powrót ruchomości bez dolegliwości bólowych...” jest raczej wyjątkiem niż regułą (9). Leczenie tych złamań, mimo ich powszechności wciąż budzi wiele kontrowersji.
Anatomia
Anatomię końca dalszego kości promieniowej należy zawsze omawiać w powiązaniu z końcem dalszym kości łokciowej oraz kośćmi nadgarstka. Obszar ten jest nazywany „funkcjonalnie” (lecz nie anatomicznie) nadgarstkiem, gdyż uszkodzenie któregokolwiek z elementów wpływa na jego funkcję (4, 5). Koniec dalszy kości promieniowej charakteryzuje się pochyleniem dłoniowym (volar tilt) 11-12° (zakres 0-28°), inklinacją promieniową (radial angulation) 22-23° (zakres 13-30°) oraz wysokością promieniową (radial length) 11-12 mm (zakres od 8-18 mm). Zakres tych wartości jest osobniczo zmienny i należy je porównywać z kończyną zdrową chorego. Odtworzenie tych parametrów jest celem leczenia złamań końca dalszego kości promieniowej. Koniec dalszy kości promieniowej tworzy z końcem dalszym kości łokciowej staw promieniowo-łokciowy dalszy (DRUJ – distal radio-ulnar joint), odizolowany od stawu promieniowo-nadgarstkowego przez układ więzadłowy kompleksu chrząstki trójkątnej (TFCC – triangular fibrocartilage complex). Obie kości przedramienia połączone są z kośćmi nadgarstka przez układ więzadłowy dłoniowy i grzbietowy. Szczegółowe omawianie anatomii więzadeł nadgarstka przekracza ramy tego rozdziału, należy jednak przypomnieć o 2 więzadłach międzykostnych szeregu bliższego nadgarstka: łódeczkowo-księżycowatym (SL – scapho-lunate ligament) i księżycowo-trójgraniastym (LT luno-triquetral – ligament), które są kluczowymi elementami decydującymi o stabilności nadgarstka. Uszkodzenia tych 3 elementów: kompleksu chrząstki trójkątnej oraz więzadeł międzykostnych mogą towarzyszyć złamaniom końca dalszego kości promieniowej.
Klasyfikacje
Do dnia dzisiejszego używa się historycznego podziału złamań pozastawowych na złamanie typu Colles´a (pierwszym, który opisał ten typ złamania był Pouteau w 1783 roku, Colles zaś dopiero w 1814) oraz złamanie typu Smith´a (opisane w 1854 roku jako „odwrotne” złamanie Colles´a) dotyczących odpowiednio grzbietowego i dłoniowego przemieszczenia odłamów (9, 10, 11). Obecnie istnieje wiele podziałów złamań końca dalszego kości promieniowej, wystarczy tylko wymienić klasyfikacje Frykman´a, Melone´a, Mayo, Lindstroem´a (3, 4, 5). Większość klasyfikacji różnicuje złamania poza- i wewnątrzstawowe, kierunek przemieszczenia odłamów oraz obecność ubytku tkanki kostnej. W naszej klinice zwykle posługujemy się klasyfikacją AO, wg której złamania podzielone są na pozastawowe (grupa A, obejmujące złamania Colles´a i Smith´a), śródstawowe z jednym odłamem (grupa B) oraz wewnątrzstawowe wieloodłamowe (grupa C). W każdej z grup istnieją 3 podgrupy, różnicujące przemieszczenie grzbietowe, dłoniowe oraz obecność ubytku tkanki kostnej. Dosyć interesujący wydaje się podział Fernandez´a i Geissler´a dotyczący stawu promieniowo-łokciowego dalszego (DRUJ), oceniający jego uszkodzenie po repozycji i stabilizacji końca dalszego kości promieniowej (12, 13). Typ I reprezentuje stabilny staw – radiograficznie może występować złamanie szczytu wyrostka łokciowego lub nieprzemieszczone, stabilne złamanie szyjki kości łokciowej. Typ II to staw niestabilny (występuje podwichnięcie lub zwichnięcie) co wynika z masywnego uszkodzenia kompleksu chrząstki trójkątnej (TFCC) lub złamania u podstawy wyrostka rylcowatego kości łokciowej. Typ III to potencjalnie niestabilne uszkodzenie DRUJ wynikające ze złamania wewnątrzstawowego dochodzącego do wcięcia łokciowego kości promieniowej lub wewnątrzstawowego złamania głowy kości łokciowej.
Wszystkie systemy klasyfikacyjne, mimo ich mnogości, nie są jednak doskonałe. Nie zawsze udaje się przyporządkować złamanie do którejś z grup, należy jednak pamiętać, że nie jest to celem samym w sobie. Kluczowe jest określenie stabilności złamania, bowiem określa to sposób postępowania. Obecnie stosowanie taktyki polegającej na zamkniętej repozcyji wszystkich złamań, a następnie operowaniu złamań przemieszczonych wtórnie, „wychwyconych” podczas kontroli, nie powinno mieć zastosowania. Oczywiście może się zdarzyć sytuacja konieczności leczenia operacyjnego złamania pierwotnie leczonego nieoperacyjnie, lecz powinno być to wyjątkiem, a nie regułą. Tak więc złamania kwalifikowane jako stabilne mogą być leczone nieoperacyjnie, zaś w przypadku złamań niestabilnych niezbędne jest leczenie operacyjne. Uważa się, że cechami niestabilności złamania są:
– dłoniowe przemieszczenie odłamów,
– przemieszczenie grzbietowe odłamów powyżej 20°,
– skrócenie wysokości promieniowej powyżej 10 mm,
– masywny ubytek tkanki kostnej (złamania zgnieceniowe),
– złamania wewnątrzstawowe,
– towarzyszące złamania kości łokciowej (lecz nie szczytu wyrostka rylcowatego kości łokciowej),
– wiek powyżej 60 lat.
W każdym z tych przypadków zalecanym sposobem postępowania jest leczenie operacyjne (4, 5, 6, 7, 14). W przypadku złamań zakwalifikowanych jako stabilne, po zamkniętej repozcji i unieruchomieniu w opatrunku gipsowym kąt przemieszczenia grzebietowego powinien być mniejszy niż 5°, a skrócenie wysokości promieniowej mniejsze niż 2 mm. Jeżeli parametry te nie są spełnione wskazana jest ponowna repozcja oraz stabilizacja złamania, tym razem operacyjnie.
Uszkodzenia towarzyszące złamaniom wewnątrzstawowym
Złamania wewnątrzstawowe, w przeciwieństwie do złamań pozastawowych powstają w wyniku zadziałania czynników o znacznej energii. Zwykle siła urazu jest na tyle duża, że wywołując złamanie wewnątrzstawowe, przenosi się również na inne struktury: kości nadgarstka i aparat więzadłowy.
Według literatury uszkodzenia towarzyszące złamaniom wewnątrzstawowym końca dalszego kości promieniowej występują w 68% przypadków i dotyczą uszkodzeń kompleksu chrząstki trójkątnej, uszkodzeń więzadeł międzykostnych, uszkodzeń chrząstki, obecności ciał wolnych (6, 8, 15, 16). Jedną z przyczyn dolegliwości bólowych i ograniczenia funkcji po przebytych złamaniach wewnątrzstawowych może być nierozpoznanie, a w konsekwencji nieleczenie uszkodzeń towarzyszących. Nierozpoznanie uszkodzeń więzadeł międzykostnych szeregu bliższego kości nadgarstka (SL – scapholunate i LT – lunotriquetral) prowadzi do niestabilności nadgarstka: DISI ( dorsal intercalated segment instability) w przypadku uszkodzenia więzadła łódeczkowo-księżycowatego (SL) i VISI ( volar intercalated segment instability) w przypadku więzadła księżycowo-trójgraniastego (LT) i rozwoju zmian zwyrodnieniowych bądź zespołu bólowego, a w konsekwencji ograniczenia funkcji kończyny. Uszkodzenia kompleksu chrząstki trójkątnej mogą prowadzić do „zespołu bólowego po stronie łokciowej nadgarstka” lub niestabilności stawu promieniowo-łokciowego dalszego (17, 18, 19, 20, 21).
Patomechanizm złamania
Najczęstszą przyczyną złamania końca dalszego kości promieniowej jest upadek na wyprostowaną kończynę. Zdecydowanie rzadziej przyczyną jest uraz bezpośredni. Rodzaj złamania zależy od wielkości działającej siły, pozycji reki, nadgarstka i rotacji przedramienia podczas upadku oraz jakości tkanki kostnej. Do złamań wewnątrzstawowych dochodzi częściej w przypadku urazów „wysokoenergetycznych” oraz osób młodych. W przypadku złamań o niskiej energii urazu, u chorych ze słabą jakością tkanki kostnej przeważają złamania pozastawowe (3, 4, 5).
Podczas upadku do przodu na nadgarstek ustawiony w wyproście, przy rotacji przedramienia w pronacji, ciężar ciała jest przenoszony wzdłuż kości promieniowej, czego następstwem jest przemieszczenie grzbietowe odłamu (lub odłamów). Kość zbita po stronie dłoniowej ustępuje pod wpływem sił „z pociągania” (tensile forces), zaś po stronie grzbietowej do zagniecenia kości pod wpływem sił kompresyjnych (compresive forces). Odłam dystalny jest przemieszczony grzbietowo i ustawiony w supinacji (głównym mięśniem odpowiedzialnym za przemieszczenie jest mięsień ramienno-promieniowy, który w tych warunkach działa „po cięciwie” nasilając deformację).
Podczas upadku do tyłu na nadgarstek ustawiony w wyproście, przy rotacji przedramienia w supinacji działająca siła powoduje dłoniowe przemieszczenie odłamu (lub odłamów) – siły kompresyjne działają na warstwę korową kości po stronie dłoniowej, zaś po stronie grzbietowej dominują siły „z pociągania”. Odłam obwodowy jest przemieszczony dłoniowo i w pronacji względem trzonu kości promieniowej. Mięsień ramienno-promieniowy również w tym przypadku nasila deformację (działając „po cięciwie”), przy współudziale mięśnia nawrotnego czworobocznego (4, 22).
Transmisja sił działających podczas złamania może być bardzo różnorodna i zależy od wielu czynników, stąd też wynika mnogość typów złamań, obecność uszkodzeń struktur kostno-więzadłowych nadgarstka oraz propagacja złamania na staw promieniowo-łokciowy dalszy i kość łokciową.
Obraz kliniczny
Jak w każdym przypadku niezbędne są wszystkie elementy badania klinicznego. Wywiad wnosi wiele istotnych informacji – mechanizm urazu może sugerować rodzaj uszkodzeń, przebyte w przeszłości urazy tej okolicy mogą mieć wpływ na obecny proces diagnostyczno-terapeutyczny, choroby towarzyszące mogą „zmieniać” wiek biologiczny i stan kości chorego. Istotny jest zawód, wiek oraz określenie kończyny dominującej. Badanie fizykalne nie jest łatwe ze względu na ból, lecz nie może być pominięte. Dla złamań końca dalszego kości promieniowej charakterystyczna jest deformacja kończyny – obrzęk okolicy nadgarstka, zniekształcenie typu „widelec” (4, 5) w przypadku złamań z grzbietowym przemieszczeniem odłamów. Niezmiernie ważne, poza oceną deformacji kończyny, jest ocena ruchomości palców, czucia i unaczynienia. Ze względu na ból i obrzęk badanie kości i więzadeł nadgarstka jest bardzo trudne, zwykle wręcz niemożliwe, stąd należy na te struktury zwrócić szczególną uwagę podczas oceny radiologicznej. Urazy nadgarstka są często „maskowane” klinicznie przez dominujący problem jakim jest złamanie, lecz ich nierozpoznanie może mieć wpływ na wynik końcowy leczenia (8, 15, 16).
Diagnostyka obrazowa
Diagnostykę obrazową zawsze rozpoczyna się od oceny radiogramów. Bardzo ważne jest wykonanie zdjęć rtg w prawidłowych projekcjach PA i bok (4). Ocena uszkodzeń na podstawie zdjęć o złej jakości, wykonanych w nieprawidłowych projekcjach jest praktycznie niemożliwa. W przypadku najmniejszych wątpliwości należy wykonać zdjęcia porównawcze drugiej kończyny. Istotne jest określenie wielkości przemieszczenia odłamów, liczby odłamów, obecności ubytku tkanki kostnej, pośrednio uszkodzeń więzadeł międzykostnych i kompleksu chrząstki trójkątnej (porównanie odległości SL i LT, kątów pomiędzy poszczególnymi kośćmi, obecności podwichnięcia w stawie promieniowo-łokciowym dalszym, złamania u podstawy wyrostka rylcowatego kości łokciowej) (4, 5). Diagnostyka uszkodzeń towarzyszących, które często współistnieją ze złamaniami wewnątrzstawowymi jest trudna, szczególnie na standardowych radiogramach. Wykorzystanie tomografii komputerowej pozwala na jednoczesną ocenę przemieszczenia odłamów w przypadkach złamań wewnątrzstawowych oraz na ocenę uszkodzenia kości nadgarstka. Pośrednio, na podstawie parametrów pomiędzy kośćmi nadgarstka, można rozpoznawać uszkodzenia tkanek miękkich, jednak w tym celu skuteczniejszy jest rezonans magnetyczny. Ostatnim etapem diagnostyki (i jednoczesnie leczenia) uszkodzeń towarzyszących może być artroskopia nadgarstka (8, 16, 23, 24).
Leczenie złamań pozastawowych
Złamania pozastawowe z przemieszczeniem dłoniowym odłamu (typu Smith´a)
Złamania te są z natury złamaniami niestabilnymi (11). W przeszłości próbowano leczenia nieoperacyjnego polegającego na zamkniętej repozycji i unieruchomieniu w supinacji, jednak rezultaty nie były zadowalające. Obecnie, leczeniem z wyboru jest leczenie operacyjne, polegające na stabilizacji złamania płytką dłoniową, z dostępu przez pochewkę ścięgna zginacza promieniowego nadgarska (4, 5). Płytki dłoniowe są odpowiednio wyprofilowane, dopasowując się swym kształtem do anatomicznego kształtu kości promieniowej. Mogą być to zwykłe płytki dociskowe lub płytki LCP (o śrubach ryglowanych w płytce). Istnieją również płytki biowchłanialne, termoplastyczne, których zaletą jest brak konieczności usunięcia zespolenia (ryc. 1). Zaletą stabilnego zespolenia płytkowego jest możliwość natychmiastowego usprawniania chorej kończyny, praktycznie bez stałego unieruchomienia gipsowego. Zwykle stosuje się czasowe unieruchomienie w ortezie (lub longecie gipsowej), zdejmowanej do ćwiczeń kilka razy dziennie. Po ustąpieniu okresu bólowego chory zdejmuje ortezę, zaś ćwiczenia siłowe z oporem rozpoczynane są po 6-8 tygodniach od operacji.
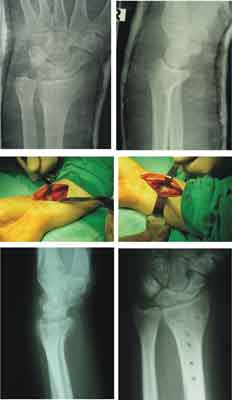 Ryc. 1. Złamanie typu Smith´a, zespolone płytką biowchłanialną od strony dłoniowej.
Złamania pozastawowe z grzbietowym przemieszczeniem odłamu (typu Colles´a)
W przypadku złamań „Colles´a” kwestią kluczową jest ocena stabilności złamania. Złamania stabilne leczone są nieoperacyjnie, złamania niestabilne należy operować. Uważa się, że cechami niestabilności złamania są:
– przemieszczenie grzbietowe odłamów powyżej 20°,
– skrócenie wysokości promieniowej powyżej 10mm,
– masywny ubytek tkanki kostnej (złamania zgnieceniowe),
– złamania wewnątrzstawowe,
– towarzyszące złamania kości łokciowej,
– wiek powyżej 60 lat.
Ostatni czynnik, czyli wiek (a więc pośrednio jakość kości) jest dyskusyjny (4). Z powodu słabej jakości kości należy ustabilizować złamanie ze względu na tendencję do wtórnego przemieszczenia odłamów. Jednocześnie istnieją prace, w których udowadnia się, że u osób w podeszłym wieku, z masywną osteoporozą oraz niewielkimi oczekiwaniami odnośnie funkcji kończyny, leczenie operacyjne nie ma wyższości nad leczeniem nieoperacyjnym. W takich przypadkach decyzja jest zawsze podejmowana po dokładnym przeanalizowaniu korzyści i ryzyka oraz rozmowie z chorym.
Leczenie nieoperacyjne
Istnieją 2 sposoby repozycji złamań końca dalszego kości promieniowej: „w rękach” operatora sposobem Kochera (polegającym na kolejno – rozklinowaniu, rozciągnięciu oraz repozycji odłamów w prawidłowym ustawieniu) oraz na „aparacie” wyciągowym. Repozycję należy przeprowadzić w znieczuleniu – możliwe jest znieczulenie 1% Xylocainą podaną do szczeliny złamania, choć optymalny jest blok splotu ramiennego. Po zamkniętej repozycji i unieruchomieniu w opatrunku gipsowym kąt przemieszczenia grzbietowego powinien być mniejszy niż 5°, a skrócenie wysokości promieniowej mniejsze niż 2 mm. Jeżeli parametry te nie są spełnione wskazana jest ponowna repozycja oraz stabilizacja złamania operacyjnie.
Jeżeli zaś parametry te są spełnione wystarczające jest unieruchomienie w opatrunku gipsowym dłoniowo-przedramiennym. Istnieje wiele prac dotyczących pozycji unieruchomienia ręki, jednak zwykle są one sprzeczne (22, 25, 26, 27). Zdecydowanie unika się nadmiernego zgięcia dłoniowego i pronacji, jako czynników sprzyjających upośledzeniu ruchomości palców lub rozwojowi algodystrofii. Preferowanym ustawieniem ręki jest pozycja pośrednia ręki, a nawet niewielkie zgięcie grzbietowe. Niezmiernie ważne jest umożliwienie choremu natychmiastowych ćwiczeń palców, stąd też stawy śródręczno-paliczkowe muszą pozostać wolne (unieruchomienie nie powinno przekraczać bruzd zgięciowych dłoniowych, zaś po stronie grzbietowej powinny być widoczne głowy kości śródręcza). Kciuk pozostaje wolny, umożliwiając natychmiastowe ćwiczenia. Na przedramieniu unieruchomienie nie powinno ograniczać zgięcia w stawie łokciowym. Kontrole radiologiczne przeprowadzamy w 7 i 14 dniu od repozycji, a następnie w chwili zdjęcia unieruchomienia – czyli po 4-6 tygodniach.
Leczenie operacyjne
W przypadku złamań niestabilnych z grzbietowym przemieszczeniem odłamów, najprostszym i najmniej inwazyjnym sposobem jest stabilizacja drutami Kirschnera. Istnieje wiele technik stabilizacji. Najbardziej popularne to stabilizacja przez szczelinę złamania sposobem Kapandji (28, 29, 30), stabilizacja 2 drutami od strony wyrostka rylcowatego (31) lub oba powyższe sposoby stosowane jednocześnie, czyli „Kapandji mix” (5). Technika Kapandji polega na stopniowej repozycji odłamu przez wprowadzenie 3 drutów w szczelinę złamania (1 drut od strony promieniowej, 2 druty od strony grzbietowej w osi II i IV kości śródręcza), stopniowej repozycji przez pochylenie drutów pod kątem ok. 45° i ich zakotwiczeniu w przeciwległej warstwie korowej. W przypadku stabilizacji od strony wyrostka rylcowatego najpierw wykonuje się repozycję na aparacie wyciągowym, a następnie stabilizację pod kontrolą monitora rtg. W przypadku złamań z dużym ubytkiem tkanki kostnej, bardzo niestabilnych, stosuje się często obie powyższe techniki (Kapandji mix). Wadą stabilizacji drutami Kirschnera jest konieczność unieruchomienia w opatrunku gipsowym dłoniowo-przedramiennym, z zachowaniem wszystkich zasad opisanych wcześniej.
W naszej klinice nie stosujemy płytek grzbietowych. Istnieją doniesienia o płytkach dłoniowych w przypadku złamań z grzbietowym przemieszczeniem odłamów (4, 5), lecz ta technika również nie była przez nas stosowana. Leczenie stabilizatorem zewnętrznym (wszczepy osadzone w II kości śródręcza i trzonie kości promieniowej) zarezerwowane jest tylko dla złamań z masywnym ubytkiem tkanki kostnej (wtedy ubytek ten należy uzupełnić przeszczepami kostnymi) oraz dla złamań otwartych (4). Po 2-4 tygodniach stabilizator zewnętrzny należy zdjąć i zastąpić unieruchomieniem w opatrunku gipsowym (lub ortezie) dłoniowo-przedramiennym.
Leczenie złamań wewnątrzstawowych
Złamania wewnątrzstawowe końca dalszego kości promieniowej posiadają kilka cech charakterysty-cznych, odróżniających je od złamań pozastawowych:
– powstają w wyniku dużej energii urazu,
– dotyczą przede wszystkim ludzi młodych,
– obecność uszkodzeń towarzyszących,
– znaczna niestabilność, stanowiąca wskazanie do leczenia operacyjnego (4, 5, 6, 7, 12, 13, 14).
Praktycznie, tylko złamania bez przemieszczenia odłamów, z obecnością linii (a nie „szczeliny”) złamania biegnącej śródstawowo mogą być leczone nieoperacyjnie (unieruchomienie w opatrunku dłoniowo-przedramiennym) pod warunkiem częstych kontroli radiologicznych.
Celem leczenia złamań wewnątrzstawowych końca dalszego kości promieniowej jest odtworzenie prawidłowych stosunków anatomicznych i rekonstrukcja powierzchni stawowej. Pierwszy cel, a więc odtworzenie prawidłowych stosunków anatomicznych realizuje się w podobny sposób jak podczas leczenia złamań pozastawowych: w przypadku dłoniowego przemieszczenia odłamów używa się płytki dłoniowej (ryc. 2), w przypadku złamań z grzbietowym przemieszczeniem odłamów stosowana jest stabilizacja drutami Kirschnera (ryc. 3) (z koniecznością unieruchomienia opatrunkiem gipsowym dłoniowo-przedramiennym lub ortezą – patrz wyżej). Stabilizator zewnętrzny stosowany jest tylko w przypadku znacznych ubytków kostnych i złamaniach otwartych.
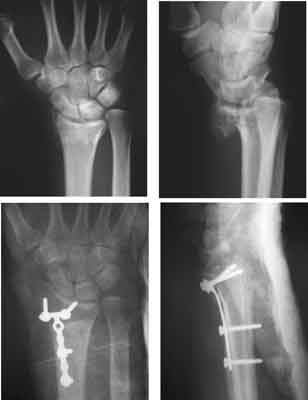 Ryc. 2. Złamanie wewnątrzstawowe z dłoniowym przemieszczeniem odłamów, stabilizacja przy pomocy płytki dłoniowej.
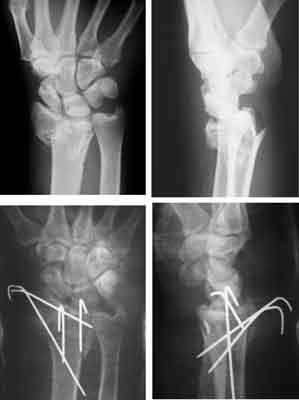 Ryc. 3. Złamanie wewnątrzstawowe z grzbietowym przemieszczeniem odłamów, stabilizacjia przy pomocy drutów Kirschnera sposobem Kapandji-mix.
Realizacja drugiego celu, czyli rekonstrukcja powierzchni stawowej, stanowi wyzwanie dla chirurga. Dopuszczalne przemieszczenie odłamów tworzących powierzchnię stawową stawu promieniowo-nadgarstkowego wynosi ok. 1-1,5 mm, większe powoduje szybki rozwój zmian zwyrodnieniowych (32, 33). Ze względu na charakterystyczną budowę stawu promieniowo-nadgarstkowego pełna wizualizacja powierzchni stawowej jest trudna przy próbie oceny pod kontrolą monitora rtg (34). Także podczas operacji „na otwarto” dokładna ocena powierzchni stawowej nie zawsze należy do najłatwiejszych. Stąd też pojawił się pomysł wykorzystania artroskopu do oceny powierzchni stawowej (podobnie jak w przypadku niektórych typów złamań plateau piszczeli). Istnieją doniesienia stwierdzające, że konieczność korekty pod kontrolą artroskopu, po teoretycznie satysfakcjonującej repozycji (6, 14, 34, 35) pod kontrolą monitora rtg wynosiła od kilkunastu aż do 70% w zależności od typu złamania (8). O ile w przypadku złamań z przemieszczeniem dłoniowym odłamów, gdy stosujemy stabilizację płytką dłoniową, weryfikacja powierzchni stawowowej z dostępu dłoniowego jest możliwa (więc weryfikacja artroskopowa mogłaby być niepotrzebna), o tyle w przypadku złamań operowanych „na zamknięto” użycie artroskopu może być uzasadnione.
Kolejny problem stanowią uszkodzenia towarzyszące złamaniom wewnątrzstawowym, które według literatury występują w blisko 70% przypadków (8). Jedną z przyczyn dolegliwości bólowych i ograniczenia funkcji po przebytych złamaniach wewnątrzstawowych może być nierozpoznanie, a w konsekwencji nie leczenie uszkodzeń towarzyszących. Problem ten dotyczy najczęściej więzadeł międzykostnych szeregu bliższego nadgarstka, czyli więzadła łódeczkowo-księżycowatego (scapholunate ligament – SL) i więzadła księżycowo-trójgraniastego (lunotriquetral ligament – LT) oraz kompleksu chrząstki trójkątnej (triangular fibrocartilage complex – TFCC). Uszkodzenie więzadła SL prowadzi do rozwoju niestabilności nadgarstka typu grzbietowego (dorsal intercalated segment instability – DISI), uszkodzenie więzadła LT do niestabilności typu dłoniowego (volar intercalated segment instability – VISI), zaś pewne typy uszkodzenia kompleksu chrząstki trójkątnej do niestabilności stawu promieniowo-łokciowego dalszego (6, 8, 14, 24, 36, 37).
Brak wczesnej diagnostyki tych uszkodzeń, zwykle niewidocznych na typowych zdjęciach rtg może prowadzić do rozwoju niestabilności nadgarstka. Do diagnostyki tych uszkodzeń wykorzystuje się zwykle zdjęcia czynnościowe celem określenia zaburzeń anatomicznych stosunków pomiędzy poszczególnymi kośćmi nadgarstka lub rezonans magnetyczny (bądź tomografię komputerową) z podaniem kontrastu celem oceny „przecieku” przez struktury więzadłowe. W przypadku złamania wykonanie powyższej diagnostyki staje się bardzo trudne.
Stąd też ponownie zastosowanie znajduje pomysł wykorzystania artroskopii, jako metody diagnostyczno-terapeutycznej. Ze względu na niewielką inwazyjność, przy jednoczesnych wskazaniach do leczenia operacyjnego tych złamań, rozszerzenie rutynowej procedury zespolenia złamania o artroskopię nadgarstka może być uzasadnione. Dzięki artroskopowej kontroli stawu możliwe jest jednoczesne zdiagnozowanie i leczenie uszkodzeń struktur więzadłowych, a także próba anatomicznej repozycji odłamów i odtworzenia powierzchni stawowej (6, 8, 14, 15, 34, 35, 38, 39) (ryc. 4, 5, 6).
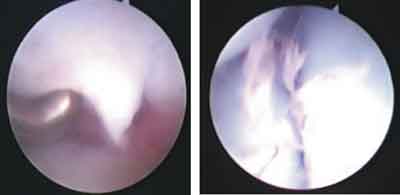 Ryc. 4. Uszkodzenie więzadła międzykostnego SL I°, obraz ze strony stawu promieniowo-nadgarstkowego (po stronie lewej) i ze strony stawu śródnadgarstkowego (po stronie prawej).
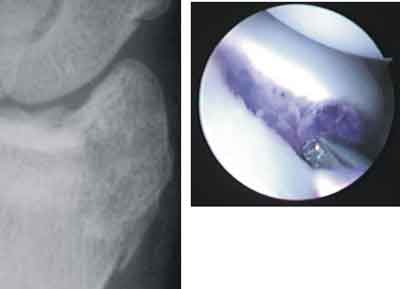 Ryc. 5. Złamanie w projekcji PA oraz obraz artroskopowy.
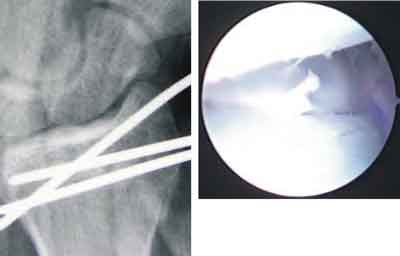 Ryc. 6. Obraz rtg i artroskopowy po repozycji i stabilizacji odłamów.
Z tego względu, w chwili obecnej, złamania wewnątrzstawowe z grzbietowym przemieszczeniem odłamów leczone są stabilizacją „na zamknięto” drutami Kirschnera pod kontrolą artroskopu. W naszym materiale podczas artroskopii wykonywano:
– usunięcie ciał wolnych,
– opracowanie uszkodzeń chrząstki stawowej kości nadgarstka (shaving pofragmentowanej chrząstki, zwykle II/III stopień wg klasyfikacji Outerbridge´a),
– modyfikacja sposobu unieruchomienia kończyny po stwierdzeniu uszkodzeń więzadeł międzykostnych (najczęściej uszkodzenie więzadła SL I°),
– usunięcie wolnych fragmentów uszkodzonego centralnie kompleksu chrząstki trójkątnej,
– korekta ustawienia odłamów tworzących powierzchnię stawową, zwykle o większym przemieszczeniu niż można było przypuszczać na podstawie zdjęć rtg.
Wykorzystanie artroskopii w leczeniu złamań wewnątrzstawowych końca dalszego kości promieniowej jest procedurą nową, dość trudną technicznie. Nie można jeszcze powiedzieć, że powinno stać się rutynową procedurą podczas leczenia złamań wewnątrzstawowych końca dalszego kości promieniowej, choć wczesne wyniki są zachęcające.
Powikłania
Powikłania złamań końca dalszego kości promieniowej stanowią osobny, rozległy problem, którego dokładne omówienie przekracza ramy tego rozdziału. Z tego względu zostaną krótko omówione (tabela 1) najczęstsze powikłania oraz sposób ich uniknięcia.
Tabela 1. Powikłania złamań końca dalszego kości promieniowej.
Piśmiennictwo
1. Owen R.A., et al.: Incidence of Colles´ fracture in a North American community. Am J Pub Health, 1982;72: 605-7.
2. Ark J, Jupiter LB.: The rationale for precise management of distal radius fractures. Orthop. Clin. North. Am., 1993; 24: 205-210.
3. Frykman G. Fracture of the distal radius including sequelae- shoulder-hand-finger syndrome, disturbance in the distal radio-ulnar joint and impairment of nerve function. A clinical and experimental study. Acta Othop. Scand., 1959, (Supll. 108): 3.
4. Berger R.A., Weiss A-P.C. Hand Surgery. Philadelphia, 2003, Lippincott Williams and Wilkins.
5. Oberlin Christophe.: Manuel de chirurgie du membre superieur. Paris, 2000, Elsevier.
6. Doi K., et al.: Intra-Articular Fractures of the Distal Aspect of the Radius: Arthroscopically Assisted Reduction Compared with Open Reduction and Internal Fixation. J. Bone and Joint Surg., 1999; 81:1093-1110.
7. Melone C.P.: Open treatment for displaced articular fractures of the distal radius. Clin. Orhotp. Relat. Res., 1986; 202: 103-111.
8. Geissler W.B., et al.: Intracarpal Soft-Tissue Lesions Associated with an Intra-Articular Fracture of the Distal End of the Radius. J. Bone Joint Surg. [Am], 1996; 78-A; 357-65.
9. Colles A. On the fracture of the carpal extremity of the radius. Edinb. Med. Surg. J., 1814; 10: 181-186.
10. Pouteau C., Oeuvres posthumes de M. Pouteau, vol. 2, Paris: PD Pierres, 1783:151.
11. Smith R.W.: A treatis on fractures in the vicinity of joints, and on certain forms of accidental and congenital dislocations. Dublin: Hodges & Smith, 1847: 129-175.
12. Fernandez D.L, Geissler W.B.: Treatment of displaced articular fractures of the radius. J. Hand Surg Am, 1991; 16: 375-384.
13. Fernandez D.L. Jupiter J.B.: Fractures of the distal radius. A practical approach to management. New York: Springer-Verlag, 1996.
14. Mehta J.A., Bain G.I., Heptinstall R.J.:Anatomical reduction of intra-articular fractures of the distal radius: An arthroscopically assisted approach. J. Bone and Joint Surg.; 2000; 82, 1: 79-86.
15. Kordasiewicz B., i wsp.: Złamania śródstawowe końca dalszego kości promieniowej – artroskopowa ocena uszkodzeń. Chirurgia Narządów Ruchu i Ortopedia Polska, 2006; 71 (2): 113-116.
16. Kordasiewicz B., i wsp.: Uszkodzenia więzadeł międzykostnych i kompleksu chrząstki trójkątnej w złamaniach śródstawowych końca dalszego kości promieniowej – porównanie obrazu radiologicznego z obrazem artroskopowym. Ortopedia Traumatologia Rehabilitacja, 2006; 3(6): Vol. 8, 263-267.
17. Richard H. Gelberman, William P. Cooney, Robert M. Szabo.: Carpal Instability. J. Bone Joint Surg. Am., 2000, 82-A, 4: 578-593.
18. Saffar P.: L´instabilite du carpe. http://www.maitrise-orthop.com/corpusmaitri/orthopaedic/mo73_saffar/index_vf.shtml
19. Morawiecki P., Sosin P., Dutka J.: Niestabilność pourazowa nadgarstka typu grzbietowego i dłoniowego po złamaniach dalszego końca kości promieniowej, Chirurgia Narządów Ruchu i Ortopedia Polska, 1999; 64, 2, 127-131.
20. Alexander Y., et al.: Lunotriquetral Instability: Diagnosis and Treatment. J. Am. Acad. Orthop. Surg., 2000; 8: 170-179.
21. Palmer AK. Triangular fibrocartilage complex lesions: A classification. J Hand Surg [Am] 1989;14:594-606.
22. Sarmiento A., et al.: Colles´ Fractures- functional bracing in supination. J. Bone and Joint Surg., 1975; 57-A, (3) 311-317.
23. Gupta R., Bozentka D.J., and Lee Osterman A.: Wrist Arthroscopy: Principles and Clinical Applications. J Am Acad Orthop Surg 2001; 9: 200-209.
24. Hofmeister E.P., et al.: The role of midcarpal arthroscopy in the diagnosis of disorders of the wrist. J. Hand Surg (Am), 2001; 26A, 3: 407-414.
25. Wahlstrom O.. Treatment of Colles´ fractur. A prospective comparison of three different positions of immobilisation. Acta Orthop. Scand., 1982; 53: 225-228.
26. Pool C. Colles´ fracture. A prospective study of treatment. J. Bone Joint Surg. Br., 1973; 55: 540.
27. Ferris B.D., Thomas N.P., Dewar M.E.. Brace treatment of Colles´ fracture. Acta Orhop. Scand. 1989; 60: 63-65.
28. Kapandji A.: L´osteosynthese par double embrochage intrafocal. Ann. Chir., 1976; 30 (11-12): 903-908.
29. Siwiński D., i wsp.: Wczesne wyniki leczenia złamań dalszego końca kości promieniowej sposobem Kapandji. Chir. Narz. Ruchu Ortop. Pol., 1993; 58, 2: 8-13.
30. Trumble T.E., et al.: Intrafocal (Kapandji) pinning of distal radius with and without external fixation. J. Hand Surg. (Am), 1998; 23 (3): 381-394.
31. DePalma A.F. Comminuted fractures of the distal end of the radius treated by ulnar pinning. J. Bone Joint Surg. Am., 1952; 34: 651-662.
32. Outerbridge R.E.: The etiology of chondromalacia patellae. J. Bone Joint Surg. Br., 1961; 43: 752-757.
33. Llinas, A., et al.: Healing and remodeling of articular incongruities in a rabbit fracture model. J. Bone and Joint Surg., 1993; 75-A: 1508-1523.
34. Augé II W.K., Velázquez P.A.:.The application of indirect reduction techniques in the distal radius. The role of adjuvant arthroscopy. Arthroscopy, November-December 2000; 16, 8: 830-835.
35. Lindau T.: Wrist arthroscopy in distal radial fractures using a modified horizontal technique. Arthroscopy, January 2001,Vol 17, No 1, on-line short report E5-E5.
36. Watson, H.K. and Ballet, F.L.: The SLAC wrist: scapholunate advanced collapse pattern of degenerative arthritis. J. Hand Surg. [Am]., 1984; 9A:358-365.
37. Widawski T., Synder M.: Ocena stabilności nadgarstka po przebytym złamaniu nasad dalszych kości przedramienia. Chirurgia Narządów Ruchu i Ortopedia Polska, 2002; 67 (2), 169-173.
38. John G., et al.: Wrist Arthroscopy for the Treatment of Ligament and TriangularFibrocartilage Complex Injuries. Arthroscopy, 1998; 14, 5: 479-483.
39. Ruch D.S., Yang C.C., Paterson Smith B.: Results of acute arthroscopically repaired triangular fibrocartilage complex injuries associated with intra-articular distal radius fractures. Arthroscopy, May-June 2003; Vol 19, No 5: 511-516.
otrzymano/received: 2007-01-24 zaakceptowano/accepted: 2007-04-02 Adres/address: *Bartłomiej Kordasiewicz Klinika Chirurgii Urazowej Narządu Ruchu i Ortopedii CMKP SPSK im. Prof. A. Grucy ul. Konarskiego 13, 05-400 Otwock tel/fax. (0-22) 788-56-75 bartekko@tlen.pl Pełna wersja artykułu Leczenie złamań końca dalszego kości promieniowej dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








