|
© Borgis - Postępy Nauk Medycznych 4, s. 112-118
*Tomasz Sikorski, Ewa Marcinowska-Suchowierska
Interpretacja wyników badań hematologicznych w praktyce lekarza rodzinnego
An interpretation of results of haematological tests in general practice
Klinika Medycyny Rodzinnej i Chorób Wewnętrznych Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. dr hab. med. Ewa Marcinowska-Suchowierska Streszczenie
Praca zawiera przegląd badań z zakresu hematologii dostępnych dla lekarza rodzinnego w Polsce i interpretację ich wyników. Omówiono diagnostykę niedokrwistości i innych zaburzeń składu morfologicznego krwi, zaburzeń hemostazy i zmian w białkach krwi. Słowa kluczowe: badania diagnostyczne, hematologia, lekarz rodzinny
Summary
The purpose of this article is to review haematological tests which are available to general practitioner in Poland and to interpret their results. The authors described diagnostics of anaemia and other abnormalities in complete blood cell count, disorders of haemostasis, and changes in blood proteins. Key words: diagnostics, general practitioner, haematology
WPROWADZENIE
Bardzo ograniczona dostępność diagnostyki i konieczność uwzględniania kosztów wymusza celowane i wysoce zindywidualizowane zlecanie badań oraz uzyskiwanie maksymalnych informacji z ich interpretacji. Lekarz rodzinny musi wiedzieć przede wszystkim, jakie informacje diagnostyczne otrzyma zlecając konkretne badanie. Dostępne dla lekarza rodzinnego badania hematologiczne (1, 2) podzielono na 4 rodzaje w zależności od informacji diagnostycznych, które z sobą niosą: 1) rozpoznające zaburzenia składu morfologicznego krwi, 2) pomocne w diagnostyce różnicowej tych zaburzeń, 3) rozpoznające zaburzenia hemostazy i 4) testy białkowe (tab. 1). Badanie morfologii krwi obwodowej analizatorem elektronicznym (3) mierzy bezpośrednio stężenie hemoglobiny (metoda fotokolorymetryczna), liczbę erytrocytów, leukocytów (z ich rozdziałem na granulocyty, limfocyty i pozostałe krwinki białe, a przy użyciu nowszych analizatorów na 5 rodzajów krwinek: granulocyty obojętnochłonne, granulocyty kwasochłonne, granulocyty zasadochłonne, limfocyty i monocyty) i płytek krwi (metoda pomiaru impedancji elektrycznej), a z rozkładu wielkości erytrocytów wylicza średnią arytmetyczną ich objętości (MCV) i współczynnik zmienności ich objętości jako stosunek odchylenia standardowego do MCV podawany w procentach (RDW). Hematokryt jest obliczany automatycznie na podstawie formuły matematycznej, podobnie jak mało przydatne 2 pozostałe wskaźniki czerwonokrwinkowe (MCH i MCHC). W każdym przypadku zmian patologicznych w morfologii krwi konieczna jest manualna ocena mikroskopowa rozmazu krwi obwodowej barwionego metodą MGG. Szereg dodatkowych badań – zarówno czysto hematologicznych (liczba retikulocytów, parametry przemiany żelaza i hemoglobiny), jak i innych badań biochemicznych (kreatynina, ALAT, ASPAT, LDH, TSH w surowicy) – umożliwia przynajmniej wstępne różnicowanie zaburzeń składu morfologicznego krwi, głównie niedokrwistości, przez lekarza rodzinnego, bez konieczności kierowania do specjalisty. Pozostające do dyspozycji lekarza rodzinnego badania pozwalają jedynie na skrining zaburzeń w zakresie hemostazy płytkowej i osoczowej (INR, APTT). Testy oceniające zmiany w białkach krwi wykorzystywane są szeroko w diagnostyce zakażeń, układowych chorób zapalnych i chorób nowotworowych, w tym również krwi (szpiczak) oraz ich powikłań i często są podstawą kierowania pacjenta do specjalisty lub szpitala. Katalog dostępnych dla lekarza rodzinnego badań nie jest doskonały i zastrzeżenia autorów budzi zwłaszcza umieszczenie w nim samego stężenia żelaza w surowicy, bez całkowitej zdolności wiązania żelaza w surowicy (TIBC), co pozwoliłoby wyliczyć wysycenie transferyny. Lepszym rozwiązaniem, choć nieco droższym, byłaby możliwość oznaczenia stężenia ferrytyny w surowicy dla oceny przemiany żelaza. Interpretując wyniki badań hematologicznych należy znać nie tylko zakres wartości prawidłowych (wartości referencyjnych) podawany przez laboratorium, ale uwzględnić również płeć pacjenta (liczba erytrocytów, stężenie hemoglobiny i hematokryt niższe u kobiet niż mężczyzn), wiek (inne wartości u małych dzieci niż u dorosłych, rozmaz limfocytarny u dzieci do 6 r.ż.) i stan fizjologiczny (spadek stężenia hemoglobiny i hematokrytu u kobiet w ciąży).
Tabela 1. Rodzaje badań hematologicznych.
* Nie należy do katalogu badań lekarza rodzinnego.
NIEDOKRWISTOŚĆ
Niedokrwistość rozpoznajemy wg kryteriów WHO na podstawie obniżonego stężenia hemoglobiny w krwi <120 g/L u kobiet i <130 g/L u mężczyzn (4). U pacjenta palącego papierosy lub mieszkającego na dużej wysokości należy jednak te granice podnieść od 3 do 7 g/L, zależnie od liczby wypalanych paczek papierosów, i od 2 do 20 g/L, zależnie od wysokości nad poziomem morza (5). Wygodny dla dalszej diagnostyki etiologicznej jest podział niedokrwistości na podstawie wartości MCV (3) na 3 typy: mikrocytową (MCV
Tabela 2. Przyczyny mikrocytozy i niedokrwistości mikrocytowej.
Tabela 3. Przyczyny niedokrwistości normocytowej.
Tabela 4. Przyczyny makrocytozy i niedokrwistości makrocytowej.
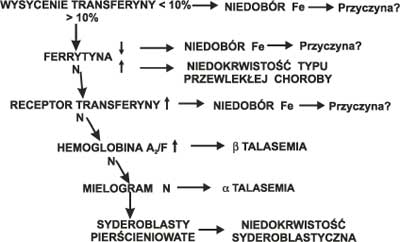 Ryc. 1. Diagnostyka niedokrwistości mikrocytowej
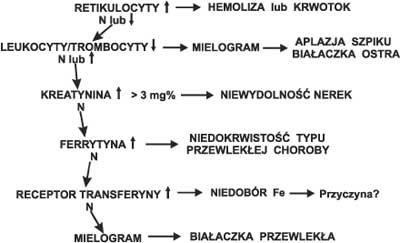 Ryc. 2. Diagnostyka niedokrwistości normocytowej
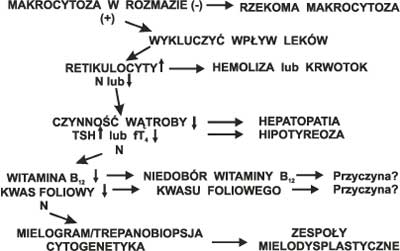 Ryc. 3. Diagnostyka niedokrwistości makrocytowej.
NADKRWISTOŚĆ
Nadkrwistość rozpoznajemy na podstawie podwyższonej wartości hematokrytu, który lepiej koreluje z zaburzeniami reologicznymi niż liczba erytrocytów. Hematokryt powyżej 0,48 u kobiet i 0,52 u mężczyzn pozwala rozpoznać nadkrwistość (10). Należy pamiętać, że hematokryt powyżej 0,54 jest wskazaniem do krwioupustu, jeśli nie można go szybko obniżyć w inny sposób. Nadkrwistość spowodowana zmniejszeniem objętości osocza przy prawidłowej masie erytrocytów określana jest jako względna (rzekoma), natomiast spowodowana wzrostem masy erytrocytów jako bezwzględna (prawdziwa). Przyczyny względnej nadkrwistości przedstawia tabela 5. Warto zwrócić uwagę na zespół Geisbocka, czyli występowanie podwyższonego hematokrytu u młodego mężczyzny, często otyłego, palacza papierosów, pracującego w stresie, niekiedy z nadciśnieniem tętniczym, jako przykład nadkrwistości względnej. Po wykluczeniu przyczyn nadkrwistości względnej, o ile hematokryt nie przekracza 0,56 u kobiet i 0,60 mężczyzn, rozpoznanie nadkrwistości bezwzględnej wymaga pomiaru masy erytrocytów metodą izotopową (10). Przyczyny nadkrwistości bezwzględnej wtórnej to hipoksemia, obecność nieprawidłowej hemoglobiny o zwiększonej zdolności wiązania tlenu (hemoglobinopatia) i zwiększone wytwarzanie erytropoetyny, a pierwotnej – czerwienica prawdziwa, wymagające już diagnostyki specjalistycznej. Wykrycie obniżonego stężenia erytropoetyny w surowicy pozwala zróżnicować klonalne (np. czerwienica prawdziwa) i nieklonalne, wtórne nadkrwistości bezwzględne (3, 10).
Tabela 5. Przyczyny nadkrwistości względnej.
MAŁOPŁYTKOWOŚĆ I NADPŁYTKOWOŚĆ
Zmniejszona liczba płytek krwi poniżej 150 K/mL pozwala rozpoznać małopłytkowość. W każdym przypadku, a zwłaszcza jeśli znacznej małopłytkowości nie towarzyszą objawy skazy krwotocznej skórno-śluzówkowej, należy wykluczyć małopłytkowość rzekomą. Prawidłowa liczba płytek krwi przy zastosowaniu innego niż wersenian antykoagulanta potwierdza rozpoznanie małopłytkowości rzekomej zależnej od obecnych w surowicy pacjenta przeciwciał reagujących z płytkami krwi ex vivo tylko w krwi wersenianowej (2). Należy pamiętać również o łagodnej małopłytkowości ciężarnych (75-150 K/mL), która nie wymaga dalszej diagnostyki. Małopłytkowość może wynikać ze zmniejszonego wytwarzania płytek krwi w szpiku (np. aplazja szpiku, cytostatyki, alkohol etylowy, wirusy) lub zwiększonego niszczenia ich w krwi obwodowej w mechaniźmie immunologicznym (samoistna plamica małopłytkowa ostra i przewlekła, ITP) lub nieimmunologicznym (zespół rozsianego wykrzepiania śródnaczyniowego, DIC, i zakrzepowa plamica małopłytkowa, TTP). W pierwszej kolejności należy wykluczyć TTP (schistocyty, czyli fragmentocyty w rozmazie krwi obwodowej, wzrost aktywności LDH i stężenia kreatyniny w surowicy) oraz DIC (wzrost stężenia D-dimerów w surowicy), gdyż zespoły te stanowią zagrożenie dla życia pacjenta i wymagają pilnego leczenia (3). W następnej kolejności eliminujemy polekowe małopłytkowości (należy pamiętać o heparynie) i hipersplenizm. Leczenie preparatem krwiopochodnym 1-2 tygodnie wcześniej sugeruje małopłytkowość potransfuzyjną. Chociaż rozpoznanie ITP stawiane jest po wykluczeniu innych immunologicznych przyczyn małopłytkowości (kolagenoza, chłoniak, zakażenie HIV), jej potwierdzenie wymaga wykonania specjalistycznych badań przeciwciał przeciwpłytkowych w surowicy lub immunoglobulin obecnych na płytkach krwi. Inne rzadsze przyczyny małopłytkowości (np. wrodzone) wymagają diagnostyki hematologicznej. Różnicowanie przyczyn małopłytkowości przedstawia rycina 4.
 Ryc. 4. Diagnostyka małopłytkowości.
Nadpłytkowość, czyli wzrost liczby płytek krwi powyżej 350 K/mL, najczęściej ma charakter odczynowy (wtórna nadpłytkowość), rzadziej klonalny (klonalna nadpłytkowość) w przewlekłych zespołach mieloproliferacyjnych: czerwienicy prawdziwej, przewlekłej białaczce szpikowej, a zwłaszcza samoistnej (pierwotnej) nadpłytkowości (3, 11). Diagnostyka przewlekłych zespołów mieloproliferacyjnych wymaga specjalistycznych badań hematologicznych. Niekiedy dokładna ocena rozmazu krwi obwodowej i wykrycie olbrzymich płytek krwi (megatrombocytów), erytroblastów lub erytrocytów w kształcie łez, zmiana składu leukocytów z odmłodzeniem w układzie granulocytów do promielocyta czy mielocyta i wzrost odsetka granulocytów zasadochłonnych mogą nasuwać podejrzenie przewlekłego zespołu mieloproliferacyjnego. Obecność splenomegalii i/lub hepatomegalii może przemawiać za takim rozpoznaniem. Najczęstsze przyczyny wtórnej nadpłytkowości przedstawia tabela 6. Należy w tym miejscu przypomnieć, iż nadpłytkowość często występuje w niedokrwistości z niedoboru żelaza.
Tabela 6. Przyczyny nadpłytkowości wtórnej.
ZMIANY LICZBY I SKŁADU LEUKOCYTÓW
Zmiany liczby i składu leukocytów są najczęściej stwierdzanymi odchyleniami w morfologii krwi obwodowej. Lepszy wgląd w istotę zaburzeń liczby i składu leukocytów daje posługiwanie się wartościami bezwzględnymi poszczególnych rodzajów krwinek białych niż ich wartościami odsetkowymi. Bezwzględna liczba granulocytów obojętnochłonnych jest bezpośrednio mierzona w analizatorze hematologicznym lub obliczana jako iloczyn całkowitej liczby leukocytów i sumy odsetka pałek i segmentów w rozmazie krwi obwodowej (3). Analogicznie otrzymuje się bezwzgledną liczbę pozostałych rodzajów krwinek białych. W tabeli 7 przedstawiono dolne i górne granice normy bezwzględnej liczby poszczególnych rodzajów krwinek białych (12, 13).
Tabela 7. Bezwzględna liczba leukocytów (dla populacji w wieku> 10 lat).
*U palaczy papierosów.
Spadek liczby leukocytów, czyli leukopenia, może być następstwem zmniejszonego wytwarzania krwinek białych w szpiku (np. aplazja szpiku, cytostatyki i inne leki, napromienianie, wirusy) lub zwiększonego niszczenia ich w krwi obwodowej w mechaniźmie immunologicznym (neutropenia autoimmunologiczna lub polekowa, zespół Felty). Neutropenia oznacza spadek bezwzględnej liczby granulocytów obojętnochłonnych poniżej dolnej granicy normy (1,5 K/mL); o ciężkiej mówimy wtedy, gdy ich liczba spada <0,5 K/mL, co oznacza zwiększone ryzyko zakażenia. Wzrost liczby leukocytów jest wynikiem zwiększonego odczynowego ich wytwarzania w szpiku kostnym w odpowiedzi na proces zapalny, bardzo często o etiologii bakteryjnej, uraz, martwicę, kwasicę, nowotwór (odczyn białaczkowy) lub pierwotnego (białaczka ostra lub przewlekła). Zmianom liczby leukocytów towarzyszą zwykle zmiany ich składu odsetkowego; np. w zakażeniu bakteryjnym odmłodzenie w układzie granulocytów do promielocyta i mielocyta, ze zwiększeniem odsetka i wartości bezwzględnych pałek i segmentów, a w zakażeniu wirusowym zwiększenie odsetka limfocytów, niekiedy monocytów, czy też obecność charakterystycznych dla mononukleozy zakaźnej mononuklearów. Szczegółowy opis zmian w składzie leukocytów w różnych chorobach infekcyjnych podają podręczniki chorób zakaźnych. Leukocytoza neutrofilowa z obecnością młodych komórek układu granulocytarnego, granulocytów zasadochłonnych i niekiedy erytroblastów (tzw. obraz leukoerytroblastyczny krwi) nasuwa podejrzenie przewlekłego zespołu mieloproliferacyjnego, a jeśli występuje również monocytoza powyżej 1,0 K/mL – przewlekłej białaczki mielomonocytowej. Dominacja dojrzałych limfocytów w rozmazie ze wzrostem ich bezwzględnej liczby sugeruje przewlekłą białaczkę limfatyczną. Obecność blastów w rozmazie krwi obwodowej budzi podejrzenie ostrej białaczki. W chorobach pasożytniczych, alergicznych, kolagenozach, w fazie zdrowienia po zakażeniu bakteryjnym i w białaczce eozynofilowej występuje zwiększenie odsetka i bezwzględnej liczby granulocytów kwasochłonnych.
ZABURZENIA HEMOSTAZY
Dla diagnostyki skaz krwotocznych lekarz rodzinny ma do dyspozycji czas częściowej tromboplastyny po aktywacji (APTT), INR i liczbę płytek krwi. Wydłużenie czasu APTT występuje we wrodzonych lub nabytych niedoborach osoczowych czynników krzepnięcia, a także przy obecności antykoagulanta toczniowego (12, 14). Podwyższony INR, czyli wydłużony czas protrombinowy, o ile nie jest wynikiem leczenia doustnym antykoagulantem, wskazuje na wrodzony lub nabyty niedobór osoczowych czynników krzepnięcia zależnych od witaminy K, najczęściej występujący w niewydolności wątroby. Ponieważ liczba płytek krwi 50 K/mL jest wystarczająca dla zapewnienia hemostazy w większości przypadków, dopiero przy większym nasileniu małopłytkowości należy spodziewać się jawnej skazy krwotocznej. Prawidłowa liczba płytek krwi i prawidłowy INR i APTT nie wykluczają skazy krwotocznej, zwłaszcza choroby von Willebranda (14). Pacjent wymaga wówczas diagnostyki w pracowni koagulologicznej.
ZABURZENIA BIAŁEK KRWI
Zmiany ilościowe i jakościowe w białkach krwi wykorzystywane są do diagnostyki chorób zapalnych, infekcyjnych i nieinfekcyjnych, nowotworowych i przebiegających z martwicą. Są one elementami tzw. odpowiedzi ostrej fazy (acute-phase response), czyli odpowiedzi organizmu na każdy czynnik uszkadzający, mającej charakter obronny i należącej do naturalnej odporności (15, 16). Do białek osoczowych, których stężenie wzrasta w odpowiedzi ostrej fazy, należy fibrynogen i białko C-reaktywne (C-reactive protein, CRP). Pośrednim testem na zmiany w białkach krwi jest szybkość opadania erytrocytów (odczyn opadania, czyli odczyn Biernackiego, OB), która koreluje ze stężeniem fibrynogenu w osoczu (15). Dodatkowo lekarz rodzinny może oznaczyć stężenie białka całkowitego i albumin w surowicy, wykonać rozdział elektroforetyczny białek surowicy, czyli proteinogram i oznaczyć czynnik reumatoidalny.
Odczyn OB wykonywany metodą Westergrena, wprowadzoną przed ponad 80 laty, bardzo często zlecany przez lekarzy, jest prostym, tanim i szybkim testem (15). Ale są to jego jedyne zalety. Poza stężeniem fibrynogenu wiele innych czynników, w tym związane z samym wykonaniem testu, mają wpływ na wartość OB (tab. 8). Znaczenie OB we współczesnej diagnostyce znacznie zmalało wraz z rozwojem nowych metod. Podwyższony OB jest kryterium diagnostycznym jedynie w dwóch chorobach: polimialgii reumatycznej i zapaleniu tętnicy skroniowej (15). U prawie wszystkich pacjentów z polimialgią reumatyczną i zapaleniem tętnicy skroniowej OB przekracza 30 mm/godz. OB ma zastosowanie do monitorowania aktywności choroby i odpowiedzi na leczenie również tylko w polimialgii reumatycznej, zapaleniu tętnicy skroniowej i reumatoidalnym zapaleniu stawów. Wzrost OB może oznaczać wznowę w ziarnicy złośliwej. W nowotworach litych OB powyżej 100 mm/godz. wskazuje zwykle na przerzuty. Znaczenie w diagnostyce ma ekstremalnie wysoki OB, czyli powyżej 100 mm/godz. (trójcyfrowy), który występuje najczęściej w zakażeniach, kolagenozach, nowotworach z przerzutami i szpiczaku mnogim lub innej gammapatii monoklonalnej (15). U bezobjawowego pacjenta z ekstremalnie wysokim OB, poza wywiadem i badaniem fizykalnym, podstawowa diagnostyka powinna obejmować rtg klatki piersiowej i próbę tuberkulinową, morfologię krwi, stężenie kreatyniny i mocznika w surowicy oraz badanie ogólne moczu, badania biochemiczne wątroby, badanie kału na krew utajoną i elektroforezę białek surowicy i moczu (15). Nieznacznie lub umiarkowanie podwyższony OB (poniżej 100 mm/godz.) bez objawów chorobowych nie jest wskazaniem do intensywnej diagnostyki laboratoryjnej, obrazowej, czy inwazyjnej, ale powinien być powtórzony po kilku miesiącach (15).
Tabela 8. Czynniki wpływające na OB.
CRP jest białkiem osocza zależnym od wapnia wiążącym ligandy, produkowanym przez hepatocyty pod wpływem IL-6 (16). Nazwa białka pochodzi od jego właściwości precypitacji somatycznego wielocukru C Streptococcus pneumoniae. CRP jest zdecydowanie lepszym testem niż OB, chociaż droższym. Wzrost jego stężenia występuje wcześniej (już w pierwszych 24 godzinach choroby), jest wysoki (nawet 10 000 razy powyżej wartości wyjściowej) i szybko spada po zaprzestaniu działania wyzwalającego czynnika chorobowego (16). Nie wykazuje ono wahań dobowych, nie wpływa na nie posiłek, większość leków ani inne stany chorobowe – z wyjątkiem niewydolności wątroby. Wysoki wzrost CRP występuje w zakażeniach (bakteryjnych, grzybiczych, wirusowych), alergicznych powikłaniach zakażeń (gorączce reumatycznej, rumieniu guzowatym), chorobach zapalnych (reumatoidalnym zapaleniu stawów, również młodzieńczym, zesztywniającym zapaleniu stawów kręgosłupa, łuszczycowym zapaleniu stawów, układowych zapaleniach naczyń, polimialgii reumatycznej, zespole Reitera, chorobie Crohna), przy martwicy (zawale serca, ostrym zapaleniu trzustki), urazie (chirurgicznym, oparzeniach, złamaniach), nowotworach (16). Natomiast w toczniu układowym (SLE), twardzinie układowej, zapaleniu skórno-mięśniowym, wrzodziejącym zapaleniu jelita grubego, białaczce, chorobie przeszczep przeciwko gospodarzowi, jeśli nie są powikłane zakażeniem, wzrost CRP jest umiarkowany lub go brak (16). Kliniczne zastosowania CRP to skrining choroby organicznej, ocena aktywności choroby w stanach zapalnych, rozpoznanie i leczenie zakażeń, zwłaszcza przy obniżonej odporności lub będących powikłaniami chorób układowych, a także różnicowanie chorób zapalnych. Wysokość stężenia CRP, ale jeszcze w granicach normy (poniżej 10 mg/L), pozwala przewidywać ryzyko epizodów wieńcowych w kardiologii (16, 17), jeśli dysponuje się metodą oznaczania CRP o wysokiej czułości (np. immunoturbidymetryczną o czułości 0,02 mg/L).
Elektroforeza białek surowicy w zależności od zastosowanego nośnika rozdziela je na 5 lub 6 głównych frakcji, z których każda zawiera białka indywidualne: albuminy, a1-globuliny (m.in. a1-antytrypsyna, HDL, kwaśna a1-glikoproteina), a2-globuliny (m.in. a2-makroglobulina, haptoglobina, ceruloplazmina), b-globuliny (m.in. transferyna, hemopeksyna, LDL) i g-globuliny (immunoglobuliny IgA, IgG, IgM). Dysproteinemia, czyli zaburzenie wzajemnych proporcji poszczególnych frakcji białkowych, występuje często w chorobach zapalnych (wzrost a1-globulin i a2-globulin), natomiast paraproteinemia, czyli pojawienie się ostro odgraniczonego wysokiego pasma we frakcji b-globulin lub g-globulin wskazującego na obecność białka patologicznego (białko monoklonalne, białko M) – najczęściej w szpiczaku mnogim, makroglobulinemii Waldenströma lub monoklonalnej gammapatii o nieokreślonym znaczeniu (18).
Odczyn lateksowy wykrywa obecność w surowicy czynnika reumatoidalnego (RF) klasy IgM w chorobach tkanki łącznej. Test polega na aglutynacji cząsteczek lateksu (nośnik) opłaszczonych IgG ludzką zagregowaną termicznie (antygen) przez czynnik reumatoidalny klasy IgM (przeciwciało) zawarty w badanej surowicy. Wynik dodatni to aglutynacja przy rozcieńczeniu surowicy powyżej 1:40 i najczęściej wystepuje w reumatoidalnym zapaleniu stawów (19). Piśmiennictwo
1. Materiały informacyjne NFZ – POZ. Zakres zadań lekarza POZ. Załącznik nr 1 do informacji 2006:1-16 (www.nfz-warszawa.pl/index/poz2006).
2. Materiały informacyjne NFZ – POZ. Wykaz badań diagnostycznych niezbędnych przy udzielaniu świadczeń zdrowotnych w zakresie podstawowej opieki zdrowotnej. Załącznik nr 8 do informacji 2006:1-2 (www.nfz-warszawa.pl/index/poz2006).
3. Tefferi A. et al.: How to interpret and pursue an abnormal complete blood cell count in adults. Mayo Clin Proc 2005; 80: 923-36.
4. Iron Deficiency Anemia. Assessment, Prevention, and Control. A guide for programme managers. WHO/NHD/01.3. World Health Organization 2001.
5. Centers for Disease Control and Prevention. Recommendations to Prevent and Control Iron Deficiency in the United States. Morbidity and Mortality Weekly Report. Atlanta, GA: US Dept. of Health and Human Services. 1998; 47 (No. RR-3):1.
6. Massey A.C.: Microcytic anemia: differential diagnosis and management of iron deficiency anemia. Med Clin North Am 1992, 76: 549.
7. Weiss G., Goodnough L.T.: Anemia of chronic disease. N Engl J Med 2005; 352: 1011.
8. DeLoughery T.G.: Anemia: a review of diagnosis and therapy. Oregon Health and Science University, Division of Hematology and Medical Oncology, April 2004, 1-12 (www.ohsu.edu/ohsuedu/healthcare/hemonc/faculty/delougheryhandouts.cfm).
9. Colon-Otero G. et al.: A practical approach to the differential diagnosis and evaluation of the adult patient with macrocytic anemia. Med Clin North Am 1992, 76: 581.
10. McMullin M.F. et al.: On behalf of the General Haematology Task Force of the British Committee for Standards in Haematology. Guidelines for the diagnosis, investigation and management of polycythaemia/erythrocytosis. Br J Haematol 2005; 130: 174.
11. Schafer A.I.: Thrombocytosis. N Engl J Med 2004; 350: 1211.
12. O´Connell C., Dickey V.L.: Blueprints Hematology and Oncology. Oxford: Blackwell Publishing Ltd; 2005.
13. Williams W.J., Beutler E., Erslev A.J., Lichtman M.A., editors. Hematology. 4th ed. New York: McGraw-Hill; 1991, 807, 1101, 1616.
14. Khair K., Liesner R.: Bruising and bleeding in infants and children – a practical approach. Br J Haematol 2006, 133: 221.
15. Brigden M.L.: Clinical utility of the erythrocyte sedimentation rate. Am Fam Physician 1999, 60: 1443.
16. Pepys M.B., Hirschfield G.M.: C-reactive protein: a critical update. J Clin Invest 2003,111: 1805.
17. Danesh J. et al.: C-reactive protein and other circulating markers of inflammation in the prediction of coronary heart disease. N Engl J Med 2004; 350: 1387.
18. The International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 2003; 121: 749.
19. Anuradha V., Chopra A.: In the era of nephelometry, latex agglutination is still good enough to detect rheumatoid factor. J Rheumatol 2005; 32: 2343.
otrzymano/received: 2006-12-18 zaakceptowano/accepted: 2007-03-01 Adres/address: *Tomasz Sikorski Klinika Medycyny Rodzinnej i Chorób Wewnętrznych CMKP SPSK im. Prof. W. Orłowskiego ul. Czerniakowska 231, 00-416 Warszawa tel. (0-22) 628 69 50, fax (0-22) 622 79 81 e-mail: tsikorski@szpital-orlowskiego.pl Pełna wersja artykułu Interpretacja wyników badań hematologicznych w praktyce lekarza rodzinnego dostępna w Czytelni Medycznej Borgis. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








