|
© Borgis - Postępy Nauk Medycznych 6, s. 474-479
*Marzena Wojewódzka-Żelezniakowicz1, Sławomir Lech Czaban1, Ewa Chabielska2, Jerzy Robert Ładny1
Ostre zespoły wieńcowe w aspekcie działań medycyny ratunkowej
Acute coronary syndromes in the emergency medicine activities
1Zakład Medycyny Ratunkowej i Katastrof Uniwersytetu Medycznego, Szpitalny Oddział Ratunkowy Uniwersyteckiego Szpitala Klinicznego w Białymstoku
Kierownik Zakładu: prof. dr hab. med. Jerzy Robert Ładny 2Samodzielna Pracownia Biofarmacji Uniwersytetu Medycznego w Białymstoku Kierownik Pracowni: prof. dr hab. Ewa Chabielska Streszczenie
Chorzy z bólem w klatce piersiowej należą do grupy osób stosunkowo często przyjmowanych do Szpitalnego Oddziału Ratunkowego. Każdy z tych chorych wymaga diagnostyki w kierunku ostrego zespołu wieńcowego (OZW). Postawienie podejrzenia OZW często jest możliwe już w warunkach przedszpitalnych na podstawie wykonanego 12-odprowadzeniowego EKG. Na tej podstawie powinno się kwalifikować chorego do odpowiedniego postępowania terapeutycznego. Pomocna w tych przypadkach stała się telemetria, która wykorzystuje możliwo?ć przekazania zapisu EKG do o?rodka kardiologicznego, w którym zostanie podjęta decyzja dotycząca dalszego postępowania z chorym. Dlatego też niezwykle ważne jest sprawne i rozsądne postępowanie diagnostyczne i wczesne terapeutyczne, tak by chory jak najszybciej uzyskał leczenie ostateczne wła?ciwe do jego stanu. W tym zakresie medycyna ratunkowa staje się najbliższym partnerem nowoczesnej kardiologii inwazyjnej, z którą zobowiązana jest wypracować i wdrażać standardy diagnostyki, wstępnej farmakoterapii i najkorzystniejszej strategii działań interwencyjnych. Słowa kluczowe: ostre zespoły wieńcowe, elektrokardiografia, zespół podstawowy, zespół specjalistyczny, transport, leczenie inwazyjne
Summary
Patients with chest pain belong to the group of people that are relatively often admitted to emergency department. Each of these patients requires diagnostics towards Acute Coronary Syndrome (ACS). Diagnosing the suspicion of ACS is often possible already in pre-hospital conditions on the basis of 12-leads ECG. On this basis, the patient is to be qualified for appropriate therapeutic procedure. Useful in such cases became telemetry which uses the possibility of transferring the ECG record to a cardiology centre in which the decision concerning further treatment of the patient is taken. That is why efficient and sensible diagnostic and early therapeutic procedure is extremely important so that the patient receives the definitive treatment appropriate for his/her condition as soon as possible. Within this scope, emergency medicine becomes the closest partner of modern invasive cardiology with which it is obliged to work out and implement the standards of diagnostics, initial pharmacotherapy and the most beneficial strategy of emergency activities. Key words: chest pain, Acute Coronary Syndrome, 12-leads ECG, emergency team, specialist team, transport, invasive treatment
Choroby układu sercowo-naczyniowego wciąż stanowią pierwszą przyczynę zgonów. Chorzy z podejrzeniem ostrego zespołu wieńcowego są najczęstszymi pacjentami szpitalnych oddziałów ratunkowych. W materiale autorów 43% pacjentów rocznie zgłasza się z bólem w klatce piersiowej, który wymaga różnicowania z ostrym zespołem wieńcowym. W Stanach Zjednoczonych do oddziałów ratunkowych przyjmowanych jest około 4,6 miliona chorych z bólem w klatce piersiowej, przy czym u 2,1% chorych zawał serca i 2,3% chorych niestabilna dławica piersiowa nie są rozpoznawane (1). W Kanadzie odsetek ten jest wyższy i odpowiednio u 4,6% i 6,4% powyższe ostre stany zagrożenia życia nie są prawidłowo diagnozowane (2). Oznacza to, że metody diagnostyczne zawału serca szczególnie we wczesnej jego fazie wciąż nie są doskonałe i może zdarzać się, że chory, u którego dokonuje się zawał serca nie ma prawidłowo postawionego rozpoznania. Należy zatem poszukiwać metod, które uzupełniając się wzajemnie pozwolą na obniżenie do minimum ryzyka błędnego rozpoznania lub nie rozpoznania przyczyny bólu w klatce piersiowej, będącego niejednokrotnie jedynym objawem ostrego zespołu wieńcowego.
Ostry zespół wieńcowy jest rozpoznaniem wstępnym. Dalsza diagnostyka możliwa w warunkach przedszpitalnych pozwala poszerzyć to rozpoznanie o ostry zespół wieńcowy z przetrwałym uniesieniem odcinka ST (STEMI), lub bez przetrwałego uniesienia odcinka ST (NSTEMI). W końcu oznaczenie troponiny pozwala postawić końcowe rozpoznanie jakim jest zawał serca z uniesieniem odcinka ST (STEMI), lub bez uniesienia odcinka ST (NSTEMI) lub niestabilna dławica. Zwykle w Polsce rozpoznania te są stawiane w szpitalu po rozpatrzeniu cało?ciowego obrazu klinicznego, badań biochemicznych i obrazowych.
W 2007 roku europejskie oraz amerykańskie towarzystwa kardiologiczne wspólnie opublikowały nową definicję zawału serca (3). ?wieży zawał serca należy rozpoznać w przypadku obecno?ci dowodów martwicy mię?nia sercowego z towarzyszącym obrazem klinicznym niedokrwienia mię?nia sercowego. Każde z niżej wymienionych kryteriów uprawnia do rozpoznania ?wieżego zawału serca (4):
1. Stwierdzenie wzrostu lub zmniejszenia stężenia lub aktywno?ci biomarkerów sercowych (najlepiej troponiny) z co najmniej jedną warto?cią przekraczającą 99. centyl zakresu referencyjnego, z towarzyszącym co najmniej jednym dowodem niedokrwienia mię?nia sercowego:
a. objawy podmiotowe niedokrwienia mię?nia sercowego,
b. zmiany w EKG wskazujące na ?wieże niedokrwienie – nowe zmiany odcinka ST-T lub nowopowstały LBBB (blok lewej odnogi pęczka Hisa),
c. powstanie patologicznych załamków Q w EKG,
d. dowody w badaniach obrazowych ?wiadczące o utracie żywotnego mię?nia sercowego lub nowe, odcinkowe zaburzenia kurczliwo?ci.
2. Nagła ?mierć sercowa obejmująca nagłe zatrzymanie krążenia, często z objawami wskazującymi na niedokrwienie mię?nia sercowego; z towarzyszącym przypuszczalnie nowym uniesieniem odcinka ST lub LBBB, bąd? udokumentowany koronarograficznie lub w badaniu po?miertnym ?wieży zakrzep.
3. W przypadku zabiegów rewaskularyzacji przezskórnej (PCI) u chorych z prawidłowym wyj?ciowym stężeniem troponiny każdy wzrost powyżej 99. centyla zakresu referencyjnego wskazuje na okołozabiegową martwicę mię?nia sercowego. Zwiększenie stężenia przekraczające 3-krotnie górną granicę normy umownie przyjęto uważać za zawał serca związany z PCI.
4. W przypadku pomostowania tętnic wieńcowych (CABG) u chorych z prawidłowym, wyj?ciowym stężeniem troponiny, każdy wzrost powyżej 99. centyla zakresu referencyjnego wskazuje na okołozabiegową martwicę mię?nia sercowego. Zwiększenie stężenia przekraczające 5-krotnie 99. centyl zakresu referencyjnego z towarzyszącymi:
a. nowymi, patologicznymi załamkami Q albo nowym LBBB w EKG, lub
b. angiograficznie potwierdzoną ?wieżą okluzją tętnicy natywnej lub pomostu, lub
c. dowodami w badaniach obrazowych ?wiadczącymi o utracie żywotno?ci mię?nia sercowego,
definiuje się jako zawał związany z CABG.
5. Zmiany anatomopatologiczne ?wiadczące o ?wieżym zawale serca.
Do rozpoznania przebytego zawału serca uprawnia stwierdzenie jakiegokolwiek z poniższych kryteriów:
1. Wytworzenie nowych, patologicznych załamków Q niezależnie od obecno?ci objawów podmiotowych.
2. Wykazanie w badaniach obrazowych obszaru mię?nia sercowego pozbawionego żywotno?ci, je?li nie ma innej przyczyny niż niedokrwienie.
3. Stwierdzenie wygojonego lub gojącego się zawału serca w badaniu sekcyjnym.
Definicja ta za główny wyznacznik zawału przyjmuje wzrost markerów martwicy mię?nia sercowego z towarzyszącymi objawami klinicznymi lub zmianami w badaniach obrazowych.
Od czasu zaistnienia medycyny ratunkowej jako odrębnej specjalno?ci i oddziałów ratunkowych jako samodzielnych jednostek w strukturze szpitali obowiązek diagnozowania bólów w klatce piersiowej spoczął wła?nie na nich. To do tych oddziałów trafiają chorzy transportowani w zdecydowanej większo?ci przez zespoły ratownictwa medycznego. Zatem istotne jest by funkcjonujący w Polsce od niedawna system ratownictwa medycznego ułatwiał choremu szybkie dotarcie do wła?ciwego leczenia. Jedną z naczelnych zasad medycyny ratunkowej jest oszczędno?ć czasu zarówno poza, jak i w szpitalu. W dużym badaniu populacyjnym poddającym analizie okres 10 lat wykazano, że pomimo obniżenia ?miertelno?ci wewnątrzszpitalnej w wyniku ostrych zespołów wieńcowych, ?miertelno?ć przedszpitalna nadal pozostaje wysoka, za? do około połowy zgonów dochodzi w ciągu pierwszych 2 godzin (5, 6). Zgodnie z założeniami „złotej godziny” chory niezależnie od przyczyny zachorowania powinien jak najszybciej mieć postawione prawidłowe rozpoznanie i natychmiast wdrożone wła?ciwe leczenie. W tym zakresie medycyna ratunkowa staje się najbliższym partnerem nowoczesnej kardiologii inwazyjnej, ponieważ w przypadku ostrych zespołów wieńcowych wybór metody leczenia jest ?ci?le zależny od upływu czasu.
Postępowanie przedszpitalne u chorych ze STEMI
Rozpoznanie STEMI często jest możliwe już na etapie przedszpitalnym i tu powinna ujawniać się dobra i sprawna współpraca pomiędzy zespołami ratownictwa medycznego a o?rodkami kardiologii inwazyjnej. Większo?ć pacjentów na ból w klatce piersiowej reaguje w podobny sposób – niepokojem oraz lękiem przed ?miercią. Chorzy ci w większo?ci przypadków wzywają zespoły ratownictwa medycznego (RM), które już w domu chorego mogą podjąć odpowiednie działania tak, aby skrócić czas do uzyskania wła?ciwego leczenia. Zgodnie z obecnie obowiązującą ustawą o Państwowym Ratownictwie Medycznym (7) dostępne są 2 rodzaje zespołów RM: „P” – podstawowy (bez lekarza) oraz „S” – specjalistyczny (z lekarzem). Pacjent, który zgłasza ból w klatce piersiowej powinien być wstępnie klasyfikowany jako chory z zawałem serca, co oznacza, że znajduje się w stanie zagrożenia życia. Do takiego chorego powinien być kierowany zespół „S”. Nie zawsze jednak jest to możliwe. Zatem powinien być opracowany schemat postępowania dla zespołów, w składzie których nie ma lekarza, tak by członkowie tego zespołu na miejscu zdarzenia wiedzieli jakie czynno?ci kolejno należy podjąć, aby nie tracić cennego czasu, oczekując na zespół „S”.
Pierwszym etapem postępowania jest zebranie prawidłowego wywiadu medycznego, w formie skróconej lecz umożliwiającej uzyskanie najważniejszych informacji. Należy bezwzględnie ustalić początek dolegliwo?ci oraz ich rodzaj. Typowy ból dławicowy jest silny, trwa dłużej niż 20 minut, nie zmniejsza się po podaniu nitrogliceryny, promieniuje do żuchwy, pleców, lewego ramienia lub palców. U osób w podeszłym wieku dominującymi objawami mogą być: duszno?ć, osłabienie, zasłabnięcie lub utrata przytomno?ci. W dalszej czę?ci wywiadu należy uwzględnić przeszło?ć chorobową pacjenta, a także pozostałe elementy wywiadu okre?lanego akronimem z języka angielskiego SAMPLE (objawy, alergie, leki przyjmowane przez chorego, wywiad chorobowy, ostatni posiłek, zdarzenia lub czynno?ci poprzedzające zachorowanie). Dane te, chociaż skrótowe pozwolą na uzyskanie istotnych informacji o stanie zdrowia chorego, nie pozwalając na nadmierną utratę czasu.
W badaniu przedmiotowym często obserwowane jest pobudzenie układu współczulnego objawiające się blado?cią powłok ciała, potami, tachykardią, hipotensją. Ponadto może wystąpić niemiarowe tętno, trzeci ton serca, rzężenia lub trzeszczenia u podstawy płuc. Choremu powinno się zabronić podejmowania jakiejkolwiek aktywno?ci fizycznej oraz ułożyć w wygodnej pozycji leżącej lub siedzącej, także podczas przenoszenia chorego do karetki. Kolejnym etapem jest wykonanie 12-odprowadzeniowego EKG, optymalnie w ciągu 10 minut od przybycia do pacjenta. W tym momencie w oparciu o obraz EKG powinna być podjęta decyzja dotycząca transportu chorego do odpowiedniego o?rodka. Tu może pojawić się problem diagnostyczny związany z interpretacją zapisu. Ocena obrazu EKG w dużym stopniu zależy od do?wiadczenia członka zespołu RM. Wydaje się jednak, że w XXI wieku opieranie się jedynie na do?wiadczeniu lekarzy lub ratowników medycznych jest zbyt ryzykowne, dlatego też z pomocą przychodzi nowoczesna technologia w postaci systemu telemedycyny (8). System ten wykorzystując telefonię cyfrową pozwala na szybkie przesłanie zapisu 12-odprowadzeniowego EKG z karetki, domu chorego lub innego miejsca, do najbliższego szpitala dysponującego pozostającą w stałej gotowo?ci pracownią hemodynamiki, wykonującą zabiegi angioplastyki wieńcowej. Zestaw nadawczy składa się z defibrylatora z możliwo?cią wykonania pełnego zapisu EKG i przystosowanego do teletransmisji danych, która może odbywać się za pomocą telefonu komórkowego lub specjalnego modemu. Po wykonaniu pełnego EKG członek zespołu RM wykonuje telefon do o?rodka kardiologii inwazyjnej z informacją o gotowo?ci przesłania danych. Dane te są odbierane przez specjalistę kardiologa, który wykonuje telefon zwrotny z zaleceniem dalszego postępowania z chorym, włączając w to farmakoterapię. W przypadku uniesienia odcinka ST w EKG lub pojawienia się ?wieżego bloku lewej odnogi pęczka Hisa oraz czasu od początku dolegliwo?ci nie przekraczającego 12 godzin chory powinien znale?ć się w o?rodku kardiologii inwazyjnej w czasie 90 minut (ryc. 1). Zgodnie z Ustawą o Państwowym Ratownictwie Medycznym zespoły ratownictwa medycznego transportują chorych do najbliższego szpitalnego oddziału ratunkowego, chyba, że lekarz obecny na miejscu zdarzenia zdecyduje inaczej. Wiele zespołów RM w Polsce postępując zgodnie z tą zasadą transportuje chorych najpierw do najbliższego SOR, w którym ustalany jest dalszy plan działania i dopiero wówczas pacjent może być przekazany do miejsca wła?ciwego leczenia. Wykorzystanie telemetrii wiąże się z dużą oszczędno?cią czasu, ponieważ transport pacjenta bezpo?rednio do szpitala wyposażonego w pracownię hemodynamiczną pozostającą w gotowo?ci z pominięciem szpitala po?redniego pozwala „zaoszczędzić” około 40-50 minut (8).
 Ryc. 1. Postępowanie wstępne z chorym z zawałem STEMI.
Postępowaniem z wyboru u chorych ze STEMI w ciągu 12 godzin od początku dolegliwo?ci jest pierwotna angioplastyka (PCI) (ryc. 1). Przeprowadzona metaanaliza 23 badań, łącznie ponad 7700 chorych, wykazała przewagę PCI nad leczeniem fibrynolitycznym pod względem obniżania ?miertelno?ci wczesnej, pó?nej, często?ci udaru mózgu oraz zawału serca nie zakończonego zgonem (9). W styczniu bieżącego roku ukazały się nowe wytyczne Europejskiego Towarzystwa Kardiologicznego dotyczące postępowania w ostrym zawale serca z utrzymującym się uniesieniem odcinka ST. Zaleca się w nich rozważenie pierwotnej PCI, gdy istnieją kliniczne i/lub elektrokardiograficzne dowody postępującego niedokrwienia, nawet gdy dolegliwo?ci trwają dłużej niż 12 godzin (10). Tym samym pierwotna PCI stała się zalecaną formą leczenia ostrego zawału serca szczególnie w grupie chorych z nasilającymi się objawami niedokrwienia.
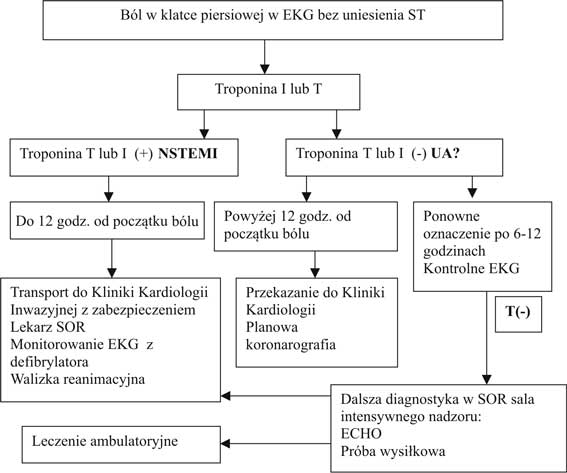 Ryc. 2. Postępowanie diagnostyczne w NSTEMI.
Zaobserwowano również, że u chorych ze STEMI bez utrzymujących się objawów niedokrwienia, u których dolegliwo?ci wystąpiły przed 12-48 godzinami zastosowanie PCI wiązało się z ograniczeniem strefy uszkodzenia mię?nia sercowego (11). Jednak jest zbyt mało danych, aby zalecić wykonywanie PCI rutynowo u chorych bez objawów niedokrwienia. Obecne wytyczne podkre?lają znaczenie opó?nienia wykonania pierwotnej PCI dla wyników leczenia (12). Dlatego też leczenie za pomocą PCI należy wdrożyć w przypadku, gdy czas pierwszego kontaktu z personelem medycznym (FMC) do napełnienia balonu wynosi poniżej 2 godzin w każdym przypadku oraz poniżej 90 minut u grupie chorych z wczesnym (<2 godzin), rozległym zawałem serca i niskim ryzykiem krwawienia (klasa zaleceń I B). Pierwotną PCI należy wdrożyć u chorych we wstrząsie i z przeciwwskazaniami do leczenia fibrynolitycznego niezależnie od czasu opó?nienia (10, 13, 14). W warunkach przedszpitalnych w każdym przypadku powinno się podać się tlen w zależno?ci od stanu chorego przez maskę (12-15 l/min) lub wąsy tlenowe (4-6 l/min). Po wykluczeniu nadwrażliwo?ci na kwas acetylosalicylowy (ASA) podaje się go w dawce 150-325 mg, najlepiej w postaci rozpuszczalnej, unikać postaci dojelitowych (10). Je?li chory był leczony, podaje się 75-100 mg. W sytuacji, gdy nie można zastosować preparatu doustnego podaje się dożylnie w dawce 250-500 mg. Ponadto należy podać klopidogrel – 600 mg oraz heparynę niefrakcjonowaną w dawkach wydłużających czas APTT 1,5-2,5-krotnie (zwykle 50-60 IU/kg) (10). Konieczne jest zmniejszenie bólu oraz lęku. W tym celu podaje się opioidy dożylnie w dawkach frakcjonowanych (morfina 4-8 mg, po 5-15 minutach można powtórzyć kolejne dawki po 2 mg). Należy zachować ostrożno?ć ze względu na depresyjne działanie morfiny na o?rodek oddechowy, a także powodowanie nudno?ci, wymiotów, hipotensji oraz bradykardii, które często pojawiają się zanim dojdzie do depresji oddechowej. W razie pojawienia się wymiotów można włączyć lek przeciwwymiotny – metoklopramid dożylnie w dawce 5-10 mg. Przy utrzymującym się wysokim poziomie lęku można zastosować benzodiazepinę w najmniejszej, skutecznej dawce. Przy nieustępującym bólu należy rozważyć podanie nitratów początkowo podjęzykowo (do 3 dawek co 5 minut), je?li nie ma poprawy – dożylnie, pamiętając o przeciwwskazaniach takich jak: zawał prawej komory (może współistnieć z zawałem ?ciany dolnej), hipotonia <90 mmHg, tachykardia>120/min przyjęcie inhibitora fosfodiesterazy w ciągu poprzedzających 24 lub nawet 48 godzin. W zaburzeniach rytmu można zastosować dożylnie β-bloker pod kontrolą ci?nienia tętniczego krwi. Unikać wykonywania wkłuć domię?niowych (10).
Postępowanie z chorym z OZW z uniesieniem odcinka ST po dotarciu do SOR ogranicza się wła?ciwie do transportu chorego w obecno?ci lekarza do pracowni hemodynamiki. Pacjent podczas transportu powinien być monitorowany oraz zaopatrzony w walizkę reanimacyjną. Idealna sytuacja ma miejsce wówczas, gdy czas od pierwszego kontaktu z personelem medycznym do rozprężenia balonu nie przekracza 120 minut, za? w przypadku leczenia fibrynolitycznego – 30 minut (10).
Postępowanie u chorych z NSTEMI
Postępowanie w przypadku chorych, u których w pierwszym, przedszpitalnym EKG nie obserwuje się uniesienia odcinka ST jest bardziej skomplikowane. Większa jest również możliwo?ć popełnienia błędu w postaci niewła?ciwego rozpoznania. Zapis spoczynkowy EKG nie jest specyficzny, można w nim obserwować obniżenie odcinka ST, ujemny załamek T. Niejednokrotnie też obraz elektrokardiograficzny pozostaje prawidłowy. Wykazano, że w 5% przypadków u chorych z prawidłowym EKG i bólem w klatce piersiowej rozwija się zawał serca. W tym przypadku również jest przydatne wykonanie teletransmisji do o?rodka kardiologii inwazyjnej i konsultacja mająca na celu ustalenie dalszego postępowania z chorym. Zwykle kardiolog zasugeruje transport do najbliższego szpitala posiadającego oddział wewnętrzny, w którym należy przeprowadzić dalszą diagnostykę w kierunku zawału serca. Postępowanie w warunkach przedszpitalnych należy oprzeć przede wszystkim o badanie podmiotowe i przedmiotowe, w którym powinno się wykluczyć pozasercowe przyczyny bólu w klatce piersiowej. Je?li chory będzie zgłaszał opisane uprzednio dolegliwo?ci, nie należy ich lekceważyć pomimo braku zmian w EKG i traktować jako pacjenta z ostrym zespołem wieńcowym. Należy pamiętać o nietypowych dolegliwo?ciach takich jak: ból w nadbrzuszu, dyspepsja, ból w klatce piersiowej o charakterze kłucia. Wszystkie te dane powinny być uzyskane w ciągu pierwszych 10 minut kontaktu z pacjentem. W warunkach przedszpitalnych pacjent powinien otrzymać leczenie stosowne do jego stanu z uwzględnieniem leczenia przeciwbólowego.
Diagnostyka NSTEMI
W szpitalu niezwłocznie powinno być ponownie wykonane EKG oraz oznaczenie Troponiny T lub I, kinazy kreatynowej (CK) i jej izoformy (CK-MB), kreatyniny, mocznika oraz morfologii krwi. Wynik powinien być dostępny w ciągu 60 minut. Należy pamiętać, że pierwszy ujemny wynik oznaczenia troponiny nie wyklucza zawału serca, ponieważ wzrost tego markera pojawia się dopiero po 3-4 godzinach od początku bólu, może więc pacjent trafić do szpitala zanim dojdzie do martwicy mię?nia sercowego i uwolnienia biomarkerów. Zatem oznaczenie powtarza się po 6-12 godzinach (tab. 1). W niektórych o?rodkach można oznaczyć stężenie mioglobiny, które narasta szybciej niż troponiny (po 1-4 godzinach) lecz jest to marker o niskiej swoisto?ci i nie zyskał przewagi nad troponiną. Ostatnio dużym zainteresowaniem cieszy się sercowe białko wiążące wolne kwasy tłuszczowe (h-FAB), obficie występujące w komórkach miokardium i bardzo szybko uwalniane z martwych kardiomiocytów (15, 16, 17). Uważa się, że wykazuje około 50% czuło?ci już w ciągu pierwszej godziny dolegliwo?ci bólowych (15). Jego oznaczenie jest możliwe za pomocą szybkiego, jako?ciowego testu, z kilku kropli krwi. W badaniach klinicznych test ten wykazał się znaczną czuło?cią w porównaniu z klasycznymi markerami martwicy mię?nia sercowego (16). Ograniczeniem jego stosowania jest fakt, że poziom h-FAB może wzrastać również w nadci?nieniu tętniczym, aortalnych wadach zastawkowych, niewydolno?ci serca co znacznie obniża swoisto?ć markera (17). Zatem h-FAB jest zbyt mało poznanym markerem, by całkowicie polegać na wiarygodno?ci oznaczenia i w oparciu o ten marker rozpoznawać NSTEMI. Spo?ród badań obrazowych przydatne jest przezklatkowe badanie echokardiograficzne spoczynkowe, które pozwala rozpoznać zaburzenia kurczliwo?ci lub inne schorzenia mogące być przyczyną bólu w klatce piersiowej. Jednak nie jest ono badaniem rozstrzygającym ponieważ nie różnicuje zaburzeń kurczliwo?ci w następstwie przebytego zawału serca. Ponadto brak zaburzeń kurczliwo?ci nie wyklucza zawału serca, a jedynie duży obszar niedokrwienia. Pojawiają się doniesienia o przydatnej roli rezonansu magnetycznego w obrazowaniu T2-zależnym z oceną grubo?ci lewej komory, które w przeciwieństwie do tradycyjnej metody pozwala zróżnicować ?wieże niedokrwienie od przebytego (18). Wykrycie zawału serca za pomocą rezonansu magnetycznego znacznie skracało czas diagnostyki, bowiem w 84% przypadków wynik uzyskiwano przed powtórnym oznaczeniem troponiny (19).
Tabela 1. Diagnostyka chorego z NSTEMI w SOR.
Dążenie do szybkiego rozpoznania zawału serca bez przetrwałego uniesienia odcinka ST jest bardzo ważne, ponieważ ma bezpo?rednie przełożenie na przyjmowaną strategię leczenia. Po ustaleniu wstępnego rozpoznania NSTEMI należy w SOR, jeszcze przed przekazaniem chorego rozpocząć leczenie polegające na podaniu kwasu acetylosalicylowego (je?li chory nie otrzymał go przedszpitalnie), azotanu i β-blokera (przy braku przeciwwskazań), klopidogrelu w dawce 600 lub 300 mg, a także leku przeciwkrzepliwego, którego rodzaj będzie zależał od dalszej strategii postępowania. Pilna strategia inwazyjna jest zalecana przy dławicy opornej, nawracającej pomimo leczenia z towarzyszącym obniżeniem odcinków ST, głębokimi, ujemnymi załamkami T, objawach niewydolno?ci serca, wstrząsie lub zagrażających życiu zaburzeniach rytmu. Chorzy ci powinni mieć niezwłocznie wykonaną koronarografię z następczą rewaskularyzacją, czyli powinni zostać przekazani do pracowni hemodynamiki. Wczesna strategia inwazyjna – koronarografia z następczą rewaskularyzacją wykonana w ciągu 72 godzin powinna być rozważona u pacjentów reagujących na leczenie przeciwdławicowe, ze zwiększonym stężeniem troponiny, z dynamicznymi zmianami odcinków ST lub załamków T, z cukrzycą, upo?ledzoną czynno?cią nerek, frakcją wyrzutową <40%, po przebytym pomostowaniu aortalno-wieńcowym, a także po przezskórnej interwencji wieńcowej w czasie poprzedzających 6 miesięcy (19, 20). W badaniu WHO-MONICA wykazano, że wprowadzenie nowoczesnych metod leczenia znacząco zmniejszyło liczbę incydentów wieńcowych oraz 28-dniową ?miertelno?ć (5).
Pi¶miennictwo
1. Pope JH et al.: Missed diagnoses of acute cardiac ischemia in the emergency department. N Engl J Med 2000; 342: 1163-70.
2. Christenson J et al.: Safety and efficiency of emergency department assessment of chest discomfort. CMAJ 2004; 170: 1803-7.
3. Thygesen K, Alpert JS, White HD: Joint ESC/ACCF/AHA/WHF Task Force for the Redefinition of Myocardial Infarction. Universal definition of myocardial infarction. Circulation 2007; 116: 2634-53.
4. Reczuch K, Banasiuk W, Ponikowski P: Ostre zespoły wieńcowe – postępy 2007. Medycyna Praktyczna 2008; 2: 47-59.
5. Tunstall-Pedoe H et al.: Contribution of trends in survival and coronary-event rates to changes in coronary heart disease mortality: 10-year results from 37 WHO MONICA project populations. Monitoring trends and determinants in cardiovascular disease. Lancet 1999; 353: 1547-57.
6. Norris RM: Fatality outside hospital from acute coronary events in three British districts, 1994-5. United Kingdom Heart Attack Study Collaborative Group. BMJ 1998; 316: 1065-70.
7. Ustawa o Państwowym Ratownictwie Medycznym z dnia 8 wrze?nia 2006 r. (Dz.U. z 2006 r. Nr 191, poz. 1410).
8. Kwiatkowski P: Telemedycyna w ratownictwie medycznym. Potencjał teletransmisji. Menedżer Zdrowia 2007; 8: 48-50.
9. Keeley EC, Boura JA, Grines CL: Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361: 13-20.
10. Van de Werf F et al.: Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J 2008; 29: 2909-45.
11. Schömig A et al.: Beyond 12 hours Reperfusion AlternatiVe Evaluation (BRAVE-2) Trial Investigators. Mechanical reperfusion in patients with acute myocardial infarction presenting more than 12 hours from symptom onset: a randomized controlled trial. JAMA 2005; 293: 2865-72.
12. Nallamothu B et al.: GRACE Investigators. Relationship of treatment delays and mortality in patients undergoing fibrinolysis and primary percutaneous coronary intervention. The Global Registry of Acute Coronary Events. Heart 2007; 93: 1552-5.
13. Steg PG et al.: Comparison of Angioplasty and Prehospital Thrombolysis In acute Myocardial infarction (CAPTIM) Investigators. Impact of time to treatment on mortality after prehospital fibrinolysis or primary angioplasty: data from the CAPTIM randomized clinical trial. Circulation 2003; 108: 2851-6.
14. Hochman JS et al.: SHOCK Investigators. Early revascularization and long-term survival in cardiogenic shock complicating acute myocardial infarction. JAMA 2006; 295: 2511-5.
15. Fazelnia C et al.: Human heart-type fatty-acid-binding protein as a point-of-care test in the early diagnosis of acute myocardial infarction. QJM 2007; 100: 203-10.
16. Figiel Ł i wsp.: Sercowe białko wiążące kwasy tłuszczowe – wiarygodny marker martwicy mię?nia sercowego w heterogennej grupie chorych z ostrym zespołem wieńcowym bez przetrwałego uniesienia odcinka ST. Kardiologia Polska 2008; 66: 253-9.
17. Iida M et al.: Predictive value of heart-type fatty acid-binding protein for left ventricular remodelling and clinical outcome of hypertensive patients with mild-to-moderate aortic valve diseases. J Hum Hypertens 2007; 21: 551-7.
18. Cury RC et al.: Cardiac Magnetic Resonance With T2-Weighted Imaging Improves Detection of Patients With Acute Coronary Syndrome in the Emergency Department. Circulation 2008 Aug 4. (w druku).
19. Kwong RY et al.: Detecting acute coronary syndrome in the emergency department with cardiac magnetic resonance imaging. Circulation. 2003 Feb 4; 107(4): 531-7.
20. Bassand JP et al.: Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology, Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007; 28: 1598-660.
21. Fesmire FM et al.: American College of Cardiology; American Heart Association Task Force on Practice Guidelines; American College of Emergency Physicians; Society for Cardiovascular Angiography and Interventions; Society of Thoracic Surgeons; American Association of Cardiovascular and Pulmonary Rehabilitation; Society for Academic Emergency Medicine. J Am Coll Cardiol 2007 Aug 14; 50(7): e1-e157. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-Elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non-ST-Elevation Myocardial Infarction) developed in collaboration with the American College of Emergency Physicians, the Society for Cardiovascular Angiography and Interventions, and the Society of Thoracic Surgeons endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine. J Am Coll Cardiol 2007; 50: e1-e157.
otrzymano/received: 2009-02-04 zaakceptowano/accepted: 2009-03-26 Adres/address: *Marzena Wojewódzka-Żelezniakowicz Zakład Medycyny Ratunkowej i Katastrof Uniwersytetu Medycznego w Białymstoku ul. Waszyngtona 15A, 15-274 Białystok e-mail: wojewodzkam@wp.pl Pełna wersja artykułu Ostre zespoły wieńcowe w aspekcie działań medycyny ratunkowej dostępna w Czytelni Medycznej Borgis. |
||||||||||||||
Chcesz być na bież±co? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








