|
© Borgis - Postępy Nauk Medycznych 1, s. 39-43
*Krzysztof J. Filipiak
Inhibitory konwertazy angiotensyny kontra sartany – co wiemy z wyników wielkich badań klinicznych w 2008 roku?
Angiotensin-converting enzyme inhibitors versus sartans – what do we know from the outcomes of the mega-trials in 2008?
I Katedra i Klinika Kardiologii Warszawskiego Uniwersytetu Medycznego
Kierownik Kliniki: prof. dr hab. med. Grzegorz Opolski Streszczenie
Trzy wielkie badania kliniczne ostatnich lat (HOPE, ONTARGET, TRANSCEND) dają nam aktualnie możliwość pośredniego, zgodnego z zasadami medycyny opartej na faktach (ang. evidence-based medicine) porównania inhibitorów konwertazy angiotensyny (inhibitorów ACE) z antagonistami receptorów angiotensynowych (sartanami). We wszystkich tych badaniach stosowano ten sam inhibitor ACE (ramipril) i/lub ten sam sartan (telmisartan). We wszystkich tych badaniach stosowano leki w takich samych dawkach, pacjentów włączano na podstawie takich samych kryteriów włączenia, obserwowano podobne punkty końcowe. Nawet uwzględniając różnice w czasie prowadzenia tych badań, jak i inne czynniki, o których mowa w poniższym artykule, można przyjąć, że status terapeutyczny i efekty kliniczne najlepiej przebadanego inhibitora ACE (ramiprilu) i najlepiej przebadanego sartanu (telmisartanu) są zbliżone. Słowa kluczowe: inhibitory ACE, sartany, wielkie badania kliniczne
Summary
Three mega-trials completed during several years before 2008 (HOPE, ONTARGET, TRANSCEND) enabled us to compare the angiotensin-converting enzyme inhibitors (ACE-inhibitors) with angiotensin receptor antagonists (sartans) according to the philosophy of evidence-based medicine (EBM). It is because in all those three trials the same ACE-inhibitor (ramipril) and/or the same sartan (telmisartan) was evaluated, the drugs were given in the same doses, and the patients were randomized in those trials according with the same inclusion criteria. Even almost the same end-points were reported. Although some differences exist (the time of each study completion, other factors discussed below) among three trails, it might be suggested that ramipril and telmisartan (boht, the most-evaluated drugs in their classes) posses the similar therapeutic status nowadays and provide similar clinical benefits. Key words: ACE-inhibitors, sartans, mega-trials
Wprowadzenie
Nie istnieje obecnie inna niż ramipril i telmisartan „para” leków z klasy inhibitorów konwertazy angiotensyny (inhibitorów ACE) i antagonistów receptorów angiotenysnowych (sartanów), która byłaby równie dobrze przebadana w wielkich badaniach klinicznych zgodnych z filozofią evidence-based Medicine (EBM, medycyna oparta na faktach). Trzy wielkie badania ostatnich lat (HOPE, ONTARGET i TRANSCEND) pozwalają nam zatem przyjrzeć się obiektywnie ramiprilowi i telmisartanowi w identycznej, pod względem kryteriów włączenia, populacji osób.
AKT I – badanie HOPE
W 2000 roku, na progu obecnego wieku, ukazało się pierwsze przełomowe badanie oceniające korzyści ze stosowania inhibitorów ACE w populacjach pacjentów podwyższonego ryzyka wieńcowego. Badanie HOPE (Heart Outcomes Prevention Evaluation study), bo o nim mowa, oceniało odległy wpływ blisko 5-letniego podawania ramiprilu w dość heterogennej grupie ponad 9 000 pacjentów (1).
Wyniki tego programu wydawały się nieść za sobą na tyle istotne implikacje terapeutyczne, że redakcja New England Journal of Medicine – zdecydowała się przed ich ogłoszeniem drukiem w styczniu 2000 roku, udostępnić je pilnie na swoich stronach internetowych, co wówczas nie było jeszcze procedurą tak często stosowaną (tzw. E-publication), jak obecnie.
W programie HOPE, 9297 pacjentów powyżej 55. roku życia z rozpoznaną chorobą naczyniową (choroba niedokrwienna serca, wywiad udarowy lub choroba naczyń obwodowych) lub cukrzycą oraz przynajmniej jednym dodatkowym czynnikiem ryzyka chorób układu sercowo-naczyniowego (nadciśnienie tętnicze, wysokie stężenie cholesterolu całkowitego, niskie stężenie HDL-cholesterolu, palenie papierosów, mikroalbuminuria) randomizowano do 5-letniego leczenia ramiprilem w dawce 10 mg/24 h lub do grupy placebo. Nie włączano do badania pacjentów z niewydolnością serca i źle kontrolowanym nadciśnieniem tętniczym.
W grupie leczonej ramiprilem zaobserwowano po pięciu latach statystycznie istotną redukcję: zgonów sercowych (redukcja o 25% w porównaniu do grupy placebo), zawałów serca (20%), udarów mózgowych (32%), konieczności wykonania procedur rewaskularyzacyjnych (15%), nowych przypadków cukrzycy typu II (31%).
Wybrane wyniki badania HOPE zebrano w tabeli 1.
Tabela 1. Wybrane wyniki badania HOPE – ramipril w porównaniu z placebo w zapobieganiu incydentom sercowo-naczyniowym w okresie blisko 5 lat. Tabela zaczerpnięta z podręcznika Opolski, Filipiak (red.) (2).
RRR – relative risk reduction – względne zmniejszenie ryzyka – część prawdopodobieństwa (ryzyka) wystąpienia niekorzystnego punktu końcowego „usunięta” w wyniku zastosowanego leczenia.
NNT – number needed to treat – liczba pacjentów, których należy poddać leczeniu, aby zapobiec jednemu niekorzystnemu punktowi końcowemu. CI – confidence interval – przedział ufności – określa stopień precyzji uzyskanego wyniku. W badaniu HOPE w grupie leczonej ramiprilem vs grupa otrzymująca placebo znalazło się odpowiednio: 79,5% i 81,3% osób z chorobą niedokrwienną serca, 42,3% i 44,8% z miażdżycą naczyń obwodowych, 38,9% i 38,0% z cukrzycą oraz 65,4% i 66,4% z hipercholesterolemią. Dobrze kontrolowane nadciśnienie tętnicze występowało odpowiednio u 47,6% i 46,1% chorych.
Pacjenci przyjmowali równocześnie beta-adrenolityki (39,2% i 39,8%), kwas acetylosalicylowy lub inny lek przeciwpłytkowy (75,3% i 76,9%), leki hipolipemizujące (28,4% i 28,8%).
W grupie leczonej ramiprilem obserwowano częstsze występowanie kaszlu (7,3% vs 1,8%), hipotonii i zawrotów głowy (1,9% vs 1,5%), rzadziej odnotowywano niekontrolowane nadciśnienie tętnicze (2,3% vs 3,9%). Średnie ciśnienie tętnicze w obu grupach nie zmieniło się jednak w porównaniu z wartościami wyjściowymi, co przekreśla tezę o „korzyściach” obserwowanych w grupie ramiprilu wypływających z dodatkowego zmniejszenia ciśnienia tętniczego w tej grupie.
Co ważne, korzyści z leczenia ramiprilem wykazano we wszystkich analizowanych podgrupach chorych, a efekt widoczny był już po 2 latach badania i utrzymywał się aż do jego zakończenia.
Pokłosiem badania HOPE było zarejestrowanie ramiprilu jako leku prewencji zgonu, zawału serca i udaru mózgu u wszystkich chorych podwyższonego ryzyka sercowo-naczyniowego po 55. roku życia. Ryzyko to rozumiano – i tak zapisano w nowym brzmieniu rejestracji terapeutycznej – jako sytuacje opisane w kryteriach włączania do badania HOPE.
AKT II – badanie ONTARGET
Korzyści ze stosowania sartanu (telmisartanu) postanowiono zweryfikować w oparciu o dane z badania HOPE kilka lat później. Postanowiono, że w populacji pacjentów zbliżonej do badania HOPE (te same kryteria włączenia) testować się będzie ponownie ramipril w dawce 10 mg/dobę, ale tym razem nie w porównaniu z placebo, ale z aktywną kontrolą – terapią telmisartanem w dawce 80 mg/dobę.
W ten właśnie sposób powstała idea protokołu badania ONTARGET (Ongoing Telmisartan Alone and in combination with Ramipril Globar Endpoint Trial), w którym do jednej grupy randomizowano chorych leczonych ramiprilem, do drugiej – telmisartanem, do trzeciej – połączeniem obu leków (3). Dla potrzeb niniejszego artykułu interesuje nas jedynie porównanie grupy leczonej ramiprilem z grupą leczoną telmisartanem.
Mediana okresu obserwacji w badaniu ONTARGET wyniosła prawie 5 lat (56 miesięcy), była więc porównywalna z okresem obserwacji w badaniu HOPE. Należy podkreślić, że nadciśnienie tętnicze występowało u prawie 70% badanych, choroba wieńcowa u 75%. W badanej grupie niemal połowa chorych przebyła zawał serca, dodatkowe leczenie można ocenić lepiej niż w badaniu HOPE (statyny otrzymywało 62% badanych, leki przeciwpłytkowe 81%, beta-adrenolityki 57%). Występowanie głównego punktu końcowego (zgon z przyczyn sercowo-naczyniowych, zawał serca, udar mózgu, hospitalizacja z powodu niewydolności serca) nie różniły się pomiędzy grupami ramiprilu ani telmisartanu (4).
Szczegółowe wyniki badania ONTARGET przedstawiono w tabeli 2.
Tabela 2. Wybrane wyniki badania ONTARGET – ramipril w porównaniu z telmisartanem w zapobieganiu incydentom sercowo-naczyniowym w okresie blisko 5 lat. Zmodyfikowano na podstawie publikacji orginalnej wyników badania (3).
AKT III – badanie TRANSCEND
Badanie TRANSCEND (Telmisartan Randomized Assessment Study in ACE Intolernat Subjects with Cardiovascular Disease) zamyka wielką trójkę powyższych badań.
W badaniu tym, pacjenci mający typowe wskazania do otrzymywania inhibitora ACE, ale nie mogący ich przyjmować z powodu przeciwwskazań i nietolerancji, randomizowani byli do otrzymywania telmisartanu w dawce 80 mg/dobę lub placebo. Wymóg osób nietolerujących inhibitor ACE był bardzo istotny – inaczej Komisja Etyczna nie zezwoliłaby na randomizację: grupa aktywnie leczona telmisartanem vs grupa placebo.
Aby porównać wyniki badania TRANSCEND ze znanym i ogłoszonym w 2000 roku badaniem HOPE (ramipril vs placebo) należy pamiętać, że sens takiego porównania – przy tych samych kryteriach włączenia – dotyczyć może wyłącznie tak samo definiowanego punktu końcowej obserwacji (5).
Pamiętajmy, że punktem tym był pierwszorzędowy punkt obserwacji w badaniu HOPE, a drugorzędowy punkt obserwacji w badaniu TRANSCEND (zgon sercowo-naczyniowy/zawał serca/udar mózgu). W badaniu TRANSCEND punkt pierwszorzędowy poszerzono o czwarty składnik – coraz bardziej krytykowany w świecie evidence-based medicine (EBM), nie do końca zdefiniowany i poddający się wielu zmiennym zakłócającym punkt obserwacji „hospitalizacja z przyczyn niewydolności serca”. Zastrzeżenie to zilustrowano poniżej:
Pierwszorzędowy punkt końcowej obserwacji w badaniu HOPE.
=
Drugorzędowy punkt końcowej obserwacji w badaniu TRANSCEND.
Porównajmy zatem tak samo zdefiniowane punkty końcowe. Ramipril w badaniu HOPE zmniejszał – w stosunku do placebo – ryzyko zgonu, zawału serca i udaru mózgu o 22%, telmisartan w badaniu TRANSCEND – w stosunku do placebo zmniejszał ten punkt końcowy o 13%. Bierąc pod uwagę różnice w zakresie charakterystyki obu grup (badanie TRANSCEND – program kliniczny „młodszy” o 18 lat – pacjenci lepiej leczeni, w większym odsetku otrzymujący standardową terapię), można uznać, że wyniki obu programów są porównywalne. Popatrzmy chociażby na odsetek pacjentów otrzymujących statyny, beta-adrenolityki czy leki przeciwpłytkowe w badaniach HOPE i TRANSCEND. Odsetki te wynoszą odpowiednio: 28,9% vs 54,4% oraz 39,5% vs 57,6% i 75% vs 85%.
Populacja badania TRANSCEND jest też nieco inna od badania HOPE pod względem rozkładu etnicznego (bardziej różnorodna), jest w niej również rekordowo dużo kobiet 43% (włączonych osób do badania).
Od dawna wiadomo, że trudniej uzyskać „lepsze wyniki” w wyjściowo „zdrowszych” populacjach. Im mniejsze ryzyko sercowo-naczyniowe populacji, tym mniej zgonów i zdarzeń wieńcowych, tym mniejsza względna redukcja ryzyka osiągana przez zastosowanie aktywnie działającej substancji. W tabeli 3. przedstawiono zestawienie częstości występowania podstawowych punktów końcowej obserwacji w trakcie trwania badania HOPE i TRANSCEND.
Tabela 3. Roczna częstość występowania wybranych zdarzeń sercowo-naczyniowych w populacji badania TRANSCEND w porównaniu z populacją badania HOPE – raportowane dane dotyczą grup placebo.
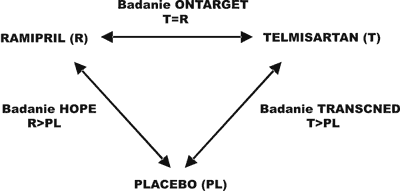
Kolejnym, pośrednim argumentem na rzecz twierdzenia, że w badaniu TRANSCEND telmisartan wypadał podobnie jak ramipril w badaniu HOPE, są oczywiście wyniki badania ONTARGET, w którym w identycznej pod względem kryteriów włączenia populacji osób, telmisartan okazał się tak samo skuteczny jak ramipril w zakresie wszystkich zdefiniowanych przed rozpoczęciem badania punktów końcowych. Rozumowanie to ilustruje rycina 1.
 Ryc. 1. Podsumowanie głównych wyników trzech wielkich badań klinicznych w podobnych populacjach pacjentów podwyższonego ryzyka sercowo-naczyniowego: badania HOPE (ramipril vs placebo), ONTARGET (ramipril vs telmisartan) i TRANSCEND (telmisartan vs placebo) – redukcja ryzyka zgonu/zawału serca/udaru mózgu.
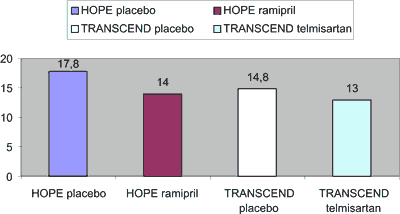
Kiedy porównamy częstość występowania pierwszorzędowego punktu końcowego (zgon/zawał serca/udar mózgu) w badaniu HOPE z tak samo definiowanym punktem drugorzędowym w badaniu TRANSCEND, wyraźnie widać, że ochrona, jaką uzyskują pacjenci otrzymujący telmisartan, jest podobna, jak przy podawaniu ramiprilu. Relatywnie większa redukcja tak definiowanego punktu końcowego w badaniu HOPE wynika, jak widzimy na rycinie 2., z różnicy pomiędzy grupą leczoną aktywnie a grupą placebo w badaniu HOPE – jeżeli porównamy natomiast wszystkie cztery grupy randomizacji obu tych badań, w praktyce najlepiej rokowała grupa aktywnie leczona telmisartanem w badaniu TRANSCEND (najmniejszy, 13% odsetek występowania tak zdefiniowanego punktu końcowego – patrz rycina 2.
 Ryc. 2. Porównanie całkowitej częstości występowania, liczonych łącznie: zgonu/zawału serca/udaru mózgu w populacjach randomizowanych do przyjmowania placebo lub aktywnego leczenia w badaniu HOPE (ramipril vs placebo) i TRANSCEND (telmisartan vs placebo).
Podsumowanie
Spośród omówionych powyżej trzech badań klinicznych, szczególne miejsce ma badanie ONTARGET – bezpośrednio porównujące ramipril z telmisartanem. To właśnie to badanie, którego program kliniczny TRANSCEND był niejako tylko „odpryskiem” (badacze włączali do programu TRANSCEND chorych spełniających kryteria ONTARGET, ale nie tolerujących inhibitorów ACE), narzuca nam aktualnie dogmat porównywalnych korzyści ze stosowania ramiprilu w stosunku do stosowania telmisartanu u wszystkich chorych podwyższonego ryzyka sercowo-naczyniowego po 55. roku życia.
Uważna, zaprezentowana powyżej analiza porównawcza TRANSCEND i HOPE pozwala dodatkowo udowodnić przytaczaną tezę. Podsumowując, nawet uwzględniając różnice w czasie prowadzenia badań HOPE i ONTARGET/ TRANSCEND (badanie „starsze” vs „młodsze”), jak i inne czynniki, o których mowa w poniższym artykule, można przyjąć, że status terapeutyczny i efekty kliniczne najlepiej przebadanego inhibitora ACE (ramiprilu) i najlepiej przebadanego sartanu (telmisartanu) są zbliżone i porównywalne klinicznie. Piśmiennictwo
1. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in highrisk patients. N Engl J Med 2000; 342: 145-153.
2. Opolski G, Filipiak KJ (red.): Leki hamujące układ renina-angiotensyna-aldosteron. Wyd. Med. Urban&Partner, Wrocław 2000.
3. Yusuf S et al.: Telmisartan, ramipril, or both in patients at high risk for vascular events. NEJM 2008; 358: 1547-1559.
4. Januszewicz A, Prejbisz A: Rola antagonistów receptora angiotensyny II w leczeniu chorych z grupy dużego ryzyka sercowo-naczyniowego – implikacje badania ONTARGET. Terapia 2008; 7-8: 57-63.
5. Filipiak KJ: Badanie TRANSCEND – co powinien o nim wiedzieć kardiolog, hipertensjolog i internista? Nadciśnienie tętnicze 2008; 12: 397-400.
otrzymano/received: 2008-11-17 zaakceptowano/accepted: 2008-12-17 Adres/address: *Krzysztof J. Filipiak I Katedra i Klinika Kardiologii Warszawski Uniwersytet Medyczny ul. Banacha 1A, 02-097 Warszawa tel.: (0-22) 599-29-58 e-mail: krzysztof.filipiak@wum.edu.pl Pełna wersja artykułu Inhibitory konwertazy angiotensyny kontra sartany – co wiemy z wyników wielkich badań klinicznych w 2008 roku? dostępna w Czytelni Medycznej Borgis. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








