|
© Borgis - Postępy Nauk Medycznych 11, s. 769-778
*Andrzej Habior1, Ewa Kraszewska1, Agata Goś-Zając2, Marek Gołębiowski3, Joanna Szutkowska-Hoser4, Krystyna Niedzielska5, Maria Niewiadomska5, Martyna Pawluczyk-Dyjecińska6
Minimalna encefalopatia u chorych z marskością wątroby – ocena metod diagnostycznych i częstości występowania**
Minimal hepatic encephalopathy in patients with liver cirrhosis – prevalence and assessment of diagnostic methods
1 Klinika Gastroenterologii i Hepatologii, Centrum Medyczne Kształcenia Podyplomowego i Centrum Onkologii – Instytut im. M. Skłodowskiej-Curie, Warszawa
Kierownik Kliniki: prof. dr hab. med. Jarosław Reguła 2Klinika Gastroenterologii, Centrum Onkologii – Instytut im. M. Skłodowskiej-Curie, Warszawa Kierownik Kliniki: prof. dr hab. med. Jarosław Reguła 3Zakład Radiologii Klinicznej, Warszawski Uniwersytet Medyczny, Warszawa Kierownik Zakładu: prof. dr hab. med. Marek Gołębiowski 4Pracownia Neuropsychologii, II Klinika Neurologii, Instytut Psychiatrii i Neurologii, Warszawa Kierownik Kliniki: prof. dr hab. med. Anna Członkowska 5Zakład Neurofizjologii Klinicznej, Instytut Psychiatrii i Neurologii, Warszawa Kierownik Zakładu: doc. dr hab. med. Maria Niewiadomska 6Klinika Okulistyki, II Wydział Lekarski, Warszawski Uniwersytet Medyczny, Warszawa Kierownik Kliniki: prof. dr hab. med. Jerzy Szaflik Streszczenie
Minimalna encefalopatia wątrobowa (MEW) u osób z marskością wątroby charakteryzuje się zaburzeniami sfery psychomotorycznej i poznawczej przy braku jakichkolwiek objawów klinicznych encefalopatii. Zalecane metody rozpoznawania MEW opierające się na testach psychometrycznych i neurofizjologicznych są kłopotliwe, czasochłonne i mało precyzyjne. Z tego powodu publikowane w światowym piśmiennictwie dane na temat występowania MEW są bardzo rozbieżne i wahają się od 25% do 60%. W pracy oceniono po raz pierwszy w Polsce występowanie MEW za pomocą rekomendowanego przez Światową Organizację Gastroenterologiczną (WGO) zestawu badań oraz stosując trzy nowe metody, niestandardowe w tej diagnostyce. U 51 chorych z marskością wątroby i nadciśnieniem wrotnym (29 osób z pierwotną żółciową marskością i 22 chorych z marskością na tle zakażenia wirusem hepatitis C) wykonano 4 badania psychometryczne (test łączenia punktów A (NCT-A) i B (NCT-B), test symboli cyfr (DST) i test klocków (BDT), EEG, spektralny encefalogram (SEEG) i badanie potencjału wzbudzonego P 300. W tym samym czasie wykonano również test krytycznej częstotliwości migotania (CFF), protonową spektroskopię rezonansu magnetycznego (1HMRS) mózgu i oznaczenia białka astroglejowego S100β w surowicy krwi. U 9 spośród 51chorych testy psychometryczne były nieprawidłowe, co upoważnia do rozpoznania MEW. Oceniając łącznie wyniki wszystkich rekomendowanych przez WGO badań (testów psychometrycznych i trzech badań neurofizjologicznych), liczba chorych z nieprawidłowymi wynikami wzrosła do 16. Uzupełniając klasyczny zestaw testów jednym nowym badaniem (CFF, 1HMRS lub S100β) nieprawidłowe wyniki zarejestrowano u ponad 40% chorych. Analiza w badanej grupie chorych z marskością wątroby wszystkich siedmiu testów wykazała, że przynajmniej jeden nieprawidłowy wynik występował u 30 osób (58,8%). Wyniki przedstawionych badań wskazują, że w polskiej populacji chorych z marskością wątroby częstość MEW wynosi 17,6%-31,3% i zależy od zestawu rekomendowanych przez WGO testów. Nowe, niestandardowe badania, jak CFF, 1HMRS lub S100β mogą być przydatne w diagnostyce MEW, ale konieczna jest ich ocena po długiej obserwacji pacjentów pod kątem występowania u nich jawnej klinicznie encefalopatii. Słowa kluczowe: marskość wątroby, minimalna encefalopatia, testy psychometryczne, testy neurofizjologiczne
Summary
Minimal hepatic encephalopathy in patients with liver cirrhosis is defined by the presence of cognitive abnormalities detectable on psychometric or neurophysiologic testing in the absence of overt encephalopathy. Actually recommended tests are cumbersome and imprecise, and it is the reason, that prevalence of the disease is reported in very wide ranges from 25% to 60%. We assessed the prevalence of minimal hepatic encephalopathy with standard diagnostic tools (psychometric and neurophysiologic tests) according to World Gastroenterology Organisation and we evaluated the usefulness of three other, non-standard tests. In 51 patients with liver cirrhosis and portal hypertension (29 with primary biliary cirrhosis, 22 with liver cirrhosis due to HCV infection) four psychometric tests (NTC-A, NTC-B, DST and BDT), EEG, spectral EEG and P300 auditory event related potential were performed. On this same time, in all patients critical flicker frequency (CFF) and proton magnetic resonance spectroscopy (1HMRS) of the brain were performed and serum concentration of astroglial protein S100β was determined. Based on the psychometric tests, 9 out of 51 patients were diagnosed to have minimal hepatic encephalopathy. If the results of all recommended test have been taken into account, the prevalence of minimal hepatic encephalopathy raised to 16 / 51 patients. Addition of one new diagnostic test enhanced the number of patients suspected of minimal encephalopathy above 40%. Analysis of seven performed tests shown, that 30 patients (58,8%) have at least one abnormal result. In conclusion, prevalence of minimal hepatic encephalopathy in Polish patients with cirrhosis ranges from 17,6% to 31,3%, depending on number and type of diagnostic tests. CFF, 1HMRS and S100β may be useful for the detection of this disease, but for confirmation of their diagnostic value longer observation of the patients is needed. Key words: liver cirrhosis, minimal encephalopathy, psychometric tests, neurophysiological tests
Wprowadzenie
Marskość wątroby jest jedną z najczęstszych przewlekłych chorób u ludzi, niezależnie od kontynentu i rasy. Jest to proces nieodwracalny, którego objawy zależą od stopnia ubytku czynnej masy komórkowej wątroby i zwłóknienia narządu. Tempo postępu marskości wątroby nie jest jednakowe u wszystkich chorych. Niekiedy progresja od pierwszych objawów do wystąpienia nadciśnienia wrotnego lub niewydolności narządu trwa kilka miesięcy, a czasem choroba ma bardzo wolny przebieg i pacjent może normalnie funkcjonować przez wiele lat. Końcową fazą marskości wątroby są powikłania nadciśnienia wrotnego (encefalopatia, żylaki przełyku, wodobrzusze, hipersplenizm) i objawy niewydolności wątroby (encefalopatia, wodobrzusze) oraz rak wątrobowo-komórkowy.
Encefalopatią wątrobową (EW) nazywa się szerokie spektrum zaburzeń neuropsychiatrycznych u osoby z chorobą wątroby, po wykluczeniu pierwotnych (organicznych) chorób innych narządów i układów, a szczególnie ośrodkowego układu nerwowego (OUN). Głównym, chociaż nie jedynym czynnikiem etiopatogenetycznym EW jest amoniak, którego nadmierne powstawanie w niewydolności wątroby udowodniono przed wielu laty. Jony amonowe gromadzone w OUN uszkadzają struktury mózgu, a ponadto powodują liczne zaburzenia w funkcjonowaniu neuroprzekaźników, co prowadzi do morfologicznych zmian w OUN. Pierwszą i najważniejszą zmianą w OUN w następstwie tych zaburzeń jest obrzęk astrocytów. Jest to główna przyczyna obrzęku mózgu i powstających w jego następstwie objawów neurologicznych u chorego z niewydolnością wątroby.
Równoczesna charakterystyka i klasyfikacja encefalopatii i niewydolności wątroby nie jest prosta i przez wiele lat było to źródło nieporozumień, zarówno między klinicystami, jak i w kręgach hepatologów zajmujących się badaniami naukowymi. W celu jej ujednolicenia, Światowa Organizacja Gastroenterologiczna ( World Gastroenterology Organisation, WGO) powołała grupę roboczą, której obowiązujące do dziś uzgodnienia przedstawiono w 1998 roku na kongresie w Wiedniu i opublikowano w 2002 roku w Hepatology (1). W klasyfikacji EW uwzględniana jest charakterystyka neurologiczna (encefalopatia epizodyczna, stała i minimalna) oraz patologia wątroby (encefalopatia w następstwie ostrej niewydolności wątroby [typ A], w przebiegu marskości [typ C] i w następstwie połączeń wrotno-systemowych bez istotnej choroby miąższu wątroby [typ B]). Niezależnie od charakteru zespołu neurologicznego i rodzaju zmian w wątrobie, stałym i najważniejszym elementem patogenetycznym EW jest uszkodzenie OUN przez substancje, które w fizjologicznych warunkach są skutecznie metabolizowane w hepatocytach (1).
W leczeniu powikłań marskości wątroby, jak żylaki przełyku, wodobrzusze i rak wątroby nastąpił ostatnio duży postęp, natomiast leczenie niewydolności wątroby będącej wyrazem schyłkowej fazy marskości stwarza klinicystom nadal duże problemy. W przypadku objawów encefalopatii u pacjenta z marskością wątroby dostępne sposoby leczenia farmakologicznego i dietetycznego mają dość ograniczoną skuteczność. Lepsze wyniki można uzyskać, jeśli wykryje się i w porę usunie egzogenny czynnik wywołujący epizod encefalopatii. Ostatecznym i najskuteczniejszym leczeniem EW jest przeszczep wątroby, ale pamiętać trzeba o ograniczonej dostępności tego postępowania w przypadkach wymagających szybkiego działania (2). W celu osiągnięcia dobrego wyniku leczenia encefalopatii pożądane jest jak najwcześniejsze ustalenie rozpoznania, najlepiej w okresie poprzedzającym wystąpienie objawów klinicznych.
Termin „subkliniczna encefalopatia” wprowadzono przed wielu laty w celu scharakteryzowania pacjentów z zaburzeniami funkcji OUN, którzy jeszcze nie mieli klinicznej manifestacji EW (3). Nieprawidłowości wykrywano testami psychometrycznymi, które ujawniały pogorszenie sprawności psychomotorycznej i poznawczej oraz percepcji bodźców wzrokowych, a także pogorszenie skupienia uwagi, natomiast sfera werbalna była niezmieniona (4). Obserwacje autorów z wielu ośrodków wskazywały również na istotne pogorszenie jakości życia chorych z marskością i subkliniczną encefalopatią (5). Dotyczyło to zarówno aktywności społecznej i zawodowej, na przykład sprawności prowadzenia pojazdów i maszyn, jak i wydajności w pracy umożliwiającej wyższe zarobki (5, 6, 7). Na podstawie tych obserwacji sądzi się dość powszechnie, że wykrycie bardzo dyskretnych zaburzeń OUN, mieszczących się w kryteriach „subklinicznej encefalopatii” i wczesne wdrożenie odpowiedniego leczenia może spowolnić, a nawet odwrócić niekorzystny przebieg choroby.
Na wspomnianej konferencji uzgodnień zmieniono używane dotychczas terminy „subkliniczna” lub „utajona” na „minimalna encefalopatia wątrobowa” (MEW) i taka nazwa jest obecnie powszechnie stosowana (1).
Rozpoznanie MEW nie jest proste. Dotychczas nie
wypracowano „złotego standardu” diagnostycznego i z tego powodu częstość rozpoznań tego zespołu u chorych z marskością wątroby w zależności od zastosowanych metod badawczych waha się w dość dużych granicach – od 25% do 55-60% (8, 9, 10, 11). Przez wiele lat podstawą rozpoznania były badania neuropsychologiczne polegające na użyciu zestawu testów psychometrycznych (4). Jednak, mimo prób udoskonalenia metodologii, badania neuropsychologiczne ze względu na małą czułość i swoistość, nie mogą być uznane za „złoty standard” rozpoznawania MEW (12, 13). Drugą grupę narzędzi diagnostycznych używanych do rozpoznawania MEW stanowią badania neurofizjologiczne. Zalicza się do nich test badający reakcję na częstotliwość migającego światła (ang. Critical Flicker Frequency, CFF) (14), klasyczne (opisowe) badanie elektroencefalograficzne (EEG) i spektralny elektroencefalogram (SEEG) (15), oraz badanie potencjałów wzbudzonych, najczęściej polegające na pomiarze latencji potencjału P300 wzbudzonego bodźcem słuchowym (17). Trzecią grupę badań pozwalających oceniać zmiany w OUN u chorych z MEW są nowoczesne techniki neuroobrazowania. Należą do nich magnetyczny rezonans jądrowy, spektroskopia magnetycznego rezonansu jądrowego (ang. Magnetic Resonance Spectroscopy, MRS) (17) i pozytronowa emisyjna tomografia mózgu. Metodami tymi można w sposób nieinwazyjny ocenić strukturalne, fizjologiczne i biochemiczne zmiany w OUN, ale na razie, nie są one zalecane, jako standardowe narzędzia diagnostyczne MEW (1).
Wiedząc, że pierwszą i główną odpowiedzią OUN na zmiany metaboliczne w EW jest aktywacja astrocytów, uzasadnione wydają się poszukiwania łatwo dostępnego markera biochemicznego tych zaburzeń. Przypuszcza się, że wskaźnikiem takim może być białko astroglejowe S100β uwalniane do krwi z aktywowanych astrocytów (18). Dotychczas nie było większych badań nad przydatnością do rozpoznawania MEW oznaczania stężenia w surowicy krwi białka S100β.
Aktualnie obowiązujące zalecenia zespołu ekspertów WGO odnośnie rozpoznawania MEW obejmują dwie grupy badań (1).
1. Badanie neuropsychologiczne
a) co najmniej dwa spośród czterech testów psychometrycznych:
– test łączenia punktów A (powszechnie używany w języku angielskim skrót NCT-A),
– test łączenia punktów B (ang. NCT-B),
– test symboli cyfr (ang. Digit-Symbol Test, DST),
– test klocków ( ang. Block-Design Test, BDT), lub
b) standaryzowany zestaw testów psychometrycznych (ang. PSE-Syndrome-Test).
2. Badania neurofizjologiczne. Zalecane są SEEG i/lub P300, które umożliwiają ocenę ilościową nieprawidłowości w OUN.
Przydatność innych badań oceniana była najczęściej przez porównanie jednego nowego testu z badaniami psychometrycznymi (13, 15, 19, 20, 21, 22, 23). Nie ma dużych, prospektywnych badań porównujących większą liczbę testów. W piśmiennictwie polskim nie ma prac badających częstość MEW w naszej populacji, ani nie ma publikacji oceniających sposoby rozpoznawania tego zespołu.
Celem pracy jest zbadanie przydatności wszystkich proponowanych w literaturze testów diagnostycznych MEW, oraz w oparciu o te badania, ocena częstości MEW we własnym materiale chorych z marskością wątroby.
Materiał
Do badania zapraszani byli od stycznia 2004 roku do lutego 2005 roku pacjenci Kliniki Gastroenterologii i Hepatologii CMKP w Warszawie i Kliniki Hepatologii Instytutu Chorób Zakaźnych Akademii Medycznej w Warszawie z rozpoznaniem zaawansowanej marskości wątroby z nadciśnieniem wrotnym, bez klinicznych objawów encefalopatii. Rozpoznanie stawiano na podstawie obrazu klinicznego, badań laboratoryjnych, badań endoskopowych i obrazowych (ultrasonografia). Nadciśnienie wrotne rozpoznawano pośrednio, na podstawie obecności żylaków przełyku w badaniu endoskopowym i/lub obecności pośrednich cech nadciśnienia wrotnego w badaniu ultrasonograficznym z dopplerowską oceną krążenia wrotnego. U większości pacjentów było również wykonywane badanie morfologiczne punktatu wątroby.
Kryteriami wyłączenia, oprócz jawnej klinicznie encefalopatii były: choroby wątroby o etiologii alkoholowej, krwawienie z przewodu pokarmowego w okresie 3 miesięcy poprzedzających kwalifikację do badania, wodobrzusze lub spontaniczne bakteryjne zapalenie otrzewnej, aktualne leczenie antybiotykami, laktulozą lub lekami psychoaktywnymi. Nie kwalifikowano chorych ze współistniejącymi ciężkimi chorobami innych narządów i układów, jak niewydolność krążenia, niewydolność nerek, choroby układu oddechowego. Kryteriami wyłączenia były także wszystkie choroby neurologiczne i psychiczne, a szczególnie choroba Alzheimera, choroba Parkinsona i inne encefalopatie nie wątrobowego pochodzenia. Wyłączono również pacjentów z zaburzeniem rozróżniania kolorów i osoby z zaćmą. Wszyscy pacjenci zakwalifikowani do projektu badawczego na podstawie dokumentacji choroby, mieli przedstawiony program badań. Zgodę na udział w projekcie wyraziło 95 chorych – 45 osób z pierwotną żółciową marskością wątroby i 40 osób z marskością na tle zakażenia wirusem hepatitis C. Wykonano u nich podstawowe badania laboratoryjne w celu oceny wydolności wątroby i testy psychometryczne oraz EEG. Po tym etapie część chorych zrezygnowała z uczestnictwa w proponowanych badaniach i w efekcie pełny program zrealizowano u 51 chorych – 29 kobiet z pierwotną żółciową marskością wątroby (powszechnie używany skrót z nazwy w języku angielskim - PBC) w wieku 48-74 lat, mediana 61 lat i 22 chorych z marskością wątroby na tle zakażenia HCV (16 kobiet, 6 mężczyzn w wieku 31-71 lat, mediana 58 lat). Wśród badanych chorych 10 osób było w stopniu B według Childa-Pugha, a pozostali chorzy byli w stopniu A. U 18 chorych z PBC i u 9 chorych z pozapalną marskością w badaniu endoskopowym wykonanym w ostatnich 12 miesiącach przed włączeniem do programu, były żylaki przełyku.
Projekt badawczy przewidywał wykonanie u każdego pacjenta 7 badań wykrywających MEW. Były to: cztery testy psychometryczne, EEG, SEEG, P300, MRS, CFF i S100β. Do każdego badania tworzono osobne grupy kontrolne składające się z osób zdrowych dobranych pod kątem płci i wieku. Grupa kontrolna do testów psychometrycznych dobrana była również odpowiednio do stopnia wykształcenia pacjentów w grupie badanej.
Metody
1. Badanie neuropsychologiczne
U każdego pacjenta wykonywano 4 testy psychometryczne według standardów zalecanych u chorych z patologią wątroby (1, 4, 12, 24):
1.1. Test łączenia punktów A (NCT-A)
Badany łączy ołówkiem kolejno liczby od 1 do 25 wydrukowane w formie „przypadkowego rozrzucenia” na arkuszu papieru.
1.2. Test łączenia punktów (NCT-B)
Badany łączy na przemian liczby oraz litery, zachowując kolejność liczb oraz kolejność alfabetu. Na planszy znajduje się 13 liczb oraz 12 liter (od A do L). Badany zaczyna test od cyfry 1. W testach NCT-A i NCT-B badany jest proszony, aby wykonywał zadanie najszybciej jak potrafi. Wskaźnikiem jest czas liczony w sekundach.
1.3. Test symboli cyfr (DST)
Test ten jest częścią powszechnie używanej na całym świecie Skali Inteligencji Wechslera dla Dorosłych (WAIS-R). Badany wpisuje pod cyframi odpowiednie znaki (symbole) wg wzoru umieszczonego na arkuszu odpowiedzi, na którym znajdują się cztery rzędy cyfr, a pod każdą cyfrą umieszczony jest puste pole. Badany wypełnia po kolei arkusz tak, aby w ciągu 90 sekund wpisać jak najwięcej symboli. Wynikiem testu jest liczba punktów.
1.4. Test klocków (BDT)
Test ten jest również częścią Skali Inteligencji Wechslera dla Dorosłych (WAIS-R). Badany układa klocki wg podanych wzorów, wykonując zadanie tak szybko jak potrafi. Każdy klocek (sześcian) ma dwie ścianki czerwone, dwie ścianki białe i dwie ścianki czerwono-białe. Wzory 1-4, mające limit czasowy 60 sek. układane są z 4 klocków. Wzory 5-9, z limitem czasu 120 sek. układane są z 9 klocków. Wynikiem ilościowym testu jest liczba osiągniętych punktów.
W Polsce nie ma norm populacyjnych dla testów psychometrycznych, ani norm dla określonych grup wiekowych i stopnia wykształcenia. Wyniki w grupie badanych chorych porównywano z wynikami w grupie kontrolnej składającej się z 22 zdrowych osób z zachowaną proporcją w stosunku do badanych chorych w zakresie wieku, płci i stopnia wykształcenia, stworzonej dla celów obecnego projektu badawczego. Wyniki testów psychometrycznych w grupie kontrolnej przedstawia tabela 1.
Tabela 1. Wyniki 4 testów psychometrycznych u 22 osób zdrowych będące podstawą przyjętego zakresu wartości prawidłowych.
NCT-A – test łączenia punktów A, NCT-B – test łączenia punktów B, DST – test symboli cyfr, BDT – test klocków
Za wynik nieprawidłowy testów NCT-A i NCT-B przyjęto wartości wyższe od średniej + 2SD, a dla testów DST i BDT wartości niższe od średniej – 2SD. Badanie psychometryczne uznawano za patologiczne, gdy pacjent uzyskał nieprawidłowe wyniki w dwóch lub więcej testach (1). Badania psychometryczne wykonywane były przez jedną osobę – psychologa przeszkolonego w neuropsychologii (J.Sz-H), w Pracowni Neuropsychologii Instytutu Psychiatrii i Neurologii.
2. Badania neurofizjologiczne
2.1. Elektroencefalogram (EEG)
Badanie EEG wykonywano standardową techniką z użyciem cyfrowej aparatury (Digi Track, Elmiko, Polska). Pacjent badany był w pozycji leżącej, w komfortowych warunkach termicznych, w wyciszonym pomieszczeniu. Elektrody umieszczano zgodnie z międzynarodowym systemem „10-20”. Impedancja nie przekraczała 5 kW. Sygnały były filtrowane cyfrowo w zakresie 0,33-70 Hz. Rejestrowano 20 minutowy zapis EEG. W czasie zapisu pacjent miał zamknięte oczy i otwierał je kilkakrotnie na 15 sekund. Zapis EEG oceniał doświadczony specjalista według powszechnie stosowanej klasyfikacji Parsons-Smitha i wsp. (25) w modyfikacji Amodio i wsp. (15).
Za nieprawidłowy zapis EEG przyjmowano każdy stopień według tej klasyfikacji powyżej stopnia 0, który odpowiada zapisowi z prawidłowo częstym rytmem alfa.
2.2. Spektralny elektroencefalogram (SEEG)
Analizę spektralną wykonywano na fragmencie zapisu EEG dokonanego gdy pacjent miał zamknięte oczy. Wybierano 2 kanały zapisów: T3-O1 i T4-O2. Dane zbierano przy następujących parametrach programu: częstotliwość próbna -240 Hz, rezolucja – 14 bitów, filtracja sygnału – 25,6 Hz. Zakres częstości analizy spektralnej wynosił 1 – 25,6 Hz. Obliczano względną moc fal delta (1 – 3,5 Hz), theta (3,5 – 8 Hz), alfa (8 – 13 Hz) i beta (13 – 25,6 Hz).
SEEG uznawano za patologiczne, jeśli względna moc fal theta była ≥ 35% (27). Ponadto obliczano stosunek mocy theta do mocy alfa (T/A).
2.3. Badanie potencjałów wzbudzonych (P 300)
Pomiaru potencjału wzbudzonego, zależnego od bodźców słuchowych (P 300) dokonywano na aparacie Nicolet Viking IV z oprogramowaniem Wiking IV Master Soft V.6.20b. P300a vers.6.0 zgodnie z zasadami Międzynarodowej Federacji Elektroencefalografii i Neurofizjologii Klinicznej według schematu „odball paradigm” (16). Do rejestracji potencjałów używano powierzchniowych elektrod miseczkowych rozmieszczonych zgodnie z systemem „10-20”. Impedancja elektrod nie przekraczała 2,5 Ω. Stosowano filtry 0,5-30 Hz. Pacjent badany był w pozycji leżącej. Przez słuchawki słyszał dźwięk tła o częstotliwości 1000 Hz i drugi dźwięk – tak zwany bodziec celowy o częstotliwości 2000 Hz. Pacjent liczył bodźce celowe. Badanie wykonywano dwukrotnie. W zarejestrowanym zapisie oceniano
morfologię, latencję i amplitudę załamka P300.
Za wyniki nieprawidłowe latencji P 300 u chorych, przyjęto wartości przekraczające średnią arytmetyczną + dwa odchylenia standardowe (SD) uzyskane u 12 osób zdrowych. Według tego kryterium, za prawidłowy czas latencji P300 uznano wartości poniżej 425 ms., a za prawidłową amplitudę P300 uznano wartości większe od 5,55μV (16). Badania neurofizjologiczne wykonywano w Zakładzie Neurofizjologii Instytutu Psychiatrii i Neurologii w Warszawie.
2.4. Test krytycznej częstotliwości migotania (CFF)
Jest to test neurofizjologiczny polegający na ocenie reakcji OUN na światło. Charakteryzuje aktywację (ang. arousal) OUN i zdolności dyskryminacyjne bodźców wzrokowych (14). Używano aparatury „Wiedeński System Testów”. Pacjent badany był w ciemnym pokoju. Aparat generował sygnał świetlny o charakterystyce: długość fali 650 nm, jasność 27 cd/m2, intensywność światła 5,3 mcd. Badanie rozpoczynano od generowania bodźców świetlnych o częstotliwości 60 Hz, które pacjent widział jako stabilną jasność. Następnie, redukowano stopniowo częstotliwość bodźca świetlnego do momentu zauważenia przez pacjenta migoczącego światła, co badany sygnalizował przyciskiem elektrycznym. Rejestrowano częstotliwość fali świetlnej, przy której płynny obraz zmieniał się w światło migocące (częstotliwość migotania, CFF). Badanie powtarzano 8 razy. Całe badanie było automatycznie rejestrowane przez system i wyliczane były wartości średnie. Grupę kontrolną stanowiło 18 zdrowych osób. Średnia CFF w grupie kontrolnej wynosiła 45,5 Hz, a SD – 4,1.
Za punkt odcięcia norma / patologia zgodnie z danymi w piśmiennictwie przyjęto 39 Hz i wyniki poniżej tej wartości uznawano za nieprawidłowe (13, 14).
3. Protonowa spektroskopia rezonansu magnetycznego (1 HMRS)
Badania 1H MRS mózgu wykonano metodą jednowymiarowej spektroskopii pojedynczego woksela, aparatem 1,5T (Gyroscan ACS NT, Philips Medical Systems) z użyciem dedykowanej cewki nadawczo-odbiorczej. Wykorzystano sekwencję PRESS (czas echa TE= 22 ms; czas repetycji TR = 2000 ms; ilość uśrednień NA=128; rozmiar badanego obszaru VOI=15 mm x 15 mm x 15 mm). W celu zaplanowania badania spektroskopowego wykonano klasyczne obrazowanie MR sekwencjami T1 i T2 zależnymi w orientacji osiowej i czołowej. Każdorazowo przeprowadzono pomiary widm pochodzących z istoty białej jąder soczewkowatych (lewego i prawego) oraz istoty szarej kory mózgowej. Obliczenia i analizę względnych stężeń metabolitów: mioinozytolu (mI), choliny (Chol), glutaminy/kwasu glutaminowego (Glx), N-acetylo asparaginianu (NAA) i lipidów (Lip) odnoszono do stężenia kreatyniny (Cr), przyjmując jej wartość za niezmienną. Grupę kontrolną stanowiło 27 osób zdrowych.
Wartości niższe od średniej minus 2 SD dla mI i wartości wyższe od średniej plus 2 SD dla Glx w grupie kontrolnej przyjęto za nieprawidłowe. Badania wykonywano w Pracowni Rezonansu Magnetycznego Zakładu Radiologii Uniwersytetu Medycznego w Warszawie.
4. Badanie stężenia białka S 100β w surowicy krwi Białko S100β oznaczano w surowicy krwi żylnej pobranej w dniu poprzedzającym pierwsze badania psychometryczne i neurofizjologiczne. Do czasu oznaczenia S100β surowice przechowywano w temperaturze - 20 C°. Do oznaczeń wykorzystano zautomatyzowaną ilościową metodę immunoluminometryczną LIAISON, Sangtec100 firmy DiaSorin, Włochy. Grupę kontrolną stanowiło 29 zdrowych osób.
Za wyniki prawidłowe u badanych chorych, przyjęto wartości nie przekraczające średniej + 2 SD w grupie kontrolnej (<0,16 μg/L).
W analizie statystycznej wyników posługiwano się wartościami średniej i odchylenia standardowego, częstość występowania cechy (%) i obliczano 95% przedział ufności oraz wskaźniki podstawowej charakterystyki testów (czułość, swoistość).
Wyniki
Wyniki jednostkowe u wszystkich pacjentów przedstawia tabela 2.
Tabela 2. Wyniki 7 badań dodatkowych w celu wykrycia minimalnej encefalopatii wątrobowej u 51 chorych z marskością wątroby.
Pacjenci 1 do 29 – PBC, pacjenci 30 do 51 – marskość HCV; (+) – wynik nieprawidłowy
Pola zacieniowane – minimalna encefalopatia rozpoznana na podstawie obowiązujących kryteriów 1. Testy psychometryczne (w tabelach oznaczone skrótem PSYCH)
U 14 chorych (27,4%) nieprawidłowy był jeden lub więcej testów psychometrycznych. Zgodnie z kryteriami WGO, nieprawidłowe dwa lub więcej z wykonywanych testów są podstawą rozpoznania MEW (1). W badanej grupie były 2 osoby z nieprawidłowymi wynikami 2 testów, 4 osoby z nieprawidłowymi trzema testami i 3 osoby z nieprawidłowymi czterema testami psychometrycznymi. Wyniki badań psychometrycznych upoważniały do rozpoznania MEW u 9 chorych (17,6%).
2. Badania neurofizjologiczne
2.1. EEG
Standardowy zapis EEG został oceniony przez eksperta jako nieprawidłowy u 7 chorych (13,7%). Tylko w 2 przypadkach nieprawidłowy EEG pokrywał się z nieprawidłowymi wynikami testów psychometrycznych (tab. 2)
2.2. SEEG
W celu określenia czy spektralny EEG jest prawidłowy, czy nieprawidłowy, posłużono się jednym kryterium, to jest częstością fal theta. Na tej podstawie patologiczny SEEG rozpoznano u 2 chorych (3,9%). Obie pacjentki miały także nieprawidłowy zapis standardowego EEG. Natomiast obie chore miały prawidłowe wyniki badań psychometrycznych.
2.3. P 300
Za nieprawidłowy wynik P 300 przyjmowano badanie, w którym czas latencji przekraczał 425 ms. Spośród 51 badanych, u 3 pacjentów (5,8%) opóźnienie potencjału P 300 uznano za patologiczne. Wszyscy ci chorzy mieli prawidłowe wyniki badań psychometrycznych (tab. 2). Na rycinie 1 przedstawiono przykładowy zapis wyniku badania P 300.
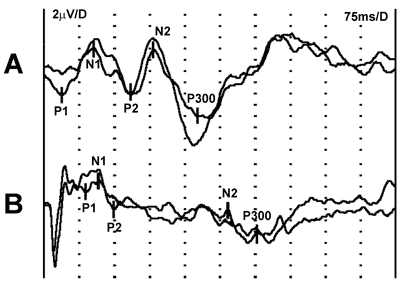 Ryc. 1. Przykłady wyników badania P 300. Wykres A: prawidłowy zapis u 60 letniego mężczyzny. Latencja 327 ms, amplituda 11,9 mV. Wykres B: zapis u chorej z marskością wątroby. Latencja 453 ms, amplituda 4,0 mV. Wynik nieprawidłowy.
2.4. CFF
U 15 chorych (29,4%) częstotliwość fali świetlnej, przy której badana osoba widziała przejście obrazu ze stabilnego na migoczący była niższa niż 39 Hz (powszechnie przyjęta granica normy). U 5 spośród tych 15 chorych nieprawidłowe były również testy psychometryczne, a u 4 chorych opisano nieprawidłowe EEG. Tylko u jednej pacjentki nieprawidłowe były równocześnie trzy badania (testy psychometryczne, EEG i CFF).
3. 1HMRS
Wyniki protonowej spektroskopii rezonansu jądrowego (1HMRS) uznawano za nieprawidłowe, gdy koncentracja mioinozytolu w jądrach podkorowych była niższa niż średni wynik u osób zdrowych pomniejszony o podwójną wartość odchylenia standardowego. Przy tym założeniu, u 7 chorych (13,7%), wyniki MRS uznano za patologiczne. Te nieprawidłowości dotyczyły 5 pacjentów, u których wszystkie dotychczasowe badania oceniono, jako prawidłowe. Jeden chory miał nieprawidłowe testy psychometryczne i u jednego chorego tylko CFF uznano za nieprawidłowe. Przykładowy zapis badania 1HMRS przedstawia rycina 2.
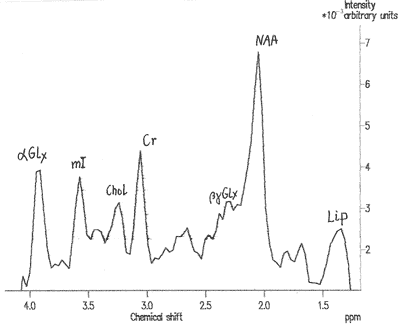 Ryc. 2. Protonowa spektroskopia rezonansu magnetycznego (1HMRS) u chorej z pierwotną żółciową marskością wątroby. Rejestr widma z jądra soczewkowatego. Pola załamków odpowiadają stężeniom poszczególnych metabolitów: mioinozytolu (mI), choliny (Chol), kwasu glutaminowego/glutaminianów (Glx), N-acetyloasparaginy (NAA) i lipidów (Lip). Obliczano względne stężenie tych metabolitów odnosząc je do stężenia kreatyniny (Cr).
4. S100β
Podwyższone stężenie w surowicy krwi astroglejowego białka S100β występowało u 7 (13,7%) chorych. Dotyczyło to głównie pacjentów z marskością HCV. U większości tych chorych, nie było nieprawidłowości w innych badaniach (tab. 2).
Częstość MEW w naszym materiale chorych była najwyższa (17,3%), gdy do jej rozpoznania zastosowano, jako wyłącznej metody cztery testy psychometryczne. Żadne inne badanie wymieniane w zaleceniach WGO z 2002 roku (1) wykonywane pojedynczo nie wykrywało większej liczby przypadków MEW (tab. 3). Połączenie dwóch badań znacznie zwiększyło częstość rozpoznania MEW w naszym materiale, a zastosowanie trzech spośród testów zalecanych przez WGO (1), to jest badań psychometrycznych, EEG i P300, niemal podwoiło liczbę przypadków MEW rozpoznanych testami psychometrycznymi (tab. 3). Gdy do zestawu zalecanych trzech badań (PSYCH, P 300 i EEG lub SEEG ) dodano jedno z nowych badań nie wymienianych w standardowym zestawie testów, to jest CFF, 1HMRS lub S100β, to liczba przypadków, u których można rozpoznać MEW, zwiększyła się do ponad 40%, a wykorzystanie łączne wszystkich dodatkowych badań dało podstawy do rozpoznania MEW u 30 (58,8%) spośród 51 badanych chorych (tab. 4).
Tabela 3. Częstość minimalnej encefalopatii wątrobowej (MEW) u 51 chorych z marskością wątroby w zależności od zastosowanego badania.
Tabela 4. Częstość minimalnej encefalopatii wątrobowej (MEW) u 51 chorych z marskością wątroby po dodaniu do badań standardowych testów nie zalecanych przez WGO (3).
Grupa ekspertów WGO w celu rozpoznania MEW zaleca badanie neuropsychologiczne i badania neurofizjologiczne (1).
Biorąc zgodnie z zaleceniami WGO za podstawę rozpoznania MEW testy psychometryczne i badania neurofizjologiczne (w naszym materiale dodatnie u 16 / 51 chorych), wartość diagnostyczna nowych badań wykonywanych pojedynczo lub w skojarzeniu – nie jest wysoka (tab. 5). Spośród nich, stosunkowo wysoką czułością charakteryzuje się test CFF (55%), a wysoką swoistością – badanie 1HMRS. Równoczesne wykonywanie dwóch, a nawet trzech nowych, niestandardowych badań nie zwiększa w istotny sposób ich czułości i swoistości, jeśli podstawą rozpoznania MEW są badania psychometryczne i testy neurofizjologiczne (tab. 5).
Tabela 5. Wartość nowych badań w wykrywaniu minimalnej encefalopatii wątrobowej (MHE). Podstawą rozpoznania MHE były testy psychometryczne.
WPWD – wartość predykcyjna wyniku dodatniego
WPWU – wartość predykcyjna wyniku ujemnego Omówienie
Rozpoznanie minimalnej encefalopatii wątrobowej u chorych z marskością wątroby jest ważnym problemem klinicznym i społecznym, ponieważ mimo braku objawów upośledzonej funkcji OUN, osoby takie mają istotne zaburzenia w tej sferze (3, 4, 9). Udowodniono, że pacjenci z MEW mają zmniejszoną sprawność wykonywania wielu codziennych czynności życiowych i zawodowych (5, 7, 10). Rozpoznanie MEW nie jest łatwe i przez wiele lat nie udawało się ustalić dobrych kryteriów rozpoznawania MEW. Najczęściej wykorzystuje się w tym celu badania psychoneurologiczne, bowiem zaburzenia funkcji OUN wykrywane tymi metodami pokrywały się z objawami rejestrowanymi we wczesnych fazach encefalopatii wątrobowej (4). Testy psychometryczne mają szereg wad i niedogodności. Są bardzo zależne od wieku i wykształcenia badanych i w ogólnej ocenie, mimo wysokiej czułości, ich swoistość w rozpoznawaniu MEW jest mała (13, 21). Do niedogodności związanych z testami psychometrycznymi, dołączyć również trzeba trudności techniczno-organizacyjne. Są to, bowiem badania czasochłonne, nużące i obarczone ryzykiem zafałszowania wyników w następstwie treningu, jeśli testy są powtarzane.
W Polsce występują dodatkowe trudności z wykonywaniem testów psychometrycznych. Mimo deklarowanej powszechnie w światowym piśmiennictwie opinii o prostocie i łatwości wykonania badania psychometrycznego, co ma umożliwiać wykorzystywanie tej metody przez lekarza w warunkach ambulatoryjnych, a nawet „przy łóżku chorego”, środowisko polskich psychologów uznaje, że ten rodzaj badań należy wykonywać w specjalnych warunkach i wyłącznie przez dyplomowanych psychologów przeszkolonych w badaniach psychoneurologicznych (oficjalne stanowisko Polskiego Towarzystwa Psychologicznego). Oznacza to, że badanie psychometryczne nie może być w naszym kraju uznane za „łatwy, prosty i powszechnie dostępny” sposób rozpoznawania MEW.
Badania neurofizjologiczne rozszerzają arsenał testów diagnostycznych encefalopatii. Wykorzystuje się w tym celu od wielu lat standardowe badanie EEG oraz nowsze techniki, jak spektralne EEG, badanie potencjałów wzbudzonych (najczęściej jest to P300) (15) i stosowane od niedawna testy z grupy neurofizjologicznych, ale wykorzystujące siatkówkę oka i szlak nerwu wzrokowego do oceny funkcji OUN (CFF) (14). Badania neurofizjologiczne, z wyjątkiem CFF, zaliczone zostały do standardowego arsenału diagnostycznego MEW (1). Natomiast CFF wzbudza ostatnio coraz większe zainteresowanie, jako dobre narzędzie w rozpoznawaniu encefalopatii (13, 21, 24).
Jest to stosunkowo tania, prosta, nieobciążająca pacjenta metoda, a ponadto, jak wykazują ostatnie badania, na wynik CFF nie ma wpływu wiek ani wykształcenie pacjenta (14). Jak wiadomo czynniki te w znacznym stopniu mogą zniekształcać wyniki badań psychometrycznych.
Duże możliwości oceny OUN dają rozwijające się bardzo dynamicznie techniki obrazowania. Spośród nich dużą przydatność w badaniu encefalopatii wykazuje spektroskopia rezonansu magnetycznego. Metoda ta pozwala bardzo precyzyjnie ocenić zmiany składu chemicznego w strukturach mózgu zachodzące w różnych stanach patologicznych (27). Nadaje się więc dobrze do oceny przypadków encefalopatii w przebiegu chorób wątroby, bowiem u podłoża tego zespołu leżą zmiany składu chemicznego komórek OUN, a szczególności astrocytów. Chociaż przydatność protonowej MRS mózgu w rozpoznawaniu MEW jest od dawna badana (17), to brak jest jeszcze ostatecznej oceny tej metody (27). Będzie jednak trudno uznać 1HMRS jako standardowy test diagnostyczny MEW, ponieważ jest to metoda kosztowna i wymaga specjalnej, drogiej i mało mobilnej aparatury.
Przed kilkunastu laty pojawiło się doniesienie o przydatności oznaczania w surowicy krwi białka astroglejowego S100β w rozpoznawaniu uszkodzeń mózgu w encefalopatii (18, 20). Podstawy patofizjologiczne przydatności tego białka w rozpoznawaniu encefalopatii są oczywiste. Jest to, bowiem białko produkowane przez astrocyty i wydzielane do krwi w stanach uszkodzenia tych komórek, co ma miejsce w MEW. Przydatność pomiaru białka S100β w surowicy krwi w diagnostyce MEW poza wspomnianą pracą Wiltfanga i wsp. i Saleha i wsp. nie była szerzej badana (18, 20).
W 2002 roku ukazały się wytyczne Światowej Orga
nizacji Gastroenterologicznej (WGO) w sprawie rozpoznawania MEW. Obowiązują one do dzisiaj. Według tych wytycznych w celu rozpoznania MEW należy wykonać badania psychoneurologiczne polegające na 4 wskazanych testach psychometrycznych lub przeprowadzić bardziej wystandaryzowane (z oceną punktową) badania psychometryczne oparte na zestawie pięciu testów. Dodatkowymi badaniami, wspomagającymi testy psychometryczne, są testy neurofizjologiczne ze wskazaniem na ich wersje ilościowe (P300, SEEG). W wytycznych wymieniono nowe badania, jak CFF i 1HMRS, ale nie wskazano ich jako testy standardowe, a podkreślono, że wymagają dalszej oceny (1).
Od tego czasu pojawiło się szereg prac analizujących nowe metody. Były to jednak badania porównujące tylko jeden nowy test z testami psychometrycznymi i z testami neurofizjologicznymi (13, 19, 20, 21, 22).
Podjęta praca jest pierwszą, w której oceniono wszystkie ze stosowanych i proponowanych badań służących do wczesnego rozpoznania MEW. U 51 chorych z marskością wątroby o etiologii autoimmunologicznej i zapalnej wykonano badania psychometryczne i testy neurofizjologiczne zgodnie z obowiązującymi zaleceniami (1). Ponadto u wszystkich chorych wykonano dodatkowe badania: CFF, MRS i oznaczenie białka S100β.
Na podstawie samych testów psychometrycznych w naszym materiale MEW rozpoznano u 17,6% chorych. Rozszerzenie diagnostyki o badania neurofizjologiczne zwiększyło odsetek chorych z MEW wśród badanych pacjentów z marskością wątroby do 31,3%. Dodanie jednego z nowych badań, zwiększało grupę chorych z „nieprawidłowymi wynikami badań” o około 10%, a połączenie wszystkich siedmiu testów wskazało, że blisko 60% badanych chorych ma wyniki nieprawidłowe. Zachodzi jednak pytanie, czy nieprawidłowe wyniki badań oznaczają obecność MEW? W celu odpowiedzi na to pytanie konieczna jest dłuższa obserwacja pacjentów i sprawdzenie, czy i kiedy u osoby z nieprawidłowym testem wystąpi jawna klinicznie encefalopatia. Bez takiej oceny nie można rozstrzygnąć, które badania dodatkowe i w jakim zestawie są optymalnym sposobem rozpoznawania MEW.
**Praca finansowana z projektu badawczego MNiSzW 3 PO 5B 03926
Podziękowania:
Autorzy dziękują Panu prof. dr. hab. med. Januszowi Cianciarze z Kliniki Hepatologii i Nabytych Niedoborów Immunologicznych WUM za pomoc w rekrutacji chorych z zakażeniem HCV. Piśmiennictwo
1. Ferenci P et al.: Hepatic encephalopathy – definition, nomenclature, diagnosis, and quantification: final report of the Working Party atthe 11th World Congress of Gastroenterology, Vienna, 1998. Hepatology. 2002; 35: 716-721.
2. Cordoba J, Minguez B: Hepatic encephalopathy. Sem. Liv. Dis. 2008; 28: 70-80.
3. Rikkers L et al.: Subclinical hepatic encephalopathy: detection, prevalence, and relationship to nitrogen metabolism. Gastroenterology. 1978; 75: 462-469.
4. Weissenborn K et al.: Neuropsychological characterization of hepatic encephalopathy. J. Hepatol. 2001; 34: 768-773.
5. Schomerus H et al.: Latent portasystemic encephalopathy. I Nature of cerebral functional defects and their effect on fitness to drive. Dig. Dis. Sci. 1981; 26: 622-630.
6. Hamster W: Neuropsychologie der latenten portosystemischen Enzephalopatie. Habilitationsschrift. Med. Fakult. Univ. Tubingen., Tubingen, 1982.
7. Watanabe A et al.: Evaluation of neuropsychological function In patients with liver cirrhosis with special reference to their driving ability. Metab. Brain. Dis. 1995; 10: 239 -248.
8. Das A et al.: Prevalence and natural history of subclinical hepatic encephalopathy in cirrhosis. J. Gastroenterol. Hepatol. 2001; 16: 531-535.
9. Li Y et al.: Prevalence of subclinical hepatic encephalopathy in cirrhotic patients in China. World J. Gastroenterol. 2004; 15: 2397-401.
10. Groenweg M et al.: Screening of subclinical hepatic encephalopathy. J. Hepatol. 2000; 32: 748-753.
11. Romero-Gomez M et al.: Subclinical hepatic encephalopathy predicts the development of overt hepatic encephalopathy. Am. J. Gastroenterol. 2001; 96: 2718-2723.
12. Ortiz m, Jacaz C, Cordoba J: Minimal hepatic encephalopathy: diagnosis, clinical significance and recommendations. J. Hepatol. 2005; 42: S45-S53.
13. Sharma P et al.: Critical flicker frequency: diagnostic tool for minimal hepatic encephalopathy. J. Hepatol. 2007; 47: 67-73.
14. Kircheis G et al.: Critical flicker frequency for quantification of low-grade hepatic encephalopathy. Hepatology. 2002; 35: 357-366.
15. Amodio P, Gatta A: Neurophysiological investigation of hepatic encephalopathy. Metab. Brain Dis. 2005; 20: 369-379.
16. Kullmann F et al.: Subclinical hepatic encephalopathy: the diagnostic value of evoked potentials. J. Hepatol. 1995; 22: 101-110.
17. Ross B et al.: Subclinical hepatic encephalopathy: proton MR spectroscopic abnormalities. Radiology. 1994; 193: 457-463.
18. Wiltfang J et al.: Elevated serum levels of astroglial S100b in patients with liver cirrhosis indicate early and subclinical portal-systemic encephalopathy. Met. Brain Dis. 1999; 14: 239-251.
19. Wessnborn K et al.: Hepatitis C virus infection and magnetic resonance spectroscopy. J. Hepatol. 2004; 41: 845-851.
20. Saleh A et al.: Serum levels of astroglial S 100-beta and neuron-specific enolase In hepatic encephalopathy patients. East. Mediterr. Health. J. 2007; 13: 1114-1123.
21. Romero-Gomez M et al.: Value of the critical flicker frequency in patients with minimal hepatic encephalopathy. Hepatology. 2007; 45: 879-885.
22. Minguez B et al.: Noncirrhotic portal vein thrombosis exhibits neuropsychological and MR changes consistent with minimal hepa-tic encephalopathy. Hepatology. 2006; 43: 707-714.
23. Romero-Gomez M et al.: Altered response to oral glutamine challenge as prognostic factor for overt episodes in patients with minimal hepatic encephalopathy. J. Hepatol. 2002; 37: 781-787.
25. Parsons-Smith B, et al.: The electroencephalograph in liver disease. Lancet. 1957; 2: 867-871.
26. Van der Rijt C et al.: Objective measurement of hepatic encephalopathy by means of automated EEG analysis. Electroenceph. Clin. Neurophysiol. 1984; 57: 423-426.
27. Grover V et al.: Current and future applications of magnetic resonance imaging and spectroscopy of the brain in hepatic encephalopathy. World J. Gastroenterol. 2006; 12: 2969-2978.
otrzymano/received: 2008-09-07 zaakceptowano/accepted: 2008-09-17 Adres/address: *Andrzej Habior Klinika Gastroenterologii i Hepatologii CMKP Centrum Onkologii Instytut im. M. Skłodowskiej-Curie ul. W. K. Roentgena, 02-781 Warszawa tel. (0-22) 546-25-03 e-mail: ahab@zeus.coi.waw.pl Pełna wersja artykułu Minimalna encefalopatia u chorych z marskością wątroby – ocena metod diagnostycznych i częstości występowania** dostępna w Czytelni Medycznej Borgis. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








