|
© Borgis - Postępy Nauk Medycznych 10, s. 677-697
*Tomasz Jaxa-Chamiec
Prewencja wtórna schorzeń sercowo-naczyniowych jako stały element kompleksowej rehabilitacji kardiologicznej
Secondary prevention of cardiovascular disease as an essential element of a comprehensive cardiac rehabilitation
Klinika Kardiologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. dr hab. Andrzej Budaj Streszczenie
Choroby sercowo-naczyniowe (CVD) są główną przyczyną zgonów oraz jedną z głównych przyczyn zachorowań i inwalidztwa w rozwiniętych krajach świata. W ostatnich kilkunastu latach wykazano, że nowoczesne, kompleksowe programy prewencji stanowią najskuteczniejszy sposób zmniejszenia umieralności z powodu CVD. Wiele grup eksperckich podkreśla znaczenie wielokierunkowej modyfikacji czynników ryzyka zarówno wśród osób z rozpoznaną CVD jak i u osób wysokiego ryzyka. Celem współcześnie rozumianego postępowania profilaktycznego powinno być: zwalczanie palenia tytoniu, zwiększenie aktywności fizycznej, leczenie nadciśnienia tętniczego, zwalczanie otyłości, stosowanie odpowiedniej diety i korekta profilu lipidowego, leczenie cukrzycy a także złożone oddziaływania psycho-socjalne. Tak zdefiniowany cel zarówno pierwotnej jak wtórnej prewencji CVD, znalazł swoje odbicie w wytycznych amerykańskich (American College of Cardiology i American Heart Association) i europejskich (European Society of Cardiology). W niniejszym rozdziale omawiane są wytyczne i przedstawiona jest rola i znaczenie modyfikacji czynników ryzyka CVD w jej współczesnym, kompleksowym kształcie. Słowa kluczowe: choroby sercowo-naczyniowe, modyfikacja czynników ryzyka, kompleksowa rehabilitacja kardiologiczna
Summary
Cardiovascular diseases (CVD) are the leading cause of death and one of the main causes of illness and disability in developed countries. During the last dozen of years it has been demonstrated that modern, comprehensive prevention programs are the most effective way to reduce mortality due to CVD. Many expert groups emphasise the importance of cross modification of risk factors among both diagnosed with CVD group and individuals at high risk. The purpose of modern prevention proceedings should be: smoking cessation, increase of physical activity, treatment of hypertension, fight against obesity, use of appropriate diet and correction of the lipid profile, the treatment of diabetes as well as complex psycho-social interactions. These defined objectives of both the primary and secondary prevention of CVD were reflected in both U.S. (American College of Cardiology and American Heart Association) and European guidelines (the European Society of Cardiology). In this chapter these guidelines and the role and importance of CVD risk factors modification in a modern and comprehensive form are discussed. Key words: cardiovascular diseases, modification of risk factors, comprehensive cardiac rehabilitation
Wstęp
Choroby sercowo-naczyniowe (CVD) są główną przyczyną zgonów oraz jedną z głównych przyczyn zachorowań i inwalidztwa w rozwiniętych krajach świata. W Europie CVD stanowią 49% wszystkich zgonów i 30% zgonów wśród osób poniżej 65 roku życia. Z powodu CVD na naszym kontynencie umiera 55% kobiet oraz 43% mężczyzn (1) . U kobiet choroba wieńcowa (CHD) jest przyczyną 23% zgonów, a u mężczyzn 21%, udar mózgu u kobiet 18% zgonów, a wśród mężczyzn 11%. Pozostałe patologie sercowo-naczyniowe są odpowiedzialne za 15% zgonów u kobiet i 11% u mężczyzn. U kobiet CVD ujawnia się średnio 10 lat później niż u mężczyzn (2).
Region Europy, w którym leży Polska, charakteryzuje się najwyższą umieralnością z powodu CVD. Jak wynika z danych epidemiologicznych Europa Środkowa i Wschodnia ma blisko 10-krotnie większą liczbę przedwczesnych zgonów z powodu CVD w porównaniu z Europą Zachodnią (1). Dane dotyczące umieralności z powodu CVD w poszczególnych regionach Europy i w Polsce przedstawia rycina 1.
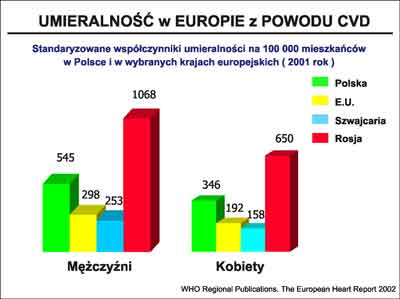 Ryc. 1. Umieralność z powodu chorób sercowo-naczyniowych w poszczególnych rejonach Europy i w Polsce (2).
W Polsce CVD stanowią, podobnie jak w Europie, najczęstszą przyczynę zgonów zarówno wśród kobiet jak i wśród mężczyzn. Ilustruje to rycina 2.
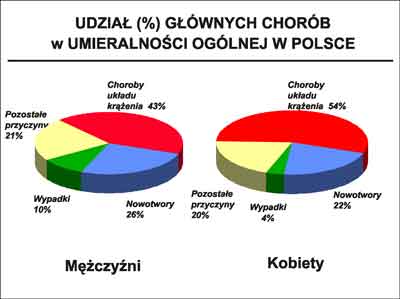 Ryc. 2. Udział głównych chorób w umieralności ogólnej w Polsce (dane GUS 2001).
Mimo, że od początku lat 90-tych obserwuje się w Polsce trend spadkowy umieralności z powodów krążeniowych, to z powodu CVD (głównie choroby wieńcowej, udaru mózgu, niewydolności serca i innych chorób serca) według danych GUS, w roku 2001 zmarło w Polsce 82 692 (43%) mężczyzn i 91 117 (54%) kobiet. Oznacza to, że codziennie z powodów sercowo-naczyniowych umiera w Polsce średnio 476 osób (226 mężczyzn i 250 kobiet).
W ostatnich kilkunastu latach, zarówno w Europie, Stanach Zjednoczonych jak i w Japonii, wykazano, że nowoczesne, kompleksowe programy prewencji stanowią najskuteczniejszy sposób zmniejszenia umieralności z powodu CVD. Wiele grup eksperckich podkreśla znaczenie wielokierunkowej modyfikacji czynników ryzyka zarówno wśród osób z rozpoznana CVD jak i u osób wysokiego ryzyka. Wnioski takie wyciągnięto na skutek obserwacji zawartych w szeregu znaczących badań, takich jak Framingham (3) w Stanach Zjednoczonych, SCORE (4) oraz EUROASPIRE I i II (5) w Europie. O wadze poszczególnych czynników ryzyka CVD świadczą także dane z głośnego, opublikowanego niedawno badania INTERHEART (6). Potwierdzono w nim z jednej strony kluczową rolę zaburzeń lipidowych, palenia papierosów, nadciśnienia tętniczego, i niezdrowego stylu życia (zła dieta i brak wysiłków fizycznych) jako czynników ryzyka pierwszego zawału serca. Udowodniono także, po raz pierwszy w tak dużej grupie badanych, wielkie znaczenie, niedocenianych wcześniej czynników ryzyka takich jak otyłość brzuszna i status psycho-socjalny chorych. Podstawowe dane z tego badania przedstawia rycina 3.
 Ryc. 3. Badanie INTERHEART (6). Czynniki ryzyka wystąpienia zawału serca.
Obecnie panuje zgodność, że podstawowym elementem współczesnej kompleksowej rehabilitacji kardiologicznej stała się prewencja wtórna schorzeń sercowo- -naczyniowych, czyli modyfikacja czynników ryzyka. Składają się na nią:
– zwalczanie palenia tytoniu
– zwiększenie aktywności fizycznej
– obniżenie ciśnienia tętniczego
– zwalczanie otyłości i stosowanie odpowiedniej diety
– korekta profilu lipidowego
– leczenie cukrzycy
– oddziaływania psycho-socjalne
Tak zdefiniowane cele prewencji wtórnej CVD znalazły swoje odbicie w publikowanych w ostatniej dekadzie, zarówno w Stanach Zjednoczonych jak i w Europie wytycznych (7, 8, 9, 10, 11, 12, 13), w oparciu o które powstał niniejszy rozdział.
Modyfikacja czynników ryzyka CVD – wyzwanie XXI wieku
Zwalczanie palenia tytoniu
Nałóg palenia tytoniu w świecie pozostaje nadal jednym z głównych wyzwań współczesnej profilaktyki zdrowotnej. Ocenia się, że na świecie pali tytoń ponad 1 mld ludzi (14). Niestety palaczy tytoniu przybywa. Szacuje się, że w roku 2025 będzie ich w świecie ponad 1,5 mld. Szkodliwość palenia papierosów jest bardzo bogato udokumentowana. Wykazano (15), że w roku 2000 z paleniem papierosów związane było blisko 5 mln przedwczesnych zgonów. Większość tych zgonów dotyczyła chorych z CVD (1,69 mln), chorych z przewlekłą obturacyjną chorobą płuc (0,97 mln), oraz z rakiem płuc (0,85 mln). Szacunkowe dane wskazują na to, że w 2030 roku liczba przedwczesnych zgonów związanych z paleniem tytoniu przekroczy w świecie 10 mln. W populacji ludzi z CHD palenie zwiększa ryzyko ponownych epizodów sercowo-naczyniowych ponad 3-krotnie (16). W badaniu INTERHEART (6) wykazano, że zagrożenie zawałem serca jest wprost proporcjonalne do liczby wypalanych papierosów (ryc. 4).
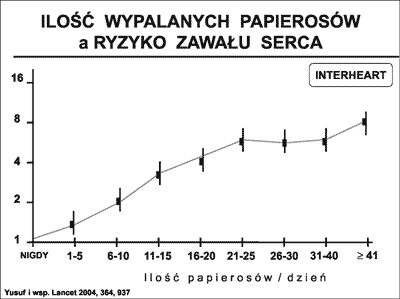 Ryc. 4. Badanie INTERHEART (6). Zależność pomiędzy liczbą wypalanych papierosów a ryzykiem wystąpienia zawału serca.
Z badań wynika, że istnieje swoisty synergizm między paleniem tytoniu i zaburzeniami lipidowymi. MONICA Augsburg cohort study (17) udowodniło, że ryzyko zgonu lub ujawnienia się CHD u osób palących i obarczonych dodatkowo hipercholesterolemią było, na przestrzeni 8 lat, 8-krotnie większe niż u osób bez tych czynników ryzyka. Także bierne palenie tytoniu zwiększa ryzyko. Metaanaliza przeprowadzona przez Lawa i wsp. (18) wykazała, że osoby nigdy nie palące mają 30% większe ryzyko rozwoju CHD, gdy przebywają na co dzień z osobami palącymi.
Od dawna wiadomo, że zaprzestanie palenia papierosów jest skutecznym sposobem zmniejszenia ryzyka CVD. Już w roku 1975 Wilhelmson i wsp. (19) wykazali, że osoby z udokumentowaną CHD, które rzuciły palenie mają o 50% mniejsze ryzyko zgonu lub wystąpienia zdarzeń sercowych. W roku 2003 Critchley i Capewell (20) opublikowali meta-analizę, z której wynika, że chorzy z CHD, którzy zaprzestali palenia mają o 36% mniejsze ryzyko przedwczesnego zgonu w porównaniu z nadal palącymi. Okazało się także, że rzucenie palenia powoduje istotną, ponad 40% redukcję ryzyka wystąpienia zawału serca nie zakończonego zgonem.
Mechanizmy, w jakich zaprzestanie palenia zmniejsza ryzyko powikłań ze strony układu sercowo-naczyniowego, są badane od wielu lat. Wykazano, że zerwanie z nałogiem powoduje m.in.:
– zwiększenie podaży tlenu
– zmniejszenie pobudzenia układu współczulnego
– zmniejszenie tendencji do kurczu naczyń
– zmniejszenie stresu oksydacyjnego
– poprawę funkcji śródbłonka
– redukcję LDL i zmniejszenie ich utleniania
– redukcję VLDL i trójglicerydów
– wzrost HDL
– zmniejszenie tendencji do zakrzepów i zatorów
– zmniejszenie agregacji płytek
– redukcję poziomu fibrynogenu
– redukcję poziomu CRP
Zaprzestanie palenia papierosów jest niestety trudno osiągalne. Jak wykazano w badaniu EUROASPIRE (5), aż 21% badanych z udokumentowaną wcześniej CHD paliło nadal albo wracało do palenia, mimo świadomości swojej choroby. Często związane jest to z niedostateczną kontrolą i skutecznością oddziaływania lekarzy i personelu odpowiedzialnego za prewencję. Pacjent pozostawiony sam sobie z problemem palenia okazuje się bardzo mało skuteczny w trwałym zerwaniu z nałogiem. Cel ten udaje się zrealizować, bez interwencji medycznej, u zaledwie 1-2% palaczy (12). Może on być jednak osiągnięty przy wsparciu psychologicznym, a przede wszystkim przy wsparciu farmakologicznym (21). Powszechność takiego oddziaływania pozostaje jednak bardzo ograniczona. Jak wynika z przytaczanego tu badania EUROASPIRE, zaledwie 6% chorych informowanych było przez swoich lekarzy o możliwości leczenia preparatami ułatwiającymi rzucenie palenia. Badania ostatnich kilkunastu lat wskazują na potrzebę wprowadzenia na szerszą skalę leczenia farmakologicznego ułatwiającego chorym zaprzestanie palenia. Zastosowanie znajdują zarówno specjalnie przygotowane preparaty w postaci plastrów przezskórnych, gum do żucia, tabletek podjęzykowych i inhalatarów wziewnych. Z metaanalizy, którą opublikował Silagy i wsp. (22) wynika, że takie metody farmakologicznego oddziaływania są nie tylko skuteczne lecz także bezpieczne.
Znaczenie, jakie przywiązuje się do skutecznego zwalczania nałogu palenia tytoniu, znalazło swoje odbicie w wytycznych europejskiego i amerykańskich towarzystw kardiologicznych. Zalecenie zaprzestania palenia papierosów przez chorego i osoby z jego otoczenia umieszczone zostało w klasie I-B według AHA/ACC (ryc. 5).
 Ryc. 5. Zalecenia ACC/AHA (7) dotyczące zaprzestania palenia papierosów.
Zwiększenie aktywności fizycznej
Brak aktywności fizycznej jest bardzo ważnym, aczkolwiek ciągle mało docenianym, czynnikiem ryzyka wielu przewlekłych schorzeń. Ryzyko CVD rośnie 1,5-krotnie u osób prowadzących siedzący trybie życia. Według danych WHO (23) brak aktywności fizycznej odpowiedzialny jest w skali świata za 2 mln zgonów i za 22% zgonów z powodu CHD. Ewolucja poglądów jaka dokonała się na przestrzeni ostatnich dwóch dekad, polegała na uświadomieniu roli wysiłku fizycznego nie tylko jako elementu rehabilitacji lecz także jako sposobu leczenia wielu chorych, w tym chorych kardiologicznych. Powszechne zrozumienie i przyjęcie tego faktu przez personel medyczny, a przede wszystkim przez samych chorych, pozostaje jednym z podstawowych wyzwań współczesnej prewencji.
We wcześniejszym rozdziale tego opracowania przedstawiono liczne dowody korzystnego wpływu treningu fizycznego u chorych z CVD. W niniejszym rozdziale poświęconym problemom prewencji wtórnej CVD, skoncentrowano się na stronie praktycznej właściwego zwiększenia aktywności fizycznej.
Wielu chorych z CHD ogranicza swoją aktywność fizyczną, w obawie przed nawrotem objawów i pogorszeniem stanu zdrowia, a koncentruje uwagę prawie wyłącznie na leczeniu farmakologicznym. Doceniając, udowodnione oddziaływanie niektórych grup leków, zapominamy zbyt często o znaczeniu innych niefarmakologicznych sposobów postępowania. Wśród nich o wysiłku fizycznym. Bardzo ciekawe zestawienie przedstawił na jednej z warszawskich konferencji Prof. Ryszard Piotrowicz z Instytutu Kardiologii w Warszawie. Metaanaliza, na którą się powołał, wskazuje na to, że wysiłek fizyczny jest lekarstwem całkowicie porównywalnym z uznanymi, na podstawie wieloośrodkowych randomizowanych badań, preparatami farmakologicznymi. Redukcja śmiertelności całkowitej pod wpływem wysiłku fizycznego dotyczyła zarówno chorych ze stabilną chorobą wieńcową, po zawale serca i/lub z niewydolnością serca (ryc. 6).
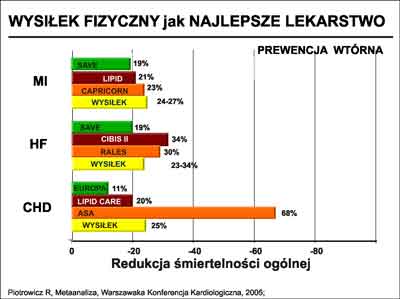 Ryc. 6. Wpływy wysiłku fizycznego na redukcję śmiertelności u chorych po zawale serca (MI), z niewydolnością serca (HF) i stabilną chorobą wieńcową (CHD).
Mechanizmy, w jakich wysiłek fizyczny korzystnie wpływa na układ sercowo-naczyniowy, badane są od szeregu lat. Odbywa się to nie tylko poprzez doraźne oddziaływanie na równowagę współczulno-przywspółczulną, działanie przeciwzakrzepowe, przeciwniedokrwienne czy antyarytmiczne, lecz także w sposób przewlekły, metaboliczny powodując spowolnienie procesu miażdżycowego, a także pobudzając procesy naprawcze np. w postaci tworzenia tętniczego krążenia obocznego. Efekty oddziaływania regularnej aktywności fizycznej na układ sercowo-naczyniowy przedstawione są na rycinie. 7.
 Ryc. 7. Wpływ regularnej aktywności fizycznej na układ sercowo-naczyniowy (adoptowane z: Perk i wsp. (24)).
W prewencji wtórnej CVD zalecenia dotyczące intensywności wysiłku fizycznego ustala się w sposób indywidualny, oparty o dane kliniczne oraz wynik testu wysiłkowego. Dla większości chorych przeznaczone są specjalne programy ćwiczeń w ramach rehabilitacji kardiologicznej. Szersze omówienie tej kwestii umieszczono w rozdziale: Rehabilitacja kardiologiczna w różnych sytuacjach klinicznych – etapy, wskazania, przeciwwskazania, bezpieczeństwo.
Zaleca się stosowanie mieszanych wysiłków, dynamicznych i statycznych, ale zdecydowanie z przewaga tych pierwszych. Rodzaje wysiłków zalecanych w treningu fizycznym, w ramach prewencji wtórnej przedstawiają się następująco:
– Izometryczny (statyczny) – mniej zalecany
dźwiganie, wyciskanie ciężarów, ćwiczenia oporowe
znaczne „ciśnieniowe" obciążenie dla serca, z istotnym ograniczeniem rzutu serca przy bardziej natężonym wysiłku
? Izotoniczny (dynamiczny) – bardziej zalecany
chodzenie, bieganie, pływanie, jazda na rowerze
zrównoważone obciążenie serca, bez nadmiernego ograniczenia rzutu serca
– Mieszany
Przykłady umiarkowanej aktywności fizycznej, które mogą być pomocne lekarzom, w proponowanych chorym planach treningowych przedstawiają się następująco (adoptowane z Perk i wsp. (24)):
– praca w ogrodzie przez 30-45 minut
– chód 3 km przez 30 minut (10 min/km)
– jazda rowerem 8 km w 30 minut
– szybki taniec (towarzyski) przez 30 minut
– aerobik wodny przez 30 minut
– pływanie przez 20 minut
– wioślarstwo przez 20 minut
Znaczenie jakie przywiązuje się obecnie do zwiększenia aktywności fizycznej, znalazło swoje odbicie w wytycznych towarzystw kardiologicznych. W zaleceniach AHA/ACC umieszczono ją w klasie I-B (ryc. 8).
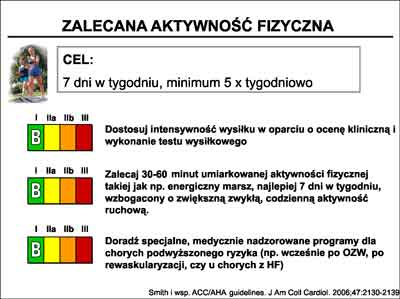 Ryc. 8. Zalecenia ACC/AHA (7) dotyczące stosowania zwiększonej aktywności fizycznej.
Obniżanie ciśnienia tętniczego
Nadciśnienie tętnicze jest jednym z najważniejszych czynników ryzyka przedwczesnego zgonu z powodu CVD. W niektórych krajach świata choruje ponad 30% społeczeństw. Lewington i wsp. (25) w metaanalizie publikowanej w 2002 roku wykazali, że wzrost RR skurczowego o każde 20 mmHg a rozkurczowego o 10 mmHg, podwaja ryzyko zachorowania na CVD. W sumie w skali świata nadciśnienie tętnicze przyczynia się do ponad połowy ogólnej liczby CVD. Wraz ze wzrostem zarówno ciśnienia skurczowego jak i rozkurczowego, liniowo przyrasta także śmiertelność z powodu CHD i udaru mózgu (ryc. 9).
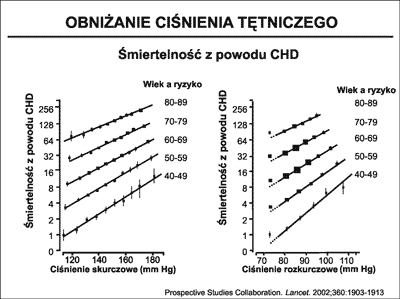 Ryc. 9. Prospective Studies Collaboration (25). Wpływy wzrastającego ciśnienia skurczowego (lewy wykres) i rozkurczowego (prawy wykres) na śmiertelność z powodu CHD oraz udaru mózgu.
Nie dziwi zatem fakt, że wykrycie i skuteczne leczenie nadciśnienia tętniczego jest jednym z głównych zadań prewencji pierwotnej i wtórnej. Zwłaszcza, że pojawiły się niedawno dowody na to, że chorzy z CVD nawet bez rozpoznanego nadciśnienia tętniczego, odnoszą korzyści z kontrolowanego obniżenia wartości RR.
Skuteczność takiego postępowania nie zależy jednak wyłącznie od leczenia farmakologicznego. Ciśnienie tętnicze może być obniżone przez modyfikację stylu życia (26, 27).
Modyfikacja taka powinna polegać na (24):
– redukcji masy ciała u osób z nadwagą
– redukcji podaży soli w diecie <6 g/dobę
– ograniczeniu spożycia alkoholu do 10-30 g dziennie (mężczyźni) i do 10-20 g dziennie (kobiety)
– regularnej aktywności fizycznej u osób prowadzących siedzący tryb życia
– zaprzestaniu palenia papierosów
– zmianach w diecie u osób z hiperlipidemią
U pacjentów z rozpoznaną CVD, skuteczne postępowanie oznacza także leczenie chorób współistniejących, np. cukrzycy i niewydolności nerek, które to schorzenia są niezależnymi czynnikami ryzyka.
Istnieją przekonywujące dowody na skuteczność leczenia farmakologicznego osób z nadciśnieniem tętniczym. MacMahon i wsp. (28) na postawie meta-analizy 17 randomizowanych badań obejmujących grupę 47 653 chorych wykazali, że długotrwałe leczenie obniżające ciśnienie tętnicze prowadziło do zmniejszenia ryzyka wystąpienia udaru zarówno zakończonego jak niezakończonego zgonem o 38%, oraz redukowało w tej grupie chorych śmiertelność z powodów naczyniowych o 21% (ryc. 10).
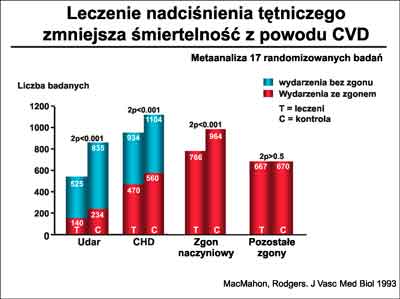 Ryc. 10. Wpływ leczenia nadciśnienia tętniczego na śmiertelność z powodu chorób sercowo-naczyniowych (CVD). Według MacMahon i wsp. (28).
Właściwy dobór leczenia farmakologicznego w prewencji wtórnej CVD u osób z nadciśnieniem tętniczym ma podwójne znaczenie. Stosowanie beta-blokerów, inhibitorów konwertazy, blokerów receptora angiotensyny, blokerów kanału wapniowego i diuretyków, podyktowane jest nie tylko udowodnionymi korzyściami wynikającymi z samego obniżenia ciśnienia, ale także z faktu oddziaływania tych leków na chorobę zasadniczą.
Kontrola ciśnienia tętniczego i zalecenie odpowiedniego postępowania jest stałym elementem działania lekarskiego w ramach prewencji wtórnej u chorych poddawanych rehabilitacji kardiologicznej. Sposób postępowania zawarty w wytycznych ESC (14) przedstawia się następująco:
– wykonaj pomiar ciśnienia tętniczego na ≥ 2 wizytach
– jeśli spoczynkowe RR skurczowe wynosi 130-139 mmHg lub RR rozkurczowe 85-89 mmHg, zaleć modyfikację stylu życia włączając:
– ćwiczenia fizyczne
– kontrolę masy ciała
– ograniczenie soli
– umiarkowane spożycie alkoholu
– jeśli chory ma cukrzycę lub/i niewydolność nerek lub/i niewydolność serca rozważ farmakoterapię
– jeśli spoczynkowe RR wynosi ≥ 140 mmHg lub rozkurczowe RR ≥ 90 mmHg, zleć farmakoterapię
– monitoruj efekty interwencji we współpracy z lekarzem rodzinnym.
Według wytycznych ESC, celem leczenia w nadciśnieniu tętniczym u chorych z podwyższonymi wartościami ciśnienia tętniczego jest:
– ciśnienie tętnicze <140/90 mmHg
lub
– ciśnienie tętnicze <130/85 mmHg u osób z cukrzycą i/lub przewlekłą niewydolnością nerek lub serca
Nowsze wytyczne ACC/AHA różnią się jedynie docelową wartością ciśnienia rozkurczowego u pacjentów ze schorzeniami współistniejącymi z nadciśnieniem. Zalecany sposób postępowania w ramach prewencji wtórnej umieszczony został w tych wytycznych w klasie I-B/I-A (ryc. 11).
 Ryc. 11. Zalecenia ACC/AHA (7) dotyczące leczenia nadciśnienia tętniczego u chorych w ramach prewencji wtórnej.
Zwalczanie otyłości i stosowanie odpowiedniej diety
Otyłość, obok cukrzycy, jest drugim z czynników ryzyka, którego częstość występowania w skali świata narasta. W Europie 20-30% populacji zalicza się do otyłych. Ten procent stale się zwiększa. Dane opublikowane w 2004 roku przez Jamesa i wsp. (29) wskazują na to, że na przestrzeni ostatnich 2 dekad liczba otyłych zwiększyła się prawie 3-krotnie. W Polsce problem otyłości także przybrał niezwykle niepokojące rozmiary. Z programu WOBASZ (30) (Wieloośrodkowe Ogólnopolskie Badanie Stanu Zdrowia) prowadzonego w ramach narodowego programu profilaktyki i leczenia chorób serca (POLCARD) wynika, że nadwagą lub otyłością dotkniętych jest w Polsce 62% mężczyzn i 50% kobiet. Nie ulega wątpliwości, że epidemia otyłości związana jest ze zmienionym trybem życia współczesnego człowieka, zwłaszcza w krajach wysoko rozwiniętych. Mamy z jednej strony do czynienia z powszechnością stosowania diet wysokoenergetycznych, bogatymi w tłuszcze zwierzęce, cukier oraz zawierającymi nadmiar soli, a z drugiej strony z ograniczoną aktywnością fizyczną i siedzącym trybem życia. Z tego samego badania WOBASZ wynika, że w Polsce do niskiej aktywności fizycznej przyznaje się 49% mężczyzn i 56% kobiet.
Już w latach 90-ych wykazano, że sama redukcja wagi ciała ma wpływ nie tylko na poprawę parametrów metabolicznych lecz także na rokowanie chorych z CVD. W Scotish Intercollegiate Guidelines Network (31) z roku 1996 znajdujemy informację, że redukcja masy ma korzystny wpływ na metabolizm lipidów i węglowodanów, a także poprawia rokowanie. W populacji szkockiej, która w owym czasie dotknięta była nadwagą i otyłością w 40%, redukcja masy ciała o każde 10 kg powodowała:
– 20% ↓ umieralności ogólnej
– 30% ↓ zgonów chorych z cukrzycą
– 40% ↓ zgonów na raka u chorych z otyłością
ponadto:
– ↓ RR skurczowego o 10 mmHg
– ↓ RR rozkurczowego o 20 mmHg
a także:
– ↓ glikemii na czczo o 50%
– ↓ cholesterolu całkowitego o 10%
– ↓ cholesterolu LDL o 15%
– ↓ triglicerydów o 30%
– - cholesterolu HDL o 8%
Do niedawna w ocenie otyłości posługiwaliśmy się prawie wyłącznie wskaźnikiem masy ciała (BMI) wyliczanym z prostego wzoru:
– BMI = waga (kg) / wzrost (m)2.
Według tego wskaźnika zakresy rozpoznawania otyłości i nadwagi przedstawiają się następująco:
– otyłość – BMI ≥ 30 kg/m2
– nadwaga – BMI 25-29,9 kg/m2
Z wcześniejszych badań wynikało jednoznacznie, że otyłość ma związek z częstszym występowaniem nadciśnienia tętniczego, dyslipidemii, cukrzycy i żylnej choroby zakrzepowej. Otyłość definiowana na podstawie BMI łączyła się także ewidentnie z częstszym występowaniem CVD, co wykazali, m.in. badacze fińscy Jousilahti i wsp. (32) na podstawie 15-letniej obserwacji.
Okazało się, że BMI koreluje z zapadalnością na CVD przede wszystkim w grupie znacznych otyłości. Mhurchu i wsp. (33) wykazali, że podwyższony BMI w sposób jednoznaczny korelował z występowaniem zarówno CHD, jak i udaru mózgu (ryc. 12).
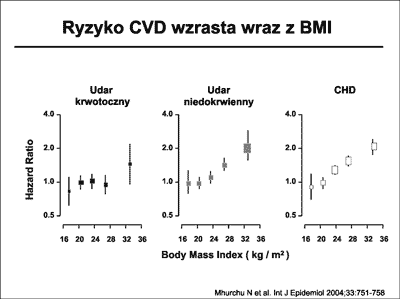 Ryc. 12. Wpływ wartości Body Mass Inndex (BMI) na ryzyko wystąpienia schorzeń sercowo-naczyniowych (CVD): udaru krwotocznego, udaru niedokrwiennego i choroby wieńcowej (CHD). Wg Mhurchu i wsp. (33).
Badania ostatnich lat wskazują na to, że precyzyjniejszym parametrem prognostycznym jest ocena lokalnego usytuowania tkanki tłuszczowej. Wykazano bowiem, że tzw. otyłość brzuszna silniej niż BMI koreluje z występowaniem CHD, nadciśnienia tętniczego, udarów mózgu, cukrzycy i hiperlipidemii. Takiego związku z zachorowalnością nie stwierdzono w przypadku otyłości biodrowej. Potwierdzeniem są wyniki przytaczanego już wcześniej badania INTERHEART (6). Wykazano w nim, że właśnie otyłość brzuszna, była obok hiperlipidemii, palenia tytoniu i czynników psycho-socjalnych, najsilniejszym czynnikiem ryzyka wystąpienia pierwszego zawału serca.
Otyłość brzuszna często wiąże się z zaburzeniami metabolicznymi, takimi jak niski poziom HDL, wysoki poziom trójglicerydów i LDL, cukrzyca i nietolerancja glukozy i nadciśnienie tętnicze. Mówimy wtedy o zespole metabolicznym. Obecnie najpowszechniej stosowana definicja zespołu metabolicznego według IDF(International Diabtes Federation) (34) przedstawiona jest na rycinie 13.
 Ryc. 13. Definicja zespołu metabolicznego proponowana przez IDF (International Diabtes Federation) (34).
Według różnych danych w Stanach Zjednoczonych w populacji osób powyżej 60 roku życia spotyka się ponad 40% osób spełniających powyższe kryteria. W Polsce według rejestru WOBASZ zespół metaboliczny rozpoznaje się u 23% mężczyzn i 20% kobiet. Chorzy z zespołem metabolicznym mają od 1,5 do 3 razy zwiększone ryzyko wystąpienia CHD lub udaru mózgu (35).
Biorąc pod uwagę powszechność występowania oraz skutki do jakich prowadzi otyłość, jej zwalczanie i zapobieganie jest jednym z kluczowych zadań współczesnej profilaktyki. Ważnym sposobem, który można w tej walce wykorzystać, jest zwiększenie aktywności fizycznej. Istnieje wiele dowodów na skuteczność treningu fizycznego w walce z otyłością (36, 37). Carlson i wsp. (38) wykazali, że wzmożona aktywność fizyczna może mieć korzystny wpływ na metabolizm tkanki tłuszczowej jeszcze przed oczekiwanymi efektami w postaci spadku masy ciała.
Obok zwiększenia aktywności fizycznej najważniejszą rolę w walce z otyłością ma jednak stosowanie odpowiedniej diety. Obecnie wiadomo, że wpływ diety na występowanie CVD, także u ludzi z otyłością, jest bardzo złożony. Mamy tu do czynienia niewątpliwie ze swoistą grą pomiędzy rodzajem diety, wydzielaniem hormonalnym a predyspozycjami genetycznymi. Na przestrzeni ostatnich dziesięcioleci udało się zaobserwować pewne związki pomiędzy rodzajem diety a skłonnością do otyłości, nadwagi jak i występowania CVD. Początkowo taki związek widziano wyłącznie poprzez pryzmat podwyższonego w diecie poziomu cholesterolu ogólnego, potem jego frakcji LDL. Wreszcie okazało się, że kluczowe znaczenie mają proporcje zawartych w diecie kwasów tłuszczowych nasyconych do jedno- i wielonienasyconych. Obecnie zalecanymi składnikami zdrowej diety są:
– kwasy tłuszczowe nasycone <7% ogólnego zapotrzebowania kalorycznego (OZK)
– kwasy tłuszczowe jednonienasycone ≤ 20% OZK
– kwasy tłuszczowe wielonienasycone ≤ 10% OZK
– tłuszcze ogólnie 25-35% lub mniej OZK
– węglowodany 50-60% lub więcej OZK (w postaci złożonej pochodzące z warzyw, owoców i ziaren)
– błonnik 20-30 g/dobę
– białka ≈ 15% OZK
– cholesterol <200 mg/dobę
Wśród prac wskazujących na związek pomiędzy dietą i rokowaniem najczęściej wymienia się głośne francuskie badanie Lyon Diet Heart Study (39), które wykazało, że tzw. dieta śródziemnomorska,bogata w owoce, warzywa, bogatoziarniste pieczywo, nasiona, oliwę z oliwek, ryby, drób i umiarkowane ilości czerwonego wina a wzbogacona dodatkowo o zwiększone ilości kwasu α-linolenowego powodowała u osób po przebytym zawale serca, istotny około 70% spadek nawrotów choroby serca (ryc. 14).
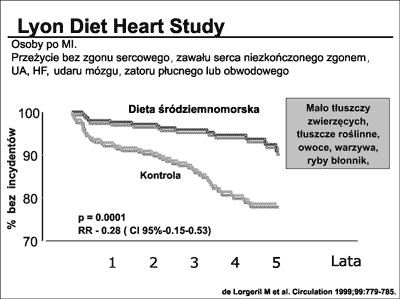 Ryc. 14. Wyniki badania Lyon Diet Heart Study (39). Dieta śródziemnomorska wzbogacona o kwas α-linolenowy powoduje redukcję głównego punktu końcowego badania o 72%. MI-zawał serca, UA – niestabilna choroba wieńcowa, HF – niewydolność serca.
Wśród kwasów tłuszczowych wielonienasyconych, niezbędnych w zdrowej diecie podnosi się szczególne znaczenie frakcji omega-3. Wykazano bowiem, że powodują one istotny wzrost frakcji HDL cholesterolu, oraz spadek LDL, triglicerydów, cholesterolu całkowitego i miażdżycogennej lipoproteiny A. Ponadto omega-3 powodują korzystne zmiany w układzie krzepnięcia:
– ↓ poziomu fibrynogenu
– ↓ adhezji i agregacji płytek krwi
– ↑ aktywności tkankowego aktywatora plazminogenu (t-PA)
– ↑ aktywności antytrombiny
Tak korzystne oddziaływania omega-3 wykazane zostały w kilku badaniach, a wśród nich w opublikowanym w 1999 roku głośnym badaniu GISSI Prevenzione Study (40).
W grupie 11 323 chorych po zawale serca stosowano Omacor w skład którego wchodziły pochodne kwasu alfa-linolenowego: EPA (kwas eikozapentaenowy) oraz DHA (kwas dokozaheksaenowy) w proporcji 46:38. Po 3,5-letniej obserwacji okazało się, że podawanie dziennie 1g tego preparatu powodowało, w porównaniu z kontrolą istotne zmniejszenie częstości występowania zgonów ogółem, zgonów z powodu choroby wieńcowej, a także częstości udarów mózgu i zawału serca nie zakończonego zgonem. Szczególną uwagę zwrócił fakt bardzo znaczącego spadku częstości zgonów nagłych. Kluczowy wynik badania GISSI przedstawia rycina 15.
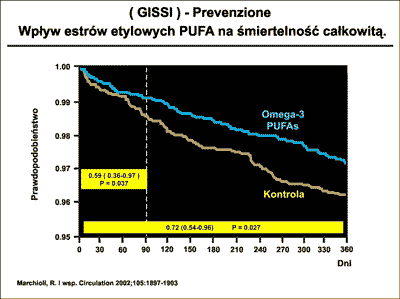 Ryc. 15. Wpływ podawania estrów etylowych wielonienasyconych kwasów tłuszczowych na śmiertelność całkowitą.
Uważa się, że głównymi mechanizmami w jakich estry etylowe korzystnie wpływają na układ sercowo-naczyniowy jest ich działanie przeciwmiażdżycowe, przeciwzapalne, przeciwzakrzepowe a przede wszystkim (choć nadal w badaniach klinicznych bezpośrednio nie potwierdzone) działanie antyarytmiczne.
Spośród innych kwasów tłuszczowych korzystne zdrowotnie oddziaływania mają również pochodne kwasu linolowego czyli omega-6 wielonienasycone kwasy tłuszczowe, a także niektóre (cis) kwasy jednonienasycone. Schemat diety zalecanej w prewencji CVD przedstawiony jest na rycinie 16.
 Ryc. 16. Dieta zalecana w prewencji schorzeń sercowo-naczyniowych (CVD). Adaptowane z wytycznych ESC 2007 (12) oraz ACC/AHA 2006 (7).
PUFA-n-3 – kwasy tłuszczowe wielonienasycone – omega-3, PUFA-n-6 – kwasy tłuszczowe wielonienasycone omega-6, MUFA-cis – kwasy jednonienasycone – cis. Omawiając diety zalecane przez europejskie i amerykańskie towarzystwa kardiologiczne w walce z miażdżycą należy również wspomnieć o zawartych tam wskazówkach co do spożywanego alkoholu. W ostatnich latach wykazano, że alkohol spożywany w umiarkowanych ilościach, powoduje wzrost frakcji HDL cholesterolu i poprawę parametrów krzepnięcia w postaci redukcji fibrynogenu, oraz wzrostu poziomu tkankowego aktywatora plazminogenu i antytrombiny. Przekłada się to na zmniejszone ryzyko występowania CHD (41). Uważa się, że uznane jako umiarkowane, optymalne ilości alkoholu, powinny wynosić, w przeliczeniu na etanol, dla mężczyzn 10-30 g/d, a dla kobiet 10-20 g/d. Komentując wytyczne zwraca się jednak uwagę na obserwowane ostatnio, niebezpieczne, zbyt liberalne podejście do spożywania alkoholu. Wiąże się ono prawdopodobnie z szeroko nagłaśnianymi i nadinterpretowanymi przez media wynikami badań kardiologicznych dotyczących diety i spożywania alkoholu. Wynika z nich, że umiarkowane ilości alkoholu zmniejszają ryzyko CVD, jednak często przemilczany jest fakt, że nawet nieznaczne przekroczenie tych dawek powoduje gwałtowne zwiększenie ryzyka zgonu (krzywa J). O tym fakcie należy przypominać i upowszechniać go (ryc. 17).
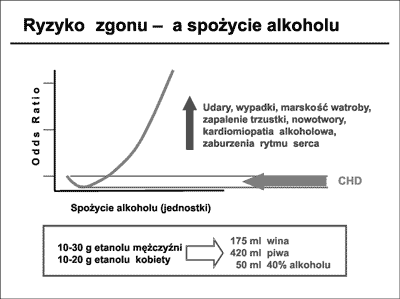 Ryc. 17. Ryzyko zgonu a dawki spożywanego alkoholu.
Zalecenia towarzystw kardiologicznych obejmują także sytuacje, w których postępowanie terapeutyczne u chorych ze znaczną otyłością powinno zawierać odchudzające leczenie farmakologiczne. Wśród leków, które można rozważyć w takich sytuacjach wymienia się preparaty z grupy sibutraminy czy orlistatu, a także rimonabant, który może doprowadzić do znaczniejszej i bardziej trwałej utraty masy ciała.
Postępowanie umożliwiające właściwą kontrolę wagi ciała wyznaczają wytyczne zarówno europejskiego jak i amerykańskich towarzystw kardiologicznych. Określają one docelowe wartości obwodu w pasie na: <88 cm u kobiet oraz <102 cm u mężczyzn (ryc. 18). Ostatnia modyfikacja wytycznych europejskich z 2007 roku obniża jednak wcześniejsze normy obwodów do: <80 cm u kobiet oraz <94 cm u mężczyzn, w grupie chorych o podwyższonym ryzyku CVD.
 Ryc. 18. Zalecenia ACC/AHA (7) dotyczące utrzymania należnej wagi ciała w ramach prewencji wtórnej.
Korekta profilu lipidowego
Istnieją bezsporne dowody na to, że podwyższony cholesterol ma związek z występowaniem CVD u kobiet i u mężczyzn (42). Wiadomo także, że obniżanie cholesterolu powoduje zmniejszenie ryzyka CVD. Jak wykazano (43), zmniejszenie poziomu cholesterolu w surowicy o 10% powoduje w ciągu 5 lat redukcję ryzyka CHD o 25%, a zmniejszenie poziomu LDL-choleterolu o 1 mmol/L powoduje spadek ryzyka wystąpienia CHD o 20%. Podwyższony poziom triglicerydów jest związany z wyższym ryzykiem CVD (44), ale zależność ta nie jest tak silna jak w przypadku cholesterolu. Podwyższony poziom HDL-choleterolu chroni przed postępem miażdżycy u chorych wysokiego ryzyka CVD.
Z praktycznego punktu widzenia, podobnie jak w przypadku nadciśnienia tętniczego, czy otyłości, pierwszym działaniem, jakie należy podjąć u chorego z zaburzeniami lipidowymi, jest redukcja innych współistniejących czynników ryzyka. Zarówno w prewencji pierwotnej jak i wtórnej zalecana powinna być zmiana stylu życia z zastosowaniem diety hipolipemicznej, z wyraźnym zwiększeniem aktywności fizycznej oraz redukcją wagi ciała w przypadku nadwagi/otyłości.
Zmiana stylu życia i zwyczajów żywieniowych wpływa na poszczególne frakcje lipidowe.
Do obniżenia poziomu LDL-choleterolu przyczynia się:
– ↓ podaży nasyconych kwasów tłuszczowych i izomerów trans
– ↓ cholesterolu pokarmowego
– ↓ masy ciała
– błonnik
– sterole i stanole roślinne (margaryny i jogurty wzbogacone w te związki)
Do redukcji triglicerydów prowadzi:
– ↓ masy ciała
– unikanie alkoholu
– ↓ podaży cukru
– ↑ aktywności fizycznej
– ↑ podaży omega-3 kwasów tłuszczowych w postaci oleju rybnego lub podanie 1g/d w postaci kapsułki
Do wzrostu poziomu HDL-cholesterolu przyczynia się:
– ↓ masy ciała
– ↑ aktywności fizycznej
– zaprzestanie palenia
– spożywanie umiarkowanych ilości alkoholu
Ocena profilu lipidowego u chorych z zawałem serca powinna uwzględniać zaburzenia, jakim podlegają one w pierwszych tygodniach choroby (45). Standardy postępowania w zawale serca, dla właściwej i wiarygodnej oceny poziomu lipidów, zalecają oznaczenie ich w pierwszych 24 godzinach od początku objawów lub po 4-5 tygodniach. Zaburzenia rzeczywistego poziomu lipidów u chorych z zawałem serca przedstawia rycina 19.
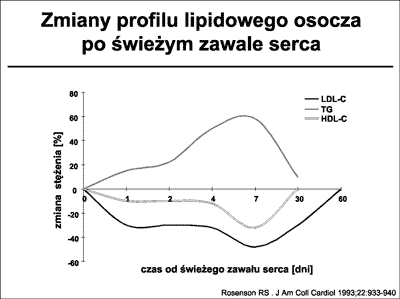 Ryc. 19. Krzywe odzwierciedlające zaburzenia rzeczywistego poziomu lipidów w ostrym zawale serca. Na podstawie: Rosenson i wsp. (45).
Według wytycznych ESC (11) celem terapeutycznym w przypadku prewencji wtórnej jest osiągnięcie wartości cholesterolu na poziomie:
– cholesterol całkowity <175 mg%lub ≅ 155 mg% dla chorych o wzmożonym ryzyku
– LDL – cholesterol <100 mg% lub ≅ 80 mg% dla chorych o wzmożonym ryzyku
HDL-choleterol oraz triglicerydy według zaleceń ESC nie są celem leczenia, ale określane są jako markery zwiększonego ryzyka, gdy ich poziom w surowicy wynosi:
– Triglicerydy> 150 mg%
– HDL-cholesterol <46 mg% u mężczyzn oraz <40 mg% u kobiet
Wytyczne ACC/AHA (6) jako cel terapeutyczny odnoszą się jedynie do wartości LDL-cholesterolu (wskazanie w klasie I-A), dopuszczając jednak możliwość jego obniżenia do poziomu <70 mg% (klasa IIa-A). W przypadku podwyższonej wartości triglicerydów zalecają obniżanie non-HDL cholesterolu (gdzie non-HDL = cholesterol całkowity – HDL) do poziomu <130 mg% (klasa I-B). Wytyczne ACC/AHA przedstawia rycina 20.
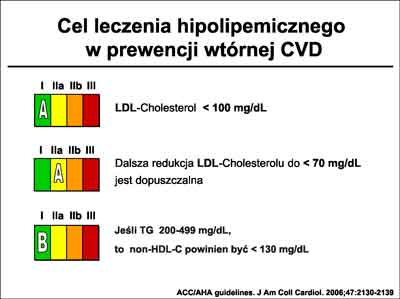 Ryc. 20. Wytyczne ACC/AHA (6) dotyczące celów terapeutycznych w leczeniu zaburzeń lipidowych w ramach prewencji wtórnej.
Standardowym postępowaniem u chorych z rozpoznaną CVD jest stosowanie inhibitorów hydroksy-3-metyl-glutaryl-CoA reduktazy (statyn), które nie tylko obniżają poziom cholesterolu, ale także mają udowodnione działanie poprawiające rokowanie. W odpowiednio wysokich dawkach mogą także hamować postęp, a nawet powodować regresję zmian miażdżycowych (46).
W zaawansowanych zaburzeniach lipidowych u chorych z rozpoznaną CVD poza statynami sięgamy i do innych leków hipolipemicznych, takich jak fibraty, kwas nikotynowy, żywice jonowymienne lub ezetymib. Wpływ tych leków na poszczególne frakcje lipidowe przedstawia rycina 21.
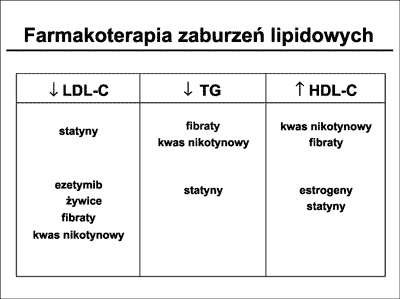 Ryc. 21. Wpływ wybranych grup leków hipolipemicznych na poziom lipidów.
Leczenie cukrzycy
Cukrzyca (DM) występuje u 8-10% dorosłych osób w USA i u 6-7% dorosłych Europejczyków. Jej częstość w populacji wzrasta. Stwierdzana jest u 38-45% chorych przyjmowanych do szpitali z powodu CVD (47, 48). Obserwuje się też stały wzrost liczby osób z DM wśród chorych poddawanych rehabilitacji kardiologicznej (49).
DM jest niezależnym czynnikiem ryzyka CVD (50). Istnieją jednoznaczne dowody na to, że chorzy z zawałem serca i współistniejącą DM, zarówno kobiety jak mężczyźni, rokują gorzej od chorych bez cukrzycy (51). Sprafka JM i wsp. (52) wykazali, że ryzyko zgonu w ciągu 6 lat po zawale serca wśród chorych z DM było o 40% wyższe niż u chorych bez DM. Krzywe przeżycia po zawale serca wśród kobiet i mężczyzn przedstawia rycina 22.
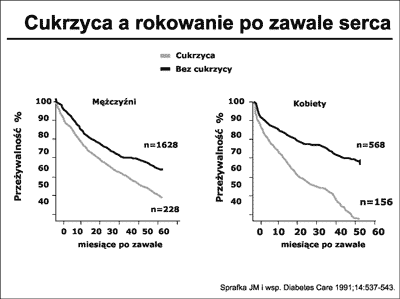 Ryc. 22. Krzywe przeżycia po zawale serca u chorych z cukrzycą i bez cukrzycy. Na podstawie Sprafka i wsp. (52).
U chorych z cukrzycą typu 2 randomizowane badania wykazują jednoznacznie, że skuteczna kontrola glikemii zapobiega występowaniu CVD. Pełne efekty w prewencji CVD u chorych z cukrzycą osiąga się jednak nie tylko przez właściwe leczenie hipoglikemiczne, ale także przez zwalczanie innych współistniejących czynników ryzyka CVD. U chorych z DM zaleca się modyfikację diety, redukcję wagi ciała oraz zwiększenie aktywności fizycznej. Cele terapeutyczne w leczeniu DM typu 2 rekomendowane przez ESC (11) przedstawiają się następująco:
– HbA1C (%) ≤ 6,5
– Poziom cukru na czczo (mmol/L) <6,0 (110 mg%)
– Poziom cukru po jedzeniu (mmol/L) <7,5 (135 mg%)
– Ciśnienie tętnicze (mmHg) ≤ 130/80
– Cholesterol ogólny (mmol/L) <4,5 (175 mg%) <4,0 (155 mg%) jeśli osiągalny
– LDL-cholesterol (mmol/L) <2,5 (100 mg%) <2,0 (80 mg%) jeśli osiągalny
Jaką wagę u chorych z cukrzycą ma leczenie współistniejących czynników ryzyka wykazali Geade i wsp (53). Okazało się, że poza kontrolą glikemii (HbA1C≤ 6,5), utrzymywanie odpowiedniej diety oraz osiąganie innych celów terapeutycznych, jak poziom cholesterolu <175 mg%, triglicerydów <150mg%, wartości RR <130/80 mmHg, prowadziło do 53% redukcji ryzyka wystąpienia zdarzeń sercowych (ryc. 23).
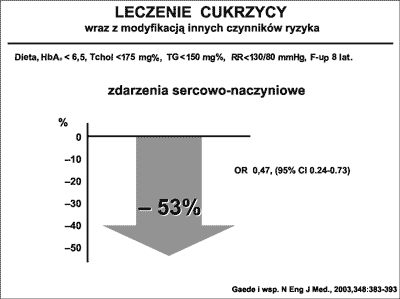 Ryc. 23. Wpływ właściwej kontroli glikemii i współistniejących czynników ryzyka na ryzyko zdarzeń sercowych. Na podstawie Gaede i wsp. (53).
W ostatnich latach wykazano (54), że czynnikiem ryzyka CVD jest także tzw. nietolerancja glukozy (IGT – impaired glucose tolerance), do niedawna nazywana stanem przed-cukrzycowym. Definicja według WHO potwierdzona w ostatnio opublikowanych wytycznych ESC oraz EASD (European Association for the Study of Diabetes) rozpoznaje obecność IGT, gdy:
– IGT – glikemia na czczo (IFG) <7,0 mmol/L (126 mg%) glikemia po 2 h po obciążeniu ≥ 7,8 mmol/L (140 mg%) a <11,1 mmol/L (200 mg%)
Natomiast dane na temat związku między podwyższoną glikemią na czczo (IFG – impaired fasting glucose) a CVD są sprzeczne. Show i wsp. (55) stwierdzili 2-krotnie zwiększone ryzyko CVD u osób z IFG, gdy tymczasem w Japaneese Funugata Study (56) wykazano związek z występowaniem CVD u osób z IGT a nie z IFG. Definicja IFG według ADA (American Diabetes Association), potwierdzona przez ESC/EASD przedstawia się następująco:
– IFG – glikemia na czczo ł 5,6 mmol/L (100 mg%) i <7,0 mmol/L (126 mg%)
Zalecenia ACC/AHA dotyczące postępowania z chorymi z DM w ramach prewencji wtórnej CVD różnią się od wytycznych europejskich oczekiwaną wartością hemoglobiny glikowanej (HbA1C <7% ACC/AHA vs HbA1C≤ 6,5% ESC) (ryc. 24).
 Ryc. 24. Wytyczne ACC/AHA (7) dotyczące celów leczenia hipoglikemicznego.
Oddziaływania psychosocjalne
Badania ostatnich lat dostarczają coraz to nowych, bardziej przekonywujących dowodów na związek pomiędzy czynnikami psychologicznymi a przedwczesnym ujawnianiem się CHD. Spośród czynników psychologicznych i psychosocjalnych, w stosunku do których udowodniono związek z występowaniem oraz rokowaniem w CHD, wymienia się następujące:
– Depresja
– Lęk
– Czynniki osobowościowe
– Przewlekły stres
– Izolacja społeczna
– Niski status socjoekonomiczny
Istnieją dane wskazujące na to, że czynniki psychologiczne są niezależnymi czynnikami ryzyka CHD (57) . We wspomnianym już wcześniej badaniu INTERHEART (6) czynniki psychosocjalne stanowiły ponad 30% ryzyka wystąpienia zawału serca. Zwiększone ryzyko występowania CHD stwierdzono także u ludzi z depresją (58) . Wykazano, że chorzy z depresją po zawale serca, mają około 5-krotnie większe ryzyko zgonu w porównaniu z osobami bez depresji (59) . Kawaschi i wsp. (60) udowodnili związek pomiędzy lękiem i zwiększonym ryzykiem nagłego zgonu, a z kolei Case i wsp. (61) badali wpływ osobowości typu A, charakteryzującej się wrogością wobec otoczenia, nadmiernym współzawodnictwem oraz pracoholizmem, na zwiększone ryzyko zgonu u osób po zawale serca. Kivimaki i wsp. (62) wykazali zaś zależność pomiędzy przewlekłym stresem w pracy a zwiększonym ryzykiem zgonu z powodu CVD, Natomiast Orth-Gomer i wsp. (63) znaleźli związek pomiędzy stresem wskutek konfliktów w życiu rodzinnym a rokowaniem u kobiet z CHD. Wpływ gwałtownego stresu, tak silnego jak np. utrata bliskiej osoby, katastrofa, trzęsienie ziemi, powódź czy zamach terrorystyczny, powoduje nawet kilkukrotne zwiększenie ryzyka nagłego zgonu, lub zawału serca.
Z innych badań wynika, że stopień wsparcia społecznego ma silny związek z występowaniem CHD oraz rokowaniem. Rosengren i wsp. (64) udowodnili, że istnieje silna korelacja pomiędzy stanem emocjonalnym a rozwojem CHD. Po 15 latach obserwacji grupy zdrowych kobiet, w wieku średnio 50 lat, dwoma niezależnymi czynnikami ryzyka wystąpienia CHD okazały się: niska społeczna integracja (HR – 0,45) oraz niska więź emocjonalna (HR – 0,58). Natomiast Berkman i wsp. (65) wykazali, że u chorych w starszym wieku z zawałem serca niezależny korzystny wpływ na rokowanie miało wsparcie emocjonalne od osób bliskich lub rodziny.
Czynnikiem ryzyka CHD jest także status ekonomiczny chorego. Dane takie potwierdza analiza FINNMONICA (66), w której wykazano, że niski status był niezależnym czynnikiem ryzyka zarówno śmiertelności przed-, wewnątrz-, jak i poszpitalnej u chorych z zawałem serca.
Mechanizm, w jakim czynniki psychosocjalne wpływają na rozwój i rokowanie w CVD, jest złożony i nie do końca poznany. Wykazano w wielu pracach eksperymentalnych, że stres powoduje przyspieszenie miażdżycy i dysfunkcji śródbłonka. Przedstawiono także dowody na to, że istnieje związek pomiędzy uwarunkowaniami psychospołecznymi a kurczliwością naczyń, procesem zapalnym, zaburzeniami krzepliwości krwi i upośledzoną fibrynolizą. Z kolei zależność między lękiem lub gwałtownym stresem a nagłym zgonem sercowym ma w dużej mierze związek z nagłymi zmianami napięcia układu autonomicznego prowadzącymi do ciężkich arytmii komorowych.
Podstawowym elementem współczesnej prewencji wtórnej a zatem i elementem współczesnej kompleksowej rehabilitacji kardiologicznej są oddziaływania psychospołeczne. Skierowane powinny być zarówno na zmianę zachowań (tzw. oddziaływania behawioralne) prowadzące do powszechniejszego i pełniejszego redukowania czynników ryzyka CVD, jak i na oddziaływania czysto psychosocjalne. Proponowane przez US Preventive Services Task Force (67) działania przedstawia rycina 25.
 Ryc. 25. US Preventive Services Task Force (67). Metody zwiększające skuteczność oddziaływania na zmiany stylu życia.
Jednym z dowodów korzystnego wpływu kompleksowych programów rehabilitacyjnych opartych o edukację i oddziaływania psychologiczne jest metaanaliza Lindena i wsp. (68), w której wykazano, że takie programy prowadziły do:
– 37% spadku śmiertelności z przyczyn kardiologicznych
– 29% spadku częstości ponownych zawałów serca
– korzystnego wpływu na:
– ciśnienie tętnicze
– stężenie cholesterolu
– masę ciała
– palenie tytoniu
– aktywność fizyczną
– zwyczaje żywieniowe
Podobnie korzystny wpływ oddziaływań psychologicznych i edukacyjnych na redukcję śmiertelności, oraz modyfikację czynników ryzyka wykazali także Dusseldorp i wsp. (69) oraz Rees i wsp. (70).
Istnieją także nieliczne dane co do efektów leczenia farmakologicznego depresji u ludzi z CVD. Spośród leków antydepresyjnych szerzej zbadane są jedynie selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI – selective serotonin reuptake inhibitors). Inne grupy leków antydepresyjnych, w tym zwłaszcza trój- i cztero-pierścieniowe, ze względu na swoją kardiotoksyczność nie weszły do szerszego użycia u chorych kardiologicznych.
SSRI okazują się lekami bezpiecznymi, zmniejszającymi objawy depresji, ale bez udowodnionego istotnego wpływu na rokowanie u chorych z CHD. W badaniu SADHART (Sertraline Antidepressant Heart Attack Randomised Trial) (71), w którym oceniano wpływ sertraliny, jednego z przedstawicieli SSRI, u chorych z depresją po zawale serca, nie wykazano wpływu takiego leczenia na rokowanie a jedynie na zmniejszenie objawów depresji. Podobne wyniki uzyskano także w badaniu ENRICHD (Enhancing Recovery in Coronary Heart Disease) (72). I w tym badaniu SSRI (sertralina) nie miała wpływu na rokowanie po zawale serca w dużej liczącej ponad 2 tysiące grupie chorych. Nie ma zatem dowodów na szersze stosowanie leczenia antydepresyjnego u chorych po zawale serca. Doceniając jednak wagę postępowania u chorych z depresją towarzyszącą CHD oraz uwzględniając dotychczasowe nieliczne dowody na jego skuteczność, wytyczne amerykańskie z 2006 roku (7) umieszczają leczenie antydepresyjne w klasie IIa-A.
W chwili obecnej w prewencji wtórnej schorzeń sercowo-naczyniowych główny nacisk należy położyć na oddziaływania psychospołeczne i behawioralne, a leczenie farmakologiczne stosować wyłącznie u chorych z objawami depresji.
Prewencja wtórna CVD – leczenie farmakologiczne
Beta-blokery
Metaanalizy publikowane na przestrzeni ostatniej dekady wskazują jednoznacznie, że beta-blokery stosowane u chorych po zawale serca, zmniejszają ryzyko zgonu z powodów sercowych i śmiertelność całkowitą. Freemantle i wsp. (73) wykazali w grupie ponad 50 000 chorych po zawale serca, że śmiertelność ogólna po 3 latach stosowania beta-blokerów zmniejszyła się o 20%. W metaanalizie Gottlieba i wsp. (74) w grupie ponad 200 000 chorych po zawale serca, wykazano skuteczność 2-letniego podawania beta-blokerów w zmniejszaniu śmiertelności całkowitej sięgającą 40%. Antman i wsp. (75) powołują się na wyniki metaanalizy zastosowania beta-blokerów w różnych fazach zawału serca (ryc. 26).
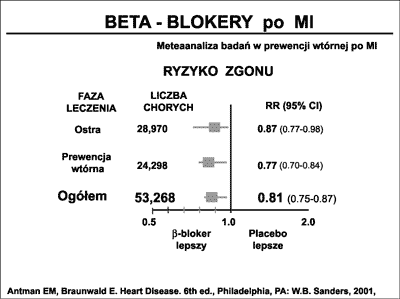 Ryc. 26. Beta-blokery po zawale serca (MI) i ich wpływ na ryzyko zgonu. Meta-analiza Antmana i wsp. (75).
Jak widać, podanie beta-blokerów ma największy wpływ na rokowanie w późniejszej fazie choroby (redukcja śmiertelności 23%) a nieco mniejsze w ostrej fazie (redukcja 13%). Jak obecnie wiadomo, istnieją także przekonywujące dane wskazujące na korzystne działanie beta-blokerów podawanych chorym z upośledzoną funkcją lewej komory serca. Podawanie takich beta-blokerów jak bisoprolol, metoprolol, nebivolol lub oddziałującego także na alfa receptory carvedilolu, znalazło powszechne zastosowanie w prewencji chorych z pozawałową objawową i utajoną niewydolnością serca. (76, 77, 78, 79).
W wytycznych ACC/AHA stosowanie beta-blokerów u chorych po zawale serca, posiada klasę I-A, a dla pozostałych chorych z CHD i miażdżycą obwodową klasę IIa-C. Zalecenia przedstawia rycina 27.
 Ryc. 27. Zalecenia ACC/AHA (7) dotyczące stosowania beta-blokerów w prewencji wtórnej CHD.
Leki przeciwpłytkowe
Podawanie kwasu acetylosalicylowego (ASA) prowadzi do znaczącej redukcji śmiertelności całkowitej, śmiertelności z powodów naczyniowych, zawałów serca nie zakończonych zgonem oraz udarów mózgu (80). Z metaanalizy Antithrombotic Trialist´ Collaboration wynika, że ASA redukuje ryzyko zdarzeń naczyniowych o 23% w ciągu roku. Leczenie takie z podaniem wstępnej dawki 300 mg i kontynuowanie w dawce 75 mg, zalecane jest we wszystkich rodzajach ostrych zespołów wieńcowych, zarówno w zawałach serca z uniesieniem ST (STEMI), jak i bez uniesienia ST (NSTEMI), a także w niestabilnej chorobie wieńcowej (UA). Zalecane jest także jako wtórna profilaktyka u wszystkich chorych z chorobą niedokrwienną serca (CHD), a także u osób po udarach niedokrwiennych oraz przemijających niedokrwieniach OUN (TIA). Korzyści z przewlekłego podawania ASA odnoszą także pacjenci po zabiegach rewaskularyzacyjnych oraz chorzy z miażdżycą naczyń obwodowych. Leczenie ASA jest bezpieczne. Uważa się, że powikłania w postaci znaczącego krwotoku, stosując dawkę 75 mg/d występują z częstością 1-2 przypadków na 1000 leczonych. Rosną w populacji w starszym wieku w której częstość krwawień ocenia się na 7 na każde 1000 leczonych. W wytycznych ACC/AHA dotyczących stosowania ASA umieszczono to leczenie w klasie I-A. Zalecenia przedstawia rycina 28.
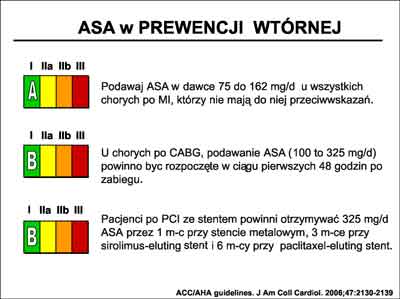 Ryc. 28. Zalecenia ACC/AHA (7) dotyczące stosowania w ramach prewencji wtórnej, kwasu acetylosalicylowego (ASA).
Przy przeciwwskazaniach do ASA w wytycznych zaleca się podanie blokera ADP-zależnego receptora płytkowego klopidogrelu. Podawanie klopidogrelu wraz z ASA w ostrych zespołach wieńcowych znajduje obecnie powszechne zastosowanie. W badaniach CURE (81), CREDO (82), CLARITY (83) i COMMET (84) udowodniono korzyści ze stosowania klopidogrelu, zarówno w niestabilnej chorobie wieńcowej, jak i zawałach serca NSTEMI i STEMI. Wytyczne ESC zalecają stosowanie klopidogrelu we wstępnej dawce 300-600 mg i kontynuowanie go w dawce 75 mg/dzień. Czas terapii uzależniony jest od typu zawału serca, stosowanego leczenia rewaskularyzacyjnego oraz rodzaju wszczepianego stentu i waha się od 1 do12 miesięcy. Wytyczne ESC dotyczące stosowania klopidogrelu przedstawia rycina 29.
 Ryc. 29. Wytyczne ESC (11) dotyczące stosowania klopidogrelu.
Blokery enzymu konwertującego oraz blokery receptora angiotensyny II
Istnieją przekonywujące dowody na to, że blokery enzymu konwertującego angiotensynę (ACE-I) stosowane u chorych z niewydolnością serca lub chorych z dysfunkcją lewej komory serca, zmniejszają znacząco ryzyko zgonu, ponownego zawału serca a także spowalniają progresję niewydolności serca. Po badaniach lat 90-tych ubiegłego wieku, takich jak SAVE (85), AIRE (86) i TRACE (87) wiadomo, że ACE-I u chorych po zawale serca z obniżoną frakcją wyrzutową lewej komory serca, redukują ryzyko zgonu o 19-27%. Z badania HOPE (88) wynika natomiast, że szczególne korzyści z leczenia ACE-I odnoszą chorzy z cukrzycą i podwyższonym ryzykiem miażdżycy.
Bezwzględnym przeciwwskazaniem do stosowania ACE-I są: obustronne zwężenie tętnic nerkowych oraz objawy obrzęku naczynioruchowego ujawnionego przy wcześniejszych próbach podania leku. Szczególnej ostrożności wymaga podawanie ACE-I u pacjentów z tendencją do hipotonii, z niewydolnością nerek, skłonnością do hiperkaliemii oraz u ludzi starszych.
Rozpoczynając leczenie ACE-I zaleca się stosowanie niskich dawek, a następnie pod kontrolą ciśnienia tętniczego, parametrów nerkowych i elektrolitowych dochodzenie do jak najwyższych dawek podtrzymujących. Najskuteczniejsze dawki do jakich należy dążyć to (89):
– enalapril do 20 mg 2 x dziennie
– kaptopril do 50 mg 3 x dziennie
– ramipril do 10 mg 1 x dziennie (5 mg 2 x dziennie)
– trandolapril do 4 mg 1 x dziennie
– chinapril do 20 mg 1 x dziennie
W wytycznych ACC/AHA zalecenia co do stosowania ACE-I znalazły się w klasie I-A. Zalecenia te przedstawia rycina 30.
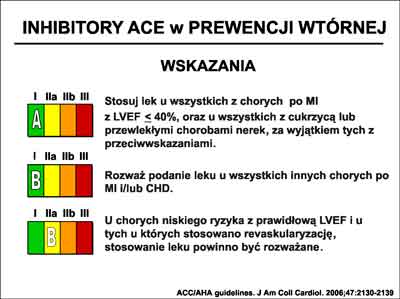 Ryc. 30. Zalecenia ACC/AHA (7), dotyczące stosowania, w prewencji wtórnej, inhibitorów enzymu konwertującego angiotensynę (ACE-I).
ACE-I hamując rozpad bradykininy mogą prowadzić do jej kumulacji i wystąpienia charakterystycznych dla tej grupy leków objawów niepożądanych, takich jak kaszel, objawy skórne i obrzęk naczynioruchowy. Takich działań ubocznych nie wykazują blokery receptora angiotensyny II (ARB).
W badaniach porównujących skuteczność ARB z placebo jak i z ACE-I, wykazano korzystny wpływ tych leków na zmniejszenie ryzyka zgonu, postępu niewydolności serca oraz częstości hospitalizacji. Metaanalizy Jonga i wsp. (90) oraz Coletta i wsp. (91) wykazały podobną skuteczność ACE-I oraz ARB pod względem wpływu na śmiertelność i chorobowość. Również badania dotyczące zastosowania ARB u chorych z pozawałową dysfunkcją lewej komory serca wykazały podobną skuteczność obu grup leków.
W badaniu VALIANT (Valsartan in Acute Myocardial Infarction Trial) (92), w grupie ponad 14 000 chorych z pozawałową niewydolnością serca lub/i dysfunkcją lewej komory serca, wykazano równowartość walsartanu i kaptoprilu podawanych zarówno osobno jak i w połączeniu w redukcji śmiertelności całkowitej. Nierozstrzygnięta jednak pozostaje kwestia korzyści wynikających z łącznego podawania ACE-I oraz ARB. Kilka mniejszych badań wykazało pozytywne znaczenie takiego połączenia w zaawansowanych postaciach skurczowej niewydolności serca. Opublikowane jednak ostatnio wyniki badania ONTARGET (93) nie tylko nie wykazały dodatkowych korzyści ze wspólnego stosowania telmisartanu i ramiprilu, ale ujawniły zwiększoną częstość objawów niepożądanych.
Blokowanie angiotensyny II przez ARB może prowadzić do analogicznych działań niepożądanych jak w przypadku ACE-I. Stąd zalecenia co do dawkowania oraz monitorowania ewentualnych objawów ubocznych są takie same dla obu grup leków.
Aktualne zalecenia ACC/AHA co do stosowania ARB w prewencji wtórnej przedstawia rycina 31. Wynika z nich, że podobnie jak w przypadku ACE-I, zastosowanie ARB u chorych po zawale serca znalazło miejsce w klasie I-A.
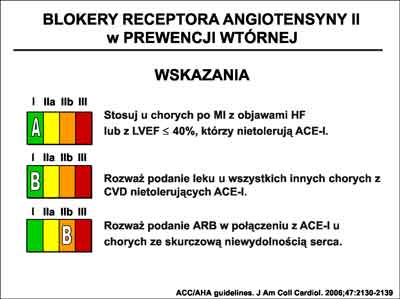 Ryc. 31. Zalecenia ACC/AHA (7) dotyczące zastosowania, w prewencji wtórnej, blokerów receptora dla angiotensyny II (ARB).
Statyny
Istnieje wiele dowodów na bezpośredni związek pomiędzy obniżaniem poziomu cholesterolu a redukcją zachorowalności na CVD (42). Każdemu obniżeniu poziomu cholesterolu całkowitego i LDL-cholesterolu towarzyszy redukcja ryzyka wystąpienia CVD. Po badaniach lat 90-tych ubiegłego wieku, w których stosowano we wtórnej profilaktyce CHD statyny wiadomo, że z obniżeniu poziomu cholesterolu towarzyszy także spadek śmiertelności i liczby ponownych zdarzeń CVD. Badania 4-S (94), CARE (95), LIPID (96) wykazały 20-40% redukcję zdarzeń sercowo-naczyniowych u chorych z hiper- i normocholesterolemią.
W badaniu HPS (97) w grupie pond 20 000 chorych z CHD i chorych wysokiego ryzyka bez CHD wykazano, pod wpływem podawanej simwastatyny, 24% redukcję zdarzeń sercowo-naczyniowych. Obniżenie ryzyka zdarzeń było niezależne od wyjściowego poziomu LDL. Zależność pomiędzy stopniem obniżenia poziomu LDL a częstością zdarzeń CVD w głównych badaniach statynowych przedstawia rycina 32.
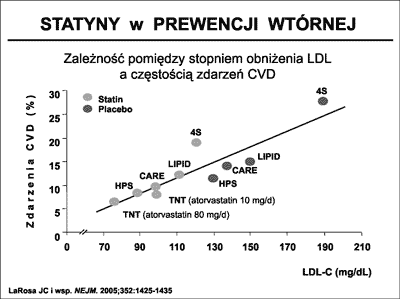 Ryc. 32. Wpływ stopnia obniżenia poziomu LDL na częstość zdarzeń sercowo-naczyniowych (CVD) w wybranych badaniach nad zastosowaniem statyn w prewencji wtórnej (97). 4S – The Scandinavian Simvastatin Survical Study, CARE – Cholesterol and Recurrent Events, LIPID – Long-Term Intervention with Pravastatin in Ischemic Disease, HPS – Heart Protection Study, TNT – Treating to New Targets.
Ostatnie lata przyniosły szereg danych wskazujących na wyższą skuteczność podawania zwiększonych dawek statyn i osiągania jako celu terapeutycznego znacznie obniżonych wartości LDL-cholesterolu. W badaniu TNT (98) w grupie ponad 10 000 chorych dawka 80 mg/d atorwaststyny w porównaniu z dawką 10 mg/d okazała się w ciągu 6 lat o 22% skuteczniejsza w zapobieganiu zdarzeniom CVD. Także w badaniu PROVE-IT TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy) (99) w grupie ponad 4000 chorych z ostrym zespołem wieńcowym wykazano wyższość intensywniejszego leczenia statynami. Okazało się, że leczenie atorwastatyną w dawce 80 mg/d w porównaniu z prawastatyna podawaną w dawce 40 mg/d na przestrzeni 2,5 roku zmniejszało ryzyko zgonu i zdarzeń CVD o 16%. Badanie PROVE-IT przyniosło także potwierdzenie plejotropowego oddziaływania statyn. Wykazano bowiem, że największe korzyści z podawania wysokich dawek statyn odnosili chorzy, u których leczenie doprowadzało nie tylko do znacznego (<70mg%) obniżenia LDL, ale także istotnego (<2 mg/L) obniżenia poziomu białka C-reaktywnego (CRP) (ryc. 33).
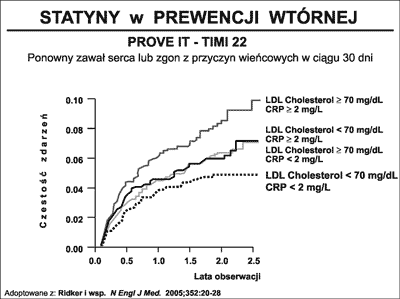 Ryc. 33. PROVE IT -TIMI 22 (98). Wpływ stopnia obniżenia poziomu LDL oraz CRP na 30-dniową śmiertelność z powodów wieńcowych i ponowne zawały serca u chorych z ostrym zespołem wieńcowym leczonych różnymi dawkami statyn.
Poza wielkością dawki statyn istotny zdaje się być także czas rozpoczęcia leczenia, zwłaszcza ważny u chorych z ostrymi zdarzeniami naczyniowymi, takimi jak ostry zespół wieńcowy lub udar mózgu. Pytanie czy statyna może ujawniać swoje korzystne efekty już w ostrej fazie choroby czy też rozwija swoje działanie na przestrzeni miesięcy nadal czeka na ostateczne wyjaśnienie. Z plejotropowymi właściwościami statyn część badaczy wiąże fakt wykazywanego eksperymentalnie i potwierdzonego klinicznie, szybkiego efektu ich działania. Saab i wsp. (100) w analizie retrospektywnej wykazali, że statyna podana w pierwszej dobie zawału serca, w porównaniu z podaniem jej po 24 h, w znamiennym stopniu (p<0,02) zmniejszała liczbę wewnątrzszpitalnych zgonów i zdarzeń naczyniowych. Także autorzy Euro Heart Survey (101) w grupie ponad 10 000 chorych z zawałem serca z uniesieniem ST (STEMI) wykazali znaczącą redukcję 7-dniowej śmiertelności całkowitej (0,4 % vs 2,6%) pomiędzy chorymi, którzy otrzymali statynę do 24 h, w porównaniu z tymi, którzy otrzymali ją po 24 h. Innego zdania są z kolei Bawry i wsp. (102). W przeglądzie prac randomizowanych dowodzą, że statyny podawane w ostrych zespołach wieńcowych rozwijają swoje działania powoli a korzystne efekty kliniczne ujawniają się dopiero po co najmniej 24 miesiącach leczenia. Sprawa zostaje zatem otwarta, prawdopodobnie do czasu opracowania sposobu bezpiecznego parenteralnego podania statyn.
Według standardów ACC/AHA leczenie statyną rozpoczynać należy jak najwcześniej, pamiętając jednak o tym, że cele terapeutyczne powinny zostać określone na podstawie oznaczenia frakcji lipidów w pierwszych 24 godzinach od początku objawów (patrz podrozdział Korekta profilu lipidowego). W przypadku zaawansowanych złożonych hiperlipidemii, lub niemożności osiągnięcia celów terapeutycznych odpowiednio wysokimi dawkami statyn, celowe może być uzupełnienie leczenia o inne leki hipolipemiczne (fibraty, kwas nikotynowy, żywice jonowymienne, lub ezetymib). Główne wytyczne dotyczące wdrożenia leczenia hipolipemicznego zawiera (ryc. 34).
 Ryc. 34. Wytyczne ACC/AHA (7) dotyczące stosowania farmakologicznego leczenia hipolipemicznego u chorych z ostrym zespołem wieńcowym (ACS).
Wytyczne ACC/AHA odnoszą się także do leczenia hipolipemicznego w bardziej zaawansowanych zaburzeń lipidowych. U chorych z ostrym zespołem wieńcowym zalecają następujące postępowanie:
– Jeśli triglicerydy 200-499 mg% to non-HDL <130 mg% (I – B)
– Dalsza redukcja non-HDL <100 mg% powinna być rozważona (IIa – B)
– Sposobem na obniżanie non-HDL powinno być zastosowanie:
– zwiększonej dawki leków obniżających LDL (I – B)
– przy braku skuteczności dołączenie niacyny (IIa – B)
– przy braku skuteczności dołączenie fibratów (IIa – B)
– Jeśli triglicerydy ≥ 500 mg% podawać fibrat lub niacynę przed terapią statyną, Po obniżeniu triglicerydów osiągać cel dla LDL (I – C)
Omega-3 wielonienasycone kwasy tłuszczowe
Wyniki prezentowanego wcześniej badania GISSI Prevenzione (40) jak i innych kilku mniejszych badań przekonały o korzyściach wynikających z podawania estrów etylowych kwasów wielonienasyconych. Znalazło to odzwierciedlenie już w wytycznych ESC z 2003 roku (4). Obok stosowania diety śródziemnomorskiej, podawanie dziennie 1g oleju rybnego znalazło się w klasie I wskazań przy poziomie wiarygodności B.
Antagoniści aldosteronu
Do niedawna leki z grupy antagonistów aldosteronu znajdowały zastosowanie wyłącznie u chorych z najbardziej zaawansowaną (NYHA III i IV) niewydolnością serca. Uzasadniały to wyniki badania RALES (103), w którym u chorych z tak zaawansowaną niewydolnością serca podanie spironolaktonu spowodowało 30% redukcję śmiertelności. W badaniu tym zdecydowana większość chorych (95%) otrzymywała równocześnie ACE-I, a tylko nieliczni (11%) beta-blokery. Obecnie wskazania do stosowania antagonistów aldosteronu rozszerzone zostały na chorych z pozawałową dysfunkcją lewej komory serca. Stało się tak po badaniu EPHESUS (104), w którym wykazano, że u chorych z pozawałową skurczową niewydolnością serca (LVEF <40%), leczonych wyjściowo ACE-I lub ARB, beta-blokerami i diuretykami dodanie selektywnego antagonisty aldosteronu (eplerenonu) powodowało 15% redukcję zgonów z jakiejkolwiek przyczyny i aż 21% redukcję nagłych zgonów.
Leczenie antagonistami aldosteronu wymaga monitorowania funkcji nerek oraz kaliemii i jest przeciwwskazane przy poziomie kreatyniny> 2,5 mg% oraz poziomie potasu w surowicy> 5 mmol/l.
Po badaniu EPHESUS w wytycznych ACC/AHA umieszczono podawanie antagonistów aldosteronu w klasie I-A (ryc. 35).
 Ryc. 35. Wytyczne ACC/AHA (7). Zalecenia co do stosowania w prewencji wtórnej antagonistów aldosteronu.
Leczenie przeciwkrzepliwe
Badania nad zastosowaniem leczenia przeciwkrzepliwego (OAC) u chorych z CHD mają swoją blisko 50-letnią historię. Wyniki wczesnych badań wyglądały zachęcająco. Metaanaliza International Anticoagulation Review Group (105) badań z lat 60-ych i 70-ych ubiegłego wieku wskazywała na to, że u chorych po zawale serca podanie OAC zmniejszało zarówno śmiertelność z przyczyn wieńcowych, jak i występowanie ponownych MI. Wyniki badań z kolejnych lat, porównujące OAC vs placebo, były jednak sprzeczne. W badaniu WARIS (106) wykazywano redukcję nie tylko śmiertelności całkowitej lecz także częstości ponownych zawałów oraz udarów mózgu. Ale w badaniu ASPECT (107) nie wykazano wpływu OAC na śmiertelność, a w badaniu CHAMP (108), w którym porównywano niskie dawki OAC i aspiryny podanych razem względem samej aspiryny nie wykazano jakiegokolwiek wpływu na zdarzenia sercowo-naczyniowe. W ostatnich latach skuteczność OAC u chorych po zawale serca oceniana była w kontekście rutynowo stosowanej aspiryny. Wyniki tych badań też nie są jednoznaczne. W badaniu WARIS-II (109) wykazano zmniejszenie liczbę zdarzeń sercowo-naczyniowych u leczonych zmniejszoną dawką OAC (śr. INR 2.0) oraz niską (75 mg) dawką aspiryny względem pełnej dawki OAC (śr. INR 2.8) oraz względem samej aspiryny podanej w dawce 160 mg. Z badania tego jednak wynikało także, że podawanie OAC wiązało się z istotnie zwiększonym ryzykiem krwawień. W badaniu LoWASA (110) nie wykazano różnicy pomiędzy leczeniem niską dawką OAC wraz z aspiryną a samą aspiryną w redukcji zdarzeń sercowo-naczyniowych. I w tym badaniu podanie OAC łączyło się ze zwiększoną liczbą powikłań krwotocznych. Ostatnio Johanson i wsp. (111) w dużej retrospektywnej analizie wykazali, że niebezpieczeństwa ze wspólnego podawania OAC i ASA przeważają nad korzyściami. Łączenie tych leków powinno więc być niezwykle ostrożne i stosowane tylko w grupach wyraźnie podwyższonego ryzyka powikłań zatorowych.
Wyniki badań ostatnich lat pozwalają zatem na stosowanie OAC samego lub w połączeniu z ASA nie u wszystkich chorych po MI, a wyłącznie u tych ze zwiększonym ryzykiem zatorów tętniczych. W ramach prewencji wtórnej zaleca się stosowanie leczenia przeciwkrzepliwego (OAC) gdy:
– Wywiad przebytych epizodów zatorowych
– Obecność skrzepliny w lewej komorze lub lewym przedsionku
– Napadowe lub przewlekłe migotanie przedsionków
– Obecność obwodowej zakrzepicy żylnej
– Zatorowość obwodowa
– Przeciwwskazania do ASA
Rozważyć należy podanie leku przeciwkrzepliwego, gdy stwierdzamy:
– rozległy zawał serca ściany przedniej
– tętniak lewej komory
– pozawałową niewydolność serca
Wytyczne ACC/AHA dotyczące stosowania leków przeciwkrzepliwych u chorych po zawale serca zawiera rycina 36.
 Ryc. 36. Wytyczne ACC/AHA (7). Zalecenia co do stosowania doustnego leczenia przeciwkrzepliwego w prewencji wtórnej po zawale serca.
Szczepienie przeciwko grypie
Udział infekcji, w tym wirusowych, w patogenezie schorzeń sercowo-naczyniowych jest od lat intensywnie badany. Obserwowany związek między częstszym występowaniem zawałów serca i udarów mózgu w okresie np. sezonowego nasilenia infekcji górnych dróg oddechowych pozwalał przypuszczać że reakcje immunologiczne mogą mieć swój udział w dysfunkcji śróbłonka, przebudowie naczyń czy tworzeniu i pęknięciu blaszki miażdzycowej. Badania epidemiologiczne i obserwacyjne ostatnich lat wskazywały równocześnie, że profilaktyczne szczepienia przeciwko grypie wiążą się z redukcją częstości zgonów oraz zapadalności na zawał serca (7, 112, 113, 114). Ciekawym potwierdzeniem korzystnego oddziaływania profilaktycznego szczepienia przeciwko grypie na schorzenia sercowo-naczyniowe jest prospektywne badanie Ciszewskiego i wsp. (115) z Instytutu Kardiologii w Warszawie. W badanej grupie chorych ze stabilną chorobą wieńcową szczepienie przeciwko grypie co prawda nie miało wpływu na śmiertelność z przyczyn sercowo-naczyniowych, ale wpływało na drugorzędowy punkt końcowy badania jakim było występowanie MACE (zgon z przyczyn sercowo-naczyniowych, zawał serca, konieczność rewaskularyzacji wieńcowej) lub konieczność hospitalizacji z powodów wieńcowych.
Korzystne wyniki, na razie nielicznych badań nad szczepionką, a także dowody na groźne powikłania do jakich prowadzić może grypa w wybranych grupach chorych, w tym chorych z CVD, skłoniły ekspertów ACC/AHA do umieszczenia szczepienia w klasie I-B najnowszych zaleceń prewencji wtórnej (ryc. 37).
 Ryc. 37. Wytyczne ACC/AHA (7). Zalecenia co do stosowania profilaktycznego szczepienia przeciw grypie u chorych z chorobami sercowo-naczyniowymi.
Podsumowanie
Najważniejszym postępowaniem profilaktycznym u chorych z udokumentowanymi schorzeniami sercowo-naczyniowymi jest modyfikacja stylu życia oraz zastosowanie zalecanych przez standardy preparatów farmakologicznych. Wyrazem tego są zamieszczone poniżej w skrócie zalecenia Europejskiego Towarzystwa Kardiologicznego (ESC) (4) z 2003 roku oraz Amerykańskich Towarzystw Kardiologicznych (ACC/AHA) (7) z roku 2006 dotyczące prewencji wtórnej CVD:
Z A L E C E N I A KLASA WSKAZAŃ –
POZIOM WIARYGODNOŚCI
– zaprzestanie palenia I – B
– leczenie nadciśnienia tętniczego I – A
– leczenie hiperlipidemii I – A
– stosowanie treningu fizycznego I – B
– leczenie otyłości I – B
– stosowanie diety śródziemnomorskiej I – B
– leczenie cukrzycy I – B
– stosowanie beta-blokerów I – A
– podawanie kwasu acetylosalicylowego I – A
– stosowanie klopidogrelu I – B
– podawanie statyn I – A
– podawanie estrów etylowych kwasów tłuszczowych wielonienasyconych (1g/dobę) I – B ??????
?????? stosowanie leczenia przeciwkrzepliwego, gdy współistnieje: I – A
– migotanie/trzepotanie przedsionków
– skrzeplina w świetle lewej komory
– zakrzepica obwodowa
– inne
– stosowanie inhibitorów enzymu konwertującego (ACE-I), gdy: I – A
– EF ≤ 40%
– współistnieje nadciśnienie tętnicze, cukrzyca, przewlekła niewydolność nerek
– stosowanie blokerów receptora angiotensyny (ARB), gdy: I – A
– istnieje nietolerancja ACE-I, a współistnieje EF ≤ 40% lub HF
– stosowanie antagonistów aldosteronu u osób: I – A
– bez choroby nerek
– hyperkaliemii
– już leczonych ACE-I, BB, diuretykiem
– gdy EF <40%
– zwłaszcza z cukrzycą
– profilaktyczne szczepienie przeciw grypie I – B
– modyfikacja stanu psycho-socjalnego I – C
– leczenie depresji II a – A Piśmiennictwo
1. Peterson S et al.: European Cardiovascular Disease Statistics. 2nd ed. British Heart Foundation, London 2005.
2. WHO Regional Publications. The European Health Report 2002. Copenhagen: WHO Europe. European Series.
3. Anderson KM et al.:An updated coronary risk profile. A statement for health professionals. Circulation 1991;83:356-362.
4. Conroy R et al.: Prediction of ten-year risk of fatal cardiovascular disaese in Europe: the SCORE project. Eur Heart J 2003;24:987-1003.
5. EUROASPIRE I and II Group. Clinical reality of coronary prevention guidelines: a comparison of EUROASPIRE I and II in nine countries. European Action on Secondary Prevention by Intervention to Reduce Events. Lancet 2001;357:995-1001.
6. Yusuf S et al.: Effects of potentially modifiable risk factors associated with myocardial infartion in 52 countries (the INTERHEART study): case-controlled study. Lancet 2004;354:937-952.
7. Smith SC et al.: AHA/ACC Guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease: 2006 update: endorsed by the National Heart, Lung, and Blood Institute. J Am Coll Cardiol. 2006;47:2130-2139.
8. Balady GJ et al.: Core components of cardiac rehabilitation/secondary prevention programs: 2007 update: a scientific statement from American Heart Association Exercise, Cardiac Rehabilitation, and Prevention Committee, the Council on Clinical Cardiology: the Council on Cardivascular Nursing, Epidemiology and Prevention, and Nutrition, Physical Activity, and Metabolism; and the American Association of Cardiovascular and Pulmonary Rehabilitation. Circulation 2007;115:2675-2682.
9. Thomas RJ et al.: AACVPR/ACC/AHA 2007 performance measures on cardiac rehabilitation for referral to and delivery of cardiac rehabilitation / secodary prevention services. J Am Coll Cardiol. 2007;50:1400-1433.
10. Working Group on Cardiac Rehabilitation and Exercise Physiology of the European Society of Cardiology. Position paper of the Working Group on Cardiac Rehabilitation and Exercise Physiology of the European Society of Cardiology: secondary prevention through cardiac rehabilitation. Eur Heart J 2003;24:1272-1278.
11. Graham I et al.: European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Fourth Joint Task Force of the European Society of Cardiology and Other Societes on Cardioascular Disease Prevention in Clinical Practice. Eur Heart J. 2007;28:2375-2414.
12. Graham I et al.: European giudelines on cardiovascular disease prevention in clinical practice: executive summary. Fourt Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur J Cardiovasc Prev Rehabil. 2007;14 (suppl.2):E1-E40.
13. Europejskie wytyczne dotyczace prewencji chorób sercowo-naczyniowych w praktyce klinicznej. Kardiol Pol 2008;66:supl 1.
14. Gielan S et al.: Rehabilitacja kardiologiczna [w:] Choroby serca i naczyń. Podręcznik Europejskiego Towarzystwa Kardiologicznego. Tom II. Camm AJ, Luschner TF, Serruys PW. (red), Blackwell Publishing Ltd, Oxford. Wydanie Polskie: Termedia 2006.
15. Ezzati M, Lopez AD: Estimates of global mortality attributable to smoking in 2000. Lancet 2003;362:847-856.
16. Kannel WB, McGee DL, Castelli WP: Latest perspectives on cigarette smoking and cardiovascular disease: the Framingham Study. J Card Rehabil. 1984;4: 267-277.
17. Keil U et al.: Clasical risk factors and their impact on incident non-fatal and fatal myocardial infarction and all-cause mortality in southern Germany. Result from MONICA Augsburg cohort study 1984-1992. Eur Heart J. 1998;19:1197-1207.
18. Law MR, Morris JK, Wald NJ: Environmental tabaco smoke exposure and ischemic heart disease: an evaluation of the evidence. BMJ.1997;315:973-980.
19. Wilhelmson C et al.: Smoking and myocardial infarction. Lancet 1975;1:415-420.
20. Critchley JA, Capewell S: Mortality risk reduction associated with smoking cessation in patients with coronary artery disease: a systemic review. JAMA 2003;290:86-97.
21. Haustein KO: What can we do in secondary prevention of cigarette smoking? Eur J Cardiovasc Prev Rehabil 2003;10:476-485.
22. Silagy C et al.: Mta-analysis on efficacy of nicotine replacement therapies in smoking cessation. Lancet 1994;343:139-142.
23. WHO Publications. The World Health Report, 2002. Geneva: WHO
24. Perk J, Rosengren A, Dallongville J: Prewencja chorób sercowo- -naczyniowych: wykrywanie i modyfikacja czynników ryzyka [w:] Choroby serca i naczyń. Podręcznik Europejskiego Towarzystwa Kardiologicznego. Tom I. Camm AJ, Luschner TF, Serruys PW. (red), Blackwell Publishing Ltd, Oxford 2006. Wydanie Polskie: Termedia 2006.
25. Lewington S et al.: Prospective Study Collabotration. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of indvidual data for one milion adults in 61 prospective studies. Lancet 2002;360:1903-1913.
26. Beilin LJ et al.: Non pharmacologic therapy and lifestyle factors in hyperension. Blood Press 2001;10:352-365.
27. Beilin LJ: Update on lifestyle and hypertension control. Clin Exp Hypertens 2004;26:739-746.
28. MacMahon S, Rodgers A: The effects of antihypertensive treatment on vascular disease: Reappraisal of the evidence in 1994. J Vasc Med Biol 1993;4:265-271.
29. James PT, Rigby N, Leach R: The obesity epidemic, metabolic syndrome and future prevention strategies. Eur J Cardiovasc Prev Rehab 2004;11:3-8.
30. Wieloośrodkowe Ogólnopolskie Badanie Stanu Zdrowia WOBASZ. Kardiol Pol 2005;63,6 (supl.4).
31. Integrating prevention and management of overweight and obesity. SIGN pub (8), 1996. www.sign.ac.uk
32. Jousilahti P et al.: Body weight, cardiovascular risk factors, and coronary mortality. Circulation 1996;93:1372-1379.
33. Mhurchu N et al.: Int J Epidemiol 2004;33:751-758.
34. Alberti K, Zimmet P, Shaw J: IDF Epidemiology Task Force Consensus Group. The metabolic syndrome – a new worldwide definition. Lancet 2005; 366:1059-1062.
35. Grundy SM et al.: Definitions of metabolic syndrome: report of the National Heart, Lung, and Blood Institute/American Heart Association conference on scientific issues related to definition. Circulation 2004;109:433-488.
36. Martinez-Gonzales M et al.: Physical inactivity, sedentary lifestyle and obesity in the European Union. Int J Obes Relat Metab Disord. 1999;23:1192-1201.
37. Rejski W et al.: Older adults with chronic disease: benefits of group-mediated counseling in the promotion of physically active lifestyles. Health Physiol. 2003;22:414-423.
38. Carlson G et al.: Self-efficacy, psychological factors, and exrecise behavior in traditional versus modified cardiac rehabilitation. J Cardiopulm Rehab 2001;21:363-373.
39. De Lorgeril M et al.: Mediterranean diet, traditional risk factors, and the rate of cardiovascular complication after myocardialinfarction: final report of the Lyon Diet Heart Study. Circulation 1999;99:779-785.
40. Marchioni R et al.: Early protection against sudden death by omega-3 polyunsaturated fatty acids after myocardial infarction. Time course analysis of the resultes of the (GISSI)-Prevenzione. Circulation 2002;105:1897-1903.
41. Rimm EB et al.: Review of moderate alkohol consumption and reduced risk of coronary artery disease: is the effect due to beer, wine or spirits. Br Med. J. 1996;312:731-736.
42. Sharrett AR et al.: Coronary heart disease prediction from lipoprotein cholesterollevels, triglycerides, lipoprotein(a), appolipoproteins A nad B, and HDL density subfractions: The Atherosclerosis Risk in communities (ARIC) Study. Circulation 2001;104:1108-1113.
43. Baigent C et al.: Cholesterol Treatment Trialists (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randimised trials of statins. Lancet 2005;366:1267-1278.
44. Hokanson JE: Plasma triglyceride level is a risk factor for cardivscular disease independent of HDL cholesterol level: a meta-analysis pf population-based prospective study. J Cardiovasc Risk 1996;3:213-219.
45. Rosenson RS: Myocardial injury: the acute phase response and lipoprotein metabolism. J Am Coll Cardiol 1993;22:933-940.
46. Nissen S et al.: Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006;295:1556-1565.
47. Takaishi H et al.: Impact of increasing diabetes on coronary artery disease in the past decade. J Atheroscler Thtomb 2004;11:271-277.
48. Zeller M et al.: The RICO survey working group. Impaird fasting glucose and cardiogenic shock in patients with acute myocardial infarction. Eur Heart J 2004;25:308-312.
49. Maki KC RS: Arguments in favor of screening for diabetes in cardiac rehabilitation. J Cardiopulm Rehabil 1995;15:97-102.
50. Laakso M: Heperglycemia and cardiovascular disease in type 2 diabetes. Diabetes 1999;48:937-942.
51. Zuanetti G et al.: Influence of diabetes on mortality in acute myocardial infarction: data from the GISSI-2 study. J Am Coll Cardiol 1993;22:1788-1794.
52. Sprafka JM et al.: Trends in prevelance of diabetes mellitus in patients with myocardial infarcion and effect of diabetes on survival. Th Minnesota Heart Survey. Diabetes Care 1991;14:537-543.
53. Geade P et al.: Multifactorial Intervention Cardiovascular Disease in Patients with Type 2 Diabetes. N Eng J Med. 2003;348:383-393.
54. Qiao Q et al.: Age- and sex-specific prevelance of diabetes and impaired glucose regulation in 11 Asian cohorts. Diabetes Care 2003;26:1770-1780.
55. Shaw JE et al.: Isolated post-challenged hyperglycaemia confirmed as a risk factor for mortality. Diabetologia 1999;42:1050-1054.
56. Tominaga M et al.: Impaired glucose tolerance is a risk factor for cardiovascular disease, but not impaired fasting glucose. The Funugata Diabetes Study. Diabetes Care 1999;22:920-924.
57. Rozanski A et al.: The epidemiology, pathphysiology, and menagement of psychosocial risk factors in cardiac practice: the emerging field of behavioral cardiology. J Am Coll Cardiol. 2005;45:637-651.
58. Glassman AH, Shapiro PA: Depression and the course of coronary artery disease. Am J Psychiatry. 1998;155:4-11.
59. Haines IP TW: Phobic anxiety and iscemic heart disaese. Br Med. J Clin Res Educ 1987;295:297-299.
60. Kawachi I et al.: Prospective study of phobi anxiety and risk of coronary artery disease in men. Circulation 1994;89:1992-1997.
61. Case RB et al.: Type A behavior and survival after myocardial nfarction. N Eng J Med. 1985;312:737-741.
62. Kivimaki M et al.: Work stress and risk of cardiovascular mortality: prospective cohort study of industrial employers. BMJ 2002;325:857-861.
63. Orth-Gomer K et al.: Marital stress worsens prognosis in women with coronary heart disease: The Stockholm Female Coronary Risk Sudy. JAMA 2000;284:3008-3014.
64. Rosengren A, Wilhelmsen L, Orth-Gomer K: Coronary disease in relation to social support and social class in Swedish men. A 15 year follow-up in the study of men born in 1933. Eur Heart J 2004:25:56-63.
65. Berkman LF: Emmotional support and survival after myocardial infarction. A prospective, population-based study of the elderly. Ann Intern Med. 1992;117:1003-1009.
66. Salomaa V et al.: Relationship of socioeconomic status on the incidence and prehospital, 28-day, and 1-year mortality rates of acute coronary events in the FINNMONICA myocardialinfarction register study. Circulation 2000;101:1913-1918.
67. Berg AO. Preventive services Task Force. U.S. Preventive services task force. Behavioral counseling in primary care to promote physical activity: recommendation and rationale. Am J Nurs. 2003;103:101-107.
68. Linden W, Stossel C, Maurice J: Psychosocial interventions for patients with coronary artery disease: a meta-analysis. Arch Intern Med. 1996;156:745-756.
69. Dusseldorp E et al.: A meta-analysis of psychoeducational programs for coronary heart disease patients. Health Psychol. 1999;18(5):506-519.
70. Rees K et al.: Psychological interventions for Coronary Heart Disease (Cochrane Review). Oxford: Update Software; 2004.
71. Glassman AH et al.: Sertraline treatment of major depression in patients with acute MI or unstable angina. JAMA 2002;288:701-709.
72. Berkman LF et al.: Effects of treating depression and ow preceived social support on clinical events after myocardial infarction: The Enhancing Recovery In Coronary Heart Disease (ENRICHD) Randomised Trial. JAMA 2003;289:3106-3116.
73. Freemantle N et al.: Beta-Blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999;318:1730-1737.
74. Gottlieb SS, McCarter RJ, Vogel RA: Effects of beta-blockade on mortality among high-risk and low-risk patients after myocadial infarction. N Eng J Med. 1998;339:489-497.
75. Antman Em, Braunwald E [w:] Branwald E. Heart Disease: A Textbook of Cardiovascular Medicine. 6th edition. 2001.
76. MERIT-HF Investigators. Effect of metoprolol CR/XL in chronic heart failre: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Falure (MERIT-HF). Lancet 1999;353:2001-2007.
77. The cardiac Insufficiency Bisoprolol Sudy II (CIBIS-II): a randomised trial. Lancet 1999;353:9-13.
78. Flather MD et al.: Randomised trial to determine the effect of nebivolol on mortality and cardiovscular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005;26:215-225.
79. Packer M et al.: (Carvedilol Prospectice Randomised Cumulative Survival Sudy Group). Effect of carvedilol on survival in severe chronic heart failure. N Eng J Med. 2001;344:1651-1654.
80. Antithrombotic Trialist´Collaboration. Collaborative metaanalysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002;324:71-86.
81. CURE Trial Investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Eng J Med 2001;345:494-502.
82. Steinhubl SR et al.: for the CREDO Investigators. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention. A randomised controlled trial. JAMA 2002;288:2411-2420.
83. Sabatine MS et al.: (for the CLARITY_TIMI 28 Investigators). Addition of clopidogrel to aspirin and fibrynolitic therapy for myocardial infarction with ST-segment elevation. N Eng J Med. 2005;352:1179-1189.
84. Chen ZM et al.: (COMMIT(ClOpidogrel and Metoprolol in Myocardial Infarction Trial) collaborative group). Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet 2005; 366:1607-1621.
85. Pfeffer MA et al.: Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocrdial infarction. Results of the survival and ventricular enlargement trail. N Eng J Med. 1992;327:669-677.
86. Acute Infarction Ramipril Efficacy. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet 1993;342:821-828.
87. Kober L et al.: Effects on mortality by trandolapril after myocardial infarction. N Eng J Med. 1995;333:1670-1676.
88. Yusuf S et al.: Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Orevention Evaluation Study Onvestigators. N Eng J Med. 2000;342:145-153.
89. Swedberg K et al.: Leczenie przewlekłej niewydolności serca. [w:] Choroby serca i naczyń. Podręcznik Europejskiego Towarzystwa Kardiologicznego. Tom II. Camm AJ, Luschner TF, Serruys PW. (red), Blackwell Publishing Ltd, Oxford. Wydanie Polskie: Termedia 2006.
90. Jong P et al.: Angiotensin receptor blockers in heart failure: meta-analysis of randomised controlled trials. J Am Coll Cardiol 2002;39:463-470.
91. Coletta AP et al.: Clinical trials update from the European Society of Cardiology: CHARM, BASEL, EUROPA and ESTREEM. Eur J Heart Fail 2003;5:697-704.
92. Pfeffer MA et al.: Valsartan in Acute Myocardial Infarction Trial Investigators. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Eng J Med. 2003;349:1893-1906.
93. Yusuf S et al.: ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Eng J Med. 2008;358:1547-1559.
94. Scandinavian Simvastatin Survival Study (4S) Group. Randomized trial of cholesterol-lowering in 4444 patients with coronary-heart-disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383-1389.
95. Sacks FM et al.: The Cholesterol and Recurrent Events Trial Onvestigators: The effect of pravastatin on coronary events after myocardial nfaction in patients with average cholesterol levels. N Eng J Med. 1996;335:1001-1009.
96. Simes RJ et al.: Relationship Between Lipid Levels and Clinical Outcomes in the Long-Term Intervention With Pravastatin in Ischemic Disease (LIPID) Trial. To what extent is reduction in coronary events with pravastatin eplained by on-study lipid levels. Circulation 2002;105:1162-1169.
97. Collins R et al.: (Heart Protection Study Collaborative Group). MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet 2003;361:2005-2016.
98. LaRosa JC et al.: Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Eng J Med. 2005;352:1425-1435.
99. Cannon CP et al.: Intensive versus modarate lipid lowering with statins after acute coronary syndrome. N Eng J Med. 2004;350:1495-1505.
100. Saab FA et al.: Comparison of outcomes in acute coronary syndrome in patients receiving statins within 24 hours of onset versus later times. Am J Cardiol 2004;94:1166-1168.
101. Lenderink T et al.: Patients using statin treatment within 24 hours after admission for ST-elevation acute coronary syndromes had lower mortality than non-users: a raport from the first Euro Heart Survay on acute coronary syndromes. Eur Heart J 2006;27:1799-1804.
102. Bavry AA et al.: Long-term benefit of statin therapy initiated during hospitalisation for acute coronary syndrome: a systemic review of randomised trials. Am J Cardiovasc Drugs 2007;7:135-141.
103. Pitt B et al.: The effect of spironolacton on morbidity and mortality in patients with severe heart failure. N Eng J Med. 1999;341:709-714.
104. Pitt B et al.: Eplerenon, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Eng J Med. 2003;348:1309-1321.
105. International Anticoagulation Review Group. Collaborative analysis of long-term anticoagulant administration after myocardial infarction. Lancet 1970;1:203-209.
106. Smith P I: The effect of warfarin on mortality and reinfarction after myocardial infarction. N Eng J Med. 1990;323:147-152.
107. Anticoagulants in the Secondary Prevention of Events in Coronary Thrombosis (ASPECT) Research Group. Effect of long-term anticoagulant treatment on mortality and cardiovascular morbidity after myocardial infarction. Lancet 1994;343:499-503.
108. Fiore LD et al.: Department of Veterans Affairs Cooperative Studies Program clinical trial comparing combined warfarin and aspirin with aspirin alone in survivors of acute myocardial infarction. Primary results of the CHAMP study. Circulation 2002;105:557-563.
109. Hurlen M et al.: Warfarin, aspirin, or both after myocardial infarction. The WARIS-II trial. N Eng J Med. 2002;347:969-974.
110. Herlitz Jet al.: LoWASA Study Group. Effect of fixed low-dose warfarin added to aspirin in the long term after acute myocardial infarction. The LoWASA study. Eur Heart J 2004;25:232-239.
111. Johanson SG et al.: Outcomes associated with combined antiplatelet and anticoagulant therapy. Chest 2008;133:948-954.
112. Naghavi M et al.: Association of influenza vaccination and reduced risk of recurent myocardial infarction. Circulation 2000;102:3039-3042.
113. Siscovick DS et al.: Influenza vaccination and risk of primary cardiac arrest. Am J Epidemiol 2000;152:674-677.
114. Gurfinkel EP et al.: Flu vaccination in acute coronary syndromes and planned percutaneous coronary interventions (FLUVACS) Study. Eur Heart J 2004;25:25-31.
115. Ciszewski A et al.: Influenza vaccination in secondary prevention from coronary ischemic events in coronary artery disease: FLUCAND study. Eur Heart J 2008; 29:1350-58.
otrzymano/received: 2008-05-16 zaakceptowano/accepted: 2008-09-17 Adres/address: *Tomasz Jaxa-Chamiec Klinika Kardiologii CMKP ul. Grenadierów 51/59, 04-073 Warszawa tel.: (0-22) 871-11-42 e-mail: tomjch@kkcmkp.pl Pełna wersja artykułu Prewencja wtórna schorzeń sercowo-naczyniowych jako stały element kompleksowej rehabilitacji kardiologicznej dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








