|
© Borgis - Postępy Nauk Medycznych 5, s. 216-234
*Roman M. Herman, Piotr Wałęga, Jacek Sobocki, Marcin Nowak, Tomasz Cegielny
Nowoczesna diagnostyka i możliwości leczenia nietrzymania stolca
Modern diagnostics and treatment option of fecal incontinence
III Katedra i Klinika Chirurgii Ogólnej Collegium Medicum UJ w Krakowie
Kierownik: prof. dr hab. n. med. R.M. Herman Streszczenie
Nietrzymanie stolca (NS) jest dolegliwością o zróżnicowanej i złożonej etiologii, wstydliwą dla chorego, wymagającą starannej diagnostyki i trudną do leczenia. Brak zasad rozpoznawania związany z mało dostępnymi technikami diagnostycznymi znacznie ogranicza możliwość podjęcia właściwej terapii. Celem tego opracowania jest przedstawienie patofizjologii, zasad diagnostyki oraz podstawowych metod leczenia zachowawczego i zabiegowego nietrzymania stolca. W artykule przedstawiono własne doświadczenia oraz krytyczną ocenę doniesień z literatury fachowej. Zalecany algorytm diagnostyczny obejmuje pełny zakres badań czynnościowych, wizualizacyjnych i elektrofizjologicznych. Omówiono także nowe metody leczenia, m.in. techniki wytwarzania zwieracza zastępczego odbytu, użycie sztucznego zwieracza jelitowego czy też prądu o częstotliwości radiowej (Secca procedure – RF remodeling). Przedstawiony algorytm ma na celu właściwą kwalifikację chorych oraz indywidualne dobranie właściwej metody leczenia zachowawczego lub operacyjnego. Omówiono wytyczne IFFGD z 2002 roku dotyczące problematyki zaburzeń defekacji. Aktualnie zalecane jest, aby diagnostyka i leczenie NS były prowadzone przez ośrodki referencyjne, posiadające odpowiednie możliwości diagnostyczne oraz doświadczenie w chirurgii kolorektalnej i leczeniu nietrzymania stolca. Zastosowanie przedstawionych zasad, pozwala uzyskać dobre efekty terapeutyczne i znacząco poprawić jakość życia chorych. Słowa kluczowe: nietrzymanie stolca, leczenie, diagnostyka
Summary
Fecal incontinence (FI) is a polyethologic disorder, where careful clinical approach is required and difficult treatment must be undertaken. Absence of broadly accepted guidelines for clinical evaluation due to rarely available diagnostic techniques limits accurate choice of treatment. The aim of this paper is to review pathophysiology, strategy of diagnostics and basic techniques of conservative and surgical treatment. We discuss also modern techniques of sphincter repair with respect to own experience. The recommended diagnostic algorithm comprise complete evaluation of anorectal physiology, electrophysiology and imaging. Recently described techniques of treatment are discussed, including muscle transposition for sphincter reconstruction, artificial prosthesis, artificial bowel sphincter and radiofrequency anal remodeling (Secca procedure). The algorithm was constructed to facilitated accurate qualification for surgery and choice of the most appropriate and effective procedure. IFFGD 2002 guidelines are discussed also. There is consensus that FI diagnostics and treatment should be performed in highly experienced centers, where broad range of colorectal diagnostic procedures are available. Following this guidelines allows to gain satisfactory results of FI treatment and improve patients´ quality of life. Key words: fecal incontinence, treatment, clinical evaluation
Nietrzymanie stolca – globalny problem ochrony zdrowia
Nietrzymanie stolca (NS), czyli nabyta lub wrodzona utrata kontroli oddawania stolca jest kalectwem eliminującym chorego z życia społecznego, ograniczającym jego aktywność w rodzinie, które w skrajnych przypadkach może prowadzić do próby samobójczej.
Waga i rozmiar tego problemu w Polsce nie zostały dotychczas jasno określone ani scharakteryzowane pod względem epidemiologicznym. Szacunkowe dane bazujące na przeprowadzonych w latach 1998-2000 badaniach są zbliżone do wyników uzyskiwanych w Europie i USA, gdzie częstość NS ocenia się na 3-5% dorosłej populacji. Są to jednak najprawdopodobniej dane niedoszacowane, na co wpływ ma także brak ujednoliconej nomenklatury (1-3) – do tej pory nie było jednolitej, jasnej i powszechnie uznanej definicji nietrzymania stolca. Dopiero w ostatnich kilku latach w wielu ośrodkach Europy i USA przyjęto ogólnie akceptowane nazewnictwo oraz algorytmy diagnostyczno-lecznicze. Ulegają one jednak ciągłym modyfikacjom (4, 5).
W Europie działa kilka ośrodków referencyjnych zajmujących się problematyką nietrzymania stolca – placówki takie istnieją w Holandii (Maastricht), Niemczech (Tuebingen), Austrii (Wiedeń, Graz), a także we Włoszech (Rzym, Ivrea). W roku 2003 i na początku 2004 opublikowano wiele doniesień na temat leczenia NS.
Od roku 1993 w Stanach Zjednoczonych w ramach International Foundation for Functional Gastrointestinal Disorders (IFFGD) działa sponsorowany i nadzorowany przez American Society of Colon and Rectal Surgeons Research Foundation narodowy program leczenia nietrzymania stolca, którego celami są: charakterystyka epidemiologiczna, opracowywanie wytycznych diagnostyczno-terapeutycznych, a także ocena socjoekonomiczna NS. Wstępne rezultaty tych badań opublikowano w 1995 roku (3). Bazując na ponad sześcioletnich badaniach, w roku 1999 w University of Wisconsin Medical School zorganizowano sponsorowane przez IFFGD sympozjum (Consensus Conference on Treatment Options for Fecal Incontinence). Na spotkaniu tym, w którym uczestniczyło 150 ekspertów z całego świata, opracowano konsensus z zakresu NS oraz określono kierunki i priorytety działania dotyczące nietrzymania stolca i moczu. Pełen tekst wytycznych został opublikowany w 2001 roku w „Diseases of the Colon & Rectum” (4).
Kolejna konferencja odbyła się w 2002 roku (Advancing the Treatment of Fecal & Urinary Incontinence Through Research), a ustalone wówczas wytyczne zamieszczono na stronie internetowej IFFGD – www.iffgd.org (5).
Powyższe dokumenty, aktualna literatura, oraz własne doświadczenia były podstawą niniejszej pracy, której celem jest przybliżenie problematyki nietrzymania stolca lekarzom różnych specjalności. Jest to także próba wykreślenia inkontynencji z „indeksu tematów zakazanych” – tematów tabu zarówno dla chorych, jak i lekarzy.
Określenie pojęcia
W powszechnej opinii termin „nietrzymanie stolca” – NS oznacza objawy wynikłe z niewydolności „mechanizmu zamykającego odbyt”, jakim jest kompleks zwieraczy odbytu. Dotyczy to nietrzymania zarówno stolca, jak i gazów. Niewydolność tego mechanizmu nie zawsze wynika z morfologicznego ubytku zwieraczy. Może być następstwem ich odnerwienia (obwodowego lub/i ośrodkowego), a także zaburzeń w odbiorze bodźców czuciowych z kanału odbytu. Sama niewydolność zwieraczy (anatomiczna lub czynnościowa) określana jest angielską nazwą „ anal incontinence ” (nietrzymanie odbytowe), co jest pojęciem węższym od NS. Z tego także powodu, trudno jest stworzyć jednolitą i uniwersalną definicję tego schorzenia.
Nelson mianem „nietrzymanie stolca” określa niezdolność powstrzymania opróżniania zawartości odbytnicy do momentu uznanego za odpowiedni z punktu widzenia norm społecznych (3). Według Whiteheada przez nietrzymanie stolca należy rozumieć bezwiedne oddawanie stolca w nieodpowiednim czasie i miejscu – ma ono występować częściej niż dwa razy w miesiącu w ciągu ostatnich czterech lat zarówno w trakcie spoczynku, jak i podczas dowolnego skurczu zwieraczy (6). Zdaniem Baetena natomiast NS to nie tylko brak możliwości powstrzymania defekacji, ale także niemożność wydalenia stolca w odpowiednim czasie i miejscu (7). Mavrantonis i Wexner w swojej opublikowanej w 1998 roku pracy pt. A clinical approach to fecal incontinence dowodzą, że oprócz utraty kontroli wydalania stolca na jakość życia wpływa brak możliwości rozróżniania (dyskryminacji) gazów i stolca, z jednoczesną niekontrolowaną ucieczką gazów (8).
Zgodnie z wytycznymi konsensusu z roku 1999 – Consensus Conference on Treatment Options in Fecal Incontinence ( Milwaukee) – sporadyczną ucieczkę gazów przy prawidłowej zdolności różnicowania gazów i stolca nie należy nazywać nietrzymaniem stolca, natomiast permanentna ucieczka gazów i brak możliwości ich różnicowania to już bez wątpienia objaw inkontynencji (4). Biorąc pod uwagę nasilenie objawów oraz ich występowanie w czasie, Parks wprowadził najprostszą skalę oceniającą stopień nietrzymania stolca (9). Obecnie jest ona stosowana rzadko. Zastąpiona została przez rozbudowane skale punktowe. Ich celem jest właściwe określenie zakresu objawów, ich nasilenia i częstości występowania, a przez to stworzenie spójnego, obiektywnego narzędzia pomiarowego, jednolitego dla wszystkich ośrodków klinicznych. Obecnie powszechnie stosuje się następujące – rekomendowane przez IFFGD – skale oceny nasilenia objawów nietrzymania stolca:
– Skala Rockwooda – Fecal Incontinence Severity Index (FISI) (10);
– Skala Jorge-Wexnera (Skala Cleveland)(11);
– Skala Vaizeya (12);
– Skala Pescatoriego (13);
– American Medical Systems Scale – Fecal Incontinence Scoring System (14).
W raporcie IFFGD nie wymieniono jedynej kliniczno-manometrycznej skali NS uwzględniającej również wyniki badań manometrycznych, tj. skali Holschneidera, używanej często w literaturze niemieckojęzycznej (Holschneider Scoring Scale) (15).
W przeprowadzonych przez Vaizeya badaniach prospektywnych nie stwierdzono istotnych statystycznie różnic w efektywności oceny stopnia inkontynencji w zależności od ilości branych pod uwagę czynników (12). W naszym ośrodku aktualnie stosujemy równocześnie trzy skale: Holschneidera (jedyna z oceną manometryczną), Jorge-Wexnera oraz FISI.
Dane epidemiologiczne
Opierając się na danych opublikowanych w 2002 roku przez IFFGD, określono częstość występowania objawów nietrzymania stolca w całej populacji dorosłej USA na około 2,2%. Wśród pensjonariuszy domów opieki społecznej ponad 47% nie potrafi w pełni kontrolować oddawania stolca (Consensus Conference Report) (3-5). W przeprowadzonych w Niemczech badaniach objawy nietrzymania stolca występowały u 4-5% dorosłej populacji. Odsetek ten zdecydowanie rośnie wraz z wiekiem. Wśród osób w wieku powyżej 70 lat, ponad 55% nie potrafi w pełni kontrolować oddawania stolca (2). W Wielkiej Brytanii objawy nietrzymania u osób poniżej 60. roku życia szacuje się na 1,5% u mężczyzn i 13% u kobiet. W piśmiennictwie polskojęzycznym opublikowano m.in. wyniki badań przeprowadzonych w grupie 174 chorych gastrologicznych, z podziałem na grupy wiekowe. Objawy nietrzymania stolca odnotowano u 3,5% badanych w grupie 31.-40. r.ż., 5% w grupie 41.-50. r.ż. i prawie 10% chorych powyżej 51. r.ż. Dane szacunkowe wieloletnich badań prowadzonych przez ośrodek autorów wskazują, iż kalectwo to może dotyczyć znacznie większego odsetka chorych, sięgając w grupach podwyższonego ryzyka nawet 7% (16).
Schorzenia i sytuacje kliniczne znacznie podnoszące ryzyko nietrzymania stolca
1. Zabiegi proktologiczne
Ich następstwa są przyczyną NS w znacznym odsetku przypadków – często w wieku starszym lub po porodzie, gdy na skutek dodatkowego uszkodzenia ujawnia się ukryta dysfunkcja zwieraczy. W przypadku forsownego rozszerzenia zwieraczy odbytu (dywulsja), hemoroidektomii, sfinkterotomii czy fistulotomii ryzyko wystąpienia objawów nietrzymania stolca wynosi od 10 do 30%, w zależności od rodzaju zabiegu oraz doświadczenia chirurga (23).
2. Ginekologia i położnictwo
Objawy nietrzymania stolca częściej zgłaszają kobiety. Związane jest to z inną u nich budową miednicy mniejszej, krótszym kanałem odbytu, wpływami hormonalnymi i przebytymi porodami (24). Szczególnie akcja porodowa z wydłużoną II fazą porodu, powikłana pęknięciem krocza lub źle wykonanym jego nacięciem, a także zastosowanie kleszczy niosą ze sobą wysokie ryzyko poporodowego nietrzymania stolca (25, 26). Również prawidłowy poród u około 30% kobiet może być przyczyną NS.
Częstość występowania nietrzymania stolca w grupie 20 500 rodzących w USA, u których doszło do pęknięcia krocza III i IV stopnia (5%), wynosi ponad 40%. Dla porównania, odsetek ten u rodzących bez nacięcia krocza i bez komplikacji wynosi ok. 1%. Podobne rezultaty uzyskano w Niemczech, Anglii i Skandynawii. Jak dotąd nie ma jednoznacznych danych dotyczących wpływu histerektomii, nie mniej jednak, co znamienne, ponad 50% kobiet z NS przebyło ten zabieg (2, 27, 28).
3. Chorzy po zabiegach onkologicznych z powodu raka odbytnicy
Wzrastająca z roku na rok zapadalność na raka odbytnicy oraz zastosowanie szwów mechanicznych i nowych technik operacyjnych sprawiają, iż znacznie w ostatnim czasie zwiększyła się liczba chorych po zabiegach resekcyjnych z zachowaniem zwieraczy. Ryzyko wystąpienia objawów NS po tych zabiegach wynosi od 15 do 60% dla przedniej i przedniej niskiej resekcji odbytnicy (19-21). Radioterapia przed- lub pooperacyjna znamiennie wpływa na funkcje anorektalne. Jest to wynikiem nie tylko odczynu zapalnego, ale także trwałych zmian histologicznych. Dochodzi do zniszczenia splotów śródściennych jelita odpowiedzialnych za odruchy anorektalne (22).
4. Nienowotworowe schorzenia jelit
Przewlekłe stany zapalne jelit (IBD) – wrzodziejące zapalenie jelita grubego, a szczególnie choroba Leśniowskiego-Crohna, która w 10-30% przypadków przebiega z objawami anorektalnymi – mogą prowadzić do objawów nietrzymania stolca. Częstość nietrzymania stolca w tej grupie chorych wynosi ponad 20%, a nasilenie objawów pozostaje w bezpośredniej korelacji z okresami zaostrzenia choroby. Czynnościowe schorzenia jelit przebiegające z zaburzeniami motoryki jelita grubego, takie jak zespół jelita nadwrażliwego (IBS) w około 20% mogą dawać objawy nietrzymania stolca (17). Objawy inkontynencji mogą występować także w przypadku przewlekłych zaparć – gdy masy stolca ulegają bakteryjnemu rozkładowi, dochodzi do niekontrolowanego wycieku płynnej treści – overflow incontinence (2, 18).
5. Neurologiczne i układowe przyczyny nietrzymania stolca
Rozwijająca się w przebiegu długoletniej cukrzycy polineuropatia u 20% chorych przebiega z objawami nietrzymania stolca i moczu (29).
U około 25% chorych z rwą kulszową występują zaburzenia kontroli oddawania moczu i stolca. Według danych IFFGD z 2002 roku 70% pacjentów po zabiegach neurochirurgicznych nie potrafi w pełni kontrolować wydalania stolca i/lub moczu (5). Także ponad połowa chorych na stwardnienie rozsiane (SM) skarży się na zaburzenia kontroli defekacji (30). Rozszczep rdzenia prowadzi w 80% przypadków do nietrzymania stolca, a ryzyko wystąpienia NS u osób po urazach rdzenia szacuje się na 25-75% (5, 31).
Patomechanizm utraty kontroli nad aktem defekacji może być różnorodny. Zaburzenia mogą dotyczyć odbytu, odbytnicy lub ich wzajemnych relacji, czyli odruchów rektoanalnych odpowiedzialnych za koordynację reakcji zwieraczy i odbytnicy (5). Schematycznie mechanizm NS można przedstawić następująco:
1. funkcjonalny – biegunka, overflow incontinence, zaburzenia emocjonalne;
2. brak odpowiedzi zwieracza – ubytek mięśnia zwieracza (zewn./wewn.), uszkodzenie nerwu sromowego, uszkodzenie CSN;
3. brak reakcji sensorycznej przy zachowanych odruchach eferentnych.
W oparciu o doświadczenia autorów, dotyczące epidemiologii nietrzymania stolca, bazując na grupie chorych leczonych w latach 1994-2002, przyczyny wystąpienia tego objawu można określić następująco:
– 37,1% – chorzy po niskiej przedniej resekcji odbytnicy i proktokolektomii;
– 14,6% – pacjenci z uszkodzeniem zwieraczy w trakcie praktyk seksualnych (w tym gwałtu);
– 13,2% – chore po pęknięciu lub nacięciu krocza w trakcie porodu;
– 12,2% – chorzy po zabiegach proktologicznych;
– 9,7% – pacjenci po bezpośrednim urazie okolicy krocza;
– 5,8% – chorzy ze stanami zapalnymi jelit, także następstwa uzupełniającego leczenia radioterapią narządu rodnego lub odbytnicy;
– 2,1% – osoby z niewydolnością zwieraczy związaną z wiekiem (chorzy powyżej 85. roku życia);
– 1,1% – chorzy psychiatryczni;
– 1,2% – chorzy ze schorzeniami układowymi – SM, sklerodermia, polineuropatia cukrzycowa.
Społeczne następstwa nietrzymania stolca
Nietrzymanie stolca i moczu jest stanem, który w znaczny sposób zmienia warunki życia wielu kobiet i mężczyzn na całym świecie. Mimo, iż rzadko zagraża życiu, znacznie pogarsza jego jakość, prowadząc do niesprawności fizycznej, dysfunkcji psychicznej i dezadaptacji społecznej. Do niedawna niewiele uwagi poświęcano tym problemom. W USA Państwowy Instytut Zdrowia ( National Institutes of Health, NIH) zwrócił uwagę na fakt, że nietrzymanie stolca i moczu to nie tylko niesprawność fizyczna o znacznych następstwach socjalnych, ale również bardzo kosztowna choroba. Rocznie koszty leczenia, rehabilitacji oraz związane z niemożnością wykonywania pracy zawodowej wynoszą około 12 miliardów dolarów, i to jedynie w odniesieniu do chorych z nietrzymaniem moczu. Koszt utrzymania jednego chorego z nietrzymaniem stolca (środki higieniczne, absencja w pracy, środki farmakologiczne) to ponad 9900 USD/rok (3-5). W Niemczech w 1998 roku wydatki związane z nietrzymaniem moczu wyniosły 26,3 mld DM. Z tego powodu w USA, Anglii i Niemczech rozpoczęto działania programowe mające na celu poprawę diagnostyki i terapii nietrzymania stolca i/lub moczu.
Panowanie nad sytuacją, w której znajduje się człowiek, ogólna przewidywalność zdarzeń, kontrola nad funkcjonowaniem własnego ciała są tym, co daje poczucie pewności, bezpieczeństwa, pozwala na podejmowanie i realizację wielu zadań, sprawowanie funkcji społecznych (rodzinnych, zawodowych, pozazawodowych), samorealizowanie się, rozwój, kreatywność. Świadomość braku kontroli w którejkolwiek z wymienionych sfer zazwyczaj prowadzi do poczucia zagrożenia, niepewności, powoduje dezintegrację na poziomie emocjonalnym – rodzi uczucie lęku i niepokoju. Gdy podejmowane działania nie przynoszą oczekiwanych rezultatów, pojawiają się frustracja, niewiara w sens dalszych prób, fiksacja na dotychczasowych nieefektywnych działaniach, poczucie bezradności, beznadziejności, stany depresyjne. Dezadaptacja psychospołeczna objawia się spadkiem aktywności życiowej, zaburzeniami motywacji; następuje wzrost drażliwości, niepokoju, lęku. Występują zaburzenia snu, spadek libido, zaburzenia seksualne, zaburzenia łaknienia, objawy wegetatywne; jednostka znajduje się w stanie stresu – to wszystko, w szczególnym przypadku osób z NS, skutkuje obniżeniem jakości życia chorych, która ma ogromne znaczenie w ich przygotowaniu oraz leczeniu. Biorąc pod uwagę powyższe uwarunkowania, stworzono szereg kwestionariuszy i skal oceniających jakość życia ( quality of life, QoL) chorych z inkontynencją. Wraz ze skalami nasilenia objawów umożliwiają one obiektywną i jednoznaczną (to samo narzędzie stosują wszystkie ośrodki badawcze) ocenę rozmiaru problemu. Poniżej wymieniono rekomendowane przez Whiteheada i wsp. systemy oceny jakości życia:
– FI-QLS – Fecal Incontinence Quality of Life Scale – Rockwood (32);
– SF-36 – Medical Outcomes Study Short-Form – 36 (33);
– Zung – Self-Rating Depression Scale (34).
Algorytm diagnostyczny i standardy analizy wyników
Prawidłowa kontrola oddawania stolca jest uwarunkowana szeregiem czynników, które razem tworzą sprawny mechanizm zaporowy w sytuacjach niesprzyjających defekacji. Do czynników tych należą:
1. sprawny kompleks zwieraczy odbytu (gładkokomórkowy zwieracz wewnętrzny, poprzecznie prążkowane mm. zwieracza zewnętrznego, łonowo-odbytniczego i dźwigacza odbytu);
2. sprawne szlaki nerwowe (receptory, nerw sromowy, układ autonomiczny oraz ośrodki CSN);
3. elastyczność i podatność ściany odbytnicy, odpowiedzialne za jej funkcje rezerwuarową i inicjację aktu defekacji;
4. koordynacja odbytniczo-odbytowa – odruch odbytniczo-odbytowy ( rectoanal reflex, RAR);
5. anatomiczny układ osi prostnicy i kanału odbytu w sposób mechaniczny uzupełniający mechanizm zaporowy.
Brak, ewentualnie zaburzenia jednego czy też kilku powyższych elementów prowadzą do wystąpienia nietrzymania stolca. Uzyskane w trakcie szczegółowego badania podmiotowego dane są systematyzowane na podstawie dzienników objawów i stanowią podstawę do wstępnej klasyfikacji nietrzymania stolca z użyciem jednej z rekomendowanych, wymienionych na wstępie skal. Celem wykluczenia zmian organicznych chorzy zawsze wymagają przeprowadzenia pełnych badań diagnostycznych (USG, kolonoskopia, rektoskopia) (22).
W ocenie przyczyn NS poza pełnym badaniem klinicznym zasadnicze znaczenie mają także badania czynnościowe (manometria) i wizualizacyjne (ultrasonografia, badania wideoproktograficzne, scyntygrafia lub NMR) (4, 35, 36).
Badania obrazowe
1. Badanie endoskopowe jest podstawowym badaniem, od którego zaczynamy diagnostykę. Jego celem jest wykluczenie organicznej przyczyny dolegliwości.
2. Ultrasonografia przezodbytowa ( TAUS), w tym ultrasonografia 3D. W badaniach wykorzystuje się specjalne sondy endorektalne (z wirującą głowicą) o zakresie częstotliwości 10-16 MHz. Zdaniem Bartrama podczas badania w obrębie kanału odbytu można wyróżnić 6 warstw ultrasonograficznych: 1 – hiperechogeniczną, odpowiadającą ścianie balonu lub osłonie plastikowej głowicy, 2 – hipoechogeniczną, odpowiadającą śluzówce odbytu, 3 – hiperechogeniczną, odpowiadającą tkance podnabłonkowej, 4 – hipoechogeniczną, odpowiadającą zwieraczowi wewnętrznemu odbytu, 5 – hiperechogeniczną, odpowiadającą przestrzeni międzyzwieraczowej i mm. podłużnym oraz 6 – o mieszanej echogeniczności, odpowiadającą prążkowanej mięśniówce zwieracza zewnętrznego odbytu. Otrzymane obrazy zależą od wysokości na której dokonujemy oceny (36). W dolnej części kanału odbytu otrzymujemy przekrój przez część podskórną zwieracza zewnętrznego co jest widoczne w postaci hyperechogenicznego pierścienia wokół sondy USG, którego zewnętrzne granice ulegają rozproszeniu i przechodzą w otaczającą tkankę tłuszczową o zbliżonej echogeniczności (ryc. 1). W części środkowej kanału odbytu możemy już wyraźnie zobaczyć wymienione na początku sześć warstw, tj. hypoechogeniczną – głowicę/śluzówkę, hyperechogeniczną warstwę podśluzową, hypoechogeniczny zwieracz wewnętrzny, mięsień podłużny o pośredniej echogeniczności i na zewnątrz hyperechogeniczną część powierzchowną zwieracza zewnętrznego (ryc. 2). W części górnej kanału odbytu widzimy podobny układ z tym, że szerokość zwieracza wewnętrznego maleje, i razem z mięśniem podłużnym, stopniowo przechodzi w warstwę właściwą mięśniówki odbytnicy. Widać część głęboką zwieracza zewnętrznego oraz okalający go rozwarty łuk mięśnia łonowo-odbytniczego (ryc. 3). TAUS umożliwia rozpoznanie i umiejscowienie morfologicznych ubytków w zakresie zwieraczy i mięśni dna miednicy. Dodatkowo odmiana 3D tej metody pozwala na uzyskanie przekrojów badanych struktur w dowolnej płaszczyźnie (ryc. 4) oraz uzyskanie obrazu przestrzennego dzięki wykorzystaniu renderowania struktur o zbliżonej echogeniczności. Możemy również usunąć z obrazu struktury, które w danej chwili nie są przedmiotem naszej oceny pozostawiając tylko te, które chcemy dokładnie ocenić pod kątem ich przestrzennej konfiguracji (ryc. 5). Badanie TAUS ma decydujący wpływ na wybór postępowania. Stwierdzony ubytek morfologiczny zwieraczy przekraczający 1/3 ich obwodu zwykle wyklucza leczenie zachowawcze. Porównania wydolności 3D przez odbytniczej ultrasonografii i endoanalnej MRI dochodzą do wniosku, że obie metody badania wykazują dobrą korelację w wykrywaniu defektów IAS i EAS, ale metodą bardziej wydolną w ocenie objętości zwieraczy i wykrywaniu ich atrofii jest MRI. Spowodowane jest to jak się wydaje brakiem ostrej granicy pomiędzy zewnętrznym brzegiem EAS a otaczającą tkanką tłuszczową na obrazach USG, co więcej metoda 3D nie ma w tym zakresie wyraźnej przewagi nad obrazowaniem 2D. Granica ta jest o wiele lepiej widoczna w przypadku endoanalnej MRI. Badania były prowadzone na dużym materiale blisko 2500 kobiet, z których kryteria włączenia do randomizacji (pęknięcie krocza drugiego stopnia lub kobiety po episiotomi) spełniło 752. Porównano wydolność TAUS i samej oceny klinicznej w wykrywaniu urazów zwieraczy. Wykryte uszkodzenia zwieraczy były naprawiane jednoczasowo. Stwierdzono wyraźny zysk z zastosowania TAUS i zmniejszenie się odsetka ciężkich trwałych uszkodzeń zwieraczy (Wexner> 4) w badanej grupie, który wyniósł 3,2% w stosunku do grupy kontrolnej 6,7% p<0,03. Cytowana pracy wyraźnie uwidacznia znaczenie wczesnej diagnostyki uszkodzeń zwieraczy w odniesieniu do późnych wyników leczenia.
 Ryc. 1. Obraz dolnej części kanału odbytu w badaniu TAUS.
 Ryc. 2. Obraz środkowej części kanału odbytu w badaniu TAUS
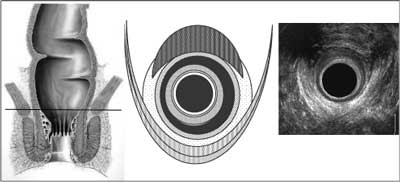 Ryc. 3. Obraz górnej części kanału odbytu w badaniu TAUS.
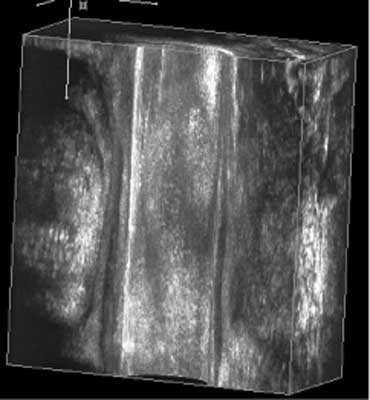 Ryc. 4. Przekrój podłużny kanału odbytu – TAUS 3D.
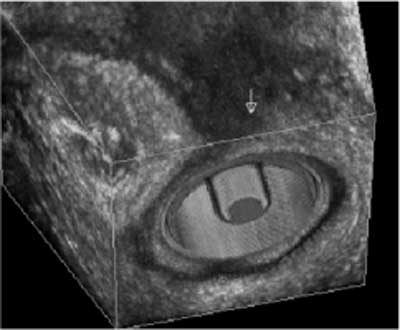 Ryc. 5. Przednie uszkodzenie zwieracza zewnętrznego – TAUS 3D.
3. MRI – obrazowanie przy użyciu rezonansu magnetycznego, najlepiej z zastosowaniem sondy doodbytniczej. Umożliwia precyzyjną ocenę stanu morfologicznego i czynnościowego zwieraczy (kurczliwość), a także ich komputerową, trójwymiarową wizualną rekonstrukcję.
4. Defekografia – jest to badanie radiologiczne umożliwiające obrazowanie oraz analizę aktu defekacji. Tzw. proktodefekografia to dynamiczne badanie odbytnicy ( dynamic rectal examination, DRE), a coraz powszechniej obecnie stosowana wideoproktografia to badanie proktodefekograficzne z utrwaleniem zapisu na taśmie wideo. Badanie rozpoczyna się doodbytniczym podaniem mieszanki papki barytowej i mąki ziemniaczanej (do chwili uczucia parcia – około 250 ml). U kobiet w celu dokładniejszej oceny tylnej ściany pochwy stosowane są nasączone kontrastem gąbki dopochwowe lub specjalne żele. Standardowo wykonuje się zdjęcia radiologiczne: w spoczynku, w trakcie maksymalnego, dowolnego skurczu zwieraczy, w trakcie parcia na stolec (4-8 zdjęć w odstępie 2-3 sekund) oraz po całkowitym wypróżnieniu (36).
Oceniane są następujące parametry: kąt odbytowo-odbytniczy (anorectal angle, ARA) – w spoczynku (granice normy 90-95°), podczas parcia (125-145°), podczas maksymalnego skurczu zwieraczy (70-80°); obniżenie dna miednicy (w zależności od metody pomiaru jest to odległość ARA od linii łonowo-guzicznej, szczytu kości ogonowej lub guza kulszowego; wynosi ona: w spoczynku do 4 cm, podczas parcia na stolec do 8 cm – ryc. 6); średnica bańki odbytnicy oraz kanału odbytu, mierzona w spoczynku oraz podczas parcia na stolec; długość kanału odbytu, mierzona w spoczynku i podczas maksymalnego skurczu zwieraczy; zdolność opróżniania – w warunkach fizjologicznych po całkowitym wypróżnieniu nie powinno zalegać w bańce odbytnicy więcej niż 10% objętości wyjściowej. W spoczynku w swym podstawowym napięciu pozostają m. łonowo-odbytniczy oraz wewnętrzny zwieracz odbytu, pozostałe mięśnie odpowiedzialne za kontrolę oddawania stolca są rozkurczone, w wyniku czego w miejscu przejścia odbytnicy w odbyt powstaje ostry kąt – kąt odbytowo-odbytniczy. W sytuacji sprzyjającej oddaniu stolca rektoanalny odruch hamowania powoduje relaksację obu mięśni, rozwarcie kąta odbytniczo-odbytowego oraz nieznaczne obniżenie przejścia odbytowo-odbytniczego. Jednocześnie kurczy się m. iliopsoas i m. iliococcygeus, czego efektem jest skrócenie i poszerzenie kanału odbytu. W trakcie dowolnego skurczu mięśnia zwieracza zewnętrznego odbytu kąt odbytniczo-odbytowy ulega zmniejszeniu, a długość kanału odbytu zwiększa się, jednocześnie unosząc przejście odbytniczo-odbytowe ku górze.
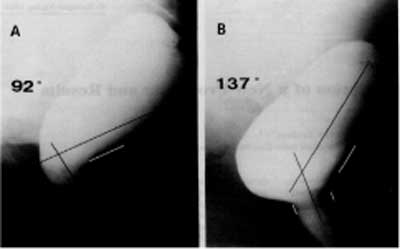 Ryc. 6. Zdjęcia radiologiczne wykonane w trakcie defekografii. Zaznaczony kąt rektoanalny: obraz prawidłowy. (A) W trakcie skurczu zwieraczy; (B) W trakcie parcia na stolec.
Patologiczne obrazy uzyskane w badaniu defekograficznym:
– Rektocele – wypuklenie najczęściej przedniej ściany bańki odbytnicy ( rectocele anterior); u kobiet małe uwypuklenie – do 2 cm jest obrazem normalnym. Subiektywne dolegliwości (puste parcia na stolec, niepełne wypróżnienia) występują zwykle przy uchyłku powyżej 4 cm, gdy stolec podczas i po defekacji zalega w uchyłku. Rzadziej zmiana dotyczy tylnej ściany odbytnicy ( rectocele posterior). Rectocele w około 20% współistnieje z objawami nietrzymania stolca.
– Wgłobienie odbytniczo-odbytnicze ( rectorectal intussusception) (ryc. 7). Wewnętrzne wgłobienie dotyczy zwykle przedniej ściany odbytnicy, jest rzadko widoczne w badaniu rektoskopowym, a doskonale uwidacznia się w defekografii. Stanowi przyczynę daremnego i nieskutecznego parcia na stolec i może powodować objawy NS. Rzadziej dochodzi do okrężnego wgłobienia wewnątrzodbytniczego, gdy czoło niejako wgłabia (uwypukla) się do bańki odbytnicy, wewnątrzodbytowego, gdy czoło przy parciu wpukla się do kanału odbytu, czy pozaodbytowego, gdy czoło wgłobienia przechodzi poza odbyt. Wgłobieniom często towarzyszy przedni uchyłek odbytnicy, a w badaniu rektoskopowym i defekograficznym stwierdzić można owrzodzenie przedniej ściany odbytnicy, samotny wrzód odbytnicy ( solitary rectal ulcer). Zaawansowane wgłobienia, szczególnie z wypadaniem odbytnicy, są przyczyną nietrzymania stolca i zwykle kwalifikują się do leczenia operacyjnego poprzedzonego treningiem behawioralnym i/lub elektrostymulacją (39).
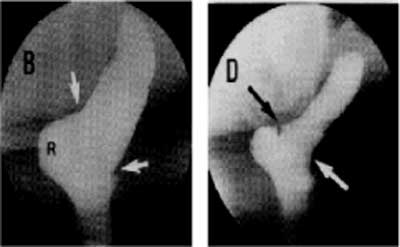 Ryc. 7. Defekografia – w trakcie parcia na stolec. B – brzeg dystalny, ściana przednia rozpoczynającego się wgłobienia odbytniczo-odbytowego; R – widoczny w trakcie parcia znaczny przedni uchyłek odbytnicy; D – dokonane wgłobienie odbytniczo-odbytowe.
– Dyskineza mięśni zwieraczy odbytu, zespół spontanicznego skurczu mięśni dna miednicy ( spastic pelvic floor syndrome).
– Zespół nadmiernego obniżenia krocza ( descending perineum syndrome, DPS) – postępujące wraz z wiekiem osłabienie przepony miednicznej, szczególnie u kobiet, prowadzi do obniżenia w spoczynku płaszczyzny krocza poniżej poziomu guzowatości kulszowej, z jednoczesnym przemieszczeniem w dół kanału odbytu, powodującym różnego stopnia objawy nietrzymania stolca.
5. Dynamiczna defekografia z użyciem rezonansu magnetycznego. Standardowe metody nie zawsze pozwalają na dokładną ocenę dysfunkcji anorektalnych i dna miednicy małej. Zdaniem Rentscha i wsp. skojarzenie klasycznej defekografii i rezonansu magnetycznego umożliwia szczegółową ocenę przyczyn dysfunkcji dna miednicy. Jest to metoda stosunkowo droga i stosowana wyłącznie przez ośrodki naukowe, jednak ze względu na wysoką skuteczność diagnostyczną może stać się jedną z cenniejszych metod wizualizacyjnych (36).
Badania czynnościowe
1. Badanie manometryczne. Standard minimum badania manometrycznego obejmuje oznaczenie następujących parametrów:
– Ciśnienie podstawowe (BAP lub IASp) – niższe niż 50 mmHg świadczy o niewydolności wewnętrznego zwieracza odbytu.
– Ciśnienie wspomagane w trakcie dowolnego skurczu (SAAP lub EASp) – gdy wartość ciśnienia maksymalnego jest większa od ciśnienia podstawowego o mniej niż 60 mmHg i po 10 sekundach maleje o ponad 50%, myślimy o niewydolnym zewnętrznym zwieraczu odbytu lub uszkodzeniu nerwu sromowego.
– Odruch odbytniczo-odbytowy (RAIR) i odruchowy skurcz zwieraczy w trakcie wzrostu ciśnienia tłoczni brzusznej (ARC). Ich brak świadczy o przerwaniu przewodnictwa pomiędzy odcinkiem przedzwieraczowym i zwieraczami (np. w przypadku polineuropatii cukrzycowej) (37).
– Funkcje vector volume, czyli trójwymiarowy rozkład profilu ciśnień oraz procent radialnej asymetrii (RA). VV jest graficzną formą prezentacji (przez program komputerowy) radialnego rozkładu ciśnień w oparciu o szereg punktowych pomiarów ciśnień w kanale odbytu. Pozwala na określenie wielkości i lokalizację tzw. czynnościowego ubytku. Radialna asymetria (RA) obrazuje zaburzenia symetrii rozkładu ciśnień w obrębie zwieraczy.
– Czynnościowa długość strefy zwieracza, tj. strefa podwyższonego i maksymalnego ciśnienia – oceniana jest także podczas badania manometrycznego, a z wykresu ciśnienia podstawowego i wspomaganego wyliczyć można wskaźnik zmęczenia zwieraczy, który lepiej ilustruje ich stan czynnościowy. Obecnie badania te uznaje się za rutynowe.
2. Elektromiografia z oceną asymetrii unerwienia zwieraczy. Celem badania jest określenie ogólnej aktywności mioelektrycznej zwieracza zewnętrznego i mięśnia łonowo-odbytniczego podczas spoczynku, dowolnego skurczu zwieracza i aktu parcia na stolec. Stosowane metody pomiaru, np. koncentryczne elektrody igłowe lub płaskie elektrody powierzchniowe, pozwalają na jednoczesną ocenę aktywności kilku jednostek motorycznych. Jednostka motoryczna oceniana na podstawie badania EMG składa się z komórki rogów przednich rdzenia, jego aksonu, gałązek obwodowych i włókien mięśniowych przez nie zaopatrywanych (zwykle od 10 do 200). Każda jednostka motoryczna charakteryzowana jest przez amplitudę i czas trwania skurczu oraz kształt impulsu. Analiza czasu trwania i kształtu impulsu decyduje o wartości fizjologicznej zapisu. O ile badanie elektrodami powierzchniowymi w stosunkowo niewielkim stopniu obciąża chorego, o tyle elektromiografia igłowa, zgodnie z zaleceniami IFFGD, ze względu na niemiłe odczucia w trakcie badania jest wskazana jedynie w przypadku podejrzenia uszkodzenia unerwienia zwieracza zewnętrznego. Elektromiografia umożliwia wykluczenie ubytku w zakresie unerwienia obwodowego zwieracza (36). Możliwe jest także wykonanie elektromiografii zwieracza wewnętrznego. Ze względu na gładkokomórkowy komponent jego budowy, wynikiem zapisu jest fala wolna. Wartość kliniczna tego badania wymaga ściślejszego ustalenia. Ocena asymetrii unerwienia zwieraczy jest metodą służącą do oceny funkcji kompleksu zwieraczy odbytu. Współczesne badania nad anatomią i fizjologią zwieraczy wykazują, że są one w wielu przypadkach unerwione niesymetrycznie, a uszkodzenie unerwienia dominującego ewidentnie obniża wydolność skurczową całego kompleksu i może być przyczyną wystąpienia objawów nietrzymania stolca. Badanie polega na wykonaniu przezodbytniczego badania elektromiograficznego przy użyciu specjalnej 16-kanałowej sondy. Przeprowadzają je tylko nieliczne ośrodki Europy (obecnie także Pracownia Badań Czynnościowych III Katedry Chirurgii Ogólnej CMUJ). Wymaga ono specjalistycznej aparatury oraz znacznego doświadczenia w celu właściwej interpretacji wyników.
3. Badania funkcji anorektalnych za pomocą barostatu. Poza oceną zjawisk motorycznych ocena reakcji sensorycznych, tzw. czucia trzewnego, w odpowiedzi na stosowane pobudzenie jest podstawą badania funkcji anorektalnych. Prawidłowe odczuwanie bodźców z unerwienia trzewnego (np. rozciągania odbytnicy) i prawidłowa rozciągliwość (podatność) ściany odbytnicy umożliwiają właściwe gromadzenie i sprawne wydalanie mas kałowych, zaś fizjologiczne reakcje skurczowo-rozkurczowe zwieracza w odpowiedzi na rozciąganie – odruch odbytniczo-odbytowy ( rectoanal reflex, RAIR) – stanowią o utrzymaniu prawidłowej koordynacji odbytniczo-odbytowej (37). Celami badań czucia wisceralnego są: ocena napięcia ściany jelita (jej tonusu lub elastyczności), wyznaczenie progów czucia trzewnego oraz obliczenie podatności ( compliance) badanego narządu, np. odbytnicy lub okrężnicy (36). Do badań tych służy zwykle cewnik zaopatrzony na końcu w cienkościenny, plastikowy (lub lateksowy) balon, połączony z urządzeniem pompującym powietrze i rejestratorem ciśnień. Współcześnie stosuje się specjalne urządzenia, tzw. barostaty (wisceralne stymulatory), które posiadają na stałe wbudowane pompy umożliwiające kontrolowane, automatyczne pompowanie powietrza do balonu pod stałym ciśnieniem lub ze stałą objętością i precyzyjnie rejestrujące zmiany ciśnień oraz objętości w odpowiedzi na rozciąganie balonu (36). Badanie konieczne w każdym przypadku nietrzymania i zaparć, szczególnie w zaburzeniach funkcji rezerwuarowej odbytnicy.
4. Centralna i obwodowa stymulacja magnetyczna. Metodę tę stosują tylko nieliczne ośrodki, jak dotychczas głównie w celach badawczych. Polega ona na stymulowaniu wybranych ośrodków kory mózgu lub rdzenia kręgowego impulsami elektromagnetycznymi, co wywołuje skurcze wybranych grup mięśniowych. Celem badania jest wykluczenie uszkodzenia centralnych ośrodków lub nerwowych dróg przewodzących odpowiedzialnych za prawidłową kontrolę defekacji (36).
5. Ocena czucia odbytowo-odbytniczego temperatury. Technikę badania oraz jej wartość kliniczną opisał Chan i wsp. (96). Badanie progów czucia w zakresie odbytu i odbytnicy w odpowiedzi na stymulację podwyższoną temperaturą wykonuje się przy użyciu specjalnie zaprojektowanej sondy. Pacjent ułożony jest w pozycji kolankowo-łokciowej. Sondę wprowadza się badając czucie w kolejnych kwadrantach i na kilku poziomach (2 cm od brzegu odbytu poniżej linii zębatej oraz 1 i 3 cm ponad nią). Czucie temperatury określa się w zakresie temperatur pomiędzy 40 i 60°C. Rozpoczynając badanie, czucie określa się przez 10 sekund przy 40, 50 i 60 °C. Jeśli próg czucia jest wyższy to stopniowo podwyższa się temperaturę sondy. Czucie temperatury zarówno w odbycie, jak i w odbytnicy wzrasta liniowo od 40 do 60°C. Wykazano znaczenie diagnostyczne pierwszego progu czucia. W celu bezpieczeństwa badania choremu podaje się przycisk bezpieczeństwa odcinający zasilanie od sondy. Próba dyskryminacji pomiędzy stymulacją mechaniczną balonem i temperaturową jest zaślepiona dla pacjenta. Badanie wykonywane jest w każdym kwadrancie i powtarzane dwukrotnie.
6. Ocena czucia odbytowo-odbytniczego stymulacji elektrycznej. W 1996 roku Meagher i wsp. opisali metodykę badania czucia odbytowo-obytniczego stymulacji elektrycznej (97). Badanie jest wykonywane przy użyciu elektrody bipolarnej platynowej o rozstawie 5 mm osadzonej na cewniku poliwinylowym średnicy 4 mm z podziałką centymetrową. Generator prądu stałego dostarcza impulsy o czasie trwania 0,1 ms z częstotliwością 5 Hz. W trakcie badania stopniowo wzrasta natężenie prądu co 1 mA aż do pierwszego progu czucia. Test wykonywany jest w czterech kwadrantach poczynając od wysokości 8 cm do 1 cm od brzegu odbytu, przesuwając się co 1 cm.
7. Morfologia czynnościowa i komórki Cajala (ICC). Strukturalna ocena budowy ściany odbytnicy i zwieracza wewnętrznego może mieć istotne znaczenie dla dalszego doboru właściwej procedury leczniczej. Dla oceny ICC konieczne jest pobranie biopsji gruboigłowej. Oznaczenia dokonuje się przy pomocy przeciwciał monoklonalnych anty-CD117 i poliklonalnych anty-c-kit. Najczęściej stosowane jest klasyczne barwienie DAB. Ocena ilościowa w przeliczeniu na pole widzenia dokonywana w mikroskopie optycznym przy powiększeniu 125 razy.
Ocena stopnia zaawansowania objawów NS wg wybranej skali (np. FISI) oraz przeprowadzone badania obrazowe (TAUS) i czynnościowe (manometria) umożliwiają szczegółowe określenie przyczyny nietrzymania stolca. Stanowi to podstawę do podjęcia właściwego leczenia i rehabilitacji.
Leczenie zachowawcze
Postępowanie lecznicze zależy od przyczyny i stopnia nietrzymania stolca. Efekty leczenia zależą w dużej mierze od prawidłowej kwalifikacji, doboru metody leczenia oraz sposobu jego wykonania. Do tej pory brak było jednolitych wytycznych kwalifikacji do leczenia, jak i przyjętych modeli terapeutycznych. Bazując na kilkuletnim doświadczeniu własnym oraz wytycznych powstałych dzięki współpracy pomiędzy ośrodkami w Europie i USA sformułowano ramowe algorytmy postępowania. Zasadą jest wykorzystanie wszystkich możliwych zachowawczych metod leczenia, zanim zapadnie decyzja o leczeniu operacyjnym. Nie dotyczy to wczesnej (do 24 godzin) plastyki zwieraczy uszkodzonych w trakcie porodu (5).
Do zachowawczych metod leczenia nietrzymania stolca zaliczamy:
1. Zmianę przyzwyczajeń dietetycznych. Ma ona szczególne znaczenie, gdy przyczyną nietrzymania są biegunki lub przewlekłe zaparcia. Modyfikacja diety w znacznym stopniu zmniejsza nasilenie objawów.
2. Środki farmakologiczne. Do najczęściej stosowanych należy loperamid (poza tym, że ma hamujący wpływ na motorykę jelita, podwyższa też ciśnienie w kanale odbytu). Także opiaty (kodeina), difenoksylat, metoksamina i amitryptylina znajdują zastosowanie jako leczenie wspomagające. Z kolei Carapeti donosi o korzystnym działaniu fenylefryny w nietrzymaniu stolca (38).
3. Zabiegi higieniczne i pielęgnacyjne. Regularnie wykonywane wlewy oczyszczające opróżniają odbytnicę z zalegającego stolca i zmniejszają objawy NS. Także odpowiednio stosowane tampony – jako mechaniczne zapory – ograniczają ucieczkę stolca. Jednocześnie właściwa higiena, stosowanie dostępnych środków pielęgnacyjnych zmniejszają skutki działania stolca i wydzieliny na skórę okolicy okołoodbytniczej.
Środki zachowawcze skutecznie ograniczają objawy nietrzymania stolca u około 20% chorych. Pozostała grupa wymaga działań bardziej inwazyjnych.
Pacjenci bez defektu zwieraczy oraz osoby, u których ubytek nie przekracza 1/4 obwodu, przy zachowanym obwodowym unerwieniu kwalifikują się do leczenia metodą treningu behawioralnego popularnie zwanego biofeedback ( BF) (39, 40).
Biofeedback jest formą warunkowania instrumentalnego, „uczenia przez wzmocnienie”, którego podstawy teoretyczne przedstawił Skinner. Typowa, oparta na schemacie Schustera terapia BF w leczeniu nietrzymania stolca odbywa się z zastosowaniem sondy balonowej umieszczonej w odbytnicy, pozwalającej na rejestrowanie zmian ciśnienia ścian odbytnicy podczas jej rozciągania i jednoczesny pomiar ciśnień w kanale odbytu (39). Chory, obserwując wykres na monitorze, kontroluje poprawność wykonanego ćwiczenia. Wraz z postępem techniki unowocześniono aparaturę do wykonywania ćwiczeń. Obecnie stosuje się aparaty rejestrujące zapis EMG – elektroda umieszczona w kanale odbytu rejestruje aktywność elektryczną kompleksu zwieraczy odbytu podczas skurczu. O sile i poprawności skurczu świadczą ilość i kolor zapalanych diod świetlnych lub głośność towarzyszącego temu sygnału akustycznego (ryc. 8). Powtarzanie ćwiczeń kilka razy dziennie (2-4 przez okres 15 minut) w różnych ułożeniach ciała po kilku miesiącach skutkuje zwiększeniem siły skurczu dowolnego, a także podstawowego napięcia kompleksu zwieraczy odbytu.
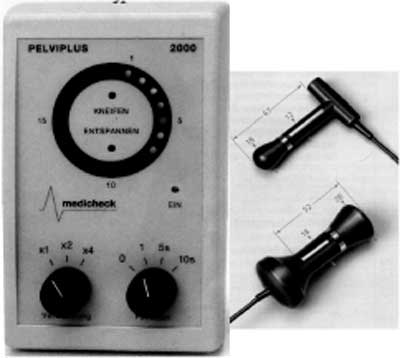 Ryc. 8. Zestaw do treningu metodą behawioralną – biofeedback trening (Medicheck, Niemcy).
Z myślą o chorych z upośledzeniem czucia w zakresie ściany odbytnicy czy okolicy pararektalnej jako przyczyny nietrzymania stolca opracowano alternatywną formę treningu behawioralnego – trening sensoryczny. Powtarzanie ćwiczeń z umieszczonym w bańce odbytnicy balonem napełnianym określoną, stopniowo modyfikowaną objętością pozwala u ponad połowy tych pacjentów ograniczyć nasilenie objawów nietrzymania.
Przekazany przez aparat sygnał świetlny lub akustyczny zamyka pętle sprzężenia zwrotnego, dzięki czemu pacjent kontroluje zmiany zachodzące w obrębie narządu, skąd rejestrowany jest rzeczony sygnał. Czując rozciąganie odbytnicy i jednocześnie widząc zapis wskazujący na wzrost ciśnienia w jej obrębie, chory w sposób wolicjonalny powoduje zaciskanie zewnętrznego zwieracza odbytu. W ten sposób dochodzi do wytworzenia mechanizmu odruchowego. W programie terapii przewidziano serię (np. tygodniowych) sesji treningowych, zazwyczaj prowadzonych trybem ambulatoryjnym. Każda z sesji trwa 45-60 minut, podczas których pacjent wykonuje 50-100 prób zaciskania zwieracza. Chory zachęcany jest do wykonywania ćwiczeń w warunkach domowych. Skuteczność tej metody w zależności od źródła wynosi od 50 do 80% (39-41).
W przypadku obniżonej wydolności skurczowej i upośledzonego obwodowego unerwienia kompleksu zwieraczy, w zakresie którego nie stwierdzono ubytków morfologicznych, efektywną metodą terapii może okazać się przezodbytowa elektrostymulacja ( ES) (42).
Metoda ta stosowana jest oddzielnie (w systemie domowym lub ambulatoryjnym) lub jako uzupełnienie treningu behawioralnego. Specjalnie skonstruowaną elektrodę umieszcza się w kanale odbytu. Podręczny generator przekazuje impuls – dobrany pod względem częstotliwości, natężenia i amplitudy – do elektrody. Następuje skurcz stymulowanych zwieraczy. Terapię przeprowadza się w okresie od kilku do kilkunastu miesięcy (42).
W ośrodku autorów stosowane są obie metody leczenia. Zarówno biofeedback trening, jak i elektrostymulacja znamiennie poprawiają siłę skurczową zwieraczy, zmniejszając objawy nietrzymania stolca. Celem prowadzenia BF korzystaliśmy z zestawów rejestrujących zapis elektryczny aktywności skurczowej produkowanych przez firmę Medicheck (Niemcy) (ryc. 9). Elektrostymulację przeprowadzono zestawem STM1 produkowanym przez niemiecką firmę Schwa-medico (ryc. 9).
 Ryc. 9. Zestaw do elektrostymulacji przezodbytowej (Schwa-medico, Niemcy).
W analizie wyników wykorzystano kwestionariusz Jorge-Wexnera i/lub skalę Holschneidera (samoocena chorych) oraz rezultaty badań manometrycznych wykonanych przed leczeniem, 6 i 12 miesięcy po rozpoczęciu leczenia. Szczególną grupą poddaną elektrostymulacji byli chorzy, u których wykonano graciloplastykę bez wszczepienia stymulatora (ze względów ekonomicznych – brak refundacji przez NFZ). Chorzy ci, poddani ciągłej stymulacji, uzyskiwali dobre efekty czynnościowe. Szczegółowy opis metod zastosowanych w materiale własnym, charakterystykę pacjentów oraz efekty leczenia BF i elektrostymulacją przedstawiono w odrębnych publikacjach (18, 19, 42).
Leczenie zabiegowe
U około 20-30% chorych z objawami nietrzymania stolca leczenie technikami nieoperacyjnymi nie przynosi oczekiwanej poprawy. Według zaleceń IFFGD kwalifikują się oni do leczenia operacyjnego – zawsze po przynajmniej 6-miesięcznej intensywnej terapii zachowawczej (BF, ES) (5).
Typ i zakres postępowania chirurgicznego zależą od tego, czy przyczyną utraty kontroli defekacji jest wrodzony brak czy nabyte uszkodzenie zwieraczy, uszkodzenie ich unerwienia czy też powstałe zmiany czynnościowe w zakresie odbytnicy i odbytu – wgłobienie rektorektalne, rectocele, wypadanie odbytnicy (43). Leczenie zabiegowe nietrzymania stolca wynikłego ze schorzeń układowych (SM, polineuropatii cukrzycowej) było do tej pory przeciwwskazane, niemniej ostatnie doniesienia zalecają stosowanie u tych chorych sztucznych protez zwieraczy – artificial bowel sphincter (ABS) (44).
W zależności od przyczyn NS, ich nasilenia oraz możliwości i doświadczenia chirurga wykonywane są następujące typy zabiegów chirurgicznych:
– plastyka i zabiegi rekonstrukcyjne zwieraczy;
– zabiegi resekcyjne (gdy współistnieje wypadanie odbytnicy czy wgłobienie);
– kombinacja zabiegów resekcyjnych i plastyki krocza (przedni uchyłek odbytnicy oraz wgłobienie czy wydłużona esica);
– wykonanie zwieraczy zastępczych z przemieszczonych mięśni własnych prążkowanych – graciloplastyka, gluteoplastyka (GP) lub gładkich – zwieracz mioplastyczny wg Schmidta;
– stymulowane zwieracze zastępcze – graciloplastyka lub gluteoplastyka dynamiczna (DGP);
– całkowite rekonstrukcje krocza ( total anorectal reconstruction, TAR);
– implantacja zwieraczy zastępczych – protezy hydrauliczne (AMS 800);
– implantacja w strefę zwieraczy kolagenu, silikonu, mikrosfer karbonowych, autologicznego tłuszczu;
– działanie fal radiowych na uszkodzone zwieracze – radiofrequency sphincter remodeling (zabieg Secci);
– zabiegi umożliwiające systematyczne płukanie światła okrężnicy ( appendicostomy, colonic conduit);
– kolostomia.
Plastyczna rekonstrukcja zwieraczy
U chorych z przerwaną ciągłością zwieraczy, u których ubytek nie przekracza 1/3 obwodu, i zachowanym ich unerwieniem, postępowaniem z wyboru jest rekonstrukcja zwieraczy. Stosuje się zarówno proste zeszycie zwieraczy koniec do końca, jak i modyfikację „plastyka na zakładkę” – overlapping sphincter repair. Zabiegi te przeprowadza się głównie u kobiet z poporodowym uszkodzeniem zwieraczy, u których defekt dotyczy najczęściej przedniej ściany zwieracza. Wydaje się, iż w przypadku okołoporodowego uszkodzenia zwieraczy przewagę mają zabiegi doraźne, wykonywane nie później niż 12 godzin po uszkodzeniu. Jak dowodzą niektórzy autorzy, znamiennie lepsze wyniki uzyskiwano, gdy operacje były wykonywane przez chirurgów z doświadczeniem w chirurgii kolorektalnej. Także ubytki zwieracza (poniżej 1/3 obwodu) powstałe wskutek urazów jatrogennych, wypadków komunikacyjnych, gwałtu lub praktyk seksualnych kwalifikują się do tego typu rekonstrukcji (5, 45). Proste zeszycie zwieraczy koniec do końca ustępuje obecnie „plastyce na zakładkę” (47).
Technika tego zabiegu została szczegółowo opisana przez Slade´a w 1977 roku ( overlapping sphincteroplasty) (48). Zabieg jest przeprowadzany w znieczuleniu ogólnym, w ułożeniu ginekologicznym i nie wymaga całkowitego oczyszczenia jelita grubego (płukanie). Cięciem łukowatym ponad brzegiem odbytu odsłania się brzegi uszkodzonego zwieracza wewnętrznego i zewnętrznego. Następnie po odpreparowaniu i uwolnieniu kikutów zwieraczy zeszywa się je szwami niewchłanialnymi lub z długim okresem podtrzymywania tkankowego, zakładając wolne brzegi jeden na drugi – „na zakładkę” (ryc. 10). Niekiedy zabieg łączy się z plastyką ciała kroczowego. Warunkami powodzenia plastyki zwieraczy są właściwa kwalifikacja chorych oraz doświadczenie wykonującego zabieg.
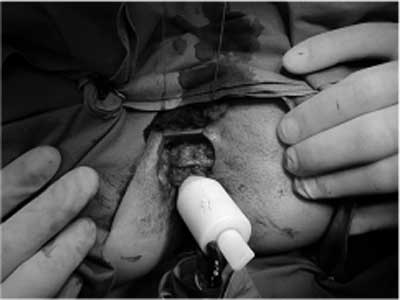 Ryc. 10. Plastyka zwieraczy – overlapping. Prawidłowość wykonanego zabiegu kontrolowana podręczną sondą manometryczną (A.M.I.) (materiał własny).
W 2002 roku w materiale obejmującym kobiety z poporodowym uszkodzeniem zwieraczy, u których wykonano plastykę zwieracza „na zakładkę” – overlapping sphincteroplasty, skuteczność tego zabiegu przy zachowaniu wszystkich kryteriów kwalifikacji i techniki zabiegu sięgała 60-65% (48-50). Z kolei Halverson i Hull wykazali w swych badaniach, iż 12 miesięcy po zabiegu aż 54% chorych nie potrafi w pełni kontrolować wydalania stolca i gazów, a tylko 14% w pełni kontroluje defekację (51). Tylko 34% operowanych chorych wskazało na znaczną poprawę jakości życia w skali Fecal Incontinence Quality of Life i odsetek ten zmniejsza się wraz z upływem czasu od zabiegu. Bazując na wynikach niekontrolowanych badań dotyczących chorych po przebytej bocznej sfinkterotomii z objawowym nietrzymaniem stolca, porównujących opisane metody plastyki zwieraczy i dna miednicy, nie zauważono istotnych statystycznie różnic między metodami (52).
W ośrodku autorów preferujemy zabiegi plastyczne zwieraczy techniką „na zakładkę” – overlapping sphincteroplasty.
Tighe i Taylor (UK) podkreślają znaczenie wczesnej rekonstrukcji (do 12 godzin od urazu) zwieraczy po urazie okołoporodowym. Strukturalny defekt zwieraczy dotyczy nawet 65% kobiet po porodzie, a 50% z nich wymaga wczesnej rekonstrukcji ( primary sphincter repair), która powinna być wykonana przy współudziale chirurga proktologa. Postępowanie to zapobiega objawom inkontynencji u prawie 90% chorych (46).
W 1975 roku Parks opisał technikę tylnej „naprawy” zwieraczy ( postanal repair, PAR), która polega na odnóg mięśnia łonowo-odbytniczego do tyłu od zwieraczy (53). Ponieważ założeniem zabiegu jest uzyskanie zbliżonego do fizjologicznego kąta odbytniczo-odbytowego ( anorectal angle, ARA) – tym samym poprawa wydolności mechanizmu zaporowego kompleksu zwieraczy – może on być wykonany jedynie w przypadku, gdy zarówno zwieracze, jak i mięsień łonowo-odbytniczy nie są mechanicznie uszkodzone. Mimo iż jeszcze kilka lat temu tylna plastyka była postępowaniem z wyboru, obecnie zabieg ten jest rzadko wykonywany (w sytuacji, gdy żaden inny typ plastyki nie wchodzi w rachubę) (54). Przy właściwie dobranej grupie chorych dobre i bardzo dobre wyniki leczenia uzyskuje się u 40-50% operowanych. Niestety, w zgodnej opinii autorów 2-3 lata po zabiegu następuje znaczne pogorszenie stanu chorych. Dotyczy to zarówno progresji objawów nietrzymania (FISS), jak i jakości życia (FIQL)(55).
Niewiele lepsze rezultaty leczenia, zwłaszcza w okresie odległym, dotyczą kombinacji tylnej rekonstrukcji (PAR) i przedniej plastyki dźwigaczy odbytu ( anterior levatorplasty, AL) (56). Także zabieg określany jako całkowita rekonstrukcja dna miednicy ( total pelvic floor repair), stanowiący połączenie plastyki przedniej z rekonstrukcją tylną, nie cieszy się w USA specjalną popularnością, a wyniki badań czynnościowych wskazują, iż efektem ich wykonania jest jedynie mechaniczna obstrukcja światła jelita (57).
Mimo iż dziś zabieg zwężania ujścia odbytu poprzez założenie przewiązki z drutu czy innego materiału obcego – zabieg Thierscha – ma znaczenie jedynie historyczne, nie można o nim zapominać. Niekiedy jeszcze wykonywany w oryginalnej wersji, stał się wzorem dla nowoczesnych technik operacyjnych. Przeprowadzony wokół zwieraczy drut powodował odczyn zapalny, a następnie zbliznowacenie. Obecnie podobny efekt, jednakże przy zachowanej kontroli zakresu, uzyskujemy poprzez działanie energii wysokiej częstotliwości fal ( radiofrequency energy – Secca procedure). Postępowanie to określane jest jako „remodeling” tkanki mięśniowej i włóknistej, a jego efektem jest obkurczenie włókien kolagenu (blizny) i poprawa mechanicznej wydolności aparatu zaporowego zwieraczy (58). W dwuletniej obserwacji chorych leczonych w ten sposób wykazano znamienną poprawę zarówno kontroli defekacji, jak i jakości życia (59). Jako modyfikację zabiegu Thierscha stosuje się wszczepy opasek dakronowych (pokrytych silikonem) wokół odbytu, niemniej wyniki i efekty uboczne tej metody są dalekie od satysfakcjonujących.
Rektopeksja i zabiegi resekcyjne
NS to problem ponad 30-40% chorych z uchyłkiem odbytnicy, wgłobieniem odbytniczo-odbytowym czy odbytniczo-odbytniczym ( intussusception) (60). W takiej sytuacji zabieg operacyjny ma na celu przede wszystkim usunięcie przyczyny, czyli wycięcie zmienionego odcinka esicy czy odbytnicy uzupełnione podwieszeniem odbytnicy metodą Ripsteina czy Goldberga (61, 62). Cirocco i wsp. już w 1993 roku donosili, iż wyniki samej tylko rektopeksji nie są zadowalające.
Podobnie jak większość autorów Aitola i wsp. uważają, że wypadanie odbytnicy ( prolapsus recti) stanowi wskazanie do wycięcia wypadającego odcinka jelita z zespoleniem w zależności od poziomu progu wypadania. Uzupełnieniem zabiegu jest rekonstrukcja dna miednicy małej. W obserwacji odległej dobre i bardzo dobre wyniki wykazano w 52% przypadków (63).
W roku 1889 Mikulicz opisał przezkroczowe wycięcie odbytnicy z powodu wypadania (64). Patogenezę wypadania odbytnicy przedstawił w 1912 roku Moschcowitz (65), niemniej jednak dopiero Nicholls w 1989, Barham w 1993 i Jackson i wsp. w 1997 roku zwrócili uwagę, iż u chorych po histerektomii znamiennie częściej obserwuje się objawy nietrzymania stolca i moczu związane z wypadaniem odbytnicy oraz pochwy. Większość kobiet zgłasza jednocześnie objawy nietrzymania moczu związane z upośledzeniem przegrody moczowo-płciowej.
W 1990 roku Sullivan opisał zespół wypadania wielu organów miednicy mniejszej ( tetralogy of fall-out) (66, 67), zwracając tym samym uwagę na konieczność prowadzenia kompleksowego leczenia ginekologiczno-proktologicznego – sugerował jednoczasowe zabiegi naprawcze z udziałem obu zespołów i rekonstrukcją miednicy z użyciem siatki (67).
W 2002 roku Collopy i Barham przedstawili wyniki kompleksowego zabiegu kolporektopeksji i rekonstrukcji miednicy z użyciem siatki dakronowej ( colporectopexy and pelvic „cul-de-sac repair”). W okresie obserwacji średnio 56 miesięcy uzyskano znamienną poprawę kontroli oddawania stolca i moczu u ponad połowy chorych (68).
Wytyczne IFFGD z 2002 jednoznacznie wskazują, że „plastyka zwieraczy odbytu z lub bez zabiegów naprawczych dna miednicy jest postępowaniem z wyboru w przypadku, gdy przyczynę nietrzymania stanowi określony (możliwy do naprawienia, obejmujący nie więcej niż 1/3 obwodu) defekt zwieraczy, bez neurologicznych ubytków”. Postępowanie to jest efektywne w 68% przypadków (5).
Przedstawione powyżej metody leczenia – biofeedback, elektrostymulacja, proste zabiegi naprawcze stanowią pierwszy etap w leczeniu NS. W sytuacji gdy działania te nie przynoszą spodziewanych rezultatów – poprawa po prawidłowo przeprowadzonym leczeniu i rehabilitacji nie następuje, należy rozważyć wykonanie „zabiegów ratujących – ostatniego kroku”. Ostatnio operacje te, zarezerwowane dotychczas dla chorych z krańcowymi stadiami NS ( end-stage faecal incontinence), przeprowadza się także u chorych z niepełnymi objawami NS, u których leczenie zachowawcze nie dało oczekiwanych efektów.
Transpozycja mięśni własnych (gluteoplastyka, graciloplastyka, graciloplastyka dynamiczna)
W latach trzydziestych dwudziestego wieku Devesa zaproponował zastąpienie niewydolnych zwieraczy z przemieszczonych mięśni pośladkowych – jedno- lub dwustronnie. Zabiegi te są wykonywane do dziś w niektórych ośrodkach, jednak ze względu na nienajlepsze odległe wyniki nie należą do popularnych(69).
Złe wyniki odległe transpozycji mięśni szkieletowych wynikają głównie z ich odmiennej od zwieraczy budowy morfologicznej, niezapewniającej ciągłego tonicznego skurczu. Mięśnie szkieletowe zbudowane są głównie z mięśni szybko i mocno kurczących się typu II, niemniej także szybko męczących się. Badania morfologiczne dowiodły, iż mięsień smukły uda najbardziej przypomina budową morfologiczną zwieracze odbytu. W latach 50. Pickrell opisał metodę transpozycji mięśnia smukłego w okolicę krocza celem leczenia nietrzymania stolca (70). Początkowego entuzjazmu Pickrella nie podzielał Corman, w którego badaniach poprawę zgłaszało jedynie 50% operowanych. Zdecydowanie złe wyniki uzyskali Yoshioki i Keighley. Jak się okazało, także i ten mięsień nie potrafi utrzymać dłuższego skurczu. Metodę Pickrella próbował usprawnić Dixon, stosując czasową stymulację mięśnia wszczepioną elektrodą. Zabiegi technicznie zmodyfikowane z dobrym efektem przeprowadzili również Cavina i Seccia (71). W 1981 roku Cor Baeten zaproponował metodę ciągłej stymulacji mięśnia smukłego, zakładając jego stopniową przebudowę. Zabieg nazwano dynamiczną graciloplastyką (ryc. 11). Wobec obiecujących wyników operacji w latach następnych położono nacisk na doskonalenie systemów stymulujących. Zastosowano implantowane, nowoczesne elektrostymulatory wzorowane na rozrusznikach używanych do stymulacji mięśnia sercowego (firma Medtronic) (72, 73).
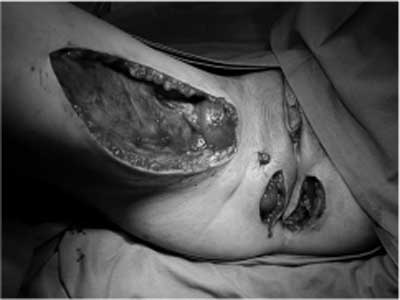 Ryc. 11. Zabieg transpozycji mięśnia smukłego (graciloplastyka). Widoczna rana udowa z odpreparowanym, odciętym i przemieszczonym w okolicę okołoodbytową końcem dystalnym mięśnia smukłego (materiał własny).
Stosowany jako zwieracz zastępczy mięsień smukły ( m. gracilis) uwalnia się, począwszy od jego przyczepu obwodowego, a następnie przeprowadza przez tunel wypreparowany wokół odbytu i mocuje do przeciwstronnego guza kulszowego lub skóry. W nowszej modyfikacji dynamicznej graciloplastyki (DGP) do mięśnia smukłego wszczepia się elektrody stymulujące. Zabieg składa się z dwóch etapów i polega na uwolnieniu mięśnia smukłego z zachowaniem pęczka naczyniowo-nerwowego oraz wykonaniu graciloplastyki w sposób opisany powyżej. Kolejnym krokiem jest wszczepienie do mięśnia elektrody oraz rozrusznika pod skórę brzucha. Przez następne 4-6 tygodni stymuluje się mięsień, stosując wzrastającą częstotliwość i czas trwania pobudzeń wywołujących skurcz. Stymulacja ta powoduje konwersję włókien mięśniowych typu II (łatwo męczliwe) we włókna typu I (mniej męczliwe, dłużej utrzymują skurcz). Następnie zmienia się program stymulacji, używając do tego celu specjalnej konsoli programującej, i utrzymuje wymagany stały poziom stymulacji. W momencie defekacji wyłącza się stymulator (służy do tego zewnętrzny pilot), dzięki czemu wytworzony na nowo zwieracz rozkurcza się, umożliwiając wypróżnienie. Obecnie żyje kilkuset chorych, u których wykonano ten typ zabiegu (w różnych modyfikacjach), a ich wyniki są na tyle zachęcające (70% wyników bardzo dobrych), iż w niektórych krajach (Holandia, Austria) metoda ta zyskała rekomendację firm ubezpieczeniowych. Obecnie powszechnie stosuje się elektrody implantowane do mięśnia smukłego w okolicy wiązki nerwowo-naczyniowej (a nie, jak to proponował Williams, bezpośrednio na nerw). Do powszechnego użycia weszły programowane zewnętrznie (przy użyciu fal radiowych) implantowane stymulatory firmy Medtronic, o przedłużonej żywotności baterii (do 10 lat). Jakkolwiek koszty stymulatora, osprzętu i całego zabiegu są nadal duże (10-15 tysięcy dolarów), to jednak efektywność takiego postępowania, a przede wszystkim fakt całkowitego powrotu do pełnej aktywności społecznej i zawodowej chorych sprawiają, iż zyskuje ono coraz większą popularność (74, 75).
Doświadczenia własne w tym zakresie wskazują, iż są możliwe całkowity i pełny powrót funkcji zwieraczowych oraz rzeczywista kontrola nad wydalaniem stolca w przypadku chorych po znacznych, rozległych uszkodzeniach zwieraczy (w wyniku urazu, gwałtu lub zmian jatrogennych), tj. w przypadkach, gdzie wykonanie konwencjonalnego zabiegu chirurgicznego jest wykluczone bądź nie dał on oczekiwanego rezultatu (76, 77). Wprawdzie prawdopodobieństwo wystąpienia powikłań (takich jak zakażenie tkanek krocza, zakażenie rany, uszkodzenia elektrod bądź zaleganie stolca) po zabiegach przemieszczenia mięśni jest duże, to jednak bez wątpienia ostateczne korzyści kliniczne przeważają nad niedogodnościami związanymi z leczeniem i rehabilitacją tych chorych (78).
Dynamiczną graciloplastykę stosuje się także u chorych po brzuszno-kroczowym odjęciu odbytnicy z powodu nowotworu, jako element zabiegu całkowitej rekonstrukcji anorektalnej (TAR). Operacja polega na wytworzeniu kolostomii kroczowej, a następnie uformowaniu zastępczego zwieracza przy zastosowaniu DGP – jedno- lub dwustronnej (71, 79). U około 66% pacjentów uzyskuje się zadowalające wyniki czynnościowe. Jeżeli szczegółowo przeanalizujemy jakość życia chorych operowanych z powodu raka odbytnicy oraz aktualne możliwości terapeutyczne, musimy zadać sobie pytanie o zasadność wykonywania definitywnej kolostomii brzusznej u chorych z niskim rakiem odbytnicy. Niektórzy autorzy są zdania, iż w elektywnej chirurgii nowotworów odbytnicy u wszystkich chorych można uniknąć definitywnej kolostomii, a przez to znacznie poprawić ich jakość życia (80).
Sztuczny zwieracz odbytu – proteza hydrauliczna (ABS)
W leczeniu NS równie chętnie jak zwieracze wytworzone z mięśni szkieletowych stosuje się zwieracze sztuczne, szczególnie zwieracz zastępczy – ABS artificial bowel sphincter (American Medical Systems). Jest to sztuczna, silikonowa, implantowana na stałe proteza hydrauliczna, spełniająca funkcję zwieracza, będąca modyfikacją sztucznego zwieracza pęcherza moczowego. W skład systemu wchodzi balon i podskórny zbiornik umieszczany w mosznie lub wargach sromowych. Silikonowy mankiet (sztuczny zwieracz) umieszcza się wokół kanału odbytu (ryc. 12). Przed defekacją wypompowuje się z niego płyn do zbiornika wyrównującego, co umożliwia oddanie stolca. Pomimo dość częstych powikłań zabiegu jego popularność rośnie. Wykazano skuteczność tego typu zabiegu sięgającą 60-70%. Opublikowano rezultaty pierwszych wieloośrodkowych, kontrolowanych badań klinicznych oceniających bezpieczeństwo i skuteczność zastosowania nowoczesnej odmiany sztucznego zwieracza – Acticon Neosphincter (AMS, Minneapolis), odmiany hydraulicznej protezy zwieracza odbytu w leczeniu NS (81, 82). Badaniami objęto 112 chorych, którym wszczepiono protezę zwieracza – u 37% pacjentów trzeba było usunąć wszczepiony implant zwieracza, a u 46 wystąpiły powikłania związane z zabiegiem. Niemniej jednak w grupie osób, u których proteza funkcjonowała poprawnie, znamienną poprawę zgłaszało aż 85% leczonych. Autorzy konkludują, że chociaż chorobowość związana z wszczepieniem protezy jest wysoka, zabieg ten może znamiennie poprawić kontrolę wydalania stolca, a co za tym idzie jakość życia chorych. Wydaje się, iż wysoka liczba powikłań po wszczepieniu protezy, a przez to koniecznych ich eksplantacji, wynika po części z małego doświadczenia niektórych z 25 uczestników badania (83). Tezę tę zdają się potwierdzać wyniki operacyjnego leczenia chorych z NS przy zastosowaniu sztucznego zwieracza w ośrodku hiszpańskim. Spośród 53 chorych operowanych przez jednego doświadczonego chirurga (J.M. Devesa) usunięcia protezy wymagało jedynie 19% pacjentów, a zdolność kontroli wydalania stolca uzyskało 65% badanych. Ciekawe, że jedynie 60% chorych z utrzymanym implantem stale stosowało pompę aktywującą funkcję kompresyjną mankietu (84).
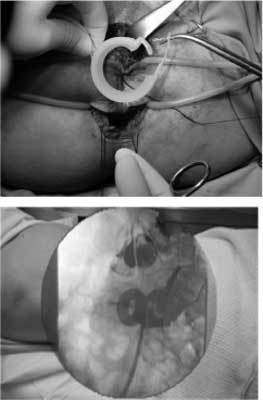 Ryc. 12. Zwieracz zastępczy ABS (materiał własny). Zwieracz jelitowy w polu operacyjnym (A) oraz na zdjęciu radiologicznym (B).
Sztuczny zwieracz jelitowy – kontrola oddawania stolca przez anus brzuszny
Mimo doskonalonych z roku na rok technik operacyjnych wciąż przybywa chorych, u których z rozmaitych powodów wykonano sztuczny odbyt brzuszny. Niestety, nawet perfekcyjnie wykonana stomia to znaczne kalectwo związane nie tylko z samą obecnością przetoki, ale także z utratą kontroli wydalania stolca i gazów oraz zmianą sposobu postrzegnia własnego ciała. Ponadto ponad 40% stomii, mimo optymalnego doboru jej zaopatrzenia sprawia obiektywne problemy z nieszczelnością i przeciekiem treści jelitowej poza worek stomijny.
Przed dziesięciu laty Herman i wsp. wprowadzili do praktyki klinicznej zabiegi sztucznego odbytu myoplastycznego u chorych po amputacji odbytnicy z powodu raka, także w zastosowaniu do przetoki na brzuchu. Wytworzony z mięśniówki gładkiej mankiet zastępował zwieracz znacznie poprawiając funkcjonowanie stomii, jednak także nie dawał możliwości dowolnej kontroli wypróżnienia.
Jak wyżej wspomniano w minionych latach nastąpił wzrost zainteresowania sztuczną, hydrauliczną protezą zwieracza odbytu, zwanym sztucznym zwieraczem jelitowym (ABS – Artifitial Bowel Sphincter). Jego budowę opisano powyżej. Istotnym elementem systemu jest zaworek oraz port kalibracyjny.
Założenie wokół ujścia stomii sztucznego zwieracza jelitowego pozwala na kontrolowane oddawanie stolca i gazów. Ideę tą wprowadził Szinicz w 1980 roku. Opisał on „system zamykający sztuczny odbyt”, hydrauliczną protezę, którą wszczepiał psom. W 1987 roku Christiansen i Lorentzen przystosował do leczenia nietrzymania stolca, opisaną przez Scotta i wsp. w 1973 roku metodę wszczepienia sztucznego zwieracza (American Medical System – AMS 800) w leczeniu nietrzymania moczu. Obecnie zabieg ten jest wykonywany w kilkunastu ośrodkach w USA, Australii i w Europie (98, 99, 100).
A.M.I. Soft Anal Band jest modyfikacją protezy AMS. W latach 70 i 80 zaproponowano też inne metody wytwarzania zwieraczy stomii jak system magnetyczny czy też zwieracz myoplastyczny. Pomimo dość wysokich kosztów protezy implantacja sztucznego zwieracza stomii jelitowych stanowić może skuteczną metodę poprawy jakości życia chorych z definitywnym sztucznym odbytem brzusznym.
Transsakralna elektrostymulacja korzeni krzyżowych (SNS)
Także inny typ leczenia NS zyskuje coraz większą popularność, szczególnie u chorych po uszkodzeniach rdzenia kręgowego, w przypadku których przyczyną nietrzymania stolca jest uszkodzenie dróg nerwowych rdzenia, a nie zwieraczy czy nerwu sromowego. Zastosowanie trwałej transsakralnej elektrostymulacji (TS), przy użyciu odpowiednich, implantowanych na stałe (przez otwory kości krzyżowej) elektrod połączonych z wszczepionym pod skórę stymulatorem sterowanym zewnętrznie (taki sam jak w dynamicznej graciloplastyce), umożliwia uzyskanie częściowej, a w niektórych przypadkach nawet pełnej kontroli nad oddawaniem stolca. Doświadczenia Matzela i Rosena wskazują, że odpowiednia stymulacja korzonków S3, S4 pozwala na osiągnięcie zadowalających wyników czynnościowych u chorych z nietrzymaniem stolca w wyniku uszkodzenia rdzenia (85, 86). Metoda zdobywa coraz większe uznanie, a jej atrakcyjność dodatkowo zwiększa możliwość zminimalizowania urazu podczas implantacji elektrod (87, 88).
Sporą nadzieję budzą także zabiegi, co prawda wciąż jeszcze w fazie doświadczeń na zwierzętach, polegające na zespoleniu nerwu sromowego unerwiającego zwieracz zewnętrzny z nerwem mięśnia pośladkowego, zaproponowane przez autorów japońskich (89).
Nie należy wreszcie zapominać o prostych zabiegach, takich jak np. appendicostomy czy specjalna kolostomia – tzw. colonic conduit – zaproponowana przez Williamsa, umożliwiających codzienne płukanie jelit u chorych całkowicie pozbawionych kontroli oddawania stolca (np. chorych neurologicznie). U pacjentów, u których zawiodły wszystkie inne operacyjne sposoby leczenia, w ostateczności należy rozważyć wytworzenie sztucznego odbytu. W wybranych przypadkach zabieg ten może być również postępowaniem pierwotnym. Ewentualność taką trzeba brać pod uwagę u pacjentów z demencją, z porażeniem kończyn dolnych i odleżynami, u których wyłonienie stomii może się okazać korzystnym rozwiązaniem (5).
Zabieg Secca – radiofrequency anal remodeling ( RFAR)
Secca jest jedną z najbardziej obiecujących spośród technik leczenia nietrzymiania stolca opisanych w ostatnich latach. Aktualnie publikowane doświadczenia sięgają 5 lat obserwacji. Ideą zabiegu jest wywołanie zmian regeneracyjnych w kompleksie zwieraczy pod wpływem dostarczonej energii cieplnej. Technika ta cechuje się szeregiem zalet do których należy niski odsetek łagodnych powikłań, krótki czas zabiegu, ograniczone znieczulenie i krótka krzywa uczenia. Ponadto wykonanie tego zabiegu nie utrudnia w żaden sposób wykonania w przyszłości każdego z pozostałych zabiegów leczenia nietrzymania stolca.
Kryteria kwalifikacji do tego zabiegu obejmują objawy nietrzymania stolca trwające powyżej 12 miesięcy przy jednoczesnym nieskutecznym leczeniu zachowawczym przez co najmniej 3-6 miesięcy. Do przeciwwskazań natomiast należą: duży ubytek zwieracza, zaburzenia krzepnięcia krwi, obecność aktywnych implantów, nietrzymanie stolca na tle biegunki, choroby zapalne jelit, zwężenie odbytu, ciąża, przebyte naświetlanie miednicy oraz zaburzenia psychiatryczne, które mogą zaburzać prawidłowy tok wizyt kontrolnych.
Czas trwania zabiegu jest relatywnie krótki a technika łatwa do opanowania. W znieczuleniu miejscowym i sedacji midazolamem przez anoskop wprowadza się czterokanałową sondę generatora fal magnetycznych (charakterystyka impulsu: 465 kHz, 2-5 W na każdą elektrodę – Curon Medical) wywołujących miejscowo efekt cieplny (ryc. 13). Charakterystyka każdej elektrody modulowana jest automatycznie po osiągnięciu temperatury 85°C. Terapeutyczny efekt cieplny uzyskuje się w wyniku: obkurczania kolagenu, „remodelowania” i gojenia rany oraz redukcji napięcia tkankowego. Czas trwania impulsu wynosi 60-70 sekund. Ciągły przepływ wody zapobiega poparzeniu tkanek (58, 59). W naszym ośrodku pacjent jest wypisywany do domu w pierwszej dobie pooperacyjnej, jakkolwiek, zabieg ten może być z powodzeniem wykonywany także w trybie ambulatoryjnym. Zabieg ten może zostać powtórzony, jeśli przewidujemy dalszą poprawę funkcji zwieraczy (101).
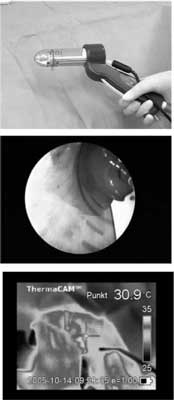 Ryc. 13. Zabieg Secca – radiofrequency anal remodeling (RFAR). Aplikator (A), widok w skopii (B), kontrola termowizyjna (C).
Pod koniec 2002 roku Takahashi i wsp. przedstawili wyniki leczenia 10 kobiet z objawami nietrzymania stolca. Średni czas trwania objawów wynosił 6,7 roku. W skali Wexnera chorzy uzyskiwali średnio 13,5 pkt przed i 5,0 pkt 12 miesięcy po zastosowanym leczeniu – kliniczna odpowiedź>50%. Wykazano poprawę jakości życia we wszystkich czterech kategoriach pytań wg FIQL (59). Podobne wyniki, tym razem wieloośrodkowych badań prospektywnych, przedstawił w 2002 roku James Fleshman (90). We wszystkich dotychczas publikowanych badaniach częstość występowania powikłań jest bardzo niska. Należą tu niewielkie miejscowe krwiaki podśluzówkowe, późne krwawienia ulegające samoograniczeniu (14-21 dzień po zabiegu), powierzchowne owrzodzenia, stany podgorączkowe, przemijający ból i biegunka (102-104).
Energia fal radiowych powoduje szereg reakcji fizycznych i biochemicznych na poziomie tkankowym, komórkowym i molekularnym. Dochodzi do zwiększonego przepływu jonów w przestrzeni międzykomórkowej oraz w poprzek błon komórkowych. W cytoplazmie produkowane są białka szoku cieplnego (HSP) w podpowiedzi na wzrost temperatury tkanki. Bezpośrednie działanie energii na włókna kolagenowe powoduje ich skracanie i wzmacnianie. Dochodzi także do proliferacji fibroblastów i zwiększonej produkcji kolagenu typu pierwszego. Ten efekt nazywany jest także odmładzaniem tkanki, przez podobieństwo zachodzących zmian strukturalnych do tkanek młodszych (zwiększenie sprężystości, elastyczności, wytrzymałości itd.). Wzrost kurczliwości gładkich włókien mięśniowych odbywa się poprzez zwiększoną polimeryzację aktyny spowodowaną aktywnością białek HSP. Natomiast zwiększona agitacja włókien zwieracza poprzecznie prążkowanego zewnętrznego odbywa się przy udziale aktywowanej metaloproteinazy typu 1.
Aktualnie prowadzone są dalsze badania w celu lepszego zrozumienia mechanizmu działania tej procedury oraz uściślenia kryteriów kwalifikacji pacjentów do zabiegu.
Nowe małoinwazyjne metody leczenia nietrzymania stolca
Niezależnie od zastosowanych metod rezultaty leczenia nietrzymania stolca nie należą do rewelacyjnych. Odsetek bardzo dobrych i dobrych wyników po leczeniu zabiegowym, bez względu na użytą technikę, wciąż nie przekracza 60%. Przedstawione metody wytworzenia zwieraczy zastępczych, z własnych mięśni czy sztucznych zwieraczy zastępczych, obarczone są ryzykiem powikłań przekraczającym 25%, a na sfinansowanie osprzętu potrzebnego do wykonania zabiegu wciąż może sobie pozwolić bardzo niewielu chorych. Dlatego też pojawiają się nowe metody, w większości bazujące na opisanych przed laty wzorcach. Wszystkie one mają na celu osiągnięcie jak najlepszego wyniku leczenia przy stosunkowo niewielkim obciążeniu dla chorego, zarówno wynikającym z wykonania procedury, jak i finansowym.
Implantacja mikrobalonów
Metodę tę, polegającą na implantacji mikrobalonów w warstwę podśluzową kanału odbytu, stosowano już wcześniej w leczeniu nietrzymania moczu ( stress incontinence). Zabieg wykonywany jest w znieczuleniu dożylnym. W swoich badaniach (2001 r.) Christos Feretis i wsp. odnotowali statystycznie znamienną poprawę u wszystkich leczonych chorych, nie stwierdzając jednocześnie żadnych działań ubocznych. Z uwagi na małą grupę objętą badaniem (6 osób) skuteczność metody wymaga dalszych analiz (91).
Implantacja mikrosfer – Durasphere
W znieczuleniu miejscowym po założeniu anoskopu podawany jest w miejsce określonego wcześniej ubytku zwieraczy środek zwiększający masę (objętość) – tzw. bulking agent (Durasphere). Według Kathy Davis środek podaje się w postaci iniekcji w dawce 0,5-3,0 ml w 1-4 podśluzówkowych wkłuciach (92). Jest to małoinwazyjna, efektywna metoda leczenia chorych z nietrzymaniem stolca i widocznym ubytkiem zwieracza wewnętrznego, niemniej wymaga dalszych badań na większej grupie chorych. Podobne efekty uzyskuje się poprzez aplikację silikonu lub autologicznego tłuszczu.
Ciekawą metodę bazującą na regeneracyjnych właściwościach komory hiperbarycznej zaproponował i opisał Cundal. Po 6 miesiącach leczenia uzyskał znamienną poprawę kontroli defekacji u chorych z przedłużonym czasem latencji nerwu sromowego (pudendopatia) (93).
Zabiegi zwiększające „pojemność” odbytnicy – tzw. rectal augmentation
U ponad 50% chorych z objawami nietrzymania stolca bez uszkodzenia zwieraczy występuje „nadwrażliwość” ściany odbytnicy na bodźce. Jest to przyczyną nietrzymania z nadmiernym parciem ( urgency incontinence). Do grupy tej należą chorzy z zaburzeniami neurologicznymi, po naświetlaniach, w przebiegu IBD, a także po zabiegach usunięcia odbytnicy (zespół przedniej resekcji odbytnicy). Obniżona podatność, compliance ściany oraz próg wrażliwości powodują, iż nawet niewielka objętość stolca czyni parcie niemożliwym do powstrzymania.
W 1988 roku Kock opisał metodę zwiększania pojemności pęcherza moczowego z użyciem wstawki z jelita biodrowego. Norman Wiliams i wsp. w roku 2001 przedstawili metodę „zwiększenia odbytnicy” – rectal augmentation. Polega ona na przeniesieniu uszypułowanej wstawki końcowego odcinka jelita biodrowego oraz wszyciu jej bok do boku z użyciem linearnych staplerów w ścianę odbytnicy czy neorectum (94). Zwiększa to jej pojemność rezerwuarową, zapobiegając NS z nadmiernego parcia. W przypadku równoczesnej niewydoloności zwieraczy zabieg połączony jest z transpozycją i ciągłą stymulacją mięśnia smukłego. Trudno dyskutować wyniki opisanej metody. Zabieg przeprowadzono zaledwie u kilku chorych, nie ma zatem danych pozwalających chociażby na wstępną jego ocenę (95).
Podsumowanie
Nietrzymanie stolca to zaburzenie powszechnie spotykane, którego częstość występowania jest niedoceniana, a które może znacznie ograniczać codzienną aktywność pacjenta. Nierzadko przyczynę tego zaburzenia da się ustalić dzięki wywiadowi i badaniu fizykalnemu, niemniej jednak w wielu przypadkach konieczne są badania dodatkowe, takie jak USG i manometria. Podstawą powodzenia terapeutycznego jest dokładne rozpoznanie etiologii zaburzeń. Nasze dotychczasowe doświadczenie uczy, że jakkolwiek kontrolę nad oddawaniem stolca można w większości przypadków poprawić, to jednak rzadko udaje się powrócić do stanu sprzed wystąpienia nietrzymania. Istotne znaczenie ma wyczerpujące omówienie tego problemu z chorym, zanim podda się on operacji, tak aby jego oczekiwania co do wyników leczenia mieściły się w rozsądnych granicach. Wielce pomocne są zaawansowane technologie medyczne, szczególnie w przypadku niektórych, specjalnie wybranych chorych, jak również w sytuacji, gdy zawiodły inne metody. Mimo to nadal dla zbyt wielu chorych zabiegiem z wyboru jest wytworzenie sztucznego odbytu. Ważne jest zatem, aby zgodnie z wytycznymi IFFGD z 2002 roku problematyką zaburzeń defekacji, szczególnie NS, zajmowały się wyłącznie ośrodki referencyjne, posiadające odpowiednią bazę instrumentalną i doświadczenie w chirurgii kolorektalnej. W przeciwnym razie nie należy liczyć na dobre efekty diagnostyczno-lecznicze NS. Piśmiennictwo
1. Bielecki K.: Nietrzymanie stolca. Pol. Przegl. Chir. 1992; 64: 270-276.
2. Enck P., Walega P.: Epidemiologie der Stuhlinkontinenz. Kontinenz 1994; 3.59-66
3. Nelson R., Norton N., Cautley E., Furner S.: Community-based prevalence of anal incontinence. JAMA 1995; 274: 559-561.
4. Whitehead W.E., Wald A., Norton N.J.: Treatment options for fecal incontinence. Dis. Colon Rectum 2001; 44: 131-144.
5. Norton N.J.: Advancing the Treatment of Fecal & Urinary Incontinence Through Research: Trial Design, Outcome Measures, and Research Priorities. 3-5 listopada 2002 r., Milwaukee, USA. Adres: www.iffgd.org.
6. Whitehead W.E., Wald A., Diamant N.E. i wsp.: Functional disorders of the anus and rectum. Gut 1999; 45 supl. 2: II55- II59.
7. Baeten C.G., Konsten J., Spaans F. i wsp.: Dynamic graciloplasty for treatment of faecal incontinence. Lancet 1991; 338: 1163-1165.
8. Mavrantonis C., Wexner S.D.: A clinical approach to fecal incontinence. J. Clin. Gastroenterol. 1998; 27: 108-121.
9. Müller-Lissner S.A., Akkermans L.M.A. (red.): Chronische Obstipation und Stuhlinkontinenz. Springer-Verlag, Berlin, Heidelberg, New York 1989: 215-230.
10. Rockwood T.H., Church J.M., Fleshman J.W. i wsp.: Patient and surgeon ranking of the severity of symptoms associated with fecal incontinence: the fecal incontinence severity index. Dis. Colon Rectum 1999; 42: 1525-1532.
11. Jorge J.M., Wexner S.D.: Etiology and management of fecal incontinence. Dis. Colon Rectum 1993; 36: 77-97.
12. Vaizey C.J., Carapeti E., Cahill J.A., Kamm M.A.: Prospective comparison of faecal incontinence grading systems. Gut 1999; 44: 77-80.
13. Pescatori M., Anastasio G., Bottini C., Mentasti A.: New grading and scoring for anal incontinence. Evaluation of 335 patients. Dis. Colon Rectum 1992; 35: 482-487.
14. American Medical Systems. Fecal Incontinence Scoring System. Minnetonka, Minnesota: American Medical Systems 1997.
15. Holschneider A.M.: Elektromanometrie des Enddarms. Diagnostik und Therapie der Inkontinenz und der chronischen Obstipation. Wyd. 2, Urban & Schwarzenberg, München, Wien, Baltimore 1983: 3-50.
16. Wałęga P., Herman R.M.: Nietrzymanie moczu i stolca - mit czy rzeczywistość. Przegląd Urologiczny 2003; 4: 108-111.
17. Drossman D.A., Sandler R.S., Broom C.M., McKee D.C.: Urgency and fecal soiling in people with bowel dysfunction. Dig. Dis. Sci. 1986; 31: 1221-1225.
18. Sagar P.M., Pemberton J.H.: Anorectal and pelvic floor function. Relevance of continence, incontinence, and constipation. Gastroenterol. Clin. North Am. 1996; 25: 163-182.
19. Herman R.M., Wałęga P., Herman K. i wsp.: Low anterior resection syndrome - clinical, manometric and videoproctographic evaluation 2 years after surgery. Monduzzi Editore Proceedings of the Eurosurgery 2002: 265-270.
20. Wałega P., Herman R.M., Popiela T.: Odległe wyniki badań funkcji anorektalnych u chorych po przedniej resekcji odbytnicy. Pol. Przegl. Chir. 2001; 73: 327-245.
21. Popiela T., Wałęga P., Herman R.M., Kawiorski W.: Ocena funkcji motorycznych zwieraczy odbytu u chorej po przedniej, niskiej resekcji odbytnicy z powodu raka. Pol. Przegl. Chir. 1997; 69: 604-610.
22. Da Silva G.M., Berho M., Wexner S.D.: Histologic analysis of the irradiated anal sphincter. Dis. Colon Rectum 2003; 46: 1492-1497.
23. Engel A.F., Kamm M.A., Bartram C.I., Nicholls R.J.: Relationship of symptoms in faecal incontinence to specific sphincter abnormalities. Int. J. Colorectal Dis. 1995; 10: 152-155.
24. Perucchini D.: Struktur und Funktion des vorderen Beckenbodenkompartiments der Frau. Coloproctology 2001; 23: 267-271.
25. Winter R., Haller U., Hepp H.: Harn- und Stuhlinkontinenz: Ein Tabu-Thema. Gynäkol. Geburtshilfliche Rundsch. 2002; 42: 131-132.
26. Damon H., Henry L., Barth X., Mion F.: Fecal incontinence in females with a past history of vaginal delivery: significance of anal sphincter defects detected by ultrasound. Dis. Colon Rectum 2002; 45: 1445-1450.
27. Enck P., Gabor S., von Ferber L. i wsp.: Prevalence of fecal incontinence and degree of information possessed by family physicians and health insurance. Z. Gastroenterol. 1991; 29: 538-540.
28. de Parades V., Etienney I., Thabut D. i wsp.: Anal sphincter injury after forceps delivery: myth or reality? A prospective ultrasound study of 93 females. Dis. Colon Rectum 2004; 47: 24-34.
29. Feldman M., Schiller L.R.: Disorders of gastrointestinal motility associated with diabetes mellitus. Ann. Intern. Med. 1983; 98: 378-384.
30. Hinds J.P., Eidelman B.H., Wald A.: Prevalence of bowel dysfunction in multiple sclerosis. A population survey. Gastroenterology 1990; 98: 1538-1542.
31. Byrne C.M., Pager C.K., Rex J. i wsp.: Assessment of quality of life in the treatment of patients with neuropathic fecal incontinence. Dis. Colon Rectum 2002; 45: 1431-1436.
32. Rockwood T.H., Church J.M., Fleshman J.W. i wsp.: Fecal Incontinence Quality of Life Scale: quality of life instrument for patients with fecal incontinence. Dis. Colon Rectum 2000; 43: 9-17.
33. McHorney C.A., Ware J.E. Jr, Lu J.F., Sherbourne C.D.: The MOS 36-item Short-Form Health Survey (SF-36): III. Tests of data quality, scaling assumptions, and reliability across diverse patient groups. Med. Care 1994; 32: 40-66.
34. Zung W.W.: A self-rating depression scale. Arch. Gen. Psychiatry 1965; 12: 63-70.
35. Wałęga P., Herman R.M., Popiela T., Legutko J.: Przydatność badań manometrycznych w diagnostyce zaburzeń funkcji odbytniczo-odbytowych w praktyce chirurgicznej. Acta Endoscop. Pol. 1999; 9: 91.
36. Herman R.M., Wałęga P.: Badania czynnościowe dolnego odcinka przewodu pokarmowego. W: Bielecki K., Dziki A. (red.): Proktologia. PZWL, Warszawa 2000: 58-75.
37. Enck P., Wałęga P., Flesch S.: Continence control during stress (coughing) in healthy volunteers. Kontinenz 1995: 4; 111-113.
38. Carapeti E.A., Kamm M.A., Phillips R.K.S.: Randomized controlled trial of topical phenylephrine in the treatment of faecal incontinence. Br. J. Surg. 2000; 87: 38-42.
39. Herman R.M., Wałęga P., Widera A.: Biofeedback jako zachowawcza metoda leczenia nietrzymania stolca. Przegl. Lek. 2004; 61: 54-59.
40. MacLeod J.H.: Biofeedback in the management of partial anal incontinence. Dis. Colon Rectum 1983; 26: 244-246.
41. Norton C., Hosker G., Brazzelli M.: Biofeedback and/or sphincter exercises for the treatment of faecal incontinence in adults. Cochrane Database Syst. Rev. 2000; 2: CD002111.
42. Herman R.M., Wałęga P., Nowakowski M. i wsp.: Transanal electrostimulation in the treatment of fecal incontinence following low anterior rectum resection. International Proceedings Division. Monduzzi Editore 2001: 295-299.
43. Vaizey C.J., Kamm M.A., Nicholls R.J.: Recent advances in the surgical treatment of faecal incontinence. Br. J. Surg. 1998; 85: 596-603.
44. Malouf A.J., Vaizey C.J., Kamm M.A., Nicholls R.J.: Reassessing artificial bowel sphincters. Lancet 2000; 355: 2219-2220.
45. Oliveira R., Pfeifer J., Wexner S.D.: Physiological and clinical outcome of anterior sphincteroplasty. Br. J. Surg. 1996; 83: 502-505.
46. Tighe M., Taylor B.A.: Emergency repair of obstetric injury to the anal sphincters - a role for the colorectal surgeon. Triplate 2002 colorectal meeting abstracts. Dis. Colon Rectum 2002; 45: abstr. 35.
47. Tjandra J.J., Han W.R., Goh J. i wsp.: Direct repair vs. overlapping sphincter repair: a randomized, controlled trial. Triplate 2002 colorectal meeting abstracts. Dis. Colon Rectum 2002; 45: abstr. 36.
48. Slade M.S., Goldberg S.M., Schottler J.L. i wsp.: Sphincteroplasty for acquired anal incontinence. Dis. Colon Rectum 1977; 20: 33-35.
49. Karoui S., Leroi A.M., Koning E. i wsp.: Results of sphincteroplasty in 86 patients with anal incontinence. Dis. Colon Rectum 2000; 43: 813-820.
50. Malouf A.J., Norton C.S., Engel A.F. i wsp.: Long-term results of overlapping anterior anal-sphincter repair for obstetric trauma. Lancet 2000; 355: 260-265.
51. Halverson A.L., Hull T.L.: Long-term outcome of overlapping anal sphincter repair. Dis. Colon Rectum 2002; 45: 345-348.
52. Nyam D.C., Pemberton J.H.: Long-term results of lateral internal sphincterotomy for chronic anal fissure with particular reference to incidence of fecal incontinence. Dis. Colon Rectum 1999; 42: 1306-1310.
53. Parks A.G.: Anorectal incontinence. Proc. R. Soc. Med 1975; 68: 681-690.
54. Matsuoka H., Mavrantonis C., Wexner S.D. i wsp.: Postanal repair for fecal incontinence - is it worthwhile" Dis. Colon Rectum 2000; 43: 1561-1567.
55. Braun J., Tons C., Schippers E. i wsp.: Ergebnisse der posterioren Raffung nach Parks bei der idiopathischen analen Inkontinenz. Chirurg 1991; 62: 206-210.
56. Athanasiadis S., Sanchez M., Nafe M.: Ergebnisse der anterioren Levator- und Externusplastik bei der idiopathischen anorektalen Inkontinenz. Chirurg 1994; 65: 634-641.
57. Bachoo P., Brazzelli M., Grant A.: Surgery for faecal incontinence in adults. Cochrane Database Syst. Rev. 2000; 2: CD001757.
58. Takahashi T., Garcia-Osogobio S., Valdovinos M.A. i wsp.: Radio-frequency energy delivery to the anal canal for the treatment of fecal incontinence. Dis. Colon Rectum 2002; 45: 915-922.
59. Takahashi T., Garcia-Osogobio S., Valdovinos M.A. i wsp.: Extended two-year results of radio-frequency energy delivery for the treatment of fecal incontinence (the Secca procedure). Dis. Colon Rectum 2003; 46: 711-715.
60. Pucciani F., Rottoli M.L., Bologna A. i wsp.: Anterior rectocele and anorectal dysfunction. Int. J. Colorectal Dis. 1996; 11: 1-9.
61. Frykman H.M., Goldberg S.M.: The surgical treatment of rectal procidentia. Surg. Gynecol. Obstet. 1969; 129: 1225-1230.
62. Ripstein C.B.: Procidentia: definitive corrective surgery. Dis. Colon Rectum 1972; 15: 334-336.
63. Aitola P.T., Hiltunen K.M., Matikainen M.J.: Functional results of operative treatment of rectal prolapse over an 11-year period: emphasis on transabdominal approach. Dis. Colon Rectum 1999; 42: 655-660.
64. Mikulicz J.: Zur operativen Behandlung des Prolapsus recti et Coli invaginati. Arch. Klin. Chir. 1889; 38: 74-97.
65. Moschcowitz A.V.: The pathogenesis, anatomy, and cure of prolapse of the rectum. Surg. Gynecol. Obstet. 1912; 15: 7-21.
66. Sullivan E.S., Stranburg C.O., Sandoz I.L. i wsp.: Repair of total pelvic prolapse: an overview. W: Schrock T. (red.): Perspectives in Colon and Rectal Surgery. Quality Medical Publishing, St Louis 1990: 119-131.
67. Sullivan E.S., Longaker C.J., Lee P.Y.: Total pelvic mesh repair: a ten-year experience. Dis. Colon Rectum 2001; 44: 857-863.
68. Collopy B.T., Barham K.A.: Abdominal colporectopexy with pelvic cul-de-sac closure. Dis. Colon Rectum 2002; 45: 522-526.
69. Devesa J.M., Madrid J.M., Gallego B.R. i wsp.: Bilateral gluteoplasty for fecal incontinence. Dis. Colon Rectum 1997; 40: 883-888.
70. Pickrell K.L., Broadbent T.R., Masters F.W., Metzger J.T.: Construction of a rectal sphincter and restoration of anal continence by transplanting the gracilis muscle; a report of four cases in children. Ann. Surg. 1952; 135: 853-862.
71. Cavina E., Seccia M., Evangelista G. i wsp.: Perineal colostomy and electrostimulated gracilis "neosphincter" after abdomino-perineal resection of the colon and anorectum: a surgical experience and follow-up study in 47 cases. Int. J. Colorectal Dis. 1990; 5: 6-11.
72. Chapman A.E., Geerdes B., Hewett P. i wsp.: Systematic review of dynamic graciloplasty in the treatment of faecal incontinence. Br. J. Surg. 2002; 89: 138-153.
73. Herman R.M.: Komentarz do art. "Dynamiczna gracilloplastyka w leczeniu nietrzymania stolca". Med. Prakt. Chir. 2002; 2: 40-45.
74. Baeten C., Spaans F., Fluks A.: An implanted neuromuscular stimulator for fecal continence following previously implanted gracilis muscle. Report of a case. Dis. Colon Rectum 1988; 31: 134-137.
75. Baeten C.G., Bailey H.R., Bakka A. i wsp.: Safety and efficacy of dynamic graciloplasty for fecal incontinence: report of a prospective, multicenter trial. Dynamic Graciloplasty Therapy Study Group. Dis. Colon Rectum 2000; 43: 743-751.
76. Herman R.M., Wałęga P., Nowakowski M. i wsp.: Gracilloplastyka dynamiczna w Polsce. Proktologia 2001; 2: 179-185.
77. Herman R.M., Wałęga P., Nowakowski M. i wsp.: Dynamic gracilloplasty as a surgical treatment of fecal incontinence. International Proceeding Division. Monduzzi Editore 2001: 149-156.
78. Matzel K.E., Madoff R.D., LaFontaine L.J. i wsp.; Dynamic Graciloplasty Therapy Study Group: Complications of dynamic graciloplasty: incidence, management, and impact on outcome. Dis. Colon Rectum 2001; 44: 1427-1435.
79. Violi V., Boselli A.S., De Bernardinis M. i wsp.: Surgical results and functional outcome after total anorectal reconstruction by double graciloplasty supported by external-source electrostimulation and/or implantable pulse generators: an 8-year experience. Int. J. Colorectal Dis. 2004; 19: 219-227.
80. Herman R.M.: When can anal sphincters be separed during rectal resection? Proktologia 2002; supl. 1: 45-46.
81. Lehur P.A., Michot F., Denis P. i wsp.: Results of artificial sphincter in severe anal incontinence. Report of 14 consecutive implantations. Dis. Colon Rectum 1996; 39: 1352-1355.
82. Lehur P.A., Zerbib F., Neunlist M. i wsp.: Comparison of quality of life and anorectal function after artificial sphincter implantation. Dis. Colon Rectum 2002; 45: 508-513.
83. Wong W.D., Congliosi S.M., Spencer M.P. i wsp.: The safety and efficacy of the artificial bowel sphincter for fecal incontinence: results from a multicenter cohort study. Dis. Colon Rectum 2002; 45: 1139-1153.
84. Devesa J.M., Rey A., Hervas P.L. i wsp.: Artificial anal sphincter: complications and functional results of a large personal series. Dis. Colon Rectum 2002; 45: 1154-1163.
85. Matzel K.E., Stadelmaier U., Bittorf B. i wsp.: Bilateral sacral spinal nerve stimulation for fecal incontinence after low anterior rectum resection. Int. J. Colorectal Dis. 2002; 17: 430-434.
86. Rosen H.R., Urbarz C., Holzer B. i wsp.: Sacral nerve stimulation as a treatment for fecal incontinence. Gastroenterology 2001; 121: 536-541.
87. Ratto C., Morelli U., Paparo S. i wsp.: Minimally invasive sacral neuromodulation implant technique: modifications to the conventional procedure. Dis. Colon Rectum 2003; 46: 414-417.
88. Vaizey C.J., Kamm M.A., Roy A.J., Nicholls R.J.: Double-blind crossover study of sacral nerve stimulation for fecal incontinence. Dis. Colon Rectum 2000; 43: 298-302
89. Sato T., Konishi F., Kanazawa K.: End-to-side pudendal nerve anastomosis for the creation of a new reinforcing anal sphincter in dogs. Surgery 2000; 127: 92-98.
90. Fleshman J., Weston E.J.: Multi-center, open label, prospective trial evaluating the safety and effectiveness of temperature-controlled radiofrequency energy delivery to the anal canal (Secca procedure) for treatment of fecal incontinence. Dis. Colon Rectum 2002; 45: 36.
91. Feretis C., Benakis P., Dailianas A. i wsp.: Implantation of microballoons in the management of fecal incontinence. Dis. Colon Rectum 2001; 44: 1605-1609.
92. Davis K., Kumar D.: Clinical evaluation of injectable anal sphincter bulking agent (Durasphere) in management of patients with persistent faecal incontinence secondary to internal anal sphincter defect. Dis. Colon Rectum 2002; 45.
93. Cundall J.D., Gardiner A., Chin K. i wsp.: Hyperbaric oxygen in the treatment of fecal incontinence secondary to pudendal neuropathy. Dis. Colon Rectum 2003; 46: 1549-1554.
94. Chan C., Williams N., Tillin T. i wsp.: Rectal augmentation: evaluation of a novel surgical procedure for the management of severe faecal urgency. Dis. Colon Rectum 2002; 45: A34-A36.
95. Williams N.S., Ogunbiyi O.A., Scott S.M. i wsp.: Rectal augmentation and stimulated gracilis anal neosphincter: a new approach in the management of fecal urgency and incontinence. Dis. Colon Rectum 2001; 44: 192-198.
96. Chan C.L., et al.: Rectal Heat Thresholds A Novel Test of the Sensory Afferent Pathway. Dis. Colon. Rectum., 2003; 46: 590-595.
97. Meagher A.P., at al.: Rectal mucosal electrosensitivity - what is being tested? Int. J. Colorectal. Dis., 1996; 11(1): 29-33.
98. Whitehead W.E., Wald A., Nancy J., Norton B.S.: Treatment option for fecal incontinence. Consensus Conference Report. Dis. Colon. Rectum., 2002, 2: 131-144.
99. Lehur P.A., Michot F., Denis P., et al.: Results of artificial sphincter in severe anal incontinence: report of 14 consecutive implantation. Dis. Colon. Rectum., 1996, 39: 1353-1355.
100. Schmidt E., Bruch H.P.: Traitment chirurgical des incontinences sphinceriennes intestinales par autotransplant libre de musculare lisse. J. Chir., 1981, 118: 315-320.
101. Herman R.M., et al.: How Radiofreguency Sphincter Remodelling (Secca procedure) improves anal continence: Clinical, Structural and Physiological Results. Paper presented: 17 Annual International Colorectal Disease Symposium. CCF Florida USA, 2006.
102. Herman R.M., et al.: The Secca Procedure:Modern Mininally Invasive Treatment of Fecal Incontinence. 9-th Annual Congress of European Surgical Society. Vienna. 2005. Acta Chir. Belgica. 2005 Suppl. 105/5 Abstr. No: 101.
103. Herman R.M., et al.: SECCA Procedure - radiofrequency energy delivery as minimally invasive method for treatment of fecal incontinence - own experience. 21 Biennale Congress of International Society University Colon & Recum Surgeons. Istambul. Turky. 2006. Abstr. No 268.
104. Takahashi T.: 5-year experience. Submitted for publication and Personal communications.
105. Herman R.M., et al.: Clinical and Physiological Results of Secca Procedure. What is the Mechanism of Action. International Consensus Conference on Fecal Incontinence. Bari. Italy. 2006.
otrzymano/received: 2006-09-28 zaakceptowano/accepted: 2006-10-26 Adres/address: *Roman M. Herman III Katedra i Klinika Chirurgii Ogólnej Uniwersytet Jagielloński Collegium Medicum ul. Prądnicka 35-37, 31-202 Kraków tel. (0-12) 633-19-95, fax. (0-12) 633-31-05 e-mail: msherman@cyf-kr.edu.pl Pełna wersja artykułu Nowoczesna diagnostyka i możliwości leczenia nietrzymania stolca dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








