|
© Borgis - Postępy Nauk Medycznych 9, s. 569-577
*Ewa Augustynowicz-Kopeć, Zofia Zwolska
Epidemiologia gruźlicy u dzieci i niektóre problemy diagnostyki mikrobiologicznej
Epidemiology of tuberculosis in children and some problems of microbiological confirmation
Zakład Mikrobiologii Instytutu Gruźlicy i Chorób Płuc, Krajowe Referencyjne Laboratorium Prątka Gruźlicy
Kierownik Zakładu: prof. dr hab. med. Zofia Zwolska Streszczenie
Gruźlica u dzieci pozostaje wciąż problemem zdrowotnym w wielu krajach i jest ściśle związana z występowaniem choroby u dorosłych. Wiek chorych na gruźlicę obniża się wraz ze wzrostem ogólnej zapadalności w danym regionie. W wielu regionach świata zapadalność na gruźlicę u dzieci wzrasta. Dokładne dane dotyczące liczby dzieci chorych na gruźlicę nie są znane, ale ocenia się je na 3-13% w ogólnej populacji. Gruźlica u dzieci w danej społeczności jest wskaźnikiem niepowodzenia prowadzonego nadzoru nad chorobą. Trudności diagnostyczne gruźlicy u dzieci wynikają z powodów klinicznych - dyskretne i mało swoiste objawy i laboratoryjnych, do których należy brak dostatecznie czułych i swoistych metod diagnostycznych. W związku z rozprzestrzenieniem się w świecie lekooporności prątków gruźlicy, należy dążyć do wykonywania hodowli i antybiogramu. Wzór oporności na leki i genetyczne zróżnicowanie szczepów Mycobacterium tuberculosis wyhodowanych u dzieci służą jako wskaźnik transmitowanej oporności prątków. Najlepszym sposobem zapobiegania gruźlicy u dzieci jest ograniczenie rozprzestrzeniania się zakażenia, co najlepiej osiągnąć poprzez wykrywanie i skuteczne leczenie chorych prątkujących. Słowa kluczowe: gruźlica u dzieci, epidemiologia, mikrobiologiczne metody diagnozowania
Summary
Tuberculosis in children is stall a major problem in most developing and many developed countries and reflects the prevalence of the disease in adults as well as current transmission rate. The peak age of tuberculosis notification decreases as the incidence of disease increases in the region. Pediatric TB appears to be increasing in many parts of the world. The exact proportion of children with tuberculosis is unknown. Overall, the estimated proportion of children with TB is 3-13% of all TB cases. The children with tuberculosis in community represent a failure of TB control in that community. Diagnosis of TB in children is difficult for many reasons as: non-specific signs, minimal symptoms, low sensitivity of laboratory methods and others. In view of the rising incidence of drug resistance, bacteriological confirmation and drug susceptibility testing should be done whenever possible. Drug resistance patterns and genotype diversity of Mycobacterium tuberculosis among children serve as a good indicator of transmitted drug resistance within the community. The only way to effectively prevent tuberculosis is to prevent the infection. The key to achieving this is to find and treat all sputum-positive tuberculosis adults. Key words: tuberculosis in children, epidemiology, microbiological methods of diagnosis
Stosowane obecnie metody walki z gruźlicą – DOT (ang. directly observed treatment) i DOTS (ang. directly observed short course of therapy) skierowane są głównie na postępowanie z chorymi prątkującymi. Dzieci chore na gruźlicę rzadko prątkują i dlatego może się wydawać, że nie są one grupą szczególnie trudną w programach nadzoru nad chorobą. Według Enarsona, eksperta WHO, pomijanie dzieci w ścisłych rygorach narzucanych przez strategie walki z gruźlicą jest błędnym podejściem do walki z chorobą (1). Głównym celem walki z gruźlicą powinna być eradykacja Mycobacterium tuberculosis. W ograniczaniu chorób zakaźnych najlepsze wyniki osiąga się, gdy istnieją skuteczne szczepionki. Szczepieni chronią całą populację, w tym głównie dzieci. Szczepionka BCG jest używana rutynowo do szczepień przeciwgruźliczych od ponad 80 lat, pomimo umiarkowanej skuteczności ocenianej po kilkudziesięciu latach stosowania na około 50% (2). Zaszczepiono nią ponad 80% populacji tj. około 3 miliardy ludzi na świecie. Obecnie niestety nie ma bardziej skutecznej szczepionki skierowanej przeciw prątkom i dlatego zapobieganie gruźlicy musi odbywać się także inną drogą. Wczesne wykrywanie chorych prątkujących i skuteczne ich leczenie jest aktualnie najlepszym sposobem ochrony dzieci przed zakażeniem M. tuberculosis.
Gruźlica – jedna z najstarszych chorób ludzkości od wieków stanowiła problem zdrowotny dla ludzi zamieszkujących wszystkie kontynenty. Pomimo dobrej wiedzy na temat jej rozprzestrzeniania się, poznanej patogenezy u ludzi i zwierząt, istnienia leków skutecznie działających na prątki, jest problemem przybierającym coraz większe rozmiary. Obecnie, szacuje się, że 1/3 światowej populacji jest zakażona prątkami gruźlicy i każdego roku około 2-3 mln ludzi umiera z tego powodu (3). Ponad 95% zgonów z powodu gruźlicy ma miejsce krajach rozwijających się. Światowa epidemia narasta wraz z rozpowszechnianiem się zakażenia HIV, wzrostem lekoopornych form i konfliktami wojennymi w różnych regionach świata. Dodatkowym czynnikiem ułatwiającym transmisję gruźlicy jest łatwiejsze niż dawniej przemieszczanie się ludzi między kontynentami. Jeżeli sytuacja nie ulegnie poprawie, WHO przewiduje, że do 2020 roku około 1 miliarda ludzi zakazi się prątkami gruźlicy, ponad 150 mln zachoruje a 36 mln umrze (4). Według danych WHO w 2002 roku było 8,8 mln nowych przypadków gruźlicy, z czego 3,9 mln (44%) było prątkujących tj. najbardziej zakaźnych dla otoczenia (5). Większość przypadków wystąpiła w Azji i Afryce, 33 % zachorowań wystąpiło w Azji Południowo-Wschodniej i 26% w Afryce, gdzie zanotowano również najwyższe wskaźniki śmiertelności.
Niektóre dane epidemiologiczne o gruźlicy u dzieci
Jakie miejsce na tle wszystkich chorych na gruźlicę zajmują dzieci? Dane epidemiologiczne dotyczące gruźlicy u dzieci są bardzo skąpe, a ich pozyskanie jest utrudnione z powodu niedokładnie prowadzonej rejestracji w wielu krajach świata, trudności w rozpoznawaniu choroby wynikających z nieswoistych objawów oraz małej czułości testów mikrobiologicznych, potwierdzających gruźlicę tylko niewielkiego odsetka chorych dzieci. Dzieci poniżej 5 roku życia bardzo rzadko wykrztuszają plwocinę, a jeżeli już taki materiał można od nich otrzymać w większości nie uzyskuje się dodatnich wyników w metodzie bakterioskopowej (6). Badanie bakterioskopowe popłuczyny żołądkowych, materiału zalecanego do diagnostyki mikrobiologicznej gruźlicy u dzieci, jest dodatnie u około 20% dzieci, a hodowla prątków u około 50% (7). Badania te są jednak wykonywane głównie w dużych, miejskich ośrodkach i wymagają wysokich kwalifikacji personelu klinicznego i laboratoryjnego. Z tego powodu u wielu dzieci gruźlica nie jest rozpoznawana i rejestrowana. Istnieje również niebezpieczeństwo innych błędów, w tym np. „przediagnozowania”.
Odsetek dzieci chorych na gruźlicę szacuje się na 3-13% ogółu chorych (8). Według danych WHO w 1989 r. zanotowano 1 300 000 przypadków gruźlicy u dzieci poniżej 15 roku życia i 450 000 zgonów. W 1994 roku na 7 500 000 wszystkich zachorowań przypadło 650 000 u dzieci, co stanowiło 9% (9). Te dane dotyczą tylko dzieci z aktywną gruźlicą, nie obejmując dzieci zakażonych. Nie ma rejestrów światowych dotyczących liczby dzieci z utajoną postacią gruźlicy, która jest bardzo trudna do oszacowania.
CDC ocenia, że 9,6-14,9 mln ludzi zamieszkujących USA jest zakażonych Mycobacterium tuberculosis. Grupa ludzi z utajoną gruźlicą regularnie powiększa się z powodu migracji z regionów świata z dużą częstością gruźlicy i zachodzącą stale transmisją wśród różnych populacji należących do grup wysokiego ryzyka. Szacuje się, że 30-50% urodzonych poza USA przyjechało z innych krajów z utajoną postacią gruźlicy, a około 50% obcokrajowców z aktywną gruźlicą mieszka w USA dłużej niż 5 lat (10). Dane o gruźlicy dziecięcej w USA, podobnie jak w innych krajach są niekompletne, chociaż właśnie w USA najlepiej jest prowadzona rejestracja chorych i nadzór nad chorobą. Nelson i wsp. podsumowali amerykańskie badania przeprowadzone w latach 1993-2001 nad gruźlicą u dzieci poniżej 15 roku życia. Roczna zapadalność na czynną gruźlicę u dzieci wynosiła około 6%, przy czym dzieci młodsze poniżej 5 r. ż. chorowały 2-3 razy częściej niż starsze. Podobnie jak u dorosłych, gruźlica częściej występowała u dzieci pochodzenia hiszpańskiego i afro-amerykańskiego (11, 12). Występowanie gruźlicy utajonej u dzieci zamieszkujących duże miasta, takie jak Nowy Jork, Miami, Denver ocenia się na 0,4-12,5%.
W regionach, w których zapadalność na gruźlicę wzrasta, chorują głównie osoby młode. W krajach wysoko rozwiniętych o zmniejszających się wskaźnikach chorują głównie ludzie powyżej 65 roku życia. Dane regionalne prezentowanych w Global Tuberculosis Control Report 2000 świadczą, że wśród dzieci do 14 r. ż. 0,6-6,9% obficie prątkuje (AFB+) (tab. 1).
Tabela 1. Odsetki chorych na gruźlicę dzieci poniżej 14 roku życia z dodatnim rozmazem bakterioskopowym do ogólnej liczby raportowanych dorosłych wg. WHO, 1998.
Różni autorzy omawiają wzrost wskaźników zapadalności na gruźlicę wśród dzieci. Lobato i wsp. opisali takie zjawisko w Kalifornii w latach 1985-1995 wśród dzieci 0-4 lat i 5-16 lat, przy czym dzieci z mniejszości etnicznych chorowały 6-34 razy częściej niż z rdzennej populacji amerykańskiej (13). W miejskich regionach Afryki Południowej wskaźnik zapadalności u dzieci w wieku 0-5 lat wynosił 3588/100 000 tj. 3,5 razy więcej niż u dorosłych (14). Stwierdzono, że wskaźniki te korelowały z niskim poziomem edukacji i przeludnieniem w domach. Podobne obserwacje pochodzą z dzielnicy Bronx w Nowym Jorku (15). W przeciwieństwie do tego, dane z Japonii wskazuje tendencję spadkową zapadalności na gruźlicę (o około 50%) wśród chorych w latach 1990-1994 w porównaniu z okresem 1975-1979. Wśród chorych dzieci u 83% potwierdzono domowy kontakt z gruźlicą, 86% dzieci nie było szczepionych BCG (16). W krajach skandynawskich gruźlica u dorosłych i dzieci występuje najczęściej w rodzinach imigrantów, co można odnieść do warunków ich życia oraz zakażenia nabytego w kraju urodzenia (17).
W niektórych krajach europejskich obserwowano wzrost zapadalności na gruźlicę u dzieci np. w Szwecji w okresie 1976-1995 (18), w Anglii włączając w to Londyn (19), na Grenlandii w latach 1990-1993 (20), w Austrii (21) i Danii w okresie 1984-1993 (22). Tendencje wzrostowe obserwowano w Izraelu, w regionie Ashkelon w latach 1958-1994 r. z powodu nagłego wzrostu liczby imigrantów z Etiopii (23). Zapadalność na gruźlicę w tym regionie Izraela wśród dzieci ocenia się na 9,7% wśród wszystkich zarejestrowanych.
Kraje byłego Związku Radzieckiego są szczególnie dotknięte wysokimi wskaźnikami gruźlicy, w tym również gruźlicy lekoopornej. Na Łotwie gruźlica u dzieci wzrosła z 43 przypadków w 1991 roku (7,5/100 000) do 144 (38,9/100 000) w roku 2000. W 2000 roku na Łotwie gruźlica u dzieci stanowiła 8,4% wszystkich zarejestrowanych przypadków (24). U dzieci poniżej 5 r. ż. wskaźnik zapadalności na gruźlicę wzrósł z 21,7/100 000 w 1996 roku do 57,3/100 000 w roku 2001. U 35% wszystkich chorych dzieci gruźlicę rozpoznano z kontaktów rodzinnych (24). Również w Rosji wzrosły wskaźniki zapadalności na gruźlicę wśród dzieci, z 7,5/100 000 w roku 1989 do 18,6/100 000 w 2001 roku. W 2001 wskaźnik zapadalności był najwyższy we wschodnich regionach Rosji i wynosił 34,7/100 000 (9).
Czynniki wpływające na ograniczenia danych o epidemiologii gruźlicy dziecięcej
Podsumowując trendy w epidemiologii gruźlicy u dzieci należy podkreślić, że dane publikowane w piśmiennictwie są niepełne, nieregularnie zbierane i charakteryzują się szeregiem ograniczeń. Wiele publikowanych danych pochodzi od dzieci hospitalizowanych, a te dane nie muszą być reprezentatywne dla całego regionu. Poza tym u wielu dzieci, gruźlicę rozpoznaje się w poradniach i nie wszystkie postacie choroby trafiają do rejestrów np. gruźlica pozapłucna, gruźlica lekooporna lub koincydencja z HIV. Brak systemów raportowania i regularnego prowadzenia nadzoru w wielu krajach przyczynia się również do niepełnej wiedzy o epidemiologii. Badania nad gruźlicą ośrodkowego układu nerwowego w Południowej Afryce wśród dzieci do 15 r. ż. wykazały, że tylko 56% wszystkich przypadków znalazło się w rejestrach, a 16% wszystkich umieszczanych w rejestrach wyłączono z nich z powodu błędnego rozpoznania, błędów w zgłoszeniu (np. dwukrotnie rejestrowano to samo dziecko) lub błędów administracyjnych placówki (25). W tych badaniach wykazano zarówno pomijanie dzieci chorych na gruźlicę, jak również włączanie ich do raportów wielokrotnie.
Inną sprawą pozostaje sposób wykrywania dzieci chorych na gruźlicę. Wielu autorów sugeruje, że miarą wykrywania wszystkich przypadków u dzieci mogłaby być liczebność gruźlicy pozapłucnej (25, 26). Rodzi to jednak obawę, że w krajach raportujących wysokie odsetki postaci pozapłucnych, z kolei gruźlica układu oddechowego może być niedodiagnozowana. Badania prowadzone w Ugandzie pokazały, że ponad 50% wszystkich przypadków pozapłucnej gruźlicy zarejestrowano u dzieci. W badaniach w Etiopii wśród 412 przypadków gruźlicy u dzieci hospitalizowanych i leczonych ambulatoryjnie w okresie 2 lat gruźlicę pozapłucną stwierdzono u 43%. Warto również zacytować dane z USA, gdzie w okresie 1990-2000 u 21% dzieci stwierdzono pozapłucne postacie choroby (27).
Epidemiologiczne czynniki ryzyka w u dzieci chorych na gruźlicę
Do głównych czynników ryzyka zachorowania na gruźlicę należy emigracja z krajów o wysokich wskaźnikach zapadalności. Poza ograniczeniami wynikającymi z błędów popełnianych w rozpoznawaniu i zgłaszaniu należy również mieć na względzie faktycznie istniejące różnice w epidemiologii gruźlicy w krajach rozwiniętych i rozwijających się. Tabela 2 podsumowuje te różnice.
Tabela 2. Porównanie głównych danych o gruźlicy dziecięcej w krajach wysoko rozwiniętych w stosunku do krajów rozwijających się.
Gruźlica u dzieci zakażonych HIV
Gruźlica stanowi powszechnie występującą na świecie infekcję oportunistyczną u ludzi zakażonych HIV. Obie te choroby wpływają bardzo negatywnie na siebie. Gruźlica pogłębia stan niedoboru immunologicznego w przebiegu zakażenia HIV, zakażenie wirusem należy do czynników wysokiego ryzyka dla rozwoju aktywnej gruźlicy u osób zakażonych a także pochodzenia egzogennego (28). Ryzyko rozwoju aktywnej postaci gruźlicy osób zakażonych wynosi około 10 % w ciągu całego życia, u zakażonych HIV wzrasta do 7-8% w ciągu roku. Zapadalność na gruźlicę u chorych na AIDS jest prawie 500 razy wyższa niż w ogólnej populacji, a zgony z powodu gruźlicy stanowią około 30% zgonów chorych na AIDS (29). Badania prowadzone w Zairze wykazały, że ryzyko zachorowania na gruźlicę jest trzykrotnie wyższe u dzieci, których matki były zakażone HIV w porównaniu do matek niezakażonych tym wirusem (30). Dzieci urodzone z matek zakażonych HIV są szczególnie wrażliwe na współistnienie obu zakażeń (HIV i M. tuberculosis).
Każdego roku blisko 5 mln ludzi (4,2 dorosłych i 700 000 dzieci) zakaża się HIV, a 95% z nich pochodzi z krajów rozwijających (31). Szacuje się, że wśród 40 mln ludzi na świecie zakażonych HIV lub chorujących na AIDS 2,5 mln (ok. 6 %) stanowią dzieci do 15 r. ż. (32). Zakażenie się dzieci HIV następuje głównie od matek w okresie ciąży, karmienia lub zabiegów pielęgnacyjnych. W wielu krajach rozwijających się ponad 90% zakażeń powstaje w życiu płodowym, przy czym wskaźniki zakażeń prenatalnych wahają się od 1% w Indiach do 25-30% w niektórych krajach południowo-wschodniej Afryki (31). Zastosowanie skutecznych metod ograniczenia zakażeń jak leczenie przeciwwirusowe w okresie ciąży, rozwiązanie porodów operacyjne i nie karmienie piersią, mogłyby ograniczyć transmisje zakażenia do ok. 2%, metody te są jednak mało dostępne dla większości matek w najbiedniejszych regionach świata.
U dzieci skierowanych do międzynarodowych adopcji występuje podwyższone ryzyko zachorowania na gruźlicę, również utajonego związanego przede wszystkim z krajem pochodzenia dziecka. W retrospektywnych badaniach 504 adpotowanych małych dzieci (średni wiek 1,6 lat) 19% miało OT>10 mm. Większość tych dzieci pochodziła z Rosji (33). W przypadku dzieci urodzonych w Rosji, kierowanych do adopcji należy również pamiętać o wysokim wskaźniku gruźlicy wielolekoopornej MDR występującym w populacji dorosłych (34).
Drogi zakażania się gruźlicą i transmisja prątków od dorosłych do dzieci.
Główną drogą zakażania M. tuberculosis jest droga kropelkowa. Transmisja choroby następuje, gdy zakaźne cząsteczki (jądra kropelkowe) w czasie kaszlu chorego są wydalane na zewnątrz i wdychane przez człowieka zdrowego. Bardzo drobne cząstki zakaźne o rozmiarach 1-5 μm utrzymują się w powietrzu przez wiele godzin i dlatego zakażenie może nastąpić nawet bez bezpośredniego kontaktu człowieka chorego i zdrowego (35). Do zakażenia usposabiają czynniki środowiskowe - głównie stężenie cząstek infekcyjnych, czas trwania ekspozycji i brak wentylacji pomieszczeń. Na ogół krótki kontakt z osobą prątkującą nie prowadzi do zakażenia. Wielu ekspertów uważa, że 4-8 godzinny kontakt jest jednak wystarczający do transmisji zakażenia.
Badania prowadzone przez CDC od 1987 roku dotyczące gruźlicy wywołanej kontaktami domowymi wskazują, że około 22% gruźlicy wynika z kontaktów domowych (36). Szereg czynników może podwyższać ryzyko transmisji w tym czynniki socjoekonomiczne (głównie niedożywienie), geograficzne, styl życia, wykonywany zawód oraz osobnicza predyspozycja.
Wiele dzieci zakaża się w domach, w których chorują rodzice, dziadkowie lub kuzyni. Opiekunki, nauczyciele, pracownicy medyczni lub inni dorośli chorzy mogą również być źródłem zakażenia dla dzieci, chociaż w mniejszym stopniu, niż źródła wynikające z codziennych kontaktów domowych (37, 38, 39). Klasycznym źródłem zakażenia dla dzieci są obficie prątkujący dorośli, u których prątki są już wykrywane najmniej czułą metodą bakterioskopową. Liczba obserwowanych w tym badaniu prątków KWASOOPORNYCH (AFB(+) – acid fast bacilli) i rozległość zmian radiologicznych, a szczególnie jam gruźliczych zwykle bogatoprątkowych, może wskazywać na dużą zakaźność danej osoby (40). Ryzyko zakażenia następującego w wyniku kontaktu z chorym prątkującym zależy od kilku czynników, głównie stężenia cząstek zakaźnych i czasu trwania kontaktu. Możliwa jest również transmisja od chorych AFB(–) i zdarza się ona z różną częstością, którą Behr i wsp. oceniają ją na 17% (41). Należy dodać, że AFB(–) nie oznacza, że chory nie prątkuje a jedynie, że nie prątkuje obficie i dlatego nie wykryto prątków metodą bakterioskopową.
Najgroźniejszy dla zdrowia dzieci jest domowy kontakt z chorymi na gruźlicę (42, 43). Publikowane dane oceniają to zagrożenie na 15-90%. Wszyscy autorzy zgodnie podkreślają, że duża część dzieci zakażonych lub chorujących na gruźlicę nie zostaje wykryta z powodu licznych zaniedbań, w tym również nie wykonywania badań środowiska rodzinnego i kontaktów domowych.
Kto z członków rodziny może zakazić dziecko gruźlicą? Według jednych badań dzieci zakażały się w 25% od matek, 15-25 % od ojców, 24-30% od ciotek i wujków i w 7-22% od dziadków i innych krewnych (44). W badaniach prowadzonych w Indii i Gambii stwierdzono zakażanie się małych dzieci do 5 r. ż. od chorych rodziców odpowiednio w 34% i 35% (45, 46).
W Południowej Afryce prowadzono badania w okresie 12 miesięcy we wschodniej prowincji, gdzie zapadalności na gruźlicę w ogólnej populacji jest bardzo wysoka (ponad 800/100 000), badano transmisję gruźlicy z kontaktów domowych u dzieci do 5 r. ż. Zidentyfikowano 80 dorosłych chorych na gruźlicę spośród 664 ludzi w wieku 17-85 lat mieszkających wspólnie. U 56 % stwierdzono jamy gruźlicze, 83 % obficie prątkowało. Spośród 154 dzieci do 5 r. ż u 17 gruźlicę potwierdzono hodowlą prątków, 16 na podstawie zmian radiologicznych w płucach skierowano na leczenie przeciwprątkowe (razem chorych dzieci było 21%), przy czym gruźlica u dzieci do 2 r. ż miała najcięższy przebieg. Autorzy podkreślają jak ważną rolę w dochodzeniu do źródła zakażenia dzieci odgrywa badanie kontaktów domowych i zasadność stosowania chemioprofilaktyki w takich przypadkach (47). W badaniach prowadzonych w Pakistanie 49% spośród badanych dzieci wykazywało dodatni OT wynikający z domowych kontaktów z prątkującymi dorosłymi (42).
Takie czynniki takie jak, ciasnota lub brak wentylacji w mieszkaniu, brak odpowiednich nawyków higienicznych potęgują problem. Ryzyko transmisji istnieje również w żłobkach, przedszkolach, szkołach, w placówkach medycznych i w środkach komunikacji (48). Młodsze dzieci do 5 r. ż. narażone są na większe ryzyko zakażenia prątkami gruźlicy niż dzieci starsze. Zwolska opisała zakażenie w izbie porodowej w Mongolii dwóch noworodków od jednej prątkującej kobiety, która przebywała w izbie porodowej zaledwie przez 5 dni (49).
Domy dziecka są miejscem, gdzie transmisja gruźlicy może wywoływać mikroepidemie. Retrospektywna analiza przypadków gruźlicy w prywatnych domach opieki nad dziećmi w San Francisco w latach 2002-2004 wykazała, że dwoje dorosłych opiekunów i 9 małych dzieci zachorowało, przy czym dorosły prątkujący opiekun uznany został za źródło zakażenia dla drugiej osoby dorosłej i wszystkich dzieci. Hodowle M. tuberculosis z plwocin i popłuczyn żołądkowych opiekunów i dzieci wykazały w badaniu molekularnym identyczne wzory genetyczne (50).
Chorzy dorośli z pozapłucnymi postaciami gruźlicy są często uważani za niezakaźnych, ponieważ nie dochodzi w tych przypadkach do powietrznej transmisji prątków.
W piśmiennictwie opisano jednak przypadki takich źródeł zakażenia, jak mocz lub wydzieliny od chorych (51), czy zainfekowane rany i opatrunki (52). Transmisja może się odbywać również drogą pokarmową z nabiałem zawierającym żywe mikroorganizmy M. bovis. Źródłem żywych prątków w badaniach opisanych w 1993 r. w San Diego w Kalifornii było mleko pochodzące od krów chorych na gruźlicę (53).
Transmisja gruźlicy od dzieci
Bardzo niewiele doniesień medycznych dokumentuje transmisję gruźlicy od chorych dzieci. Panuje przekonania, że dzieci nie prątkują i bardzo rzadko mogą być źródłem zakażenia M. tuberculosis dla innych osób (54). Umieszczanie dzieci na końcu łańcucha zakażenia nie jest zgodne ze stanem faktycznym i jest jednym z głównych powodów lekceważenia znaczenia gruźlicy dziecięcej dla zdrowia publicznego.
Curtis i wsp. opisali przypadek 9-letniego chłopca z Północnej Dakoty prątkującego (AFB(+)), który zaraził wiele osób z otoczenia, w tym trzech członków swojej rodziny, 16 kolegów ze szkoły i 9 opiekunów szkolnych (55). Należy dodać, że zapadalność na gruźlicę w Północnej Dakocie jest bardzo niska (1,9/100 000). Chłopiec był badany w kierunku gruźlicy, ponieważ u jego opiekunki stwierdzono pozapłucną postać choroby. U chłopca stwierdzono jamy gruźlicze w obu płucach i uznano go za jedyne możliwe źródło zakażenia także opiekunki. W szkole w Sydney, 7-letni chłopiec prątkujący zakaził 9 spośród 61 zbadanych opiekunów i 13% kolegów szkolnych (56).
Inne przypadki opisane w literaturze to transmisja gruźlicy w szpitalach od pięciorga małych dzieci. Wiek czworga z nich był poniżej15 miesięcy. Wszystkie wymagały odessania wydzieliny, dwoje dzieci było mechanicznie wentylowanych. W piątym przypadku, 5-letni chłopiec z gruźlicą prątkującą zakaził dwie osoby spośród 28 pracowników medycznych (56, 57, 58, 59, 60). Ponadto opisano zakażenie szpitalne u dwóch pielęgniarek od 10-miesiecznego dziecka, u którego rozpoznano i potwierdzono hodowlą prątków gruźlicę otrzewnej. Personel medyczny był narażony na kontakt z zakażonym płynem dializacyjnym (61). Obecnie łatwiej prowadzi się dochodzenia epidemiologiczne, ponieważ istnieją techniki molekularne, które obiektywnie potwierdzają źródło zakażenia i określają transmisję (62).
Gruźlica lekooporna u dzieci. Alertowe rodziny molekularne prątków gruźlicy u dzieci
Leczenie gruźlicy jest utrudnione, gdy prątki wykazują oporność na leki. Lekooporność powstaje w wyniku błędnego leczenia (lekooporność nabyta), a szczepy lekooporne mogą być transmitowane na ludzi zdrowych (lekooporność pierwotna). Szczepy o oporności na główne leki przeciwprątkowe izoniazyd (INH) i ryfampicynę (RMP) są nazwane wielolekoopornymi MDR – multi - drug resistance), a gruźlica wywołana przez nie charakteryzuje się dużo gorszymi wynikami leczenia, często występującymi objawami ubocznymi, wysoką śmiertelnością i około 100 razy wyższymi kosztami leczenia (63,64). Gruźlica lekooporna, a szczególnie gruźlica wielolekooporna stanowi jedno z najpoważniejszych zagrożeń dla zdrowia populacji ludzkiej i określa skuteczność prowadzonych programów walki z gruźlicą.
Badania wykazały, że dorośli chorzy na gruźlicę MDR są przyczyną zakażeń i zachorowań u dzieci w kontaktach domowych z taka samą częstością jak chorzy z gruźlicą lekowrażliwą (65, 66), choć jak wynika z analiz przeprowadzonych w 11 krajach przez Espinal i wsp. u dzieci do 15 r. ż. było ono najniższe wśród wszystkich grup wiekowych (67).
Wzory lekooporności wśród prątków izolowanych od dzieci chorych na gruźlicę powinny być na ogół podobne do tych, które występują w danym regionie w populacji dorosłych (68, 69). W piśmiennictwie niewiele publikacji omawia gruźlicę lekooporną u dzieci. Dane o gruźlicy MDR u dzieci są ograniczone do kazuistyki lub opisu nielicznych przypadków (70, 71). U dzieci rozpoznanie i leczenie gruźlicy MDR jest trudniejsze niż u dorosłych. Wiąże się to z trudnościami w wyhodowaniu prątków u dziecka i tym samym z określeniem wzorów oporności (72, 73). Jeżeli nie podejrzewa się gruźlicy lekoopornej u dziecka, zostaną zastosowane leki I rzutu, co powoduje jeszcze szybszą selekcję szczepów lekoopornych (74). Z tego powodu w przypadkach podejrzanych o gruźlicę MDR (jako wynik zidentyfikowanego kontaktu z dorosłymi z gruźlicą MDR) stosuje się leczenie empiryczne.
Badania prowadzone w Peru w latach 1999-2003 dotyczące leczenia 38 dzieci do 15 r. ż. chore na gruźlicą MDR, u których stosowano przez 18-24 miesięcy co najmniej 5 leków wg wykonanych testów lekowrażliwości wskazują, że leczenie było dobrze tolerowane i 95% z nich udało się odprątkować (75). Wyniki leczenia 36 dzieci z gruźlicą MDR w Południowej Afryce dwom lub trzema lekami przez 9-18 miesięcy przedstawione przez Schaff´a i wsp. były dużo gorsze, gdyż wyleczono tylko 54% dzieci (76).
Badania prowadzone w latach 2003-2005 w dziecięcym szpitalu w Tygerberg (Południowa Afryka) wśród 391 dzieci chorych na gruźlicę potwierdzoną hodowlą prątków wykazały gruźlicę MDR u 20 dzieci (5,1%). Badania genetyczne metodą spoligotyping wykazały, że dominującą rodziną molekularną szczepów prątków wyizolowanych od dzieci był genotyp Beijing, kolejno LAM ( Latin American and Mediterranean) i Haarlem, to jest tych samych, które dominują w tym regionie u dorosłych chorych na gruźlicę (77).
Bardzo ciekawe, retrospektywne badania molekularne (metodami RFLP i spoligotyping) przeprowadzono wśród szczepów prątków wyizolowanych od dzieci chorych na gruźlicę leczonych w dwóch klinikach w Teksasie w latach 1995-2000 (78). Profile genetyczne szczepów wyizolowanych od dzieci przyrównywano do profili szczepów uzyskanych od dorosłych, którzy byli uznani za źródło transmisji. Stwierdzono, że 51 z 71 szczepów (72%) tworzyło 33 molekularne klastery (wspólne grupy molekularne). Najwięcej klasterów stwierdzono wśród szczepów izolowanych od dzieci poniżej 5 roku życia, co potwierdza aktywną transmisję ze źródła zakażenia. Wśród wszystkich analizowanych szczepów M. tuberculosis 28% stanowiły prątki należące do rodziny molekularnej Beijing. Rodzina molekularna Beijing jest obecnie dobrze scharakteryzowaną grupą o odmiennej od innych prątków budowie genetycznej (79).
Wśród szczepów prątków gruźlicy Beijing spotyka się zarówno wrażliwe na leki, jak i o bardzo wysokiej wielolekowej oporności. Szczepy te charakteryzuje wysoka patogenność, szybka zdolność do nabywania lekooporności, zdolność do transmisji, wzrostu i rozmnażania się w makrofagach i monocytach, nieprzewidywalna odpowiedź na leczenie, interakcje pomiędzy prątkami Beijing a układem immunologicznym człowieka, łatwa selekcja mutantów lekoopornych podczas leczenia (80). Badania prowadzone na myszach zakażonych szczepami Beijing wykazały zmniejszenie odporności uzyskanej po szczepieniu BCG (77).W Polsce również stwierdzono u osób dorosłych gruźlicę wywołaną prątkami Beijing (80, 81, 82).
Od wielu lat obserwuje się w naszym kraju tendencje spadkowe w ogólnej zapadalności na gruźlicę, a od 2003 roku nie zarejestrowano żadnego zgonu dziecka z powodu gruźlicy (83) (ryc.1). Nie zanotowano również lekooporności wśród szczepów izolowanych od dzieci, oprócz jednego przypadku oporności na INH (62, 84).
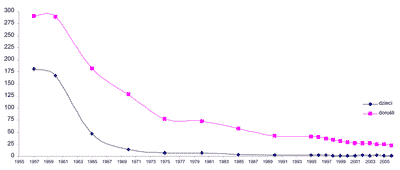 Ryc. 1. Porównanie zapadalności na gruźlicę w Polsce w latach 1957-2006 wśród dorosłych i dzieci.
Laboratoryjne metody rozpoznawania gruźlicy dzieci
Jak wspomniano wcześniej, najbardziej obiektywnym kryterium rozpoznania gruźlicy u chorego jest uzyskanie potwierdzenia mikrobiologicznego tj. hodowli M. tuberculosis (85). Patofizjologia gruźlicy u noworodków i dzieci jest różna od gruźlicy u dorosłych. U dzieci zachorowanie jest nieodległym w czasie następstwem zakażenia (na ogół kilka miesięcy), u dorosłych pierwotne zakażenie i przejście prątków gruźlicy ze stanu latencji do pełno objawowej choroby może trwać miesiącami, latami lub nawet nie zdarzyć się nigdy.
Gruźlicę u dorosłych łatwiej udaje się potwierdzić metodami laboratoryjnymi niż u dzieci. Nawet w krajach wysoko rozwiniętych, popularny schemat diagnostyki opiera się na wynikach odczynu tuberkulinowego i zmianach radiologicznych w klatce piersiowej. Zarówno materiał pobrany podczas bronchoskopii jak i popłuczyny żołądkowe od dziesięcioleci są stosowane w diagnostyce mikrobiologicznej (54, 86). Prątki gruźlicy udaje się wyhodować od około 20-30% dzieci z porannych popłuczyn żołądkowych pobranych w ciągu trzech kolejnych dni. Niektórzy autorzy podkreślają niedogodności pobierania materiału, takie jak: konieczność pobytu w szpitalu, kilkakrotne pobrania popłuczyn i niemożność spożywania pokarmów w nocy. Alternatywnym materiałem polecanym do diagnostyki mikrobiologicznej jest plwocina indukowana, której wartość u chorych dorosłych jest dobrze udokumentowana (87). Badaniach przeprowadzone u 250 małych dzieci potwierdziły większą przydatność diagnostyczną plwociny indukowanej niż popłuczyn żołądkowych (88).
Dostępne w Polsce mikrobiologiczne metody rozpoznawania gruźlicy są jednakowe zarówno dla dorosłych jak i dla dzieci. Mają one swoje wady i zalety, każda z nich charakteryzuje się innymi wymaganiami aparaturowymi i odmiennymi kosztami. Metody te mogą być ze sobą łączone i mogą się uzupełniać. Należy przeprowadzić badanie mikroskopowe w kierunku prątków kwasoopornych i założyć hodowlę w jednym z automatycznych systemów hodowlanych (np. Bactec-460 Tb) oraz wykonać badanie genetyczne ze swoistą dla M. tuberculosis sondą genetyczną (85, 89). Te dwa ostatnie badania należą do najbardziej czułych i są szczególnie polecane do diagnostyki dzieci podejrzanych o gruźlicę (83, 90).
Niezwykle ważne jest by materiał do badań bakteriologicznych od dziecka był prawidłowo pobrany i odpowiednio przekazany do laboratorium. Ma to szczególnie duże znaczenie u dzieci, u których gruźlica jest zwykle skąpoprątkową (91).
Obecnie w Polsce w Krajowym Referencyjnym Laboratorium Prątka (KRLP) w IGiChP jest możliwe ustalenie źródła zakażenia tj. badanie gruźlicy z kontaktów (rodzinnych, szkolnych, szpitalnych i innych środowisk) stosowanymi na świecie metodami biologii molekularnej. W tym celu wyhodowane od dzieci szczepy prątków gruźlicy i prątków BCG mogą być przysyłane do KRLP do bezpłatnych badań molekularnych.
Oddzielna sprawą pozostaje mikrobiologiczne rozpoznawanie niepożądanych odczynów poszczepiennych i rozróżnianie czynnika etiologicznego tych powikłań ( M. bovis BCG) od procesu gruźliczego. Problem opisany jest szczegółowo w wielu publikacjach (92, 93, 94).
Podsumowanie:
1. Odczyn tuberkulinowy (OT) jest pierwszym badaniem u dzieci podejrzanych o gruźlicę. U dzieci szczepionych BCG jest on na ogół dodatni. Są również możliwe fałszywie ujemne wyniki OT.
2. Bardziej swoistą metodą wykrywania zakażenia prątkiem gruźlicy są testy oparte na uwalnianiu gamma-interferon po swoistej stymulacji (QuantiFERON-TB Gold(r)) (95).
3. Potwierdzenie mikrobiologiczne gruźlicy u dziecka jest bardzo trudne. Ranking metod wg ich czułości jest następujący: badanie mikroskopowe, hodowla konwencjonalna, hodowla przyspieszona w systemach automatycznych, amplifikacja kwasów nukleinowych (metody genetyczne). Dla zwiększenia czułości metody powinny być ze sobą łączone (2-3 metody równolegle).
4. Gruźlica u dzieci powinna być rozpoznawana odpowiednio wyposażonych laboratoriach (automatyczne systemy hodowlane i genetyczne systemy zamknięte, a nie PCR). Wyhodowane szczepy muszą być identyfikowane metodą chromatograficzną HPLC dla odróżnienia od siebie: prątków gruźlicy, prątków BCG i prątków MOTT (96).
5. Wyhodowanie szczepu prątków gruźlicy z materiału pobranego od dziecka potwierdza rozpoznanie choroby.
6. Pediatra, który podejrzewa gruźlicę lekooporną u dziecka powinien postarać się, aby badanie wykonano także u dorosłych, którzy mogą być źródłem zakażenia. Badanie powinno być wykonane w laboratorium mikrobiologicznym dysponującym molekularnymi metodami służącymi do badań epidemiologicznych. Piśmiennictwo
1. Enarson DA: Children and the global Tuberculosis situation. Pediatr Respir Rev 2004;5(Suppl. A):S143-145.
2. Colditz GA, et al.: Efficacy of BCG vaccine in the prevention of tuberculosis: meta-analysis of the published literature. JAMA 1994;271:698-702.
3. Raviglione MC: The TB epidemic from 1992 to 2002. Tuberculosis 2003;83:4-14.
4. Global Tuberculosis Control. WHO report 2000. WHO/CDC/TUBERCULOSIS/ 2000.275. Geneva, 2000.
5. World Health Organization. Global tuberculosis control. Control; surveillance, planning, financing. Geneva, Switzerland. WHO/HTM/TB/2004.331. World Health Organization 2004.
6. Charnace G de, Delacourt C: Diagnostic techniques in pediatric tuberculosis. Pediatr Resp Rev 2001;2:120-125.
7. Khan EA, Starke JR: Diagnosis of TB in children: increased need for better methods. Emerg Infect Dis 1995, 1:115-123.
8. Khan EA, Hassan M: Recognition and management of tuberculosis in children. Curr Pediatr 2002;12:545-550.
9. Nelson LJ, Wells CD: Global epidemiology of childhood tuberculosis. Int J Tuberc Lung Dis 2004;8:636-647.
10. Centers for Disease Control and Prevention. Controlling tuberculosis in the United States: recommendations from the American Thoracic Society, CDC, and the Infectious Diseases Society of America. MMWR Recomm Rep 2005;54:1-69.
11. Nelson IJ, et al.: Epidemiology of childhood tuberculosis in the United States, 1993-2001: the need for continued vigilance. Pediatrics 2004;114:333-341.
12. Powell DA, Garrett HW: Tuberculosis in children: an update. Advan Pediatr 2006;53:279-322.
13. Lobato MN, et al.: Tuberculosis in children and adolescents. Pediatr Infect Dis J 1998;17:407-411.
14. Van Rie A, et al.: Childhood tuberculosis in a urban population in South Africa: burden and risk factors. Arch Dis Child 1999;80:433-437.
15. Drucker E, et al.: Childhood tuberculosis in the Bronx, New York. Lancet 1994;343:1482-1485.
16. Ibe M, et al.: Analysis of children with tuberculosis in the past 20 years. Kansenshogaku-Zasshi 1997;71:513-521.
17. Rosenfeldt V, et al.: Childhood tuberculosis in a Scandinavian metropolitan area 1984-1993. Scand J Infect Dis 1998;30:53-57.
18. Eriksson M, Bennet R, Danielsson N: Clinical manifestations and epidemiology of childhood tuberculosis in Stockholm 1976-1995. Scand J Infect Dis 1997;29:569-572.
19. Atkinson P, Taylor H, Maguire H. Resurgence of paediatric tuberculosis in London. Arch Dis Child 2002;86:264-265.
20. Soborg C, et al.: Doubling of tuberculosis incidence in Greenland over an 8-year period (1990-1997). Int J Tuberc Lung Dis 2001;5:257-265.
21. Makristathis A, et al.: Infant tuberculosis in Austria – trend reversal since 1990 ?. Infection 1998;46:42-44.
22. Rosenfeldt V, et al.: Childhood tuberculosis in a Scandinavian metropolitan area 1984-1993. Scan J Infect Dis 1998;30:53-57.
23. Bibi H, et al.: Epidemiology of childhood tuberculosis region in Israel, 1958-1994. Acta Paediatr 1997;86:183-186.
24. State Center of Tuberculosis and Lung Disease. Tuberculosis in Latvia 1991-2000. Riga, Latvia, 2001.
25. Berman S, et al.: Childhood tuberculosis and tuberculosis meningitis: high incidence rates in the Western Cape of South Africa. Tubercle 1992;73:349-355.
26. Schaaf HS, et al.: Respiratory tuberculosis in childhood: the diagnostic value of clinical features and special investigations: the diagnostic value of clinical features and special investigations. Pediatr Infect Dis J 1995;14:189-194.
27. Centers for Disease Control and Prevention, Division of tuberculosis Elimination. Tuberculosis in the United States-2000, Atlanta, GA: US Department of health and Human Services, 2001.
28. Toossi Z: Virological and immunological impact of tuberculosis on human immunodeficiency virus type I disease. J Infect Dis 2003;188:1146-1155.
29. Swaminathan S, et al.: Risk of development of tuberculosis of HIV infected patients. Int J Tuberc Lung Dis 2000;4:839-844.
30. Braun MM, et al.: A retrospective cohort study of the risk of tuberculosis among women of child boring age with HIV infection in Zaire. Am Rev Respir Dis 1991;143:501-504.
31. Swaminathan S: Tuberculosis in HIV-infected children. Paediatr Respir Rev 2004;5:225-230.
32. World Health Organisation. Fight Stigma and Discrimination. New Delhi: WHO SEARO, 2003.
33. Saiman L, et al.: Prevalence of infectious diseases among internationally adopted children. Pediatrics 2001;108:608-612.
34. Viljanen WK, et al.: Survey of drug-resistant tuberculosis in Northwestern Russia from 1984 through 1994. Eur J Clin Microbiol Infect Dis 1998;17:177-183.
35. Riley R. Airborne infection. Am J Med 1974;57:466-475.
36. Centers for Disease Control and Prevention. Core curriculum on tuberculosis: what a clinician should know. 4th ed. Atlanta (GA): US Dept of Health and Human Services; 2000.
37. Leggiadro RJ, Collery B, Dowdy S: Outbreak of tuberculosis in a family day care home. Pediatr Infect Dis J. 1989;8:52-54.
38. Aznar J, et al.: Nosocomial transmission of tuberculosis infection in pediatric wards. Pediatr Infect Dis J 1995;14:44-48.
39. Smith KC: Tuberculosis exposure in a day-care center: recommended management. South Med J 2000;93:877-880.
40. Schmit KC: Tuberculosis in children. Curr Probl Pediatr 2001;31:5-30.
41. Behr MA, et al.: Transmission of Mycobacterium tuberculosis from patients smear-negative for acid-fast bacilli. Lancet 1999;353:444-449.
42. MacIntyre CR, Plant AJ: Preventability of incident cases of tuberculosis in recently exposed contacts. Int J Tuberc Lung Dis 1998; 2:
43. Rathi SK, et al.: Prevalence and risk factors associated with tuberculin skin test positivity among household contacts of smear-positive pulmonary tuberculosis cases in Umerkot, Pakistan. Int J Tuberc Lung Dis 2002;6:851-857.
44. Loeffler AM:. Pediatric Tuberculosis. Semin Respir Infect 2003;18:272-291.
45. Singh M, et al.: Prevalence and risk factors for transmission of infection among children in household contact with adults having pulmonary tuberculosis. Arch Dis Child 2005;90:624-628.
46. Lienhardt C, et al.: Risk factors for tuberculosis infection in children in contact with infectious tuberculosis cases in the Gambia, West Africa. Pediatrics 2003;111:608-614.
47. Bayers N, et al.: A prospective evaluation of children under the age of 5 years living in the same household as adults with recently diagnosed pulmonary tuberculosis. Int J Tuberc Lung Dis 1997;1:38-43.
48. Zwolska Z, Jezierska-Anczuków A: Transmisja prątków gruźlicy zagrożeniem dla ludzi chorych i zdrowych. Nowa Med 1998;4:25-29.
49. Zwolska Z: Assignment report on tuberculosis control. Mongolia, WHO Project, 1988-1989.
50. Dewan PK, et al.: A tuberculosis outbreak in a private-home family child care center in San Francisco, 2002 to 2004. Pediatrics 2006;117:863-869.
51. D´Agata E, et al.: Nosocomial transmission of Mycobacterium tuberculosis from an extrapulmonary site. Infect Control Hosp Epidemiol 2001;22:10-12.
52. Alonso-Echanove J, et al.: Occupational transmission of Mycobacterium tuberculosis to care workers in a university hospital in Lima, Peru. Clin Infect Dis 2001;33:589-596.
53. Danken WM, et al.: Mycobacterium bovis infections in San Diego: a clinico-epidemiologic study of 73 patients and a historical review of a pathogen. Medicine (Baltimore) 1993;72:11-37.
54. Centers for Disease Control and Prevention: Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care facilities. 1994. MMWR Morb Mortal Wkly Rep 1994; 43(RR-13):1-132.
55. Curtis A, et al.: Extensive transmission of Mycobacterium tuberculosis from child. N Engl J Med 1999;341:1491-1495.
56. Starke JR.: Transmission of Mycobacterium tuberculosis to and from children and adolescents. Sem Pediatr Infect Dis 2001;12:115-123.
57. Verteresian-Karanfil L, et al.: Pulmonary infection and cavity formation caused by Mycobacterium tuberculosis in a child with AIDS. N Engl J Med 1988;319:1018-19.
58. Rabalais G, Adams G, Stover B: PPD skin conversion in health-care workers after exposure to Mycobacterium tuberculosis infection in infants. Lancet 1991;338:826.
59. Lee LH, LeVea CM, Graman PS: Congenital tuberculosis in a neonatal intensive care unit: case report, epidemiological investigation, and management of exposures. Clin Infect Dis 1998;27:474-477.
60. Cantwell MF, et al.: Congenital tuberculosis. N Engl J Med 1994; 330:1051-1054.
61. Matlow AG, Harrison A, Monteath A, et al. Nosocomial transmission of tuberculosis (TB) associated with care of a infant with peritoneal TB. Infect Control Hosp Epidemiol 2000;21;222-223.
62. Augustynowicz-Kopeć E: Gruźlica lekooporna w Polsce. Analiza epidemiologiczna, mikrobiologiczna i genetyczna. Rozprawa habilitacyjna Warszawa 2007.
63. Kent JH: The epidemiology of multidrug resistant tuberculosis in the United States. Med Clin N Am 1993;77:1391-1409.
64. Goble M, et al.: Treatment of 171 patients with pulmonary tuberculosis resistant to isoniazid and rifampicin. N Engl J Med 1993;328:527-532.
65. Schaaf HS, et al.: Transmission of multidrug-resistant tuberculosis. Pediatr Infect Dis 2000;19:695-699.
66. Schaaf HS, et al.: Evaluation of young children in household contact with adult multidrug-resistant pulmonary tuberculosis cases. Pediatr Infect Dis 1999; 18:494-500
67. Espinal MA, et al.: Determinants of drug-resistant tuberculosis: analysis of 11 countries. Int J Tuberc Lung Dis 2001;5:887-893.
68. Steiner P, Rao M: Drug-resistant tuberculosis in children. Sem Pediatr Infect Dis 1993;4:275-282.
69. Sun SJ, et al.: Identifying the sources of tuberculosis in young children: a multistate investigation. Emerg Infect Dis 2002;8:1216-1223.
70. Schluger NW, et al.: Multidrug-resistant tuberculosis in children: two cases and revive of the literature. Pediatr Pulmonol 1996;21:138-142.
71. Pavlopoulou ID, et al.: Drug-resistant tuberculosis mastoiditis in 2 children. Scand J Infect Dis 2000;32:436-438.
72. Schluger NW, et al.: Multidrug resistant tuberculosis in children: two cases and a review of the literature. Pediatr Pulm 1996;21:138-142.
73. de Charnac G, Delacourt C: Diagnostic techniques in paediatric tuberculosis. Pediatr Respir Rev 2001;2:120-125.
74. Espinal MA, et al.: Standard short-course chemotherapy for drug-resistant tuberculosis: treatment outcomes in six countries. JAMA 2000;283:2537-2545.
75. Drobac PC, et al.: Community-based therapy for children with multidrug-resistant tuberculosis. Pediatrics 2006;117;2022-2029
76. Schaaf HS, Shean K, Donald PR: Culture confirming multidrug resistant tuberculosis: diagnostic delay, clinical features, and outcome. Arch Dis Child 2003;88:1106-1111.
77. Marais BJ, et al.: Beijing and Haarlem genotypes are overrepresented among children with drug-resistant tuberculosis in the Western Cape province of South Africa. J Clin Microb 2006;44:3539-3543.
78. Wootton SH, et al.: Epidemiology of pediatric tuberculosis using traditional and molecular techniques: Houston, Texas. Pediatrics, 2005;116:1141-1146.
79. Tsolaki AG, et al.: Genomic deletions classify the Beijing/W strains as a distinct genetic lineage of Mycobacterium tuberculosis. J Clin Microbiol 2005;43:3185-3191.
80. Zwolska Z, Augustynowicz-Kopeć E: Aktualna sytuacja epidemiologiczna gruźlicy i nowe zagrożenia dla świata. Postępy w Medycynie Zakażeń (red) Hryniewicz W. Warszawa, 2006, 71-78.
81. Augustynowicz-Kopeć E, et al.: Molekularne dochodzenia epidemiologiczne wśród ludzi blisko spokrewnionych, chorujących na gruźlicę płuc. Pneumonologia Info. 2007;3:14-22.
82. Augustynowicz-Kopeć E, Zwolska Z: Gruźlica w Europie i w Polsce - nowe rodziny molekularne i nowe wzory oporności. Przegl Epidemiol 2008 (w druku).
83. Ziołkowski J: Zmiana obrazu gruźlicy pierwotnej u dzieci. Rozprawa habilitacyjna, Warszawa 2006.
84. Zwolska Z, Augustynowicz-Kopeć E, Klatt M: Primary and acquired drug resistance in Polish tuberculosis patients: results of a study of the national drug resistance surveillance programme. Int. J. Tuberc. Lung Dis. 2000;4:832-838.
85. Zwolska Z: Wybrane zagadnienia mikrobiologii gruźlicy. W: Choroby infekcyjne układu oddechowego u dzieci. (red). Chmielewska-Szewczyk D. wyd. Via Media, Gdańsk 2001, 237-272.
86. Abadco DL, Steiner P: Gastric lavage is better than bronchoalveolar lavage for isolation of Mycobacterium tuberculosis in childhood pulmonary tuberculosis. Pediatr Infect Dis 1992;11:735-738.
87. Menzies D: Sputum induction: simpler, cheaper, and safer: but it is better. Am J Respir Crit Care Med 2003;167:667-676.
88. Zar J H, et al.: Induced sputum versus gastric lavage for microbiological confirmation of pulmonary tuberculosis in infants and young children: a prospective study. Lancet 2005;365:130-134.
89. Bahammam A, Choudhri S, Long R: The validity of acid-fast smears of gastric aspirates as an indicator of pulmonary tuberculosis. Int J Tuberc Lung Dis 1999,3:62-67.
90. American Thoracic Society. Rapid diagnostic tests for tuberculosis: What is the appropriate use? Am J Respir Crit Care Med 1997;155:1804-1814
91. Zwolska Z: Mikrobiologiczne metody diagnozowania gruźlicy. w: Gruźlica u dzieci (red) Ceglecka-Tomaszewska K. Biblioteka Pediatry 21. PZWL 1996, 27-43.
92. Zwolska Z, et al.: Metody izotopowe, genetyczne i chromatograficzne w diagnostyce powikłań po szczepieniu BCG. Przegl Epidemiol 2004;58(Supl. 1):123-128.
93. Zwolska Z, et al.: Zastosowanie nowoczesnych metod mikrobiologicznych do diagnozowania powikłań po szczepieniu BCG. Opis przypadków. Pneumonol Alergol Pol 2005;72:505-511.
94. Augustynowicz-Kopeć E, et al.: Zastosowanie testu molekularnego PCR Multiplex do identyfikacji szczepów Mycobacterium bovis BCG. Pneumonol Alergol Pol 2005;73:228-233.
95. Demkow U: Nowe metody wykrywania zakażenia prątkiem gruźlicy. Urticaria & Related Problems, 2007;2:18-21.
96. Zwolska Z, Augustynowicz-Kopeć E: Identyfikacja gatunkowa prątków kwasoopornych jako ważny element diagnostyki gruźlicy i mykobakterioz. Urticaria & Related Problems 2007;2:26-29.
otrzymano/received: 2008-07-07 zaakceptowano/accepted: 2008-08-05 Adres/address: *Ewa Augustynowicz-Kopeć Instytut Gruźlicy i Chorób Płuc, ul. Płocka 26, 01-138 Warszawa tel.: (0-22) 431-21-82 e-mail: e.kopec@igichp.edu.pl Pełna wersja artykułu Epidemiologia gruźlicy u dzieci i niektóre problemy diagnostyki mikrobiologicznej dostępna w Czytelni Medycznej Borgis. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








