|
© Borgis - Postępy Nauk Medycznych 8, s. 535-540
*Agata Ptak-Belowska, Tomasz Brzozowski, Robert Pajdo, Michał Pawlik, Sławomir Kwiecień, Danuta Drozdowicz, Wiesław W. Pawlik
Rola leptyny w gastroprotekcji
Role of leptin in gastroprotection
Katedra Fizjologii Collegium Medicum Uniwersytetu Jagiellońskiego w Krakowie
Kierownik Katedry: prof. dr hab. med. Wiesław W. Pawlik Streszczenie
Wstęp: Stosunkowo niewiele jest informacji na temat ochronnego działania leptyny w żołądku narażonym na kontakt z czynnikami nekrotyzującymi takimi jak np. etanol, sole żółciowe czy roztwory hiperosmotyczne. W związku z tym pozostaje do zbadania, czy w zwierzęcym modelu ostrych uszkodzeń błony śluzowej żołądka leptyna odgrywa rolę w ich gojeniu oraz zbadanie mechanizmów odpowiedzialnych za gastroprotekcyjne działanie tego hormonu, a także porównanie tych efektów z działaniem jednego z najważniejszych enterogastronów, jakim jest cholecystokinina (CCK). Materiał i metody: Badania zostały przeprowadzone na szczurach białych rasy Wistar. Mechanizmy gastroprotekcji pod wpływem leptyny badano w modelu etanolowym, który polegał na wywołaniu ostrych uszkodzeń błony śluzowej żołądka poprzez dożołądkową aplikację 1 ml 75% etanolu. U wszystkich grup zwierząt mierzono żołądkowy przepływ krwi metodą Dopplera, stosując przepływomierz laserowy Dopplera. Wyniki: W wyniku przeprowadzonych doświadczeń stwierdzono, że leptyna, podobnie jak CCK oraz pokarm, które podnoszą stężenie leptyny w osoczu, chroni błonę śluzową żołądka przed uszkadzającym działaniem etanolu. Wykazano, że działanie gastroprotekcyjne tego peptydu przejawia się w statystycznie znamiennym, zależnym od dawki, zmniejszeniu powierzchni uszkodzeń śluzówki żołądka, ocenianych w 60 min. po aplikacji etanolu. Wnioski: Egzogenna leptyna chroni błonę śluzową żołądka przed uszkodzeniami wywołanymi przez 75% etanol, zmniejszeniu powierzchni ostrych uszkodzeń etanolowych towarzyszy wzrost stężenia leptyny w osoczu krwi i wzrost żołądkowego przepływu krwi. W gastroochronnych efektach i w towarzyszącej hyperemii pod wpływem leptyny i CCK bierze udział tlenek azotu (NO). Słowa kluczowe: gastroprotekcja, leptyna, żołądkowy przepływ krwi, tlenek azotu
Summary
Introduction: There are few data concerning protective effects of leptin on gastric epithelium treated with necrotic factors such as: ethanol, bile salts and hiperosmotic solutions. Further investigations are needed to establish the role of hormone leptin in gastroprotection and in the process of chronic gastric ulcers healing in animals. Material and methods: Experiments were carried out using Wistar rats. Acute gastric leasions were elicited by intra gastric administration of 1 ml 75% ethanol. Gastric blood flow was measured in each animal by means of Doppler´s phenomenon. Results: Our experiments showed that leptin, CCK and food played gastroprotective role via increasing serum leptin level. This action is responsible for gastric epithelium protection against acute injury after ethanol administration. Gatroptotective actions of leptin are dose-dependent and resulted in decreasing of damage area in gastric epithelium in 60 mins after ethanol administration Conclusions: Exogenous leptin administration plays protective effects against 75% ethanol damage in gastric epithelium. The area of acute gastric leasions caused by ethanol is decreased after leptin administration. Additionaly leptin administration results in increased gastric blood flow. Nitric oxide is involved in gastroprotective effects of leptin and CCK. Key words: gastroprotection, leptin, gastric blood flow, nitric oxide
Wstęp
W świetle przyjętej ogólnie koncepcji utrzymanie integralności błony śluzowej żołądka jest wynikiem wzajemnej równowagi biologicznej między czynnikami agresywnymi i protekcyjnymi. Pojęcie gastroprotekcji oznacza unikalną właściwość śluzówki żołądka polegającą na ochronie tej błony śluzowej przed czynnikami uszkadzającymi jej ciągłość i mogącymi wywołać nawet krwotoczną martwicę błony (np. absolutny etanol, czynniki hiperosmotyczne, aspirynę i inne niesterydowe leki przeciwzapalne) (1). Zjawisko powyższe początkowo przypisywano wyłącznie prostaglandynom (PG), które w doświadczeniach u ludzi i zwierząt wzmacniają barierę śluzówkową żołądka poprzez wzrost wydzielania alkalicznego (HCO3-) śluzu, neutralizującego kwas oraz zwiększają przepływ krwi w tym narządzie (2, 3). Ostatnio jednak w mechanizmach protekcyjnych i antywrzodowych zwrócono uwagę na leptynę.
Leptyna, odkryta w 1994 roku przez Zhang i wsp. (4), jest hormonem peptydowym (białkiem o masie 16 kDa zawierającym 167 aminokwasów) będącym produktem ekspresji genu ob. Leptyna znajdująca się w surowicy krwi jest peptydem zawierającym 146 aminokwasów (o masie 13-16 kDa). Ze względu na podobieństwo strukturalne leptynę zalicza się do klasy cytokin zawierających m.in.: IL-6, IL-11, IL-12, LIF, G-CSF oraz onkostatynę M. Leptyna oddziałuje na rodzinę receptorów, zaliczaną do receptorów cytokin klasy I, w skład której wchodzą: OB-Ra, OB-Rb, OB-Rc, OB-Rd, OB-Re.
Stosunkowo niewiele jest informacji na temat ewentualnego ochronnego (tzw. „gastroprotekcyjnego”) działania leptyny w żołądku narażonym na kontakt z czynnikami nekrotyzującymi takimi jak np. etanol, sole żółciowe czy roztwory hiperosmotyczne. Pozostaje w związku z tym do zbadania, czy w zwierzęcym modelu ostrych uszkodzeń błony śluzowej żołądka leptyna odgrywa przyspieszający wpływ na szybkość ich gojenia oraz zbadanie mechanizmów odpowiedzialnych za gastroprotekcyjne działanie tego hormonu.
Dokładne zrozumienie i poznanie mechanizmu ewentualnego gastroprotekcyjnego działania tego hormonu może mieć znaczenie terapeutyczne i zwrócić uwagę na inne niż powszechnie wiadomo funkcje tego peptydu. Ponadto pozwoli na zbadanie możliwości wykorzystania leptyny w procesach reparacyjnych i regeneracyjnych błony śluzowej żołądka.
Materiał i metody
Dane ogólne
Badania zostały przeprowadzone na szczurach białych, rasy Wistar. Dzień przed eksperymentem zwierzęta pozbawiano pokarmu i umieszczano w indywidualnych klatkach, typu Bollmana, uniemożliwiających wzajemne kontaktowanie się zwierząt, a jednocześnie pozwalających na ich swobodny dostęp do wody pitnej.
Wywoływanie ostrych uszkodzeń błony śluzowej żołądka
W celu wywołania ostrych uszkodzeń błony śluzowej żołądka szczurom podawano 75% etanol w objętości 1,5 ml do żołądka przy pomocy metalowego zgłębnika wg metody standardowo stosowanej w Katedrze Fizjologii (5). Po 1 godzinie od podania etanolu, zwierzęta zostały poddane płytkiej narkozie.
Podział zwierząt na grupy eksperymentalne
Schemat doświadczeń w poszczególnych grupach wyglądał następująco:
Grupa I (kontrola): Placebo (0,9% NaCl 1 ml i.p. 30 min. przed podaniem etanolu).
Grupa II: Leptyna podawana we wzrastających dawkach (0,1-50 μg/kg i.p.) lub CCK-8 podawana we wzrastających dawkach (1-100 μg/kg i.p.), 30 minut przed etanolem.
W wyniku stosowania wzrastających dawek leptyny i CCK-8 wyselekcjonowano dawki standardowe w ilości 10 μg/kg dla obu hormonów, które hamowały rozwój uszkodzeń etanolowych w ok. 70%.
Grupa III: Indometacyna w ilości 5 mg/kg i.p., a następnie po 60 min leptyna lub CCK-8 w standardowej dawce (10 μg/kg i.p.) 30 min. przed aplikacją etanolu.
Grupa IV: W grupie tej badano udział NO w gastroprotekcji wywołanej podaniem egzogennej leptyny lub CCK-8 poprzez:
1. zastosowanie związku NG-nitro-L-argininy (L-NAME), inhibitora syntazy NO, osobno lub w kombinacji z aminokwasem L-argininą, który jest substratem dla syntazy NO,
2. podanie L-NAME w kombinacji z D-argininą, która nie jest substratem dla syntazy NO.
Schemat badawczy wyglądał więc następująco:
a) L-NAME 5 mg/kg w injekcji dożylnej podawany 15 min. przed leptyną lub CCK-8 i po 30 dalszych minutach dożołądkowo podawany etanol,
b) L-arginina lub D-arginina w dawce 300 mg/kg w injekcji dożylnej z wyprzedzeniem 15 minut, a następnie L-NAME (5 mg/kg dożylnie) i po 15 minutach CCK-8 lub leptyna (10 μg/kg i.p.), a po dalszych 30 minutach etanol dożołądkowo.
Grupa V: Badano wpływ nerwów czuciowych na gastroprotekcję wywołaną podawaniem standardowych dawek leptyny lub CCK-8 u zwierząt z denerwacją aferentnych włókien czuciowych, wywołanych kapsaicyną. Pod wpływem kapsaicyny dochodzi do blokady włókien czuciowych i upośledzone zostaje ich działanie protekcyjne na błonę śluzową żołądka.
Pomiar żołądkowego przepływu krwi
Celem wykonania pomiaru żołądkowego przepływu krwi zwierzęta zostały poddane narkozie. Po otwarciu jamy brzusznej cięciem wzdłuż linii środkowej ciała i odsunięciu żołądka od mięśni przepony unieruchomiono ten narząd pincetą chirurgiczną, ograniczając do minimum jego ruchy związane z oddychaniem. Kolejno dokonywano pomiaru żołądkowego przepływu krwi metodą Dopplera stosując przepływomierz laserowy Dopplera (Laserflometer, Model BPM 403A, Blood Perfusion Monitor) firmy Vasamedics Inc. St. Paul, MN, USA. W tym celu w grupie zwierząt przykładano sondę światłowodową do części trzonowej żołądka od strony błony surowiczej, bez konieczności otwierania żołądka. Za każdym razem dokonywano trzech pomiarów, zarówno na jego przedniej jak i tylnej ścianie w miejscach nieobjętych ostrymi uszkodzeniami. Wartość żołądkowego przepływu krwi, wyrażona w ml/min/100 g tkanki, była odczytywana bezpośrednio z cyfrowego czytnika przepływomierza.
Oznaczenie stężenia leptyny w osoczu
Po zakończeniu pomiaru żołądkowego przepływu krwi, pobrano krew z żyły próżnej dolnej do probówek zawierających 10% wodny roztwór soli sodowej kwasu etylenodwuaminoczterooctowego (EDTA), aby zapobiec wykrzepianiu krwi. Następnie krew wirowano przez 10 minut w 4°C z prędkością 3000 obrotów na minutę. Po odwirowaniu odciągano osocze w postaci supernatantu i próbki przechowywano w temperaturze – 80°C do czasu wykonania oznaczeń.
Celem oznaczenia poziomu leptyny w surowicy krwi zastosowano RIA-kit dla szczurzej leptyny (Linco Research Inc. St. Charles, Missouri, USA). W oznaczeniu tą metodą używano poliklonalnych przeciwciał króliczych oraz leptyny znakowanej 125J. Czułość metody wynosiła 0,5 ng/ml, wewnętrzną zmienność testu oceniano na ok. 7%, a zmienność zewnętrzna wynosiła ok. 9%.
Ocena uszkodzeń błony śluzowej żołądka
Po wyjęciu żołądka z jamy brzusznej rozcinano go wzdłuż krzywizny większej i dokonywano makroskopowej oceny uszkodzenia błony śluzowej mierząc powierzchnię tych uszkodzeń metodą planimetryczną. Średnią powierzchnię uszkodzeń wyrażano w mm2.
Analiza statystyczna wyników
Wyniki badań we wszystkich typach doświadczeń poddano analizie statystycznej przy użyciu nieparametrycznego testu Manna-Whitneya (test U). Za statystycznie znamienne przyjęto te różnice, dla których poziom istotności był mniejszy od 0,05 (p<0,05). Wyniki wyrażano jako średnie arytmetyczne ± standardowe błędy średnich (SEM).
Wyniki
Wpływ egzogennej leptyny, CCK-8 na ostre uszkodzenia błony śluzowej żołądka, żołądkowy przepływ krwi oraz stężenie leptyny w surowicy krwi.
Na rycinie 1 przedstawiono wyniki średniej powierzchni uszkodzeń żołądkowych i wartości żołądkowego przepływu krwi w błonie śluzowej u zwierząt otrzymujących dootrzewnowo placebo (0,9 % NaCl) lub leptynę we wzrastających dawkach poczynając od 0,1-50 μg/kg. Leptyna wywołała dawkozależną redukcję powierzchni uszkodzenia błony śluzowej żołądka, wywołaną dożołądkowym podaniem 75% etanolu. Dawką „progową”, przy której obserwowano zmniejszenie powierzchni uszkodzeń było stężenie leptyny wynoszące 1 μg/kg. Zaobserwowano, że leptyna w dawce 10 μg/kg hamowała uszkodzenia żołądkowe w około 70%, w stosunku do grupy otrzymującej placebo. Redukcji tych uszkodzeń towarzyszył, zależny od dawki leptyny, wzrost przepływu krwi w błonie śluzowej oraz wzrost stężenia leptyny w osoczu krwi, który przy maksymalnej dawce tego hormonu osiągał wartość 1,19 ± 0,07 ng/ml, a w grupie kontrolnej 0,21 ± 0,05 ng/ml.
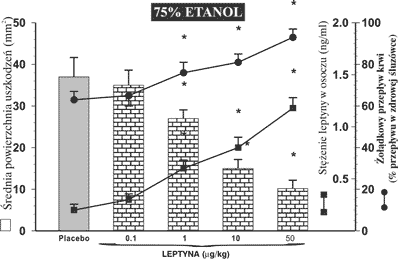 Ryc. 1. Powierzchnia uszkodzeń błony śluzowej żołądka, wywołanych podaniem do żołądka 75% etanolu, żołądkowy przepływ krwi i osoczowe stężenie leptyny u szczurów, którym podawano placebo i leptynę we wzrastających dawkach (0,1 – 50 μg/kg dootrzewnowo).
Rycina 2 obrazuje wpływ CCK-8 podawanej dootrzewnowo we wzrastających dawkach poczynając od 1 μg/kg do 100 μg/kg, ukazując jej optymalny redukujący wpływ na uszkodzenia etanolowe przy stężeniu 10 μg/kg. Protekcyjnemu oddziaływaniu leptyny i CCK-8 na śluzówkę żołądka towarzyszył, zależny od dawki tego hormonu, wzrost żołądkowego przepływu krwi. Średnia wartość żołądkowego przepływu krwi w przypadku nieuszkodzonej błony śluzowej osiągnęła wartość 48 ± 7 ml/min/100 g tkanki.
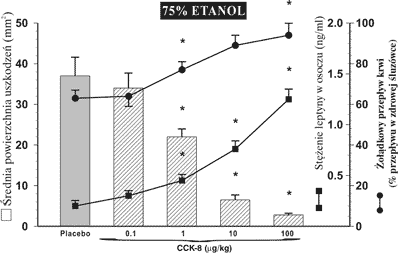 Ryc. 2. Powierzchnia uszkodzeń błony śluzowej żołądka, wywołanych podaniem do żołądka 75% etanolu i równoczesne zmiany w żołądkowym przepływie krwi i w osoczowym stężeniu leptyny u szczurów, którym podawano placebo i CCK-8 we wzrastających dawkach (0,1-100 μg/kg dootrzewnowo).
W przypadku wyprzedzającego podania leptyny lub CCK-8 przed dożołądkową aplikacją 75% etanolu obserwowano dawkozależny wzrost żołądkowego przepływu krwi począwszy od stężenia 10 μg/kg obu substancji.
Osoczowe stężenie leptyny, zarówno przy dootrzewnowym podawaniu leptyny jak i CCK-8, wzrastało w zależności od zastosowanej dawki i wzrost ten korelował ze zmniejszeniem powierzchni uszkodzeń błony śluzowej wywołanych podaniem 75% etanolu.
Rycina 3 przedstawia makroskopowy obraz uszkodzeń błony śluzowej żołądka szczura indukowanych aplikacją 75% etanolu. Wykazano, że wyprzedzające podanie leptyny lub CCK-8 w standardowych dawkach powoduje statystycznie znamienne zmniejszenie powierzchni uszkodzeń śluzówki żołądka, potwierdzając gastroochronne działanie tych hormonów.
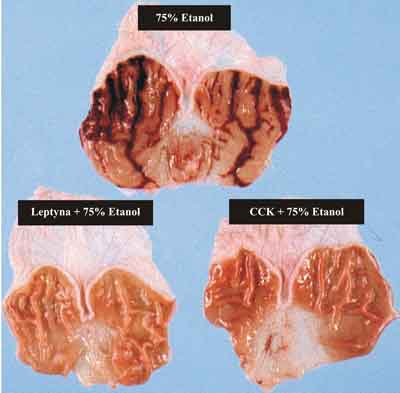 Ryc. 3. Makroskopowy obraz uszkodzeń błony śluzowej żołądka traktowanej 75% etanolem oraz obraz śluzówki żołądka po, wyprzedzającej podanie etanolu, aplikacji leptyny i CCK-8.
Wpływ zahamowania produkcji prostaglandyn w błonie śluzowej żołądka przez indometacynę na wartości średniej powierzchni uszkodzeń i żołądkowy przepływ krwi u zwierząt otrzymujących leptynę i CCK-8
Rycina 4 pokazuje, że podanie indometacyny, która jest nieselektywnym inhibitorem COX-1 i COX-2, w dawce 5 mg/kg dootrzewnowo na 90 min. przed następową dożołądkową aplikacją 75% etanolu powodowało nieznamienny statystycznie wzrost powierzchni uszkodzeń błony śluzowej w stosunku do wartości otrzymanej w grupie zwierząt traktowanych samym etanolem. Generacja prostaglandyny E2 (PGE2) w błonie śluzowej zdrowego żołądka osiągnęła wartość 126 ± 18 ng/g tkanki i pozostawała bez istotnych zmian po dożołądkowej aplikacji 75% etanolu, natomiast obserwowano wyraźny spadek generacji PGE2 w błonie śluzowej żołądka po wcześniejszym podaniu indometacyny. Dootrzewnowa injekcja leptyny lub CCK-8 w dawkach 10 μg/kg, wyprzedzająca podanie etanolu, nie wpływała w sposób znamienny statystycznie na produkcję PGE2 w śluzówce żołądka w porównaniu z grupą zwierząt, która otrzymała placebo na 30 min. przed etanolem. Indometacyna nie wpływała statystycznie znamiennie na spadek powierzchni uszkodzeń żołądkowych pod wpływem leptyny i CCK-8 oraz na wzrost żołądkowego przepływu krwi pod wpływem tych hormonów.
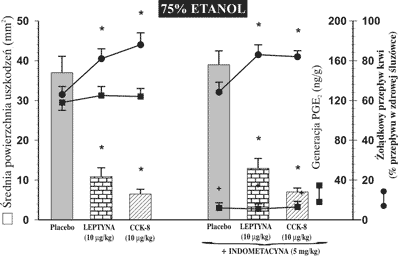 Ryc. 4. Powierzchnia uszkodzeń błony śluzowej żołądka, wywołanych podaniem do żołądka 75% etanolu, żołądkowy przepływ krwi i wielkość generacji PGE2 w śluzówce żołądka u szczurów, którym podawano placebo, leptynę lub CCK-8 w dawce 10 μg/kg dootrzewnowo osobno lub w kombinacji z indometacyną (5 mg/kg dootrzewnowo).
Wpływ blokera syntazy NO, związku L-NAME, na średnią powierzchnię uszkodzeń i żołądkowy przepływ krwi w błonie śluzowej u zwierząt otrzymujących leptynę i CCK-8 osobno i w kombinacji z etanolem
Podanie L-NAME przed leptyną powodowało zwiększenie powierzchni uszkodzeń śluzówki, wywołanych dożołądkową aplikacją 75% etanolu z towarzyszącym spadkiem żołądkowego przepływu krwi i różnice te były statystycznie znamienne w stosunku do korespondujących wartości, osiągniętych u zwierząt bez podawania L-NAME. Podobne wyniki uzyskiwano w przypadku podania L-NAME przed dootrzewnową injekcją CCK-8. Natomiast L-arginina, podawana w dawce 300 mg/kg dożylnie, która jest substratem dla syntazy NO, przywracała gastroprotekcyjne właściwości leptyny lub CCK-8 w modelu uszkodzeń etanolowych. W przypadku zastąpienia L-argininy D-argininą, podawaną w dawce 300 mg/kg dożylnie, nie obserwowano redukcji średniej powierzchni uszkodzeń błony śluzowej żołądka. (tab. 1)
Tabela 1. Średnia powierzchnia uszkodzeń błony śluzowej żołądka, wywołanych podaniem 75% etanolu, oraz żołądkowy przepływ krwi u szczurów, którym podawano placebo (0,9% NaCl), leptynę lub CCK-8 w standardowych dawkach 10 μg/kg dootrzewnowo osobno lub w kombinacji z L-NAME (5 mg/kg dożylnie) aplikowanego również osobno lub w kombinacji z L-argininą lub D-argininą w dawkach 300 mg/kg dożylnie.
Wpływ denerwacji włókien czuciowych za pomocą kapsaicyny na efekty gastroochronne leptyny i CCK-8
Denerwacja aferentnych włókien czuciowych za pomocą kapsaicyny, która jak wykazały wcześniejsze badania wybitnie upośledza mechanizmy obronne błony śluzowej żołądka, nie powoduje istotnej statystycznie różnicy w wielkości powierzchni uszkodzeń śluzówki w porównaniu ze zwierzętami, które nie były traktowane kapsaicyną i otrzymywały 75% etanol dożołądkowo. Natomiast u zwierząt z denerwacją włókien czuciowych, średnia powierzchnia uszkodzeń była statystycznie znamiennie wyższa i wynosiła 38,75 ± 3,75 mm2 w przypadku podawania leptyny, w porównaniu do zwierząt otrzymujących leptynę, bez wcześniejszego uszkodzenia włókien czuciowych, gdzie średnia powierzchnia owrzodzenia wynosiła 6,87 ± 3,12 mm2. Żołądkowy przepływ krwi osiągnął znamiennie niższe wartości w grupie z denerwacją kapsaicynową (w grupie otrzymującej leptynę 57,50% ± 3,75) w porównaniu do odpowiednich wartości obserwowanych u zwierząt otrzymujących leptynę i CCK-8 bez wcześniejszej ekspozycji na kapsaicynę (ryc. 5).
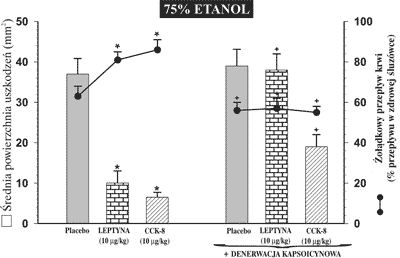 Ryc. 5. Średnia powierzchnia uszkodzeń błony śluzowej żołądka, wywołanych podaniem do żołądka 75% etanolu, oraz zmiany żołądkowego przepływu krwi u szczurów, którym podawano placebo (0,9% NaCl), leptynę lub CCK-8 w standardowych dawkach 10 μg/kg dootrzewnowo w grupie osobno lub z wcześniej wykonaną denerwacją włókien czuciowych przez kapsaicynę.
Dyskusja
Leptyna i jej funkcje w organizmie
Leptyna pełni wiele ważnych funkcji w organizmie, m.in. bierze udział w długoterminowej regulacji przyjmowania pokarmu, a co za tym idzie ma wpływ na masę ciała, uczestniczy w procesach metabolizmu glukozy, sprawuje kontrolę nad funkcjami układu rozrodczego i krwiotwórczego oraz uczestniczy w mechanizmach reakcji zapalnej (6, 7, 8, 9). Mało poznany jest natomiast wpływ tego hormonu, którego obecność wykazano (10) w błonie śluzowej żołądka, na integralność funkcjonalną tego narządu, a zwłaszcza udział tego peptydu w mechanizmach gastroprotekcji oraz w procesach odnowy i gojenia się błony śluzowej po zadziałaniu czynników uszkadzających. Wcześniejsze obserwacje wykazały, że leptyna działa synergistycznie z CCK-8, np. w wysyłaniu sygnałów do ośrodka sytości, zlokalizowanego w podwzgórzu (7). Sugerowano również, że endogenna leptyna może pełnić funkcje ochronne (gastroprotekcyjne) (10, 11), gdyż podanie CCK-8 chroniło błonę śluzową przed uszkodzeniami etanolowymi i efekt ten zachodził wraz ze wzrostem poziomu leptyny w osoczu krwi.
Działanie gastroprotekcyjne leptyny i CCK
Zamierzeniem tej pracy była odpowiedź na pytanie, czy egzogenna leptyna oraz leptyna uwalniana w wyniku stymulacji CCK-8 wpływa na mechanizmy integralności błony śluzowej oraz czy uczestniczy w gastroprotekcji i w procesie gojenia się wrzodów. Po dootrzewnowej aplikacji tego hormonu obserwowano dawko-zależne działanie gastroprotekcyjne tego peptydu na błonę śluzową żołądka, poddawaną uszkadzającemu wpływowi 75% etanolu. Efekt gastroochronny leptyny przebiegał wraz ze znaczącym wzrostem żołądkowego przepływu krwi i osoczowego stężenia leptyny. Działanie gastroprotekcyjne leptyny przejawiało się w znamiennej redukcji powierzchni uszkodzeń etanolowych, które było porównywalne z efektem gastroprotekcyjnym po podawaniu egzogennej CCK-8, która jest hormonem o wcześniej poznanym działaniu ochronnym w stosunku do błony śluzowej żołądka. W obserwowanej lokalnej hyperemii pod wpływem leptyny i CCK-8 bierze udział NO, gdyż po zablokowaniu syntazy NO, poprzez podanie L-NAME, zniesiony zostaje efekt wzmożenia przepływu krwi przez błonę śluzową indukowany przez leptynę lub CCK-8. W przeciwieństwie do NO, który bierze udział w gastroprotekcji pod wpływem leptyny i CCK-8, w pracy nie dostarczono dostatecznych dowodów na udział PG w gastroprotekcji, wywołanej podaniem egzogennej leptyny lub CCK-8, gdyż indometacyna, która jest nieselektywnym blokerem COX, nie wpływała na gastroochronny efekt tych hormonów na błonę śluzową żołądka.
Spośród innych czynników gastroprotekcyjnych badano również, czy włókna czuciowe uwalniające neuropeptydy, w tym głównie CGRP mogą pośredniczyć w mechanizmie ochronnego działania leptyny i CCK-8 przeciwko uszkodzeniom rozwijającym się w następstwie narażenia błony śluzowej żołądka na czynniki uszkadzające, np. 75% etanol. U zwierząt z denerwacją kapsaicynową nie obserwowano ochronnego działania leptyny i CCK-8 na błonę śluzową żołądka traktowaną 75% etanolem, co rzeczywiście dowodzi pośrednictwa neuropeptydów uwalnianych z tych nerwów w gastroprotekcji pod wpływem tych hormonów. Zgodnie z obecną koncepcją receptorowego działania CCK wiadomo, że CCK-8 działa głównie poprzez receptory CCK-A, zlokalizowane na zakończeniach nerwów czuciowych (3). Zahamowanie gastroprotekcji było mniejsze w porównaniu z ochroną zaobserwowaną po podawaniu leptyny u zwierząt z denerwacją kapsaicynową otrzymujących następnie etanol. Dowodzi to, że włókna czuciowe oraz odruchy wago-wagalne stanowią zasadniczą „drogę” działania leptyny, pośrednicząc w uwalnianiu NO, co w zasadzie tłumaczy wzrost żołądkowego przepływu krwi w tych warunkach stanowiąc wyjaśnienie dla redukcji uszkodzeń etanolowych (2).
Powyższe badania dowodzą, że leptyna odgrywa ważną rolę w mechanizmach gastroprotekcji i utrzymaniu integralności błony śluzowej żołądka. Podawanie tego hormonu redukuje powstawanie ostrych uszkodzeń śluzówki żołądka, wywołanych 75% etanolem (5). Przeprowadzone badania w powiązaniu z danymi o zwiększonym stężeniu leptyny w śluzówce żołądka, która została poddana działaniu czynnika uszkadzającego jak 75% etanol, świadczą o tym, że lokalne wydzielanie tego hormonu odgrywa ważna rolę w procesach naprawczych w tym narządzie (13).
Wnioski
1. Egzogenna leptyna chroni błonę śluzową żołądka przed uszkodzeniami wywołanymi przez 75% etanol, a zmniejszeniu powierzchni ostrych uszkodzeń etanolowych towarzyszy wzrost stężenia leptyny w osoczu krwi i wzrost żołądkowego przepływu krwi.
2. Gastroprotekcyjne działanie CCK-8 związane jest z wydzielaniem leptyny i wzrostem żołądkowego przepływu krwi, natomiast nie zależy od generacji endogennych PG w błonie śluzowej żołądka.
3. W gastroochronnych efektach i w towarzyszącej hyperemii pod wpływem leptyny i CCK-8 bierze udział NO, gdyż po zablokowaniu syntazy NO przez L-NAME obserwowano upośledzenie zarówno gastroprotekcji jak i przekrwienia wywołanego przez te hormony.
4. Neuropeptydy uwalniane z aferentnych nerwów czuciowych jak CGRP pośredniczą w mechanizmie gastroprotekcyjnego działania leptyny i CCK-8 ponieważ deaktywacja tych nerwów przez kapsaicynę hamuje gastroochronne i przekrwienne działanie tych hormonów przeciwko uszkodzeniom etanolowym. Piśmiennictwo
1. Konturek SJ.: Gastroenterologia i hepatologia kliniczna. Warszawa. PZWL. 2001;152-70.
2. Brzozowski T. et al: Acceleration of ulcer healing by cholecystokinin (CCK): role of CCK-A receptors, somatostatin, nitric oxide and sensory nerves. Regul Pept 1999;82:19-33.
3. Konturek PC. et al: Enhanced expression of leptin following acute gastric injury in rat. J Physiol Pharmacol 1999;50:587-95.
4. Zhang Y. et al: Positional cloning of the mouse obese gene and its human homolouge. Nature 1994;372:425-32.
5. Brzozowski T. et al: Leptin in gastroprotection induced by cholecystokinin or by a meal. Role of vagal and sensory nerves and nitric oxide. Eur J Pharmacol 1999;374:263-76.
6. Friedman JM, Halaas JL.: Leptin and the regulation of body weight in mammals. Nature 1998;395:763-70.
7. Kamegai J. et al: Chronic central infusion of ghrelin increases hypothalamic neuropeptide Y and Agouti-related protein mRNA levels and body weight in rats. Diabetes 2001;50:2438-43.
8. Maffei M. et al: Leptin levels in human and rodent: measurement of plasma leptin and ob RNA in obese and weight reduced subjects. Nat Med 1995;1:1155-61.
9. Masuzaki H. et al: Nonadipose tissue production of leptin: leptin as a novel placenta-derived hormone in humans. Nature Med 1997;9:1029-33.
10. Bado A. et al: The stomach is a source of leptin. Nature 1998;394:790-3.
11. Konturek PC. et al: Role of leptin in ulcer healing. Eur J Pharmacol 2001;414:87-97.
12. Evangelista S, Maggi CA.: Protection induced by cholecystokinin-8 (CCK-8) in ethanol-induced gastric lesions is mediated via vagal capsaicin-sensitive fibres and CCK-receptors. Br J Pharmacol 1991;102:119-22.
13. Brzozowski T. et al: Role of L-arginine, a substrate for nitric oxide-sythase, in gastroprotection and ulcer healing. J Gastroenterol 1997;32:442-52.
otrzymano/received: 2008-04-08 zaakceptowano/accepted: 2008-05-21 Adres/address: *Agata Ptak-Belowska Katedra Fizjologii CM UJ ul. Grzegórzecka 16, 31-531 Kraków tel.: (0-12) 421-10-06 e-mail: agata.ptak-belowska@uj.edu.pl Pełna wersja artykułu Rola leptyny w gastroprotekcji dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








