|
© Borgis - Postępy Nauk Medycznych 6, s. 335-359
Janusz Badurski1, Edward Czerwiński2, *Ewa Marcinowska-Suchowierska3
Osteoporoza – ocena ryzyka złamania. Status Quo Arte Anno 2007/2008: Przegląd stanowisk: Światowej Organizacji Zdrowia (WHO), Europejskiej Agencji Medycznej (EMEA), Europejskiego Towarzystwa Klinicznych i Ekonomicznych Aspektów Osteoporozy (ESEAO), Międzynarodowej Fundacji Osteoporozy (IOF), Polskiej Fundacji Osteoporozy (PFO) i Polskiego Towarzystwa Osteoartrologii (PTOA)
Osteoporosis – fracture risk estimation Status Quo Arte Anno 2007/2008: Review of positions of World Health Organisation (WHO), European Medicine Agency (EMEA), European Society Of Clinical And Economic Aspects Of Osteoporosis And Osteoartritis (ESEAO), International Osteoporosis Foundation (IOF), Polish Foundation Of Osteoporosis (PFO) and Polish Osteoartrology Society (PTOA)
1Polska Fundacja Osteoporozy, Białystok
Przewodniczący: prof. dr hab. med. Janusz Badurski 2Polskie Towarzystwo Osteoartrologii, Kraków Przewodniczący: dr hab. med. Edward Czerwiński 3Klinika Medycyny Rodzinnej i Chorób Wewnętrznych Centrum Medycznego Kształcenia Podyplomowego w Warszawie Kierownik Kliniki: prof. dr hab. med. Ewa Marcinowska-Suchowierska Streszczenie
Opracowanie niniejsze uzasadnia potrzebę zasadniczej zmiany rozumienia istoty i praktyki wobec osteoporozy, przez jednych rozumianej w kategorii densytometrycznej (T-score -2.5), przez drugich – w kategorii zagrożenia złamaniem, z jakichkolwiek przyczyn by ono nie wynikało. Wieloprzyczynowy charakter obniżenia wytrzymałości kości, zwiększający ich łamliwość, nie umożliwia rozpoznania choroby, czyli osteoporozy, na podstawie jednolitego kryterium przed pierwszym złamaniem w wyniku małego urazu. Możliwa jest natomiast ocena całkowitego, indywidualnego, 10-letniego zagrożenia złamaniem (RB-10), uwzględniająca niezależne i samowystarczające czynniki ryzyka. Są nimi: zaawansowany wiek, uprzednio przebyte złamanie, złamania biodra u rodziców, niski BMI, niska masa kostna, leczenie glikokortykosteroidami, reumatoidalne zapalenie stawów, nikotynizm i nadużywanie alkoholu. Gęstość mineralna kości, dotychczas uznawana za kryterium rozpoznania osteoporozy (BMD o T-score = -2.5) lub jej wykluczenia (T-score> -2.5), współuczestniczy na równi z klinicznymi czynnikami ryzyka w ocenie bezwzględnego zagrożenia złamaniem, tak jak badanie rtg kręgosłupa, wykrywające złamania kręgów. Indywidualne, całkowite RB-10, odzwierciedla wpływ liczby czynników ryzyka na ryzyko populacyjne (RP-10) w każdej dekadzie życia. Celem leczenia jest zmniejszenie zagrożenia złamaniem. Obejmuje ono ograniczenie wpływu czynników ryzyka złamań, w tym zapobieganie upadkom oraz poprawę jakości kości z wykorzystaniem terapii farmakologicznej. Wymagają go osoby obciążone ryzykiem złamania osteoporotycznego większym od średniego ryzyka populacyjnego. Jego znajomość jest niezbędna do określenia progu interwencji leczniczej w każdym kraju osobno, gdyż próg ten jest wynikiem ugody i opracowań grup eksperckich, administracyjnych i ubezpieczycieli. Czy za próg interwencji uznać jeden wspólny dla wszystkich grup wiekowych, czy wcelowany dla każdego wieku osobno, jest przedmiotem debaty. W opracowaniu podkreślono, że: pomiar gęstości mineralnej kości, dotychczas uznawany za kryterium rozpoznania osteoporozy lub jej wykluczenia, nie jest wykonywany w celu diagnostyki, ale do oceny bezwzględnego ryzyka złamania, a badanie rtg kręgosłupa zleca się w celu stwierdzenia złamań trzonów kręgowych, które oznaczają wielokrotny wzrost ryzyka złamania. Omówiono podstawy diagnostyki różnicowej niskiej masy kostnej oraz współczesne możliwości leczenia farmakologicznego. Przedstawiono zasady prewencji upadków w profilaktyce złamań. Słowa kluczowe: wytyczne, osteoporoza, czynniki ryzyka złamania, próg interwencji, leczenie, upadki
Summary
The study documents the reason for major change in perceiving osteoporosis as well as practice and treatment against this disease. Osteoporosis is understood by some in densitometric category, by others in the category of fracture risk, resulting from any reasons. A multifactorial nature of decreased bone resistance, which contributes to fragility, does not allow diagnosing osteoporosis based on a single criterion before the first fracture due to a small injury. It is possible, however, to evaluate an individual 10-year fracture risk (AR-10) on the basis of independent and self-sufficient risk factors. These are: advanced age, prior fragility fracture, parental history of proximal femur fracture, low BMI, low bone mass, glicocortycosteroid treatment, rheumatoid arthritis, smoking, overuse of alcohol. Bone mineral density, which has been used as a criterion for diagnosis of osteoporosis (BMD T-score = –2,5) or its exclusion (T-score> –2,5), is a variable, together with clinical risk factors, in the evaluation of the absolute risk factor, similar to vertebral x-ray revealing vertebral fracture. The individual absolute fracture risk (AR-10) shows the influence of the number of risk factors on the population risk (PR-10) in each decade of life. The aim of the treatment is to decrease fracture risk. It combines a limitation of fracture risk factors effects including fall prevention and improvement of bone quality with applying pharmacotherapy. It is required for persons with fracture risk greater than average population risk. The knowledge of population risk is necessary to evaluate the intervention threshold in each country separately, because it is a result of agreement and guidelines of expert groups, administrators, and insurance companies. Whether one should accept one common intervention threshold for all age-groups or for each age-group individually, is an issue for a debate. This study highlights that a bone mineral measurement, so far accepted as a criterion for diagnosis of osteoporosis or its exclusion should not be made to diagnose a disease but to assess an absolute fracture risk. Spinal X-ray pictures are performed in aim to diagnose vertebral fractures, which multiply the risk of further fractures. The principles of low bone mass differential diagnosis and current possibility of pharmacological treatment are also described. Guidelines for fall avoidance in fracture prevention are described. Key words: guidance, osteoporosis, fracture risk factors, intervention threshold, treatment, falls
Wprowadzenie
Opracowanie niniejsze podsumowuje ponadsiedmioletni dorobek wielu międzynarodowych gremiów zaangażowanych w badanie i popularyzację osteoporozy, w tym i stanowisko Światowej Organizacji Zdrowia Anno 2007/2008.
1. Ilustruje pouczający proces ewolucji wiedzy i wyobrażeń o przyczynach obniżenia wytrzymałości kości, objawiającej się podatnością na złamania po niewielkim urazie.
2. Uzasadnia potrzebę zmiany wizerunku jej istoty oraz potrzebę wprowadzenia do codziennej praktyki nowych standardów postępowania.
3. Uświadamia, jakimi możliwościami w ocenie zagrożenia złamaniem dysponujemy na obecnym etapie wiedzy i jaka jest logika kryteriów decydujących o leczeniu.
4. Przedstawia aktualne poglądy na badania: densytometryczne, radiologiczne i diagnostykę różnicową niskiej masy kostnej.
5. Omawia terapię osteoporozy: cel, próg interwencji leczniczej, wybór leku oraz znaczenie i zapobieganie upadkom.
I. Osteoporoza a złamanie – aktualna koncepcja i logika postępowania lekarskiego
Nie diagnozujemy „osteoporozy”, tylko całkowite, indywidualne, 10-letnie zagrożenie złamaniem, oceniając współoddziaływanie niezależnych i samowystarczających czynników ryzyka, a celem leczenia jest zmniejszenie zagrożenia złamaniem, z jakiegokolwiek powodu by ono wynikało.
W zrozumieniu istoty osteoporozy (definicja, rozpoznanie, cel leczenia) najskuteczniejszym jest, jak zawsze, odwołanie się do logicznego myślenia lekarza, a ten z natury swojej posługuje się najchętniej narracją opisową i porównaniami z innymi przykładami codziennej praktyki.
Nawykiem i powinnością przy badaniu pacjenta jest rozpoznanie choroby już zaistniałej lub zagrożenia jej wystąpieniem. Chorobę na ogół definiują określone czynniki etiologiczne, charakterystyczny przebieg i objawy kliniczne, a badania obrazowe, płynów ustrojowych i tkanek uwiarygodniają rozpoznanie. Skuteczność rozpoznania jest wprost proporcjonalna do wiedzy o ww. jego składnikach.
W bezobjawowej na ogół osteoporozie (OP) „nic się nie dzieje, aż do wystąpienia złamania”. Podobnie jak w przypadku zawału mięśnia sercowego, rozpoznanie możliwe jest dopiero po jego dokonaniu. Badania epidemiologiczne jednakże zidentyfikowały czynniki ryzyka przyspieszające wystąpienie złamania lub zawału. Umiejętne wykorzystanie tej wiedzy precyzuje rozmiary zagrożenia i daje lepsze szanse leczenia/zapobiegania. Kiedyś diagnostyka kardiologiczna zagrożenia zawałem opierała się jedynie na podawanych przez chorych w wywiadzie objawach wieńcowych, na poziomie cholesterolu i obrazie załamków T w zapisie EKG. Obecnie ocenia się całkowite ryzyko zawału, wyrażając je w procentach prawdopodobieństwa w najbliższych 5-10 latach. Stało się to możliwe po zaimplementowaniu do tej oceny wielu czynników ryzyka, takich jak wiek, palenie tytoniu, otyłość, nadciśnienie, cukrzyca, hiperlipidemia, itd., z których każdy może stanowić samodzielną przyczynę zawału. Ten standard nowoczesnego myślenia stosuje się do każdej patologii, w tym i do osteoporozy.
1. Nie możemy rozpoznać „osteoporozy”, ale mamy obowiązek ocenić zagrożenie złamaniem
Wynika to z wątpliwości czy osteoporoza jest procesem, czy chorobą? Co się rozpoznaje? Czy cokolwiek identyfikuje osteoporozę przed złamaniem? Czy ocena zagrożenia pierwszym czy następnym złamaniem jest możliwa? Jak spełnić podstawowe oczekiwanie pacjenta, a nasz również podstawowy obowiązek, rozpoznanie i zmniejszenie tego zagrożenia?
Źródłosłów, to osteo – kość, porosis – porowatość/zrzeszotnienie, czyli osteoporoza – zrzeszotnienie/zanik kości. „Mało kości w kości” jak to trafnie nazwał Albright 65 lat temu. Przewaga resorpcji nad tworzeniem powoduje, że ilość i jakość, masa i wytrzymałość kości maleją z wiekiem. Równolegle zapotrzebowanie na aktywność fizyczną, masa mięśniowa i sprawność ruchowa maleją, zaś podatność na upadki wzrasta, a ryzyko i częstotliwość złamań rośnie. Te dwa czynniki, kostny i pozakostny, determinują rozmiary zagrożenia złamaniem. Przy znanym wieku, jedynie BMD poddaje się pomiarom. Inne, niemierzalne czynniki ryzyka złamań wymagają oceny ilościowej i jakościowej, określanej ryzykiem względnym (RW), tzn. liczbą wskazującą, o ile badana osoba będąc nim/nimi obciążona ma większe prawdopodobieństwo złamania niż populacja ogólna tej samej płci i w tym samym wieku
W ocenie ilości/masy/gęstości kostnej (BMD) posługujemy się wielkością odchylenia standardowego od szczytowej masy kostnej w 29-30 roku życia zdrowych kobiet, tzn. od T-score ± 1,0, której ujemna wartość jest tym większa, im jesteśmy starsi, oraz tzw. od Z-score = 0,0, która porównuje badaną BMD do średniej BMD równolatka, czyli niejako różnicuje normę wieku od choroby, jeśli jest od tej normy niższa. Zgodnie z rozkładem krzywej Gaussa, tylko 65%-70% z nich mieści się w granicach T-score ± 1,0 odchylenia standardowego od normy, 15% wykazuje BMD w granicach od -1,0 do -2,5, a 0,6% nawet poniżej T-score-2,5, nie wykazując żadnej patologii, może co najwyżej cechę genetyczną [za 1].
Z-score -1,0 w każdym wieku oznacza niższą niż norma wieku masę kostną i świadczy albo o wadzie genetycznej (bardzo rzadko), albo (najczęściej) o skutkach oddziaływania jakiegoś czynnika („kliniczny czynnik ryzyka złamania” – K.Cz.R., ang. CRF), który doprowadził do utraty masy kostnej i zwiększył ryzyko złamania 2,6-krotnie. T-score -2,0 zaś oznacza mniejszą niż średnia BMD u młodych i zdrowych kobiet, ale w późniejszych dekadach życia jest już normą wieku, nie świadczy wtedy o chorobie, tylko o wieku. Ta sama wartość T-score, np. -2,5 (stosowana dotąd jako próg rozpoznania choroby) oznacza wielokrotnie mniejsze zagrożenie złamaniem w V i VI (2,2%-7.8%) niż w VIII i IX dekadzie życia (18,3%-27,9%), jak to ilustruje tabela 1 [2].
Tabela 1. Odmienne ryzyko złamania biodra (bliższego końca kości udowej-b.k.k.u.) u osób o tej samej masie kostnej (BMD T-score mierzonego w b.k.k. u.) ale w różnym wieku [2]
Publikacje po 2000 roku podsumowujące doświadczenia w stosowaniu densytometrycznych kryteriów WHO z 1994 roku zauważyły rozbieżność pomiędzy T-score -2,5 jako celu diagnostycznego osteoporozy a ryzykiem złamania oraz wskazaniem do leczenia farmakologicznego [3, 4, 5]. W Polsce również intensywnie wskazywaliśmy na szkodliwość dualistycznego rozumienia istoty osteoporozy, w której co innego diagnozujemy (T-score -2.5), a co innego leczymy (zagrożenie złamaniem z innych niż niska masa kostna przyczyn [6, 7, 8, 9].
Prospektywne badania epidemiologii złamań przed i po 10 latach obserwacji, przeprowadzone w Szwecji i Anglii [wg.10] pozwoliły na wyznaczenie ryzyka populacyjnego złamania w tych krajach (RP-10) (Tab. 2). Obciążeni jesteśmy nim wszyscy z racji starzenia się, bowiem ilość, jakość i wytrzymałość kości z wiekiem obniża się. Czy to zjawisko należy traktować jako proces starzenia się tkanki, który po obniżeniu pewnej krytycznej jakości czy masy, zwiększając ryzyko złamania, staje się osteoporozą? Zważywszy zaś na ryzyko populacyjne w każdym wieku i wpływ patologii/przyczyn wtórnych i jatrogennych na jakość kości, również w każdym wieku, nie można osteoporozy wiązać jedynie z procesem starzenia się. Natomiast na proces starzenia się kości nakładają się pozostałe, dotąd poznane k.cz.r. Stąd poznanie ryzyka populacyjnego (RP-10) pozwala na odgraniczenie prawdopodobieństwa złamania wynikającego z wieku, od tego, który dotyczy każdego indywidualnego osobnika.
Tabela 2. 10-letnie ryzyko złamania b.k.k.u. w populacji kobiet i u mężczyzn w różnym wieku w populacji szweckiej (RP-10) [10].
Z polskich badań epidemiologii złamań wynika (11), że w wieku 50-59 lat jedna na 333 kobiet dozna złamania b.k.k.u., w wieku 60-69 jedna na 42, 10 lat później jedna na 13, a powyżej 80 roku życia już co szósta. Taka jest częstotliwość złamań. Liczebność natomiast, np. w tej samej, IX dekadzie życia kobiet jest kilkakrotnie mniejsza niż pań sześćdziesięcioletnich i siedemdziesięcioletnich, zatem bezwzględna liczba złamań w populacji kobiet po menopauzie największa jest w młodszej i liczniejszej populacji. Obrazowo i celnie ilustruje to opracowanie Siris i zaczerpnięta stamtąd rycina 1 [12].
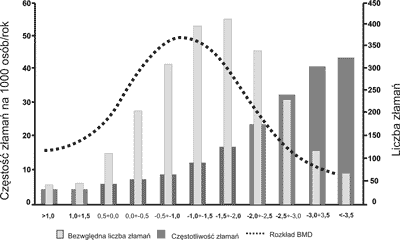 Ryc. 1. Częstotliwość i liczebność złamań na tle naturalnych, populacyjnych poziomów BMD [12]
Badania epidemiologii złamań ostatnich lat, konfrontujące złamania niskoenergetyczne z BMD wykazały, że od 55% do 75% tych złamań ma miejsce u osób z masą kostną na pograniczu normy i osteopenii, przy T-score wokół -1,5 [11, 13, 14].
Dotykają więc one w przewadze osób niewypełniających kryteriów densytometrycznych osteoporozy (T-score -2,5) WHO z 1994 roku [1], za to obciążonych innymi niż niska masa kostna, przyczynami obniżenia wytrzymałości kości. O ile definicja osteoporozy z 1994 roku, sprzed badań epidemiologicznych złamań, opisywała jej postać starczą (spadek masy kostnej z zaburzoną mikroarchitekturą), to już definicja NIH z 2000 roku wspomina jedynie obniżoną wytrzymałość kości jako przyczynę podatności kości na złamanie w wyniku niewielkiego urazu [15].
Nie zachęca to do skupiania się na definiowaniu i rozpoznawaniu osteoporozy jako choroby o jednolitych cechach etiologicznych, patogenetycznych i klinicznych. Jest to raczej złożony i wieloprzyczynowy problem łamliwości kości. Stawia on przed nami wymóg oceny ryzyka złamania, z jakiegokolwiek powodu by ono nie wynikało.
2. Metodologia obliczania indywidualnego bezwzględnego zagrożenia złamaniem
Nie negując znaczenia i doceniając rolę utraty masy kostnej, wiemy już, że rozpoznawanie choroby w oparciu tylko o wiek i jeden parametr (np. BMD) znacznie ogranicza możliwość oceny zagrożenia złamaniem. W każdym bowiem osobniczym przypadku na ilość/jakość/wytrzymałość kości wpływają uwarunkowania genetyczne, konstytucyjne, styl życia i odżywiania, choroby towarzyszące, używki, tzn. zidentyfikowane badaniami epidemiologicznymi czynniki negatywnie nań wpływające. Podobnie jak brak zmian w EKG i prawidłowy poziom cholesterolu nie wykluczają zagrożenia zawałem, bo może ono wynikać z powodu np. nadciśnienia, otyłości czy cukrzycy.
Podobnie wiedza o cechach jakościowych kości nie wystarcza do oceny ryzyka złamania bez uwzględnienia oddziaływania czynników zewnętrznych. Przy dwóch identycznych pod każdym względem kośćcach, z których jeden doznał złamania w wyniku upadku, osteoporoza ujawniła się u niego wyłącznie dzięki zadziałaniu czynnika zdecydowanie pozakostnego. Jakiekolwiek badanie samej tkanki kostnej stanowi tylko część działań zmierzających do rozpoznania zagrożenia złamaniem.
Mając świadomość ograniczonych możliwości narzędzi do diagnostyki ryzyka złamań, musimy w pełni wykorzystać te, którymi dysponujemy. Szereg metaanaliz zidentyfikowało owe niezależne i samodzielnie wystarczające do zwiększenia ryzyka złamania czynniki, wśród nich i wiek, i niską masę kości. Wysokości RW tych czynników przedstawiają tabele 3, 4, 5. Zrozumiałe, że tym większe jest to ryzyko, im więcej takich czynników jednocześnie oddziałuje.
Tabela 3. Niezależne, samodzielne wystarczające do zwiększenia ryzyka złamań czynniki i ich iloczyn ryzyka względnego (RW).
Tabela 4. Wartości RW złamania b.k.k.u. wynikającego z BMI (RWBMI) [19].
Tabela 5. Wzrost RW złamania w lokalizacji, w której przeprowadzono badanie BMD u kobiet, w miarę spadku BMD o każde Z-score –1,0 (tzn. o 1,0 SD, odchylenia standardowego, spadku BMD poniżej średniej wieku) [20].
Chociaż nie wykazano w stopniu statystycznie znamiennym niezależnego wpływu na zwiększenie ryzyka złamań, czynnikami niekorzystnie oddziałującymi na metabolizm kości również są:
– mała aktywność fizyczna, szczególnie z zaburzeniem koordynacji mięśniowo-nerwowej i ze skłonnością do upadków;
– zły ogólny stan zdrowia ze współoddziaływaniem chorób przewodu pokarmowego (zespół złego wchłaniania, resekcja żołądka), pierwotnej i wtórnej nadczynności przytarczyc, przewlekłej niewydolności nerek;
– niedożywienie, szczególnie z niedoborami białka, wapnia i witaminy D (w tym długotrwały brak ekspozycji skóry na światło słoneczne).
Ilustracją wpływu oddziaływania klinicznych czynników ryzyka (RW-K.Cz.R.) na wzrost populacyjnego, 10 letniego prawdopodobieństwa złamania biodra (RP-10 b.k.k.u.) i/lub głównych złamań osteoporotycznych (RP-10 z.o.) w każdym wieku u kobiet i u mężczyzn wyrażone w procentach, są modelowe wyniki epidemiologii złamań w Szwecji (wg 2) przedstawione w tabelach 6 i 7:
Tabela 6. Wpływ klinicznych czynników ryzyka (RW-K.Cz.R.) na ryzyko populacyjne (RP-10 b.k.k.u.) złamania biodra w populacji szwedzkiej w różnym wieku (wg 2).
Tabela 7. Wpływ klinicznych czynników ryzyka (RW-K.Cz.R.) na ryzyko populacyjne głównych złamań osteoporotycznych – biodra, kręgu, k.ramiennej, Collesa (RP-10 z.o.) u kobiet i u mężczyzn w różnym wieku w populacji szwedzkiej (wg 2).
Narzędziami, jakimi obecnie dysponujemy, aby ocenić indywidualne prawdopodobieństwo złamania osteoporotycznego, jest ryzyko populacyjne RP-10 i indywidualne, kliniczne ryzyko względne RW-K.Cz.R. Ich integracja była przedmiotem uprzednich opracowań i rekomendacji w Polsce (23, 24).
Aktualnie wchodzi w życie algorytm WHO, stosujący metodę FRAX(tm) (WWW.shef.ac.uk/FRAX), pozwalający na realizację założonego, dwuetapowego postępowania wobec osteoporozy (25, 26, 27). Jego zasadniczym celem jest możliwość oceny ryzyka złamania w każdym gabinecie lekarskim, bez uzależniania jej od wyniku jakiegokolwiek innego badania specjalistycznego, w tym głównie od BMD. W czasie pierwszego kontaktu z pacjentem lub przy badaniach przesiewowych, na podstawie wywiadu o niezależnych czynnikach ryzyka złamań, wieku i wskaźnika masy ciała FRAX(tm)BMI umożliwia wyznaczenie pułapu 10-letniego ryzyka złamań osteoporotycznych (kręgi, biodra, nadgarstek, ramię) lub tylko szyjki kości udowej (przykład w tabelach 8 i 9).
Tabela 8. 10-letnie prawdopodobieństwo (%) złamania szyjki kości udowej wynikające z masy ciała ( BMI) i liczby klinicznych czynników ryzyka złamania (CRF – K.Cz.R.) w populacji kobiet powyżej 50 r.ż. w Anglii obliczone metodą FRAX(tm).
Wiek 50-59 lat
Wiek 60-69 lat
Wiek 70-79 lat
Wiek 80-89 lat
Istotne przekroczenie ryzyka populacyjnego stanowi wskazanie do badania BMD biodra, które ponownie weryfikuje ocenę RB-10 i pozwala na podjęcie decyzji o potrzebie leczenia hamujacego resorpcję kości, szczególnie lekami aktywnymi tylko przy T-score poniżej -2.0. Służy temu celowi FRAX(tm)BMD. Przykładem jest tabela 8.
Tabela 9. 10-letnie prawdopodobieństwo (%) złamania osteoporotycznego (kręgi, nadgarstki, kości ramienne, biodra) wynikające z masy kostnej ( BMD, T-score sz.k.u., Ang. FN) i liczby klinicznych czynników ryzyka (K.Cz.R., ang. CRF) w populacji kobiet Anglii powyżej 50 r.ż. obliczone metodą FRAX(tm)BMD.
Wiek 50-59 lat
Wiek 60-69 lat
Wiek 70-79 lat
Wiek 80-89 lat
Liczby w nawiasach nie oznaczają przedziału ufności, ale ponieważ poszczególne czynniki ryzyka mają różną moc/rozpiętość oddziaływania, odzwierciedlają ten przedział. Inne, poza r.z.s., osteoporozy wtórne nie są brane pod uwagę, jeśli znane jest BMD, które określa stopień zagrożenia złamaniem w FRAX(tm)BMD.
Ujednolicenie sposobu obliczania RB-10 w Europie jest konieczne ze względu na potrzebę operowania wspólnym językiem określającym stopień zagrożenia złamaniem i celowość podejmowania leczenia. W Unii Europejskiej EMEA wyznaczyła standardy oceny leków, które mogą być zarejestrowane do leczenia osteoporozy. Zarówno EMEA (28), jak i WHO (26) oraz European Society of Clinical Aspects of Osteoporosis and Osteoarthritis (ESCEO) (27) operują metodą FRAX(tm)BMI i FRAX(tm)BMD. Aby zatem porównać i dostosować ocenę polskiej populacji kobiet powyżej 40 r.ż. do ww. standardu oraz wyrobić sobie pogląd na populacyjne ryzyko złamania, wykorzystaliśmy kohortę BOS-2 (29).
U 1608 kobiet w wieku od 45 do 89 lat, średnio 63,9 lat z przypadkowego doboru w regionie białostockim analizowano: wiek, BMI, wywiad dotyczący niezależnych czynników ryzyka – n.cz.r.z. (przebyte złamanie, wywiad rodzinny złamania biodra, przewlekła glukokortykosteroidoterapia-GKT, reumatoidalne zapalenie stawów-r.z.s., nikotynizm i alkoholizm) oraz BMD DXA w Li-L4 i szyjce kości udowej. We wszystkich przypadkach obliczono RB-10 metodą FRAX(tm)BMI (bez BMD) i FRAX(tm)BMD wyznaczając ryzyko populacyjne złamania bez i z uwzględnieniem BMD*.
Odsetkowa analiza występowania w/w n.cz.r.z wskazuje na następującą kolejność: BMI mniejsze od RW=1.0 w 36,5%, przebyta złamanie osteoporotyczne po 50 roku życia w 27,0%, nikotynizm w 14,8%, wywiad rodzinny złamania biodra w 11,7%, r.z.s. w 6,8%, przewlekła GKT w 2,1%, alkoholizm w 0,4%. Taki jest profil przyczyn ponadpopulacyjnego ryzyka złamania w polskiej populacji BOS-2.
10-letnie ryzyko populacyjne złamania osteoporotycznego biodra, kręgu, Collesa i ramienia oraz samej szyjki kości udowej z i bez badania BMD metodą FRAX prezentują ryciny 2 i 3:
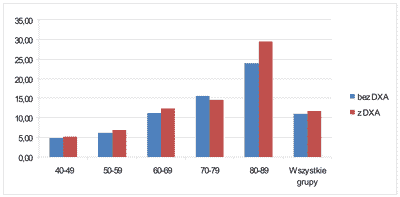 Ryc. 2. 10-letnie prawdopodobieństwo złamania osteoporotycznego u polskich kobiet (RP-10 z.o.) ocenione bez i z BMD (DXA sz.k.u.) metodą FRAX(tm) na podstawie epidemiologii złamań kobiet w Anglii.
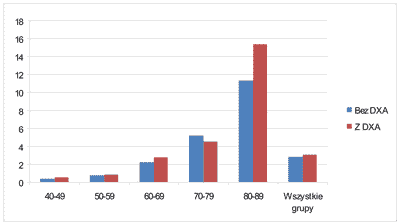 Ryc. 3. 10-letnie prawdopodobieństwo złamania szyjki kości udowej u polskich kobiet (RP-10 sz.k.u.) ocenione bez i z BMD (DXA sz.k.u.) metodą FRAX(tm) na podstawie epidemiologii złamań kobiet w Anglii.
Wyniki wskazały na rosnące RP-10 z.o.z wiekiem, podobnie ocenianego zarówno bez, jak i z badaniem BMD, kolejno bez BMD/z BMD: w V dekadzie życia 4,80%/5,20%, w VI – 6,18%/6,82%, w VII – 11,14%/12,45%, w VIII – 15,51%/14,49% i w IX – 23,89%/29,51%. Średnie RP-10 wszystkich kobiet po 45 roku życia – 11,0% bez badania BMD i 11,8% z BMD. W samej RP-10 sz.k.u. – w V dekadzie życia 0,42%/0,54%, w VI – 0,79%/0,87%, w VII – 2,2%/2,77%, w VIII – 5,18%/4,53%, i w IX – 11,36%/15,43%, z średnim RP-10 – 2,8% bez badania BMD i 3,1% z BMD.
3. Dyspensaryzacja każdej badanej osoby do odpowiedniego poziomu ryzyka i kwalifikacja do leczenia
Dysponując wagą, wzrostem i BMI oraz wywiadem o klinicznych czynnikach ryzyka, znając ryzyko populacyjne (RP-10), u każdej badanej osoby mamy możliwość odczytu RB-10 z tabel FRAX(tm)/BMI, j.w. Pozwala to na zakwalifikowanie badanej osoby do jednego z trzech poziomów zagrożenia złamaniem osteoporotycznym (ryc. 4). Ten typ złamań jest najodpowiedniejszy do oceny populacji polskiej ze względu na krótszy okres przeżycia kobiet polskich niż angielskich, co głównie wpływa na porównanie RP-10 sz.k.u. populacji o niższej (±78 lat) wobec wyższej (±88 lat) śmiertelności. W dalszych analizach będziemy posługiwali się RP-10 z.o. Pamiętając średnie populacyjne RP-10 z.o. populacji w Polsce – 11,0% bez badania BMD i 11,8% z BMD, kwalifikujemy ryzyko badanej osoby do wysokiego, jeśli istotnie przekracza ryzyko populacyjne w swoim przedziale wieku, i przez to wymaga już leczenia, średniego – wokół RP-10 właściwemu wiekowi, powinien być kierowany na badanie BMD do dalszej decyzji, oraz istotnie mniejszego od RP-10 swojej grupy wiekowej, nie wymagającej interwencji leczniczej ani dalszych badań.
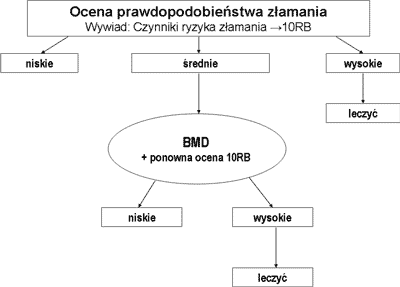 Ryc. 4. Kryteria dyspensaryzacji i kwalifikacji do leczenia [26, 31].
Europejska Agencja Medyczna (European Medicine Agency) opierając się na stwierdzonej częstości występowania złamań w grupach placebo w ramach przeprowadzonych badań klinicznych [28] zaleca, by kryterium włączeniowym do badań nad nowymi lekami były następujące poziomy RB – 10 złamania: b.k.k.u. 5%-7,5%, głównych złamań osteoporotycznych pozakręgowych (b.k.k.u., Collesa, bliższy koniec ramienia, miednicy, żebra, b.k. piszczeli) 10%-15% oraz kręgosłupa 15%-20%.
Co decyduje o wysokości progu interwencji leczniczej, skoro jedynie złamanie, które wystąpiło po nieadekwatnie małym w stosunku do skutku urazie (powszechnie zwane złamaniem osteoporotycznym), rozpoznaje chorobę (osteoporozę) i gdzie wszystkie inne zabiegi usiłują ją tylko przewidzieć, po to, aby nie dopuścić do pierwszego lub następnego złamania? Istotą i szansą zapobiegania czy leczenia osteoporozy jest zmniejszenie oddziaływania czynników ryzyka i poprawienie kondycji kości.
Przy jakim zagrożeniu złamaniem interwencja lecznicza jest zbędna, uzasadniona, konieczna, skoro wynika ona zarówno z preferencji zdrowotnych pacjenta, jak i z jego i państwa oraz ubezpieczyciela możliwości budżetowych?
Pierwszą wskazówką jest zagrożenie populacyjne, tzn. RP-10. Leczeniu powinny być poddane osoby o ponadpopulacyjnym ryzyku, w granicach ekonomicznie uzasadnionych. O tym zaś decyduje zamożność płacących za leczenie.
Drugą wskazówkę przynosi rozważenie, co składa się na leczenie, skoro leczenie przyczynowe ma niewielką szansę. Osteoporoza nie ma jednolitej etiologii i jednolitej patogenezy, ma tylko jednakowy skutek: zmniejszenie wytrzymałości kości, które może nie podołać rutynowemu, codziennemu obciążeniu, a usiłuje to ocenić RB-10. Na wiek, obciążenie dziedziczne, przebyte już złamanie, niskie BMI nie mamy wpływu. Prawie każdy czynnik ryzyka złamania indukuje inne zmiany w kościach (kumulacja mikrozłamań, zbyt intensywna lub zbyt wolna przebudowa kości prowadząca do niewystarczającej lub nadmiernej mineralizacji, geometria kości itd., niektóre złamania przebiegają z nadmierną resorpcją kości, inne nie).
Większość zarejestrowanych leków antyresorpcyjnych wykazuje skuteczność tylko u chorych z niską masą kostną, co jest zrozumiałe, gdyż nadmierna resorpcja u nich była przyczyną osteoporozy. Jakie zatem mamy możliwości zmniejszenia ryzyka złamania u osób z wysokim zagrożeniem, ale z prawidłową lub tylko „osteopeniczną” BMD? Dążenie do zminimalizowania oddziaływania wykrytych wywiadem czynników ryzyka jest wtedy leczeniem jedynie możliwym. Stąd wywiad jest niezbywalnym elementem dalszego postępowania i żadne inne badanie go nie zastąpi.
*Autorzy BOS-2 wyrażają wdzięczność Prof. J. Kanisowi i Pani H. Johansson za merytoryczną i metodyczną pomoc w opracowaniu i analizę statystyczną 1608 zestawów informacji, porównując ją z epidemiologią złamań kobiet w Anglii.
Pomiar gęstości mineralnej kości
Pomiar gęstości mineralnej kości nie jest wykonywany w celu diagnostyki, ale do oceny bezwzględnego ryzyka złamania
Wprowadzenie
Pomiar gęstości mineralnej kości (BMD) był dotychczas uznawany za kryterium decydujące o rozpoznawaniu lub wykluczeniu osteoporozy. Stosując przyjęty przez WHO w 1994 roku próg rozpoznawnia T-score -2,5 [1] kwalifikowano pacjentów do leczenia osteoporozy lub uznawano ich za zdrowych [2]. Niestety, takie postępowanie nie spełnia podstawowego wymogu diagnostycznego, bowiem nie pozwala na odróżnienie osób z podwyższonym ryzykiem złamania od niezagrożonych. Obniżenie gęstości mineralnej zwiększa ryzyko złamania, ale wartości prawidłowe też go nie wykluczają [3, 4].
1. Wskazania do badania densytometrycznego
W świetlne obecnych zaleceń WHO/IOF badanie densytometryczne jest kolejnym etapem oceny bezwzględnego ryzyka złamania i wykonujemy je u osób obciążonych czynnikami ryzyka. Zatem wskazania do badania densytometrycznego są następujące [5, 6]:
– weryfikacja wartości względnego ryzyka złamania,
– podejrzenie obniżenia masy kostnej skutkiem istniejących schorzeń lub zażywania leków [7, 2],
– weryfikacja chorych planowanych do leczenia współczesnymi lekami antyresorpcyjnymi, które jest skuteczne przy obniżonej masie kostnej,
– monitorowane leczenie.
2. Zasady pomiaru gęstości mineralnej kośćca
Metoda pomiaru. Standardową metodą pomiaru gęstości mineralnej kości jest podwójna absorpcjometria rentgenowska ( DXA - Dual Energy X-ray Absorptiometry). W wyniku pomiaru otrzymujemy bezwzględną wartość gęstości mineralnej wyrażoną wg masy ( BMC- Bone Mineral Content). Podzielenie tej liczby przez powierzchnię pomiaru daje gęstość mineralną kości w g/cm2 ( BMD – Bone Mineral Density). Metodę DXA cechuje bardzo wysoka precyzja pomiaru i minimalne narażenie na promieniowanie. Błąd pomiaru wynosi 1-2%, a dawka zaabsorbowana tylko 0,6-2 mSv (dzienna dawka promienienia kosmicznego 5-8 mSv). Standardową aparaturą DXA są densytometry całego ciała wiązki pojedynczej lub nowocześniejsze – wiązki wachlarzowej. Aparaty te nie różnią się precyzją pomiaru. Aparat wiązki wachlarzowej wykonuje pomiar szybciej i daje obraz densytometryczny wystarczającej jakości do pomiarów morfometrycznych kręgosłupa i analiz biomechanicznych bliższego końca kości udowej [8].
Miejsce pomiaru. Pomiar BMD najdokładniej ocenia ryzyko złamania dla miejsca szkieletu, w którym jest wykonany [8]. IOF/WHO przyjęło pomiar BMD b.k.k. udowej za podstawę do obliczania 10-letniego bezwzględnego ryzyka złamania (RB-10), ponieważ złamanie w tym miejscu jest najcięższym powikłaniem osteoporozy w aspekcie klinicznym i ekonomicznym, a zarazem jest najdokładniej ewidencjonowane w lecznictwie [6, 10]. Obniżenie BMD w b.k.k. udowej ma ponadto najsilniejszy gradient ryzyka złamania. Przy obniżeniu o 1 SD ryzyko złamania wzrasta 2,6-krotnie, podczas gdy taki sam spadek BMD w kręgosłupie oznacza wzrost ryzyka 1,6-krotny [11]. Należy również podkreślić, że kryteria diagnostyczne WHO z 1994 r. opierały się właśnie na pomiarach b.k.k. udowej u kobiet w okresie menopauzy [1, 12]. Stąd też zalecenia IOF z 2000 r. podkreślają, że do rozpoznawania osteoporozy wg tych kryteriów upoważnia wyłącznie pomiar w b.k.k. udowej [5].
Ograniczenie pomiarów BMD tylko do bkk udowej nie jest wolne od kontrowersji. Złamania kręgosłupa mają również istotny wpływ na śmiertelność i chorobowość populacji. Zasada, że pomiar w danym odcinku szkieletu najlepiej przewiduje jego ryzyko złamania odnosi się również do kręgosłupa. Ponadto wszystkie badania kliniczne współczesnych leków stosowały za kryterium włączenia badanie BMD kręgosłupa i z tym kryterium diagnostycznym są dopuszczone do leczenia. Pomiar w kręgosłupie jest zalecany przez IOF do monitorowania leczenia, bowiem tutaj wzrost BMD będzie największy i najszybszy z racji dużej zawartości kości beleczkowej [3].
Większość towarzystw naukowych uznaje rozpoznanie osteoporozy również na podstawie pomiaru BMD w kręgosłupie, co jest niezgodne ze stanowiskiem IOF/WHO (International Society for Clinical Densitometry (ISCD), National Osteoporosis Society (NOS) oraz National Osteoporosis Foundation (NOF) i towarzystw kanadyjskich [7, 2, 13].
Podsumowując, optymalne wydaje się wykonywanie pomiaru BMD zarówno w b.k.k. udowej, jak i w kręgosłupie, a załączony „Kalkulator RB-10” (ryc. 3) umożliwia wykorzystanie do obliczenia RB-10 Z-scorów w obu lokalizacjach [14].
Analizy pomiarów densytometrycznych. Powszechnie przyjęte zasady pomiarów densytometrycznych określają konkretne miejsca pomiarów w obrębie szkieletu (ROI-Region of Interest). W b.k.k. udowej są nimi: szyjka (neck), krętarz (trochanter) trójkąt Warda (Ward) i total (obejmujący szyjkę, krętarz i trójkąt Warda). Do diagnostyki wybieramy najniższy pomiar w zakresie szyjki lub total. Trójkąt Warda nie nadaje się do diagnostyki ani do monitorowania [2, 8, 15].
Do analizy pomiarów w kręgosłupie wykorzystujemy uśrednione wartości pomiarów L1-L4 w projekcji AP. Nigdy nie opieramy się na pomiarze jednego kręgu, z analizy natomiast należy wykluczyć krąg złamany. Zasadniczą wadą pomiarów BMD w kręgosłupie jest to, że pojawiające się z wiekiem zmiany zwyrodnieniowe powodują zwiększenie absorpcji promieniowania rtg i wynik staje się niewiarygodny [2, 16].
3. Badanie kontrolne i porównywanie wyników
Kontrolne badanie BMD wykonuje się w okresach rocznych. Wynika to z oczekiwanego zakresu zmiany gęstości (kilka procent) i z błędu metody. O wzroście lub spadku można mówić, jeżeli zmiana gęstości u danego pacjenta jest większa od określonej dla danej pracowni densytometrycznej najmniejszej znamiennie zmiany (LSC – Lower Significant Change). Porównania wyników densytometrycznych u pacjenta dokonujemy na podstawie bezwzględnej wartości BMD wykonanej tym samym aparatem i w tym samym miejscu. Bardzo często spotykanym błędem jest porównanie zmian w zakresie wskaźników T-score lub Z-score. Bezwzględne wyniki pomiarów różnych typów aparatów są nieporównywalne [2, 16].
4. Badania przesiewowe
Wartość prowadzenia badań przesiewowych w kierunku osteoporozy na podstawie badania densytometrycznego jest dyskusyjna. Są zalecane przez National Osteoporosis Foundation (USA) [13]. Obowiązującym standardem w Europie jest selektywna identyfikacja chorych do badania densytometrycznego zalecana przez większość krajowych i międzynarodowych organizacji. Niestety, nie jest to uzasadnione ekonomicznie, bowiem np. u kobiet po 50 r.ż. stwierdzimy osteoporozę u ok. 30% badanych, czyli u pozostałych 70% badanie będzie wykonane niepotrzebnie. Niestety wystąpienie złamania jest bardziej prawdopodobne w tej drugiej grupie [17]. Badania przesiewowe powinny być prowadzone w oparciu o ocenę bezwzględnego ryzyka złamania, a nie na podstawie badania densytometrycznego [18].
5. Pomiary gęstości mineralnej kości innymi metodami i w innych lokalizacjach
Ilościowa tomografia komputerowa ( QCT - Quantitative Computed Tomography) umożliwia oznaczenie gęstości mineralnej zarówno w szkielecie osiowym (b.k.k. udowa i kręgosłup), jak i w miejscach obwodowych. Oznacza gęstość mineralną zgodnie z prawami fizyki, tj. stosunek masy do objętości, a nie do powierzchni, jak w metodzie DXA. Ponadto pozwala na niezależny pomiar gęstości mineralnej kości beleczkowej i korowej. Na pomiar nie wpływa ani wielkość kości, ani obecność zmian zwyrodnieniowych, np. kręgosłupa. Ma wielką wartość naukową, ale nie jest uznana za badanie standardowe [19].
Ilościowa ultrasonografia QUS ( Quantitative Ultrasonography) nie określa gęstości mineralnej kości, a tylko parametry akustyczne kości. Nie może być stosowana w diagnostyce osteoporozy. Metoda ta może być wykorzystywana do oceny ryzyka złamania [5, 13].
Wskaźniki T-score i Z-score, obliczane na podstawie innych metod i w innych miejscach pomiarów, nie mogą być stosowane wymiennie w stosunku do oznaczeń metodą DXA w b.k.k. udowej [2, 5].
Badanie radiologiczne w osteoporozie
Badanie rtg kręgosłupa zleca się w celu stwierdzenia złamań trzonów kręgowych, które oznaczają wielokrotny wzrost ryzyka złamania
Wprowadzenie
Badanie radiologiczne stanowi podstawę rozpoznania złamania, które jest niepodważalnym, a niekiedy jedynym dowodem na istnienie osteoporozy. Stąd też skuteczność terapeutyczna leków opiera się na stwierdzeniu zmniejszenia liczby złamań trzonów kręgowych przez badanie radiologiczne w grupie osób leczonych w porównaniu z grupą kontrolną.
1. Rozpoznawane złamania kręgosłupa w rtg
Rozpoznawanie złamania kręgosłupa ma ogromne znaczenie rokownicze i jest niedoceniane. Po jego wystąpieniu ryzyko następnego złamania kręgosłupa wzrasta 11-krotnie, a bkk udowej 2–3-krotnie [1]. Występują one u 25% kobiet po 50 r.ż. [2], przy czym aż 60% złamań kręgosłupa jest bezobjawowych [3]. Zatem informacja, jaką uzyskujemy z wywiadu pytając o przebyte złamania, nie jest do końca prawdziwa, bowiem chora najczęściej nie wie, czy miała złamanie kręgosłupa. O złamaniu kręgosłupa może świadczyć zmniejszenie wzrostu. Obniżenie wzrostu o 2 cm w ciągu 1-3 lat wskazuje na złamanie kręgosłupa z 35-procentowym prawdopodobieństwem, a brak obniżenia wyklucza złamanie w 93.6%. Orientacyjnie przyjmuje się, że zmniejszenie wzrostu o 4,0 cm wskazuje na obecność złamania [4].
2. Wskazania do badania radiologicznego kręgosłupa w osteoporozie
Do badania radiologicznego kręgosłupa w osteoporozie ustalono następujące wskazania:
– dolegliwości bólowe wskazujące na świeże złamanie kręgosłupa,
– utrata wzrostu ok. 4 cm,
– weryfikacja skuteczności leków w badaniach klinicznych,
– podejrzenie innych schorzeń stanowiących wskazanie do wykonania rtg.
3. Zasady oceny radiogramów kręgosłupa
Niezbędne jest wykonanie osobno radiogramu odcinka piersiowego i lędźwiowego. W celu diagnostyki oceny złamań kręgów wykonujemy radiogramy w projekcji bocznej, natomiast przy innych wskazaniach również w projekcji AP. Ocenie podlegają odcinki Th4-Th12 oraz L1-L4. Wszystkie złamania kręgosłupa są kompresyjne. Z racji deformacji odróżniamy złamania [5, 6]:
– klinowe – obniżona wysokość przednia (najczęstsze),
– dwuwklęsłe – obniżona wysokość środkowa,
– zmiażdżeniowe – obniżona wysokość tylna.
Do oceny złamań kręgosłupa stosujemy półilościową metodę wg Genanta [7, 8]. Jest to metoda prosta, najczęściej stosowana w praktyce odróżnia deformacje od 0 do 3 stopnia.
– stopień 0 – trzon prawidłowy,
– stopień 1 – niewielka deformacja, obniżenie wysokości trzonu około 20-25%,
– stopień 2 – umiarkowana deformacja, obniżenie wysokości około 25-40%,
– stopień 3 – ciężka deformacja, obniżenie wysokości i powierzchni około 40%.
4. Ilościowa ocena złamań kręgosłupa
Częste wątpliwości, czy widoczna na radiogramie deformacja już jest złamaniem rozwiązuje morfometria radiologiczna (MRX – Morphometric radiography). Jest to metoda bezwzględnie wymagana w badaniach klinicznych weryfikujących skuteczność antyzłamaniową leków. Wprawdzie jej realizacja nie wymaga szczególnych umiejętności, ale jest ona, niestety, czasochłonna. Pomiar można przeprowadzić za pomocą zwykłej linijki lub metodą komputerową po digitalizacji radiogramu.
Na radiogramie mierzymy kolejno wysokość kręgu: tylną, środkową i przednią. Następnie obliczamy procentową różnicę wysokości w stosunku do wysokości tylnej. Jeżeli złamanie obejmuje również wysokość tylną, to odnosimy ją do kręgu leżącego powyżej lub poniżej.
Za próg złamania przyjmuje się najczęściej obniżenie 20% [9, 10].
5. Diagnostyka różnicowa
Badanie radiologiczne kręgosłupa lub szkieletu obwodowego stosujemy w diagnostyce różnicowej wielu schorzeń:
– chorób metabolicznych kości, jak: osteomalacja, choroba Pageta, dysplazja włóknista kości, odruchowa dystrofia współczulna (choroba Sudecka);
– zespoły endokrynogenne: nadczynność przytarczyc, nadczynność tarczycy, choroba Cushinga;
– choroba nowotworowa: szpiczak mnogi, ogniska przerzutów i pierwotne nowotwory kości;
– zespoły bólowe kręgosłupa i inne.
Laboratoryjna diagnostyka różnicowa niskiej masy kostnej
Stwierdzenie niskiej masy kostnej wymaga przeprowadzenia diagnostyki różnicowej w oparciu o badania laboratoryjne
Wprowadzenie
Obniżenie gęstości minerału kostnego (BMD) o więcej niż 2,5 wartości odchylenia standardowego w stosunku do szczytowej masy kostnej (T-score) do niedawna uważano za kryterium rozpoznania osteoporozy, a wykonywanie podstawowych badań laboratoryjnych u wszystkich osób diagnozowanych w kierunku osteoporozy pierwotnej za obowiązujące.
W świetle aktualnej wiedzy wartość BMD (T-score poniżej -2,5) uznano za jeden z czynników ryzyka złamania kośćca w osteoporozie (ale niepatognomiczny dla osteoporozy), a zlecanie i wykonywanie podstawowych badań analitycznych krwi u każdej kobiety po menopauzie z osteoporozą pierwotną (bez nieprawidłowości wskazujących na istnienie innych przyczyn, skutkujących rozwojem osteoporozy wtórnej, tj. leki, choroby ogólnoustrojowe, niedobory żywieniowe) za niecelowe – z wyjątkiem oznaczeń TSH [1, 2].
Zebranie wywiadu i badanie fizykalne zazwyczaj pozwala na identyfikację pacjentów zagrożonych złamaniem (scrining selektywny) wskutek osteoporozy pierwotnej (niedobór estrogenów, starzenie się ustroju) lub osteoporozy wtórnej (inne znane przyczyny) już przez lekarza opieki podstawowej. Podejrzenie osteoporozy wtórnej jest podstawą do bezpośredniego kierowania tych osób do dalszej diagnostyki i leczenia specjalistycznego - w zależności od choroby podstawowej [3].
Zaobserwowano jednak, że u jednej na pięć kobiet po menopauzie kierowanych do Poradni Specjalistycznej Osteoporozy celem leczenia osteoporozy pierwotnej, u których wykonano badanie BMD, przyczyną obniżenia masy kostnej nie jest osteoporoza pierwotna, ale inna choroba ogólnoustrojowa o przebiegu asymptomatycznym skutkująca obniżeniem BMD (najczęściej jest to skutkiem niedoboru witaminy D, pierwotnej i wtórnej nadczynności przytarczyc, chorób wątroby, nerek lub nadczynności tarczycy) [2, 4, 5, 6, 7, 8].
Dlatego u osób, u których stwierdzono obniżoną masę kostną (T-score poniżej –2,5), nawet bez wywiadu i cech klinicznych wskazujących na istnienie osteoporozy wtórnej (asymptomatycznych), niezbędne jest przeprowadzenie diagnostyki różnicowej obniżonej BMD na podstawie ukierunkowanych, specjalistycznych badań laboratoryjnych. Dobór badań powinien być taki, aby jak najtrafniej i przy minimalnym koszcie postawić trafną diagnozę.
Przytaczane w literaturze algorytmy diagnostyki różnicowej niskiej BMD, zalecane przez Organizacje i Towarzystwa zajmujące się osteoporozą, nie są jednolite, a niektóre z tych Towarzystw nawet nie ustalają strategii postępowania (tabela 9) [9, 10, 11]. Przyczyn tej sytuacji należy dopatrywać się w braku danych populacyjnych dotyczących częstości występowania nieprawidłowych wyników badań laboratoryjnych u osób dotkniętych osteoporozą - chorobą asymtomatyczną do chwili wystąpienia złamania.
Tabela 9. Algorytmy diagnostyki różnicowej niskiej BMD zalecane przez Organizacje i Towarzystwa zajmujące się osteoporozą.
Przy braku konsensusu co do rodzaju i zakresu diagnostyki laboratoryjnej niskiej masy kostnej u osób asymptomatycznych (bez wywiadu i cech klinicznych, wskazujących na przyczynę obniżonego BMD) w ustalaniu przyczyn niskiej masy kostnej pozostają do wykorzystania doświadczenia klinicystów z uwzględnieniem dostępności do badań laboratoryjnych, a także zdolności finansowych płatnika pokrywającego koszty diagnostyki.
Po weryfikacji przyczyn obniżonej BMD powinno się dopiero włączyć odpowiednie postępowanie terapeutyczne w przypadku osteoporozy wtórnej przyczynowe, a osteoporozy pierwotnej w oparciu o kompleksową ocenę ryzyka złamania w perspektywie dziesięcioletniej [RB-10) [12,13,14].
1. Czy wykonanie podstawowych badań krwi u każdej kobiety po menopauzie z osteoporozą jest konieczne?
Odpowiedzią na to jest analiza badań laboratoryjnych (wtórna) uzyskanych w badaniach FIT ( Fracture Intervention Trial), w których udział wzięło 15 316 zdrowych (na podstawie wywiadu) kobiet po menopauzie. U wszystkich kobiet w wieku 55-80 lat przeprowadzono badania: składu morfologicznego krwi, czynności wątroby i nerek, gospodarki mineralnej (wapń, fosfataza alkaliczna), elektrolitów, badań gęstości mineralnej kości (BMD) w szyjce kości udowej (BMD-neck) i całym kośćcu (BMD-total), rtg kręgosłupa. Na podstawie wartości BMD (kryteria WHO) wyłoniono grupę kobiet z osteoporozą i bez niej, a wynik badania rtg stał się podstawą wyodrębnienia dwóch grup chorych ze złamaniami trzonów kręgowych lub bez ich złamań.
Analiza częstości występowania nieprawidłowych wyników badań laboratoryjnych (jednego lub więcej) wykazała, że wstępują one u 57,5% wszystkich obserwowanych, a po uwzględnieniu BMD jest tak samo częsta (tzn. nie różni się) u kobiet z obniżonym BMD i prawidłowym (57,1% vs 58,3%) – z wyjątkiem TSH.
Obecność niskiego TSH stwierdzono u 4,9% kobiet z obniżonym BMD i 3,7% w grupie kobiet z prawidłowym BMD; dodatni wskaźnik prawdopodobieństwa wynosił 1,2. Nie stwierdzono różnic w częstości występowania nieprawidłowych badań laboratoryjnych także u kobiet ze złamaniami trzonów kręgowych w porównaniu z grupą kobiet bez złamań (57,1% vs 55,8%) – z wyjątkiem TSH; dodatni wskaźnik prawdopodobieństwa wynosił 1,4 [2].
W świetle przytoczonych informacji (wskazujących, że częstość nieprawidłowych badań jest taka sama w grupie osób zdrowych, zarówno z niską masą kostną, jak i prawidłową), a także danych opublikowanych ostatnio przez Rajsewaran C. [15], powszechne zlecanie przez lekarzy wykonywania u wszystkich kobiet po menopauzie z osteoporozą pierwotną panelu podstawowych badań laboratoryjnych wydaje się niecelowe, ponieważ „nie dyskryminują” one osób z niską i prawidłową masą kostną. Pociągają one natomiast dodatkowe koszty i wywołują niepokój u badanych. Tylko oznaczenie TSH może być pomocne w wykryciu ukrytej patologii tarczycy, skutkującej osteoporozą wtórną. Powstaje jednak pytanie, jak diagnozować przyczynę niskiej masy kostnej?
2. Diagnostyka różnicowa niskiej masy kostnej (możliwe strategie)
Dotychczas nie ustalono jednoznacznie, jaki panel (zestaw badań laboratoryjnych) powinien być wykonany, aby jak najtrafniej ustalić (uwzględniając ich dostępność i koszty) przyczynę niskiej masy kostnej u osób asymptomatycznych.
Retrospektywne badania Tannenbauma i wsp.[16], przeprowadzone w grupie 664 kobiet zdrowych, ale z osteoporozą, wykazały, że przyczyną niskiej masy kostnej aż w 32,4% były inne choroby o przebiegu asymptomatycznym.Najczęstszą przyczyną była hiper- i hipokalciuria, zaburzenia wchłaniania u osób z przewlekłymi chorobami przewodu pokarmowego, nadczynność przytarczyc – pierwotna i wtórna – oraz niedobór wit. D. Procent właściwych rozpoznań był zależny od doboru dodatkowych badań specjalistycznych i wynosił od 59% do 98%. Wykonanie dobowej kalciurii i TSH u wszystkich kobiet, a w przypadku jej nieprawidłowości rozszerzenie badań u tych osób o oznaczenie w krwi stężenia wapnia i PTH, pozwoliło w 59% na ustalenie przyczyny niskiej BMD. Wykonanie jednocześnie oznaczenia dobowej kalciurii, TSH, stężenia wapnia i PTH w krwi pozwoliło na ustalenie właściwego rozpoznania u 86%, a po ich rozszerzeniu o oznaczenie 25(OH)D procent właściwych rozpoznań zwiększył się aż do 98. Koszt diagnostyki różnicowej niskiej masy kostnej w oparciu o wyżej wymienione badania diagnostyczne wynosił odpowiednio 116, 272 i 366 dolarów, a średni koszt badań laboratoryjnych u jednego pacjenta wynosił 22,75 i 116 dolarów.
Biorąc pod uwagę % rozpoznań (86%) i koszty (272 dolary), Tannenbaum w celu wyjaśnienia przyczyny niskiej BMD sugeruje wykonywanie następujących badań: stężenie wapnia w krwi, PTH, TSH oraz dobowe wydalanie wapnia z moczem. Badania Freitaga i Barzela [17] dotyczące diagnostyki różnicowej niskiej masy kostnej, z wykorzystaniem podobnego zakresu badań dodatkowych, wskazują nie tylko na konieczność oznaczenia 25(OH)D w surowicy krwi (pomimo wzrostu kosztów), ale i uznanie jej wartości 30 ng/ml za minimalną prawidłową (nie dochodzi wtedy do wzrostu wydzielania PTH, a wchłanianie wapnia z przewodu pokarmowego jest maksymalne). Wskazaniem do oznaczania 25(OH)D są wyniki badań nad częstością niedoborów wit. D w populacjach osób zdrowych, u których wykazano, że aż 70% osób dorosłych ma niedobory tej witaminy, co skutkuje (w miarę czasu ich trwania) obniżeniem BMD [4, 17].
3. Algorytm diagnostyki różnicowej niskiej masy kostnej – na podstawie doświadczenia klinicystów
Przy braku konsensusu co do rodzaju i zakresu diagnostyki laboratoryjnej niskiej masy kostnej u osób bez wywiadu i cech klinicznych, wskazujących na jej przyczynę (asymptomatyczni), pozostają do wykorzystania doświadczenia klinicystów w ustalaniu przyczyn niskiej masy kostnej (różnicowanie najczęstszych uogólnionych osteopatii, tj. osteoporozy pierwotnej z osteomalacją, pierwotną i wtórną nadczynnością przytarczyc, szpiczakiem mnogim) [13, 17, 18].
W świetle danych literatury i doświadczeń własnych, uwzględniając dostępność i koszt badań dodatkowych u każdego chorego ze zmniejszoną gęstością mineralną kości należy wykonać badania laboratoryjne. Celowe jest ich wykonanie w dwóch etapach. Rozpocząć należy od badań podstawowych krwi oraz tradycyjnych badań biochemicznych oceniających gospodarkę wapniową (pierwszego rzutu), a w uzasadnionych przypadkach prowadzić dalszą diagnostykę, wykorzystując badania laboratoryjne specjalistyczne (drugiego rzutu).
Badania podstawowe (1-go rzutu):
– OB, morfologia,
– kalcemia, fosfatemia,
– fosfataza zasadowa, aminotransferazy, kreatynina,
– UCa/24h.
Badania specjalistyczne (2-go rzutu):
– PTH,
– 25(OH)D,
– białko monoklonalne.
W interpretacji wyników badań należy uwzględnić rodzaj stosowanej diety, aktualnie przyjmowane leki, czynność nerek i wątroby (odgrywają zasadniczą rolę w regulacji homeostazy wapniowo-fosforanowej).
Wysokie wartości odczynu opadania krwinek czerwonych (OB) nakazują prowadzenie badań w kierunku szpiczaka mnogiego (tabela 10). Hiperkalcemia sugeruje przede wszystkim pierwotną nadczynność przytarczyc lub chorobę nowotworową, często o przebiegu skąpo- lub bezobjawowym. Hipokalcemia u osoby z obniżoną masą kostną przemawia za osteomalacją. Hipofosfatemię stwierdza się najczęściej w osteomalacji i pierwotnej nadczynności przytarczyc. Zwiększona aktywność fosfatazy zasadowej w surowicy krwi u chorego z prawidłową czynnością wątroby może występować w osteomalacji, przy zaawansowanych zmianach kostnych - w pierwotnej nadczynności przytarczyc i szpiczaku mnogim. Zwiększone wydalanie wapnia z moczem (UCa/24h) towarzyszy chorobom przebiegającym z hiperkalcemią, tj. pierwotnej nadczynności przytarczyc i szpiczakowi mnogiemu. Hiperkalciuria przy prawidłowym stężeniu Ca w surowicy krwi wskazuje na hiperkalciurię samoistną. Hipokalciuria może występować u osób z osteomalacją wskutek niedoboru wit. D. Oznaczenie aminotransferaz i kreatyniny jest pomocne w ujawnieniu przewlekłej patologii wątroby i nerek, skutkujących rozwojem wtórnej nadczynności przytarczyc i zmianami kostnymi; ułatwiają one też dobór właściwego leczenia i dawkowanie leków) [16, 17, 18, 19].
Tabela 10.Różnicowanie przyczyn niskiej masy kostnej.
Jeśli u osób z obniżonym BMD badania podstawowe są nieprawidłowe (tabela 10), to należy wykonać dodatkowe badanie specjalistyczne (drugiego rzutu) ukierunkowane na rozpoznanie konkretnej choroby (PTH-nadczynność przytarczyc, białko monoklonalne - szpiczak mnogi, 25(OH)D - osteomalacja z niedoboru wit. D) [13, 15, 16, 22].
Koszt wykonania badań laboratoryjnych pierwszego rzutu wynosi od 42 do 70,0 PLN, a drugiego od 92 do 210 PLN; kosztów tych nie pokrywa w pełni Narodowy Fundusz Zdrowia w ramach świadczeń za ambulatoryjną opieką specjalistyczną (bez względu na typ porady).
Leczenie osteoporozy/zapobieganie złamaniom
Leczeniem należy objąć osoby obciążone ryzykiem złamania powyżej ryzyka populacyjnego w perspektywie najbliższych 10 lat
Wprowadzenie
Celem leczenia w osteoporozie jest zapobieganie złamaniom kości: pierwszemu u osób, które nie doznały złamania, a następnemu, u których już wystąpiło złamanie. Leczenie osteoporozy obejmuje: ograniczenie wpływu czynników ryzyka złamań, w tym zapobieganie upadkom itp oraz poprawę jakości kości [1, 2, 3].
1. Kogo leczyć?
Leczenie powinno być skierowane do osób, które są obciążone ryzykiem złamania powyżej ryzyka populacyjnego. Ryzyko to wynika z przyczyn klinicznych, pozaszkieletowych i szkieletowych, które oceniane łącznie (na podstawie wywiadu) określają poziom indywidualnego bezwzględnego (RB) zagrożenia złamaniem w przedziale 10-letnim (RB-10) i wyznaczają próg interwencji leczniczej [4].
Wysokość tego progu jest wynikiem ugody i opracowań różnych grup eksperckich, działających w oparciu o uwarunkowania ekonomiczne w swoim kraju. Wartości progu interwencji leczniczej dla złamania b.k.k.u. określonego dla płci i wieku proponowane przez różnych autorów wahają się od 10% do 14% i 20%, a nawet 25%. Decyzja o konieczności wdrożenia leczenia farmakologicznego jest tym łatwiejsza, im indywidualne ryzyko złamania (RB-10) jest większe i im bardziej dotyczy b.k.k.u. [3, 5].
W świetle danych literatury (brak pełnych opracowań polskich) wydaje się, że pacjentom przy RB-10 niższym niż 8% powinno zalecać się zdrowy styl życia, zapobieganie upadkom oraz poprawę ogólnej sprawności fizycznej. Wysokie RB-10, tj. powyżej 14%, wymaga włączenia leczenia niezależnie od wielkości masy kostnej (BMD). Przy średnim zagrożeniu złamaniem (RB-10 pomiędzy 8%-14%) o potrzebie leczenia może przesądzić wynik pomiaru BMD. Obniżona wartość BMD może przesunąć ocenę poziomu zagrożenia złamaniem powyżej 14% i zdecyduje o konieczności terapii, a prawidłowa wartość wskaże na celowość działań tylko profilaktycznych (rycina 4).
2. Leczenie farmakologiczne
Terapia farmakologiczna z wykorzystaniem leków zarejestrowanych do leczenia osteoporozy wpływa na podstawowe procesy zachodzące podczas przebudowy tkanki kostnej, tj. resorpcję (leki antyresorpcyjne) i/lub tworzenie kości (leki anaboliczne). Poprawia ona zatem jakość kości, zwiększając jej wytrzymałość mechaniczną i dlatego są skuteczne (zwłaszcza leczenie antyresorpcyjne) tylko u osób z niską masą kostną.
Wprowadzenie do praktyki diagnozowania i leczenia zagrożenia złamaniami 10-letniego ryzyka złamania (RB-10), a nie diagnozowania „choroby” i wypełniania jej definicji, jednak spowodowało wymuszenie:
– poszukiwań leków zmniejszających ryzyko złamania u pacjentów z prawidłową masą kostną, u których owo ryzyko wypływa z przyczyn innych niż nadmierna resorpcja kości;
– badań nad innymi niż densytometria sposobami oceny jakości kości.
Unijne ustawodawstwo wykonało już istotny krok w tym kierunku. EMEA [6], Europejska Instytucja ds. Rejestracji Leków ze skutkiem 31.05.2007 zaleciła rejestrację tylko tych leków „do leczenia osteoporozy pomenopauzalnej z wysokim ryzykiem złamania”, które, wykonane w wysokim standardzie, wykażą skuteczność u osób z wysokim ryzykiem [6].
Lekami zmniejszającymi ryzyko złamania niezależnie od masy kostnej obecnie nie dysponujemy. Do czasu wprowadzenia leków zmniejszających zagrożenie złamaniem przy każdej masie kostnej logiczną wskazówką do podjęcia decyzji terapeutycznych wydaje się być metaanaliza wystandaryzowanych prób klinicznych oceniających wpływ badanej interwencji na ryzyko złamań. Opiera się ona na losowym doborze pacjentów, w próbie podwójnie zaślepionej, pod kontrolą placebo, opublikowanej w indeksowanym czasopiśmie i powszechnie jest uznana za dowód o najwyższej wiarygodności. Ostatnio przeprowadził ją Belgian Bone Club i stanowi podstawę poniższego przeglądu [1].
W tabelach 11 i 12 wymieniono leki zarejestrowane w Unii Europejskiej wraz z analizą ich skuteczności w hamowaniu złamań kręgów (tab. 11) i w hamowaniu złamań b.k.k. udowej (tab. 12) u kobiet w trzech zakresach densytometrycznych: w osteopenii (T-score między –1.0 a –2.5), w osteoporozie bez złamań (T-score równe i poniżej –2.5) i w zaawansowanej osteoporozie (T-score poniżej –2.5 z obecnością złamań). Opracowanie to jest szczególnie przydatne obecnie, a już wiemy, że większość złamań niskoenergetycznych ma miejsce w zakresie masy kostnej powyżej progu T-score –2.5.
Tabela 11. Skuteczność leków w hamowaniu złamań kręgów (w próbach klinicznych z pacjentkami losowo dobieranymi, leczonymi vs placebo + wapń i wit. D).
DN – Działanie nie udowodnione; ? – działanie udowodnione w zaplanowanym celu badania klinicznego ? – działanie udowodnione w powtórnej analizie badania klinicznego
Tabela 12. Skuteczność leków w hamowaniu złamań pozakręgowych, w tym b.k.k.u. (w próbach klinicznych z pacjentkami losowo dobieranymi, leczonymi vs placebo + wapń i wit. D).
DN – działanie nie udowodnione; ? – działanie udowodnione w zaplanowanym celu badania klinicznego; ? – działanie udowodnione w powtórnej analizie badania klinicznego; ? – działanie udowodnione w zaplanowanym celu badania klinicznego w odrębnej podgrupie pacjentek
3. Zasady wyboru terapii i zalecenia
Wspomniana metaanaliza [1] formułuje następujące uwagi i rekomendacje:
– Pokrycie dziennego zapotrzebowania na wapń i witaminę D odgrywa pierwszoplanową rolę w zapobieganiu i strategii leczenia osteoporozy. W Polsce przy średnim spożyciu wapnia w ilości 400 mg i powszechnym niedoborze witaminy D suplementacja 600-800 mg wapnia elementarnego, jak również 800 IU witaminy D jest uzasadniona w 6-8 dekadzie życia, zaś w starszym wieku powyższe wymogi zwiększają się, uwzględniając także, stosowanie aktywnej formy wit. D, alfa-kalcidolu, w dziennych dawkach 0,5-1,0 μg.
– Hormonalna terapia zastępcza nie stanowi obecnie leczenia pierwszego rzutu ze względu na skuteczność przeciwzłamaniową (kręgów i przedramienia) tylko do 60 r.ż. i na możliwe zagrożenia nowotworowe sutka i jajników oraz prawdopodobieństwo nasilenia powikłań sercowo-naczyniowych. Uzasadnionym jest oferowanie jej tylko osobom z wypadowymi objawami klimakterycznymi, najkrócej i możliwie w najmniejszej dawce.
– Działanie kalcytoniny ujawnia się głównie w kości beleczkowej. Jej przeciwbólowe właściwości są zaletą w ostrym okresie złamań kręgów. Uciążliwość formy inie-kcyjnej, jak i wysoka cena postaci donosowej, ogranicza jej stosowanie.
– Raloksyfen, jedyny zarejestrowany obecnie selektywny modulator receptora estrogenowego, stanowi opcję u kobiet z niską masą kostną, z/bez złamań kręgów. Hamuje złamania kręgów już w zakresie BMD osteopenii.
– Bisfosfoniany – alendronian (10 mg/dobę) i risedronian (5 mg/dobę) – hamują ryzyko złamań b.k.k.u. u pacjentek z zaawansowaną osteoporozą, stanowiąc pierwszorzędową opcję u kobiet w zaawansowanym wieku. Ibandronian wykazuje znamienną skuteczność w osteoporozie ze złamaniami, ograniczając zagrożenie nowymi złamaniami kręgów i pozakręgowymi. Ibandronian od 2005 r. dostępny jest w dawce 150 mg raz w miesiącu [7], a w styczniu 2006 r. zarejestrowano formę dożylną ibandronianu w dawce 3 mg raz na 3 miesiące) [8].
– Czas trwania leczenia nie powinien przekraczać czasu przeprowadzonego badania klinicznego wykazującego jego skuteczność i bezpieczeństwo. To stanowisko wynika z nowych badań na modelach zwierzęcych, wskazujących na osłabienie wytrzymałości kości przez nadmierne zahamowanie resorpcji kości, prowadzące do nadmiernej mineralizacji i niezdolności do samonaprawy mikrozłamań. Jednotygodniowe dawki alendronianu (70 mg) i risedronianu (35 mg) wykazują podobną reakcję ze strony BMD i wydalania markerów tworzenia i resorpcji, podobny profil bezpieczeństwa, większy komfort przyjmowania, sugerując podobną skuteczność p/złamaniową. Wykazują również efektywność w leczeniu osteoporozy posteroidowej u mężczyzn.
– PTH (Teriparatide) hamuje ryzyko złamań kręgowych i pozakręgowych u kobiet w zaawansowanej osteoporozie. Analiza kosztów do korzyści adresuje ten lek do osób o najwyższym stopniu zagrożenia złamaniami i z niską masą kostną.
– Ranelinian strontu, pobudzając tworzenie i hamując resorpcję, hamuje ryzyko złamań kręgów u kobiet z osteopenią, osteoporozą i zaawansowaną osteoporozą. Ryzyko złamań pozakręgowych hamuje u kobiet w 8 i 9 dekadzie życia z niską masą kostną.
Nie wykazano liniowej zależności pomiędzy wzrostem BMD a stopniem hamowania przebudowy kości i ryzyka złamań. Skuteczności p/złamaniowej leków nie powinno się więc porównywać na podstawie krzywych wydalania markerów (istnieją trzy odmienne ich typy, jak w przypadku bisfosfonianów, parathormonu i strontu) ani BMD (brak proporcji pomiędzy stopniem potencji p/złamaniowej a stopniem wzrostu BMD). Iistnieje taki związek natomiast w przypadku bisfosfonianów. U osób nimi leczonych coroczna kontrola BMD ma uzasadnienie w monitorowaniu skuteczności leczenia, podobnie jak zasadne jest monitorowanie skuteczności leczenia raloksyfenem przy użyciu wskaźników przebudowy, w dążeniu do osiągnięcia jej tempa sprzed menopauzy.
Brak jest wystarczających dowodów na zwiększenie istotnej skuteczności poprzez łączenie ww. leków, mogą się natomiast sumować objawy niepożądane oraz niekorzystnie zahamować fizjologiczną, potrzebną przebudowę kości.
Prewencja upadków/zapobieganie złamaniom
Zapobieganie upadkom ma krytyczne znaczenie w prewencji złamań. Każdy pacjent w wieku podeszłym, niezależnie od podejrzenia o osteoporozę powinien być poinformowany o ryzyku upadkiem i możliwości jego unikania
Wprowadzenie
Upadek jest bezpośrednią przyczyną prawie wszystkich złamań pozakręgowych i części złamań kręgosłupa. Ewidentny wpływ zagrożenia upadkami na ryzyko złamania wykazano w badaniu EPIDOS [1] i OFELY [2]. Podkreśla to również w swoich publikacjach Kanis JA [3], ale nie dysponujemy obecnie danymi upoważniającymi nas do uwzględnienia ryzyka upadków w obliczaniu RB-10. Niemniej jednak zapobieganie upadkom ma krytyczne znaczenie w prewencji złamań. Każdy pacjent w wieku podeszłym, niezależnie od podejrzenia o osteoporozę, powinien być poinformowany o ryzyku upadkiem i możliwości jego unikania.
1. Częstość upadków i ich skutki
Upadek jest to nagła i niezamierzona zmiana pozycji ciała z poziomu dotychczas zajmowanego na niższy z utratą przytomności lub bez [4, 5]. Upadki są przyczyną 100% złamań przedramienia, 90% złamań bliższego końca kości udowej i około 25% złamań kręgosłupa [6]. Po 65 r.ż. około 35-40% ogólnie zdrowych, samodzielnych osób upada co najmniej raz w roku, a po 80 r.ż. prawie 50% [7]. Wykazano, że pacjenci hospitalizowani upadają 3 razy częściej niż osoby mieszkające samodzielnie. Kobiety upadają 3-krotnie częściej niż mężczyźni [8, 9]. 60% upadków ma miejsce w domu, pozostałe na zewnątrz [10]. Około 5% upadków kończy się złamaniem, z czego połowa to złamania b.k.k. udowej [11]. Pacjenci domów pomocy i szpitali doznają znacznie częściej złamań, bo aż 10-25% upadków prowadzi do złamania, zranienia lub wymaga specjalistycznej opieki medycznej. Z tego powodu upadki są jedną z głównych przyczyn inwalidztwa i piątą co do częstości przyczyną zgonów osób powyżej 75 r.ż. [12].
2. Przyczyny upadków
Na upadek składa się najczęściej kilka przyczyn, które można podzielić na: zewnętrzne (środowiskowe) i medyczne (wewnętrzne) [5].
Czynniki zewnętrzne (środowiskowe):
– w domu: słabe oświetlenie, przeszkody na podłodze, śliskie dywaniki, nieprawidłowe obuwie, brak uchwytów w łazience, progi, schody,
– poza domem: śliskie powierzchnie, nierówne chodniki, lód, śnieg, transport publiczny.
Czynniki wewnętrzne (medyczne) to opisanych dotąd około 400 [13] różnych czynników ryzyka upadków; z tego tylko kilkanaście ma udokumentowane badania spełniające kryteria EBM (medycyna oparta na faktach) (tab. 13).
Tabela 13. Czynniki ryzyka upadków spełniające kryterium EBM (medycyny opartej na faktach) [14].
Do innych najczęściej podawanych czynników należą: omdlenia, choroby serca, zaburzenia neurologiczne, leki (sedatywne, psychotropowe, kardiologiczne), terapia wielolekowa [4].
3. Strategia zapobiegania upadkom
Ogólnymi programami zapobiegania upadkom powinna być objęta cała populacja, a indywidualnie dobranymi osoby, które są zagrożone upadkami. Takimi osobami są pacjenci starsi (60-65 lat) oraz osoby obarczone czynnikami ryzyka upadku. Na strategie zapobiegania upadkom składają się: identyfikacja osób zagrożonych upadkiem, wieloczynnikowa analiza upadków i wieloczynnikowa prewencja upadków.
Identyfikacja osób zagrożonych upadkiem. Wg rekomendacji National Institute for Clinical Exellence UK każdego starszego pacjenta zgłaszającego się do lekarza (rodzinnego lub specjalisty) należy rutynowo pytać o występowanie upadków w ciągu ostatniego roku. Pacjent, który zgłasza występowanie co najmniej jednego upadku powinien mieć przeprowadzone badanie chodu i równowagi. Na podstawie jego wyników należy rozważyć ewentualne dalsze postępowanie, zgodnie z modyfikowanym algorytmem za American Geriatric Society (ryc. 5) [4].
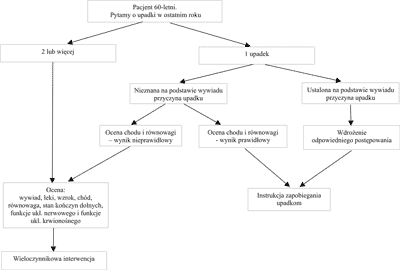 Ryc. 5. ALGORTYM POSTĘPOWANIA W ZAPOBIEGANIU UPADKOM na podstawie Am Geriat Soc, Brit Geriat Soc, Am Acad of Orthop Sur Panel on Falls Prevention [15].
Na analizę zagrożenia upadkiem składają się: ocena zażywanych leków, badanie wzroku, ocena chodu i równowagi, badanie neurologiczne, badanie układu sercowo-naczyniowego [15].
Do oceny chodu i równowagi rekomendowanych jest kilka testów klinicznych; większość z nich jest czasochłonna, wymaga doświadczenia oraz dużego nakładu pracy.
Oto dwa testy, łatwe do wykonania w codziennej praktyce:
– Test chodu pięta-palce; pacjent najpierw stoi, stopa za stopą, a następnie porusza się po linii, kładąc stopy jedna za drugą. Wykonuje około 20 drobnych kroków. Nieprawidłowy wynik testu polega na niemożności wykonania poprawnie całego zadania (zboczenie z linii prostej lub niemożności przejścia poprawnie całego dystansu) [16].
– Test „wstań i idź” (The timed "up and go” test); pacjent wstaje z krzesła bez użycia rąk, idzie do przodu 3 metry, zawraca i siada na krześle. Mierzymy czas wykonania testu w klasyfikacji 5-punktowej, biorąc pod uwagę, że prawidłowy czas wynosi 7-10 sek [17]. Wynik prawidłowy – 1 nie wskazuje na ryzyko upadku, a 5 potwierdza duże zagrożenie upadkiem. Ponadto bardzo istotną informacją jest, czy pacjent używa rąk przy wstawaniu z krzesła. Jak wykazał D.M. Black, ryzyko złamania u chorych, które potrzebują podparcia wzrasta 2,3-krotnie [18].
Wieloczynnikowa analiza ryzyka upadku. Na podstawie dotychczasowych badań zaleca się, by u wszystkich pacjentów z osteoporozą i tych, którzy doznali upadku w ostatnim roku lub mają nieprawidłowy wynik testów równowagi i chodu, przeprowadzić wieloczynnikową analizę ryzyka upadku [4]. Powinna ona obejmować:
1. szczegółowy opis dotychczasowych upadków,
2. ocenę chodu, równowagi, ruchomości i siły mięśniowej,
3. ocenę ryzyka osteoporozy,
4. ocenę narządu wzroku, funkcji poznawczych (pamięci), badanie neurologiczne,
5. ocenę nietrzymania moczu,
6. ocenę czynników ryzyka w domu,
7. badanie kardiologiczne,
8. weryfikację stosowanych leków.
Do oceny ryzyka upadku niezbędny jest wielodyscyplinarny zespół, w którego skład wchodzą: pielęgniarka, rehabilitant, pracownik socjalny, dietetyk, konsultujący specjaliści, a całość ocenia lekarz prowadzący. Jeżeli nie jest to możliwe, np. z powodów organizacyjnych, Perell proponuje uproszczony model, w którym oceniane są [14]:
– stan zdrowia na podstawie badania fizykalnego (badanie lekarskie),
– badanie/wywiad dotyczących najważniejszych czynników ryzyka (ocena pielęgniarska),
– badanie chodu i równowagi.
Wieloczynnikowy program prewencji upadków. Ponieważ na upadek składa się wiele różnych przyczyn, skuteczne zapobieganie zastosowania wieloczynnikowego programu prewencji, dopasowanego indywidualnie do stwierdzonych zaburzeń, programy te muszą uwzględniać rozpoznane u danego chorego problemy zdrowotne (np. osteoporoza, niewydolność serca, omdlenia) oraz zdiagnozowane czynniki ryzyka. Programy prewencji upadków obejmują 4 zasadnicze obszary interwencji:
– trening siły i równowagi,
– eliminacja domowych czynników ryzyka,
– poprawa funkcjonowania narządu wzroku, układu krążenia, funkcji umysłowych,
– weryfikacja stosowanych leków, włącznie z odstawieniem niektórych środków.
4. Praktyczne zalecenia lekarskie w zakresie zapobiegania upadkom w Polsce
Mając świadomość, że w obecnej sytuacji służby zdrowia w Polsce zarówno wdrożenie przedstawionej analizy przyczyn upadków, jak i wieloczynnikowych programów prewencji jest nierealne, proponujemy tymczasowy uproszczony schemat postępowania [19].
Zalecenia praktyczne:
– Każdego pacjenta po 60 r.ż. pytamy o upadki w ostatnim roku i przebyte złamania.
– Każdego pacjenta, a zwłaszcza z ryzykiem złamania, informujemy, że przyczyną złamań są upadki i co jest ich przyczyną. Przyczyny zewnętrzne – w domu: słabe oświetlenie, przeszkody na podłodze, śliskie dywaniki, obuwie, brak uchwytów w łazience, progi. Przyczyny zewnętrzne – poza domem: śliskie powierzchnie, nierówne chodniki, lód, śnieg, transport uliczny.
– Sprawdzamy czy chory nie jest obciążony typowymi czynnikami ryzyka upadku:
– wzrok (czy dobrze widzi, czy nosi okulary),
– siła mięśniowa (orientacyjne informacje – uścisk dłoni),
– chód (czy nie ma zawrotów głowy, zaburzeń chodu, zmian zwyrodnieniowych stawów,
– czy zażywa leki (uspokajające, sedatywne, nasenne, przeciwdepresyjne).
– Jeżeli pacjent doznał upadku – ustalamy jego przyczyny i wdrażamy odpowiednie leczenie: weryfikujemy wymienione wyżej czynniki ryzyka upadku, oceniamy stan układu neurologicznego, sercowo-naczyniowego, oceniamy chód i równowagę ciała.
– Wdrożenie schematu aktywnego zapobiegania upadkom, jak przedstawiono w tekście opracowania: trening siły i równowagi, eliminacja domowych czynników ryzyka, poprawa funkcjonowania narządu wzroku, układu krążenia, funkcji umysłowych, weryfikacja stosowanych leków, włącznie z odstawieniem niektórych.
– Informujemy o osobistym zabezpieczeniu: „wolne ręce” celem możliwości amortyzacji upadku (torba na ramię lub plecak na zakupy), obuwie z podeszwą przeciwpoślizgową,
– Pomoce ortopedyczne dla osób w złej kondycji fizycznej (laski, balkoniki, podpórki itp.). Piśmiennictwo
1. WHO Study Group. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Technical Report 843. Geneva 1994.
2. Kanis JA, et al.: Assessment of fracture risk. Osteoporosis Int 2005; 16: 581-589.
3. Black DM: Revision of T-score BMD diagnostic thresholds. Osteoporosis Int 2000; 11: Supl. 2: S58.
4. Kanis JA, et al.: An update on the diagnosis and assessment of osteoporosis with densitometry. Osteoporosis Int 2000; 11: 192-202.
5. Kanis JA: Diagnostic criteria for osteoporosis – where do we stand? Osteoporosis Int 2001;12 Supl. 1: S1.
6. Badurski JE i wsp.: Przełomowy rok 2000 w dziedzinie osteoporozy: czy ważniejsze jest wypełnienie kryterium rozpoznania osteoporozy, czy rozpoznanie zagrożenia złamaniem? Postępy Osteoartrologii 2001; 12: 41-53.
7. Badurski JE: Zasady diagnostyki i leczenia osteoporozy i ryzyka złamań oraz leczenia farmakologicznego. Postępy Osteoartrologii 2001;12 Supl. 1: 144-179.
8. Badurski JE: Co diagnozujemy, a co leczymy – zagrożenie złamaniami czy „osteoporozę”? Postępy Osteoartrologii 2002; 13: 1-7.
9. Stanowisko Rady Naukowej Polskiej Fundacji Osteoporozy wobec diagnostyki i leczenia osteoporozy – czerwiec 2002. Postępy Osteoartrologii 2002; 13: 9-10.
10. Kanis JA, et al.: Ten year probabilities of osteoporotic fracture according to BMD and diagnostic thresholds. Osteoporosis Int 2001; 12: 989–995.
11. Nowak NA i wsp.: Epidemiologia osteoporozy u kobiet w aglomeracji Białegostoku (BOS), I: Gęstość kości a złamania. Postępy Osteoartrologii 2003; 14: 1-5.
12. Siris ES, et al.: Bone mineral density thresholds for pharmacological intervention to prevent fracture. Arch Intern Med 2004; 164/10: 1108-1112.
13. Burger H, et al.: Risk factors for increase bone loss in an elderly population: the Rotterdam Osteoporosis Study. Am J Epidemiol 2000; 147/9: 871-79.
14. Wainwright SA, et al.: A large proportion of fractures in postmenopausal women occur with baseline bone mineral density T-score=-2.5. J Bone Miner Res 2001, 16: S155.
15. Osteoporosis Prevention, Diagnosis, and Therapy. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis and Therapy. JAMA 2001, 285/6: 785-794.
16. Kanis JA, et al.: A meta analysis of previous fracture and subsequent fracture risk. Bone 2004; 35: 375-382.
17. Kanis JA, et al.: A family history of fracture and fracture risk: a meta-analysis. Bone 2004; 35(5): 1029-37.
18. Kanis JA, et al.: A meta-analysis of prior corticosteroid use and fracture risk. J Bone Miner Res 2004; 19: 893-9.
19. De Laet C, et al.: A body mass index as a predictor of fracture risk: a meta-analysis. Osteoporosis Int 2005; 16: 1330-8.
20. Marshall D, Johnell O, Wedel H.: Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. Br Med J 1996; 312: 1254-1259.
21. Kanis JA, et al.: Smoking and fracture risk: a meta-analysis. Osteoporosis Int 2005; 16: 155-162.
22. Kanis JA, et al.: Alcohol intake as a risk factor for fracture. Osteoporosis Int 2005;16(7):737-42.
23. Badurski JE, Czerwiński E, Marcinowska-Suchowierska E: Zalecenia Polskiej Fundacji Osteoporozy i Polskiego Towarzystwa Osteoartrologii wobec osteoporozy w oparciu o stanowisko Światowej Organizacji Zdrowia (WHO) i Międzynarodowej Fundacji Osteoporozy (IOF). Ortopedia, Traumatologia, Rehabilitacja 2007; 9 Supl. 3:1-20.
24. Lorenc RS i wsp.: Zalecenia postępowania diagnostycznego i leczniczego w osteoporozie. Obniżenie częstości złamań poprzez efektywną profilaktykę i leczenie. Terapia 2007; 9(3):6-33.
25. Word Health Organization (2007). Assessment of osteoporosis at the primary health care level. Summary Report of a WHO Scientific Group. WHO, Geneva (w druku).
26. Kanis JA: On behalf of the Wordl Health Organization Scientific Group (2007). Assessment of osteoporosis at the primary health-care level. Technical Report. WHO Collaborating Centre, University of Sheffield, UK. 2007 (w druku).
27. Kanis JA, et al.: On behalf of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporosis Int 2007 (w druku).
28. EMEA European Medicines Agency. Guideline on the evaluation of medicinal products in the treatment of primary osteoporosis. London, 16 Nov 2006, oc.Ref.CPMP/EWP/552/95, Rev.2.
29. Badurski JE i wsp.: Populacyjne ryzyko głównych złamań osteoporotycznych i/lub szyjki kości udowej (RB-10 z.o. i RP-10 sz.k.u.) u 1608 kobiet regionu Białegostoku (BOS 2) oceniane metodą FRAX(tm). Reumatologia 2008 (w druku).
30. Kanis JA, et al.: Ten year risk of osteoporotic fracture and the effect of risk factors on screening strategies. Bone 2001, 30:251-258.
31. Johnell O: When is intervention worthwhile in osteoporosis. Fifth Baltic Bone & Cartilafe Conference in Naantali, Finland, 2005.
32. Dobreńko A i wsp.: Impact of BMD measurement on the evaluation of 10-years absolute risk of fracture and intervention threshold in postmenopausal women. A Polish perspective. J Bone Mineral 2006.
1. WHO Study Group. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Technical Report 843. Geneva 1994.
2. Leib ES, Lewiecki EM, Binkley N, Hamdy RC: International Society for Clinical Densitometry. Official positions of the International Society for Clinical Densitometry. J Clin Densitom 2004 Spring; 7(1): 1-6.
3. Kanis JA, et al.: Assessment of fracture risk. Osteoporosis Int 2005;16: 581-589.
4. Dobreńko A i wsp. Impact of BMD measurement on the evaluation of 10-years absolute risk of fracture and intervention threshold in postmenopausal women. A Polish perspective. J Bone Mineral 2006.
5. Kanis JA, Gluer CC: An update on the diagnosis and assessment of osteoporosis with densitometry. Osteoporosis Int 2000; 11: 192-202.
6. Kanis JA, et al.: Ten year probabilites of osteoporotic fractures according to BMD and diagnostic thresholds. Osteoporosis Int 2001; 12:989-995.
7. National Osteoporosis Society. Primary Care Strategy for Osteoporosis and Falls. October 2002.
8. Bonick LS: Bone densitometry in clinical practice. New Jersey: Human Pres; 2004.
9. Lorenc RS (red).: Diagnostyka osteoporozy 2000. Warszawa: Osteoforum; 2000.
10. Badurski JE: Osteoporoza a złamania. Warszawa: Blackhorse Scientific Publishers; 2003.
11. Marshall D, Johnell O, Wedel H: Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. Br Med J 1996; 312:1254-1259.
12. Looker AC, et al.: Prevelance of low femoral bone density in older US adults from NHANES III. J of Bone Min. Res 1997; 12: 1761-1768.
13. National Osteoporosis Foundation: Review of the evidence for prevention, diagnosis and treatment and cost-effectiveness analysis. Osteoporosis Int. 1998, 8, Suppl.
14. Czerwiński E, i wsp.: Stanowisko Polskiego Towarzystwa Osteoartrologii i Wielodyscyplinarnego Forum Osteoporotycznego w sprawie standardów diagnostyki i leczenia osteoporozy w Polsce. Wersja z dn. 21.12.05. Medycyna po Dyplomie 2006 Luty; 4(06): 1-10.
15. Kanis JA, Devogelaer JP, Gennari C: Practical guide for the use of bone mineral measurements in the assessment of treatment of osteoporosis: a position paper of the European foundation for osteoporosis and bone disease. The Scientific Advisory Board and the Board of National Societies. Osteoporosis Int 1996; 6(3): 256-261.
16. Black GM, Wahner HW, Fogelman I: The evaluation of osteoporosis: Dual Energy X-ray Absorptiometry and Ultrasound in Clinical Practice. London: Martin Dunitz Ltd; 1999.
17. National Institutes of Health. Consensus Statement, Osteoporosis, Prevention, Diagnosis, and Therapy. 2000.03. 27-29; 1(17).
18. Kanis JA, et al.: A new approach to the development of assessment guidelines for osteoporosis. Osteoporosis Int 2002; 13: 527-536.
19. Martin JC, Campbell MK, Reid DM: A comparison of radial peripheral quantitative computed tomography, calcaneal utrasound, and axial dual energy X-ray abosorptiometry in women aged 45-55 yr. J Clin Densitom 1999; 2(3): 265-273.
1. Melton LJ III, et al.: Vertebral fractures predict subsequent fractures. Osteop Int 1999; 10(3): 214-221.
2. Kanis JA, et al.: Ten year probabilites of osteoporotic fractures according to BMD and diagnostic thresholds. Osteoporosis Int 2001; 12:989-995.
3. Cooper C: The epidemiology of vertebral fractures. Bone 1993; 14: 89-97.
4. Siminoski K, et al.: Accuracy of height loss during prospective monitoring for ndetection on incydent vertebral fractures. Osteoporosis Int 2005; 16: 403-410.
5. Kleerekoper M, Partiff AM, Ellis BI: Measurement of vertebral fracture rates in osteporosis. w: red. Christiansen Osteoporosis; 103-109. Glostrup, Denmark: Aalborg Stifsborgtrykkeri; 1984.
6. Cummings SR, Cosman F, Jamal SA: Osteoporosis. An evidence-based guide to prevention and management. Philadelphia: Am Coll of Physicians, 2002.
7. Genant HK, et al.: Comparison of methods for in vivo spinal mineral measurement w Proceedings of the 4th International Workshop on Bone and Soft Tissue Densitometry. Journal of Computer Assisted Tomography 1985; 9:630-631.
8. Arnaud CD, et al.: Osteoporosis: Proceedings of the Copenhagen international symposium on osteoporosis; 1984; pp 263-238.
9. National Osteoporosis Fundation working group on vertebral fractures. Report Assessing Vertebral Fractures. J Bone Min Res 1995; 4(10): 518-523.
10. Czerwiński E, Osieleniec J, Borowy P: Złamania w osteoporozie. Twój Magazyn Medyczny. Osteoporoza II. 14/2003, rok VIII, 131;4-10.
1. Kanis JA, et al.: Assesment of fracture risk. Osteoporosis Int 2005; 16: 581-9.
2. Jamal SA, et al.: Clinical utility of laboratory testing in women with osteoporosis. Osteoporosis Int 2005; 16: 534-540.
3. Wehren LE: The role of the primary care physician in diagnosis and management of osteoporosis. Int J Fertil Womens Med 2002; 47: 116-122.
4. Holick MF, et al.: Prevalence of vitamin D inadequacy among postmenopausal North American women receiving osteoporosis therapy. J Clin Endocrinol Metab 2005; 90: 3215-24.
5. Lichtenstein GR, Sands BE, Panzianas M: Prevention and treatment of osteoporosis in inflammatory bowel disease. Inflamm Bowel Dis 2006; 12: 797-813.
6. Cunningham J, et al.: Osteoporosis in chronic kidney disease. Am J Kidney Dis 2004; 43: 556-571.
7. Vestergaard P, Rejnmark L, Mosekilde L: Influence of hyper- and hypothyroidism, and the effects of treatment with antithyroid drugs and levothyroxine on fracture risk. Calcif Tissue Int 2005; 77: 137-144.
8. Favus MJ: (ed) Postmenopausal osteoporosis and the detection of so-called secondary causes of low bone density. J Clin Endocrinol Metab 2005; 90: 3800-1.
9. Badurski JE, Czerwiński E, Marcinowska-Suchowierska E: Zalecenia Polskiej Fundacji Osteoporozy i Polskiego Towarzystwa Osteoartrologii wobec osteoporozy w oparciu o stanowisko Światowej Organizacji Zdrowia (WHO) i Międzynarodowej Fundacji Osteoporozy (IOF). Ortopedia, Traumatologia, Rehabilitacja 2007; 9 Supl. 3:1-20.
10. Lorenc RS i wsp.: Zalecenia postępowania diagnostycznego i leczniczego w osteoporozie. Obniżenie częstości złamań poprzez efektywną profilaktykę i leczenie. Terapia 2007; 9(3):6-33.
11. Word Health Organization (2007). Assessment of osteoporosis at the primary health care level. Summary Report of a WHO Scientific Group. WHO, Geneva (w druku).
12. Badurski JE: Osteoporoza i złamania. Warszawa: Blackhorse; 2003.
13. Mauck KF, Clarke BL: Diagnosis, scrining, prevention and treatment of osteoporosis. Mayo Clin Proc 2006; 81(5): 662-672.
14. Kanis JA, et al.: Ten Year Probabilities of Osteoporotic Fracture According to BMD and Diagnostic Thresholds. Osteoporosis Int 2001; 12: 989-995.
15. Rajeswaran C, et al.: Utility of biochemical screening in the context of evaluating patients with a presumptive diagnosis of osteoporosis. Clin Rheumatol 2007; 26 (3): 362-5.
16. Tannenbaum C, et al.: Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab 2002; 87: 4431-7.
17. Freitag A, Barzel US: Diferential diagnosis of osteoporosis. Gerontology 2002; 48: 98-102.
18. Wagman RB, Maracus R: (ed) Beyond bone mineral density: navigating the laboratory assessment of patients with osteoporosis. J Clin Endocrinol Metab 2002; 87: 4429-30.
19. Ross PD, et al.: Serum bone alkaline phosphatase and calcaneus bone density predict fractures: a prospective study. Osteoporosis Int 2000; 11: 76-82.
20. Giannini S, et al.: Hypercalciuria is a common and important finding in postmenopausal women with osteoporosis. Eur J Endocrinol 2003; 149: 209-213.
21. Bischoff-Ferrari H, et al.: Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr 2006; 84:18-28.
22. Lata PF, Elliot ME: Patients assesment in the diagnosis, prevention and treatment of osteoporosis. Nutr Clin Proc 2007; 22: 261-275.
1. Boonen S, et al.: Evidence-based guidelines for the treatment of postmenopausal osteoporosis: a consensus document of the Belgian Bone Club. Osteoporos Int 2005; 16:239-254.
2. Czerwiński E i wsp.: Stanowisko Polskiego Towarzystwa Osteoartrologii i Wielodyscyplinarnego Forum Osteoporotycznego w sprawie standardów diagnostyki i leczenia osteoporozy w Polsce. Medycyna Po Dyplomie II.2006 (wydanie specjalne).
3. Badurski J: Aktualne możliwości oraz wymogi diagnostyki i leczenia osteoporozy pomenopauzalnej. Polska Fundacja Osteoporozy. Biuletyn Informacyjny 2005; 5.
4. Kanis JA, et al.: Ten year risk of osteoporotic fracture and the effect of risk factors on screening strategies. Bone 2001, 30:251-255.
5. Johnell O: When is intervention worthwhile in osteoporosis. Fifth Baltic Bone & Cartilafe Conference in Naantali, Finland, 2005.
6. EMEA European Medicines Agency, London, 16 Nov 2006, Doc.Ref.CPMP/EWP/552/95, Rev.2: Guideline on the evaluation of medicinal products in the treatment of primary osteoporosis.
7. Chesnut III CH, et al.: Oral Ibandronate Osteoporosis Vertebral Fracture Trial in North America and Europe (BONE). Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004; 19(8): 1241-1249
8. Adami S, et al.: Intravenous Ibandronate injections are at least as effective and similarly well tolerated as daily oral Ibandronate in postmenopausal osteoporosis: 1-year results from DIVA. BONE, June 2005; 36, suppl. 2; S137-S138 (P005-Mo).
1. Robbins JA, et al.: Risk factors for hip fractures in women with high BMD: EPIDOS study. Osteoporosis Int 2005; 16: 149-154.
2. Albrand G, et al.: Independent predictors of all osteoporosis-related fractures in healthy postmenopausal women: The OFELY Study. Bone 2003; 32: 78-85.
3. Kanis JA, et al.: Assessment of fracture risk. Osteoporosis Int 2005; 16: 581-589.
4. National Institute for Clinical Exellence (NICE). Clinical practice guideline for the assessment and prevention of falls in older people. Royal College of Nursing; November 2004.
5. Czerwiński E, Borowy P, Jasiak-Tyrkalska B: Współczesne zasady zapobiegania upadkom z wykorzystaniem rehabilitacji. Ortopedia Traumatologia Rehabilitacja 2006; 8(4): 380-387.
6. Cummings SR, Melton III LJ: Epidemiology and outcomes of osteoporotic fractures. LANCET 2002; May 18: 359.
7. Rubenstein LZ, Josephson KR: The epidemiolgy of falls and syncope. Clinics in Geriatrics Medicine. Philadelphia: W.B Saunders Co; 2002.
8. Nevitt MC, Cummings SR: Type of fall and risk of hip and wrist fractures: the study of osteoporotic fractures. J Am Geriatr Soc 1993; 41: 1226–1234.
9. Greenspan SL, et al.: Fall severity and bone mineral density as risk factors for hip fracture in ambulatory elderly. JAMA 1994; 271: 128–133.
10. Cummings SR, Nevitt MC. Falls: N Engl J Med 1994; 331(14), 872-873. - brak tytułu pracy
11. Runge BM, Schacht E: Multifactorial pathogenesis of falls as a basis for multifactorial interventions. J Musc Neur Interact 2005; 5(2):127-134.
12. Scuffham P, Chaplin S, Legood R: Incidence and costs of unintentional falls in older people in the United Kingdom. Journal of Epidemiology and Community Health 2003; 57, 9: 740-744.
13. Cummings SR, et al.: Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med 1995; 332: 767-773.
14. Perell KL, et al: Fall risk assessment measures: an analytic review. Journals of Gerontology. Series A, Biological Sciences and Medical Sciences 2001; 56(12):M761-M766.
15. American Geriatrics Society, British Geriatrics Society, American Academy of Orthopaedic Surgeons Panel on Falls Prevention. Guideline for the Prevention of Falls in Older Persons. JAGS 2001; 49: 664-672.
16. Jacques P. Brown, Robert G: Josse and The Scientific Advisory Council of the Osteoporosis Society of Canada: 2002 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada. CMAJ November 12, 2002; 167 (90100).
17. Podsiallo D, Richardson S:The Timed Up and Go: A test of Basic Functional Mobility for Frail Elderly Persons. Journal of the American Geriatrics Society 1991; 39:142-148.
18. Black DM, Steinbuch M, Palermo L: An Assessment Tool for Predicting Fracture Risk in Postmenopausal Women. Osteoporosis Int 2001; 12: 519-528.
19. Czerwiński E i wsp.: Stanowisko Polskiego Towarzystwa Osteoartrologii i Wielodyscyplinarnego Forum Osteoporotycznego w sprawie standardów diagnostyki i leczenia osteoporozy w Polsce. Wersja z dn. 21.12.05. Medycyna po Dyplomie 2006 Luty; 4(06): 1-10.
otrzymano/received: 2008-03-26 zaakceptowano/accepted: 2008-05-21 Adres/address: *Ewa Marcinowska-Suchowierska Klinika Medycyny Rodzinnej i Chorób Wewnętrznych CMKP ul. Czerniakowska 231, 00-416 Warszawa e-mail: e.marcinowska@cmkp.edu.pl Pełna wersja artykułu Osteoporoza – ocena ryzyka złamania. Status Quo Arte Anno 2007/2008: Przegląd stanowisk: Światowej Organizacji Zdrowia (WHO), Europejskiej Agencji Medycznej (EMEA), Europejskiego Towarzystwa Klinicznych i Ekonomicznych Aspektów Osteoporozy (ESEAO), Międzynarodowej Fundacji Osteoporozy (IOF), Polskiej Fundacji Osteoporozy (PFO) i Polskiego Towarzystwa Osteoartrologii (PTOA) dostępna w Czytelni Medycznej Borgis. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








