|
© Borgis - Postępy Nauk Medycznych 5, s. 310-316
*Urszula Piotrowska1, Grażyna Adler1, Wanda Krasuska1, Ireneusz Kozicki2
Obecność fosducyny w tarczycy
Presence of phosducin in the thyroid
1Zakład Biochemii i Biologii Molekularnej Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Zakładu: prof. dr hab. Andrzej Gardas 2Klinika Chirurgii Ogólnej i Przewodu Pokarmowego Centrum Medycznego Kształcenia Podyplomowego w Warszawie Kierownik Kliniki: prof. dr hab. med. Krzysztof Bielecki Streszczenie
Fosducyna, występująca w dużych ilościach w siatkówce oka i w mniejszej w szeregu innych narządów, ma zdolność wiązania wszystkich typów heterotrimerycznych białek G. Mogłaby więc regulować też stymulację tarczycy. Metodą immunoblottingu, stosując trzy przeciwciała skierowane przeciw fosducynie, wykazano jej obecność w tarczycy. Występowała ona we frakcji cytoplazmatycznej oraz we frakcji rozpuszczalnych białek jądrowych izolowanych z pooperacyjnych tarczyc wola guzowatego. Wykazano również, że we frakcji białek jądrowych wykrywane są też inne immunoreaktywne białka o wyższych ciężarach cząsteczkowych odpowiadające prawdopodobnie koniugatom fosducyny z SUMO. Obecność fosducyny i jej rozmieszczenie w komórce sugeruje, że fosducyna w tarczycy może regulować przekazywanie sygnałów zarówno w cytoplazmie jak i w jądrze komórkowym. Słowa kluczowe: fosducyna, tarczyca
Summary
Phosducin present abundantly in retina and in smaller amount in some other organs can bind all members of regulatory G protein, so thyroid stimulation could be regulated by phosducin too. By immunoblotting, using three antibodies directed against phosducin, we have shown the presence of phosducin in the thyroid. It was found in cytosolic and soluble nuclear protein fractions isolated from thyroids of patients with multinodular goiter treated by surgery. In soluble nuclear protein fraction, other immunoreactive proteins were found too. They had higher molecular weight and may correspond to the phosducin-SUMO conjugates. The presence of phosducin and its distribution in the cell suggests that in the thyroid phosducin regulates transmission of signals as well to the cytoplasm as to the nucleus. Key words: phosducin, thyroid
Wstęp
Obecne w błonie komórek tarczycy białko o siedmiu transbłonowych helisach stanowiące receptor dla tyreotropiny (TSH), oraz podobnie zbudowane receptory występujące w innych komórkach, przekazują sygnały ze środowiska zewnętrznego do jądra komórkowego za pośrednictwem białek wiążących GTP, tzw. białek G. Jednym z etapów tego szlaku sygnalizacyjnego jest dysocjacja białka G na podjednostki: związaną z GTP podjednostkę Gα posiadającą aktywność GTP-azy i kompleks podjednostek Gβγ. Zarówno kompleks GTP-Gα jak i podjednostki Gβγ reagują z wewnątrzkomórkowymi efektorami (1). Jednym z wewnątrzkomórkowych regulatorów przekazywania sygnału jest fosducyna (Phd) – cytosolowa fosfoproteina o ciężarze cząsteczkowym 28 kDa, wykrywana w elektroforezie (SDS-PAGE) na poziomie 33 kDa. Jej zlokalizowana blisko N-końca domena o sekwencji TGPKGVINDWR odznacza się dużym powinowactwem do podjednostki β białek G. Związanie się Phd z kompleksem podjednostek Gβγ blokuje reasocjację podjednostek w kompletne białko G a także uniemożliwia wiązanie się białek Gβγ z efektorami wewnątrzkomórkowymi lub z błoną komórkową. Fosforylacja powoduje zmiany konformacyjne Phd prowadzące do rozpadu kompleksu i uwolnienia Gβγ (2-4). Z niższym powinowactwem fosducyna wiąże podjednostkę Gα, hamując jej aktywność GTP-azową. Regulatorowa rola fosducyny została szczegółowo zbadana przede wszystkim dla komórek fotoreceptorowych oka, gdzie Phd jest głównym czynnikiem odpowiedzialnym za adaptację wzroku do światła i ciemności.
Obok komórek fotoreceptorowych obecność fosducyny wykazano u ssaków również w: szyszynce, miocytach, śledzionie, grasicy, wątrobie, płucach, sercu, nerkach, nadnerczach, i mózgu (5). W mięśniu sercowym wykazano ekspresję mRNA dla fosducyny, przy czym w kardiomiopatii ekspresja ta była niższa niż w sercach dawców (6). Informacje o tym, jaką funkcję pełni fosducyna w tkankach są fragmentaryczne i pośrednie. Zdolność do wiązania się fosducyny z różnymi wariantami podjednostek białek G (jak Gs, G0, Gi) sprawia, że może ona hamować zarówno aktywność GTP-azową tych białek jak i ich funkcję sygnalizacyjną (7). Stwierdzono np, że w izolowanych neuronach, do których wprowadzono plazmid kodujący fosducynę, dochodzi do zmian inhibicji kanału wapniowego zależnego od noradrenaliny (8).
Wewnątrzkomórkowa aktywność samej fosducyny również może być regulowana w różny sposób; poprzez fosforylację i defosforylację, tworzenie kompleksów bądź koniugatów z innymi cząsteczkami albo przemieszczanie się do innych rejonów komórki.
Fosforylowana fosducyna o zmniejszonym powinowactwie do kompleksu Gβγ ma zwiększone powinowactwo do regulatorowego białka wiążącego fosfoserynę nazwanego 14-3-3.
W komórkach nabłonkowych, do których zaliczają się komórki pęcherzykowe tarczycy powszechna jest izoforma sigma białek 14-3-3. W brodawkowatym raku tarczycy jej stężenie jest podwyższone (9).
Innymi mechanizmami regulującymi aktywność fosducyny (a zatem, pośrednio i szlaku zależnego od białek G) są ubikwitylacja i konkurująca z nią sumoilacja. Utworzenie wiązania między grupą ε-aminową którejś z reszt lizynowych białka a jedną lub kilkoma cząsteczkami ubikwityny kieruje to białko na szlak prowadzący do jego rozkładu w proteasomie. Przyłączenie w tej samej pozycji jednej z czterech izoform małej, ubikwitynopodobnej cząsteczki – tzw. SUMO chroni białko przed degradacją, ale też zmienia jego zadanie w komórce. Sekwencja fosducyny posiada motyw FKLE zidentyfikowany jako miejsce sumoilacji (10). Mutacje wprowadzone do tego regionu cząsteczki fosducyny znacznie obniżają jej trwałość w komórce. Powstanie koniugatu SUMO – Phd, podobnie jak fosforylacja fosducyny, zamyka możliwość wiązania się tej cząsteczki z podjednostkami Gβγ. Nie należy więc wykluczać możliwości, że związanie SUMO pełni podobną do fosforylacji rolę – reguluje dostępność fosducyny dla kompleksu podjednostek Gβγ, ale robi to bardziej dynamicznie – w ciągu sekund a nie, jak w przypadku fosforylacji minut. Nie zostało to jednak udowodnione. Bardziej prawdopodobna wydaje się funkcja sumoilacji wykazana dla innych białek podlegających tej modyfikacji. Przyłączenie SUMO powoduje przemieszczenie cząsteczki ze szlaku regulowanego białkami G do jądra komórkowego (11). Wykazano też istnienie korelacji między tworzeniem się koniugatów SUMO z białkami – regulatorami transkrypcji a zahamowaniem ekspresji genu (12).Obecność fosducyny w jądrach komórkowych została po-twierdzona dla komórek fotoreceptorowych bydła domowego (13).
Oprócz fosducyny wykryto w komór-kach szereg białek o sekwencji aminokwasów w około 41% zgodnej z sekwencją fosducyny – tzw. białek fosducynopodobnych, tworzących wraz z fosducyną rodzinę cytoplazmatycznych białek regulatorowych. Białka tej rodziny posiadające sekwencje N–końcowe fosducyny – PhLPL, PhLPS, PhLP1 – zdolne są, podobnie jak ona, do wiązania podjednostek Gβγ i regulowania przekazywania sygnału. Te, którym brak tej sekwencji – PhLOP1 i PhLOP2 nie wiążą Gβ. PhLOP1, podobnie jak fosducyna, w C-końcowym rejonie cząsteczki posiada domenę wiążącą fotoreceptorowy czynnik transkrypcyjny CRX (14) i potencjalny mediator transkrypcji, proteasomowe białko SUG1 (15), ale w przeciwieństwie do niej lokalizowana jest głównie w jądrach komórek fotoreceptorowych i transfekowanych komórek COS-7 (14).
W gruczole tarczowym główny szlak stymulacji komórki przez TSH zachodzi z udziałem białka Gs i aktywację cyklazy adenylanowej. TSH indukuje jednak również zmiany zależne od regulatorowego białka Gq/G11 prowadzące do stymulacji fosfolipazy C. U myszy, których tyrocyty selektywnie pozbawiono podjednostki α białka Gq/11 rozwijała się niedoczynność tarczycy (17). W błonach ludzkiej tarczycy zidentyfikowano też obecność białek G należących do pozostałych podstawowych typów, Gi, i G12 oraz wykazano, że in vitro TSH aktywuje wszystkie typy tych białek (17). W procesie stymulacji komórek tarczycy jest więc miejsce na funkcję regulatorową fosducyny. Przedstawiona praca miała na celu zbadanie występowania fosducyny w ludzkiej tarczycy.
Materiały i metody
Przeciwciała poliklonalne przeciwko fosducynie
Przeciwciała królicze otrzymano po zaszczepieniu królików koniugatem syntetycznego peptydu i hemocyjaniny z krwi ślimaka Keyhole limpet (KLH).
Do immunizacji wybrano następujące peptydy o sekwencjach pochodzących z fosducyny:
– p33 (CSQSLEEDFEGQATHTGPK) obejmujący aminokwasy 6-23 z dodaną na początku łańcucha cysteiną.
– p34 (CKIKASNTGAGDRFSLDVLPT) obejmujący aminokwasy 168-188.
Sprzęganie peptydów 33 i 34 z KLH przez sulfo – SMCC przeprowadzono zgodnie z instrukcją producenta zestawu do sprzęgania firmy Pierce.
Króliki szczepiono trzykrotnie emulsją utworzoną z roztworu koniugatu i adjuwanta Freunda. Miano przeciwciał przeciwko peptydom mierzono testem ELISA.
Dodatkowo zakupiono w firmie Santa Cruz Biotechnology kozie poliklonalne przeciwciała Phd(N15) skierowane przeciwko N-końcowemu fragmentowi cząsteczki fosducyny.
Oczyszczanie surowic odpornościowych przeciwko fosducynie
Przeciwciała poliklonalne przeciwko fosducynie (ap33 i ap34) oczyszczono na NHS-Sefarozie (Pharmacia Biotech) sprzęgniętej z peptydami p33 i p34 zgodnie z instrukcją producenta.
Przeciwciała rozpoznające peptyd wiązały się z kolumną podczas przepuszczania przez nią surowicy odpornościowej. Niespecyficznie zaadsorbowane składniki surowicy eluowano zbuforowanym roztworem soli fizjologicznej (PBS), a związane przeciwciała 100 mM glicyną o pH 3. Każdą frakcję wycieku zobojętniano 1 M buforem fosforanowym pH 8. Białka w eluacie oznaczano metodą BCA (Pierce) albo metodą Bradforda (Sigma - Aldrich). Aktywność otrzymanych przeciwciał kontrolowano testami ELISA, w których peptydy p33, p34 lub preparat fosducyny z siatkówki oka związane były z fazą stałą.
Otrzymywanie standardu fosducyny z frakcji cytoplazmatycznej komórek siatkówki oka
Do badań ilościowych oraz do przygotowania własnego standardu fosducyny z siatkówki wołowego oka zastosowano handlowy standard rekombinowanej fosducyny firmy Roche. Sekwencja fosducyny wołowej i ludzkiej jest zgodna w 88 procentach, miejsca rozpoznawane przez przeciwciała królicze ap33 i ap34, są zgodne w 100%, tak więc fosducyna wołowa mogła być używana jako standard w elektroforezie i immunoblottingu.
Zaadaptowane do ciemności siatkówki izolowano z gałek ocznych pod lampą fotograficzną w temperaturze 4°C, stosując bufor o składzie: 10 mM MOPS pH 7,5, 60 mM KCl, 30 mM NaCl, 2 mM MgCl2, 1mM PMSF, 1mM DTT i 45% sacharoza. Tkankę siatkówki zawieszoną w tym buforze wytrząsano, następnie odwirowano wstępnie 20 min. 27 000xg a supernatant odwirowano ponownie 45 min. 43 500xg. Osad z tego wirowania zawieszono w powyższym buforze bez sacharozy i odwirowano 45 min. 46 000xg. Oddzielono w ten sposób frakcję zawierającą białka cytoplazmatyczne (supernatant) od frakcji białek błonowych segmentów zewnętrznych komórek pręcikowych siatkówki (osad). Ponieważ, jak to wykazano metodą elektroforezy, mimo adaptowania siatkówek do ciemności, frakcja cytoplazmatyczna zawierała dużo immunoreaktywnego białka o ciężarze cząsteczkowym 33 kDa, identycznego ze standardem rekombinowanej fosducyny, użyto ją do dalszego oczyszczania fosducyny metodą elektroelucji, jak to opisano poniżej. Oczyszczony preparat wykorzystywano w dalszych doświadczeniach jako standard.
Otrzymywanie subfrakcji komórkowych z tkanki tarczycy
Zamrożone, pooperacyjne tkanki tarczyc pochodzących od chorych z wolem guzowatym, rozdrabniano a następnie homogenizowano homogenizatorem nożowym w buforze o składzie: 20 mM Tris-HCl pH 7,4, 50 mM NaCl, 10 mM EDTA, 10 mM EGTA, 50 mM NaF, 1mM Na3VO4, 1 mM PMSF, koktajl inhibitorów proteaz (aprotyniny, pepstatyny, leupeptyny). Homogenat sączono przez stalową siatkę, ponownie homogenizowano homogenizatorem teflonowo – szklanym i wirowano 15 min. 800xg. Z osadu izolowano frakcję białek jądrowych. Supernatant wirowano 30 min. 25 000xg, a następnie, po oddzieleniu osadu błon komórkowych, wirowano 60 min. 100 000xg. Osad z tego wirowania stanowił frakcję mikrosomalną, supernatant zawierał białka frakcji cytoplazmatycznej oraz białka koloidu.
Otrzymywanie preparatu rozpuszczalnych białek z subfrakcji komórkowych
Osad z wirowania homogenatu tarczycy przy szybkości 800xg, stanowiący frakcję jądrową zawieszono w buforze: 0,25 M sacharoza, 0,02 M Tris – HCl pH 7,85, 1,1 mM MgCl2, 0,5% Triton X 100, 0,5 mM PMSF, koktajl inhibitorów proteaz. Zawiesinę odwirowano 10 min. 2000xg. Osad, po przepłukaniu tym samym buforem zawieszono w buforze o składzie: 0,25 M sacharoza, 0,02 M Tris-HCl pH 7,85, 1,1 mM MgCl2 0,4 M KCl, 20% glicerol, 5 mM dithiotreitol, sonifikowano, wytrząsano w temperaturze 4°C przez 30 min. i odwirowano 15 min. 12 000xg. Supernatant zawierający rozpuszczalne białka jądrowe używano do dalszych badań.
Frakcje błonową i mikrosomalną solubilizowano wytrząsając przez godzinę w 1,5% Tritonie X100 w PBS a następnie wirowano 100 000xg. Supernatant, zawierający białka rozpuszczalne, odpowiednio błonowe i mikrosomalne charakteryzowano elektroforetycznie.
Oczyszczanie fosducyny
Oczyszczanie fosducyny monitorowano metodą elektroforezy i immunoblottingu poprzez oznaczanie w kolejnych frakcjach obecności białek rozpoznawanych przez przeciwciała przeciwko fosducynie.
Pierwszym etapem oczyszczania fosducyny z frakcji białek cytoplazmatycznych było usunięcie cząsteczek o dużej masie (tyreoglobuliny, fibrynogenu, immunoglobulin itp.) przez przesączenie preparatu przez błonę XM100 (Amicon) zatrzymującą białka o ciężarze powyżej 100 kDa. Preparaty zawierające immunoreaktywne białka zatężano na koncentratorach Viva. W następnym etapie oczyszczania wykonywano elektroforezę preparatywną i elektroelucję jak to opisano poniżej.
Jądrowe białka rozpoznawane przez przeciwciała przeciw fosducynie oczyszczano metodą elektroelucji z frakcji rozpuszczalnych białek jądrowych. Obecny w elektroeluatach SDS usuwano przez wymianę buforu a białka dodatkowo zatężano na koncentratorach Viva.
Techniki elektroforezy, elektroelucji i Western blottingu
Do rozdzielania i identyfikacji białek stosowano elektroforezę denaturującą na 12% żelu poliakrylamidowym zawierającym SDS (SDS - PAGE) opracowaną przez Laemmli (18). Przed nałożeniem na żel próbki przez 3 min. redukowano 2% merkaptoetanolem w temperaturze 100°C. Rozdzielone białka przenoszono metodą immunoblottingu na błonę nitrocelulozową, na której, (po wysyceniu 0,5% albuminą z surowicy bydlęcej w PBS) przeprowadzano reakcje z przeciwciałami. Stosowano przeciwciała rozpoznające fosducynę – ap33 w stężeniu 90 albo 900 nM, ap34 w stężeniu 77,5 nM albo Phd(N15) 1 μg/ml, a następnie przeciwciała firmy Dako, sprzęgnięte z peroksydazą chrzanową, rozpoznające odpowiednio królicze albo kozie IgG (II przeciwciało). Do płukania błon i rozcieńczania przeciwciał używano buforu PBS zawierającego 0,05% tween. Kompleksy immunologiczne uwidaczniano w reakcji z preparatem DAB: 3,3´-diamino-benzydyną zawierającą CoCl2 firmy Roche, albo metodą chemiluminescencyjną przy użyciu zestawu West Piko (Pierce). Ciężary cząsteczkowe białek wyznaczano posługując się dwubarwnymi standardami firmy Bio Rad.
W metodzie elektroelucji po preparatywnym rozdziale elektroforetycznym z żelu wycinano pasek zawierający białka o pożądanej masie, rozdrabniano go i umieszczano w naczynku aparatu do elektroelucji firmy Bio Rad. Białka eluowano buforem do elektroforezy za pomocą prądu elektrycznego o stałym natężeniu. Do oceny ciężaru cząsteczkowego wycinanych z żelu białek używano niebiesko wybarwionych standardów firmy Bio Rad.
Ocena ilości fosducyny we frakcji cytoplazmatycznej
Wykonano elektroforezę i transfer na nitrocelulozę standardu rekombinowanej fosducyny w kolejnych rozcieńczeniach i preparatu fosducyny otrzymanego z tarczycy.
Białka przeniesione na nitrocelulozę uwidaczniano metodą chemiluminescencyjną z zastosowaniem zestawu West Piko. Otrzymany obraz analizowano za pomocą programu do analizy żeli firmy Kodak i programu Origin do analizy danych.
Test konkurencji antygenów o przeciwciało
Aby upewnić się, że wiązanie przeciwciał ap33 i ap34 z wykrywanymi na nitrocelulozie białkami cytoplazmatycznymi bądź jądrowymi jest specyficzne, wykonano test wypierania, w którym antygeny z prążka i obecny w roztworze peptyd użyty do immunizacji konkurują o wiązanie przeciwciała.
W doświadczeniach stosowano dobrane empirycznie, najniższe stężenia przeciwciał wybarwiające fosducynę: 90 nM dla ap33 i 77,5 nM dla ap34. Roztwory przeciwciał o stałym stężeniu inkubowano wstępnie przez 2 godziny w temperaturze pokojowej albo przez noc w temperaturze 4°C z różnymi stężeniami odpowiadających im peptydów. Aby uzyskać pełne wysycenie przeciwciał peptydami, stężenia peptydów użytych podczas preinkubacji znacznie przewyższały stężenia przeciwciał, maksymalnie do 1000 razy.
Następnie paski nitrocelulozy z zaadsorbowanymi, rozdzielonymi elektroforetycznie białkami z frakcji jądrowej albo cytoplazmatycznej cięto na paski i inkubowano przez noc z powyższymi, preinkubowanymi roztworami przeciwciał lub, dla kontroli z przeciwciałami, do których nie dodano peptydu. Po reakcji z II przeciwciałem immunoreaktywne prążki uwidaczniano DAB.
Wyniki
Identyfikacja immunoreaktywnych białek we frakcji cytoplazmatycznej
W preparatach rozpuszczalnych białek z kolejnych subfrakcji komórkowych tarczycy immunoreaktywne białka lokalizujące się na elektroforogramach na wysokości standardu fosducyny, widoczne były tylko we frakcji białek jądrowych. W preparatach otrzymanych z błon komórek tarczycy i we frakcji mikrosomów fosducyny nie wykryto. Wstępne oczyszczenie preparatu białek cyto-plazmatycznych przez usunięcie białek wysokocząsteczkowych pozwoliło na uwidocznienie obecności fosducyny również w tej frakcji. Stanowiła ona jednak jedynie nieznaczny procent wszystkich białek. Znaczne oczyszczenie preparatu uzyskano dopiero po zastosowaniu metody elektroelucji. W oczyszczonym tą metodą preparacie z tarczycy, z którego eluowano białka o ciężarach od około 30 do około 37 kDa (ryc. 1C), podobnie jak w standardzie oczyszczonym z siatkówki oka (białka 25-50 kDa) (ryc. 1B) wszystkie trzy rodzaje przeciwciał przeciwko fosducynie – ap33, ap34 i Phd(N15) rozpoznawały białko o ciężarze cząsteczkowym 33 kDa (ryc. 2A). Barwienie przeciwciałami ap33 wykazywał też drugi prążek o ciężarze około 66 kDa (ryc. 2A). Obecność takiego samego prążka w preparacie rekombinowanej fosducyny (ryc. 1A) może świadczyć, że jest to wtórnie wytworzony dimer fosducyny. Ilość tego agregatu fosducyny w próbce była zmienna i zależała od czasu przechowywania próbki, a także prawdopodobnie od warunków eksperymentu.
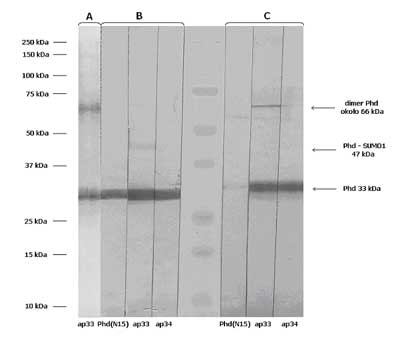 Ryc. 1. Reakcja kozich (Phd(N15) i króliczych (ap33 i ap34) przeciwciał poliklonalnych z preparatami fosducyny po elektroblottingu. Na rycinie zaznaczono ciężary cząsteczkowe umieszczonych w środkowej części standardów oraz położenie immunoreaktywnych białek.
A) Preparat rekombinowanej fosducyny firmy Merck (80 ng Phd). B) Elektroeluat białek o ciężarach cząsteczkowych od 25 do 50 kDa pochodzących z siatkówki oka wołowego. Z każdym paskiem związane jest 1,3 μg białek cytosolowych. C) Elektroeluat białek o ciężarach cząsteczkowych od 30 do 37 kDa z frakcji cytoplazmatycznej tkanki tarczycy. Z każdym paskiem związane jest 11,2 mg białek cytosolowych, pochodzących z 66 mg wyjściowej tkanki. 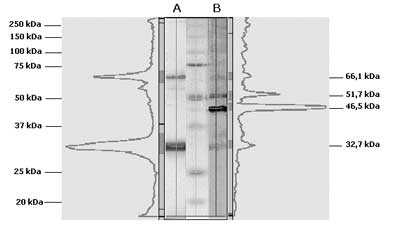 Ryc. 2. Obraz immunoblottingu preparatów tarczycowych. Na rycinie zaznaczono ciężary umieszczonych na środku standardów oraz ciężary cząsteczkowe immunoreaktywnych prążków białek obecnych w elektroeluacie z frakcji cytoplazmatycznej tarczycy ludzkiej (A) i frakcji białek jądrowych (B) wyznaczone w programie do analizy żeli Kodak 1D 3.5.
A) Wolna fosducyna i jej dimer w elektroeluacie białek o ciężarach około 30-37 kDa otrzymanych z 66 mg tkanki. Immunoreaktywne białka wywoływano ap33 o stężeniu 90 nM i DAB. B) Immunoreaktywne prążki we frakcji białek jądrowych otrzymanej z około 6,3 mg tkanki tarczycy. Immunoreaktywne białka wywoływano 900 nM ap33 i DAB. Ocena ilości fosducyny we frakcji cytoplazmatycznej tarczycy
Pomiar zawartości monomerycznej fosducyny w tkance tarczycy wykonano wykorzystując fakt, że powierzchnia zaczernienia kliszy fotograficznej przez związki wykazujące chemiluminescencję jest proporcjonalna do ilości tych związków.
Wykonano elektroforezę, w której do poszczególnych studzienek żelu naniesiono znane ilości standardu rekombinowanej fosducyny i kilka rozcieńczeń tarczycowego preparatu frakcji cytoplazmatycznej po elektroelucji białek o ciężarach około 33 kDa. Rozdzielone białka przeniesiono na błonę nitrocelulozową, wykonano reakcję z przeciwciałami a obraz wywołano za pomocą zestawu West Piko. W obu preparatach kliszę zaczerniły zarówno prążki fosducyny jak i jej wtórnie powstałego dimeru. Do analizy otrzymanego wyniku używano programu do analizy żeli Kodak 1D 3.5. Program odcinał tło na poziomie mediany intensywności zaczernienia kliszy. Dla każdego rozcieńczenia preparatów intensywność zaczernienia otrzymaną po odjęciu tła, tzw. intensywność netto, prążków fosducyny zsumowano z intensywnością netto prążków pochodzących od jej dimeru. Stwierdzono, że w zakresie od 0,6 do 2,4 pmola fosducyny w próbce zależność ilości białka od intensywności zaczernienia jest prostoliniowa. Posługując się tą krzywą wyznaczono zawartość fosducyny w tej próbce białka pochodzącego z tarczycy, której intensywność zaczernienia mieściła się w wymienionym zakresie.
Stwierdzono, że frakcja cytoplazmatyczna z 60 mg tkanki tarczycy zawiera 1,3 pmola fosducyny. Ponieważ, jak wynika z oznaczeń białka 1 mg białek cytosolowych pochodzi z około 6 mg tkanki, więc ilość fosducyny wykrywanej w 1 mg białek cytosolowych wynosi 0,13 pmola.
Identyfikacja immunoreaktywnych białek we frakcji białek jądrowych
W przeciwieństwie do frakcji cytoplazmatycznej, w której fosducyna jest zbyt rozcieńczona na to, aby można ją było wykryć bezpośrednio, we frakcji rozpuszczalnych białek jądrowych, stosując 900 nM ap33, wykryto słabo widoczne prążki odpowiadające wolnej fosducynie i jej dimerowi a także dwa intensywniejsze prążki, których ciężar pokrywa się z ciężarem cząsteczkowym opisanego dla komórek siatkówki koniugatu Phd-SUMO1 (10) i nieznacznie cięższego białka (ryc. 2).
Testy konkurencji białek z peptydami o przeciwciało
Test, w którym związane z nitrocelulozą białko antygenowe i obecny w roztworze peptyd konkurują o dostęp do paratopu, pozwala ocenić, czy przeciwciało rzeczywiście w specyficzny sposób rozpoznaje białko, czy tylko niespecyficznie się na nim adsorbuje. W czasie preinkubacji roztworów przeciwciał o stałym stężeniu ze zmienną ilością peptydów część przeciwciał tworzy z peptydami kompleksy immunologiczne, przez co ich ilość dostępna dla immunoreaktywnego białka na błonie zmniejsza się. Odpowiada to widocznemu na immunoblottach zmniejszeniu zabarwienia prążków. Zarówno przeciwciała ap33 jak i ap34 specyficznie rozpoznają obecne we frakcji cytoplazmatycznej prążki odpowiadające wolnej fosducynie i jej agregatowi a we frakcji jądrowej wszystkie cztery immunoreaktywne prążki.
Dyskusja
Zastosowanie elektroforezy i elektro-transferu na nitrocelulozę białek obec-nych w oczyszczonej frakcji cytoplaz-matycznej i jądrowej z ludzkiej tarczy-cy pozwoliło po raz pierwszy wykazać obec-ność fosducyny w komórkach tego narządu. Oceniono, że we frakcji cytoplazmatycznej z tarczycy jest 0,13 pmola Phd na 1 mg białek cytosolowych. Jest to ilość około 77x mniejsza od obliczonej dla oczyszczanej metodą immunoprecypitacji fosducyny z frakcji cytoplazmatycznej z mózgu wołowego (10 pmoli/1 mg białek cytosolowych) (5). Należy jednak uwzględnić, że badana frakcja cytosolowa zawiera również białka koloidu, nieobecnego w mózgu, tak więc w samym cytosolu tarczycy stężenie fosducyny może być wyższe i bardziej zbliżone do stężenia w mózgu.
Oprócz wolnej, monomerycznej, fos-ducyny, w badanych preparatach wy-kryto kilka immunoreaktywnych białek o wyższych niż ona ciężarach cząs-teczkowych.
Metoda elektroelucji z paska żelu białka o ciężarze cząsteczkowym 30-37 kDa, wykluczająca elucję cięższych białek, pozwoliła stwierdzić, że immunoreaktywne białko o masie około 66 kDa wykrywane po elektroelucji jest tworzącym się in vitro agregatem. Może to być homodimer fosducyny albo heterodimer z białkiem o zbliżonej masie np. z 14-3-3, którego ciężar cząsteczkowy wynosi 33 kDa. Zauważono, że ilość agregatu wzrasta z upływem czasu i zależy od rodzaju operacji, jakim poddawana jest próbka. Jego trwałość, mimo redukcji próbki i denaturujących warunków elektroforezy sugeruje, że wytworzone wiązania mają charakter kowalencyjny i nie powstają między resztami cysteiny. Interesujący jest też fakt, że omawiany związek fosducyny jest dużo słabiej wykrywany przez przeciwciała ap34 rozpoznające sekwencje zlokalizowane blisko C-końca cząsteczki fosducyny. Mogłoby to świadczyć, że po agregacji, ten rejon cząsteczki jest mniej dostępny dla przeciwciał. Natura tego połączenia wymagałaby odrębnych badań. Istnienie podobnych związków fosducyny w preparatach pochodzących z różnych tkanek zaobserwowali również Danner i Lohse (5). Izolowali oni fosducynę z homogenatów tkankowych metodą immunoprecypitacji. Ponieważ fosducyna tworzy w cytoplazmie kompleksy z białkiem 14-3-3 zastosowana metoda nie wykluczała agregacji obu tych białek. Z kolei za homodimerycznym charakterem omawianych agregatów przemawiałoby pojawienie się ich w preparacie fosducyny otrzymanym drogą rekombinacji (ryc. 1).
Możliwe, że powstawanie w preparatach fosducyny jej homo czy heterodimerów, a być może i bardziej złożonych agregatów jest przyczyną problemów, jakie napotykały próby bezpośredniego wykrycia tego białka w tkankach (2).
Rola fosducyny badana była szcze-gółowo w komórkach fotoreceptoro-wych oka, gdzie, jak się uważa odpowiada za dostępność podjednostek βγ transducyny dla receptora fotonów – rodopsyny i w ten sposób reguluje wrażliwość siatkówki na światło. W roku 2007 opublikowano wyniki badań komórek fotoreceptorowych myszy, u których gen kodujący fosducynę był nieaktywny (19). Stwierdzono, wbrew przewidywaniom, że brak fosducyny nie miał bezpośredniego wpływu na zdolność tych komórek do adaptacji do zmian natężenia światła, wpływał natomiast na poziom ekspresji transducyny. Być może w tarczycy fosducyna mogłaby podobnie regulować ekspresję genów dla białek G.
W niniejszej pracy wykazano we frakcji białek jądrowych ludzkiej tarczycy obecność niewielkiej ilości monomerycznej fosducyny i jej zagregowanej, dimerycznej formy. Prócz tego frakcja jądrowa zawierała kilkakrotnie większą ilość immunoreaktywnych białek o wyższych od fosducynowych ciężarach cząsteczkowych. Białka te mogłyby odpowiadać koniugatowi fosducyny z którąś z izoform cząsteczki SUMO lub koniugatowi białka fosducynopodobnego PhLP1 z SUMO. Korelację między tworzeniem się koniugatów SUMO z białkami regulatorowymi transkrypcji a zahamowaniem ekspresji genu wykazano dla szeregu komórek (20). Można spekulować, że w jądrach komórek tarczycy podobną regulatorową rolę pełnią również koniugaty SUMO z fosducyną czy też białkiem fosducynopodobnym. Piśmiennictwo
1. Cabrera-Vera TM, et al.: Insights into G Protein Structure, Function, and Regulation. Endocrine Reviews. 2003; 24: 765-81.
2. Fabczak H, Sobierajska K, Fabczak S: Fosducyna i jej izoformy – regulatory białek G. Post. Biol. Kom. 2003; 30: 745-761.
3. Gaudet R, et al: A molecular mechanism for the phosphorylation-dependent regulation of heterotrimeric G proteins by phosducin. Mol Cell. 1999; 3: 649-60.
4. Schulz R.: The pharmacology of phosducin. Pharmacological Research. 2001; 43: 1-10.
5. Danner S. Lohse MJ.: Phosducin is a ubiquitous G-protein regulator. Proc. Natl. Acad. Sci. 1996; 93:10145-50.
6. Gupta RC, et al.: Expression of Phosducin Is Reduced in Left Ventricular Myocardium of Explanted Failed Human Hearts and Hearts of Dogs with Experimentally-Induced Heart Failure. Journal of the American College of Cardiology. 2008; 51(10), Supplement 1: abstract 1002-4.
7. Bauer PH, et al.: Phosducin is a protein kinase A-regulated G-protein regulator. Nature. 1992; 358: 73-6.
8. Partridge JG, Puhl HL, Ikeda SR.: Phosducin and phosducin like protein attenuate G protein coupled receptor mediated inhibition of voltage gated calcium channels in rat sympathetic neurons. Molecular Pharmacology. 2006; 79:90-100.
9. Ito Y, et al.: 14-3-3 sigma possibly plays a constitutive role in papillary carcinoma but not in of the thyroid. Cancer Letters 2003; 200:161-166.
10. Klenk C, et al.: SUMO-1 Controls the Protein Stability and the Biological Function of Phosducin. J. Biol. Chem. 2006; 281: 8357-8364.
11. Gill G.: SUMO and ubiquitin in the nucleus: different functions, similar mechanisms? Genes & Dev. 2004; 18: 2046-2059.
12. Gill G.: Something about SUMO inhibits transcription. Current Opinion in Genetics and Development. 2005; 15: 536-541.
13. Margulis A, et al.: Presence of phosducin in the nuclei of bovine retinal cells. Mol Vis. 2002; 8: 477-82.
14. Zhu X, Craft CM. Modulation of CRX Transactivation Activity by Phosducin Isoforms. Mol. Cell. Biol. 2000; 20: 5216-5226.
15. Zhu X, Craft CM.: Interaction of phosducin and phosducin isoforms with a 26S proteasomal subunit, SUG1. Mol Vis 1998; 4: 13.
16. Kero J, et al.: Thyrocyte specific Gq/G11 deficiency impairs thyroid function and prevevts goiter development. J Clin Invest 2007; 117:2399-2407.
17. Laugwitz KL, et al., The human thyrotropin receptor: A heptahelical receptor capable of stimulating members of all four G protein families. Proc Natl Acad Sci 1996; 93:116-120.
18. Laemmli UK.: Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227: 680-685.
19. Krispel CM, et al.: Phosducin Regulates the Expression of Transducin β Subunits in Rod Photoreceptors and Does Not Contribute to Phototransduction Adaptation. J. Gen. Physiol. 2007; 130: 303-312.
20. Seeler JS, Dejean A.: Nuclear and unclear functions of SUMO. Nat Rev Mol Cell Biol. 2003; 4: 690-699.
otrzymano/received: 2008-03-25 zaakceptowano/accepted: 2008-05-10 Adres/address: *Urszula Piotrowska Zakład Biochemii i Biologii Molekularnej Centrum Medyczne Kształcenia Podyplomowego ul. Marymoncka 99/103, 01-813 Warszawa tel.: (0-22) 569-38-45 e-mail: urszulap@cmkp.edu.pl Pełna wersja artykułu Obecność fosducyny w tarczycy dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








