|
© Borgis - Postępy Nauk Medycznych 5, s. 291-296
Barbara Górka, Joanna Skubis-Zegadło, *Barbara Czarnocka
Ekspresja NrCAM w rakach brodawkowatych tarczycy
NrCAM expression in papillary thyroid carcinomas
Zakład Biochemii i Biologii Molekularnej Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Zakładu: prof. dr hab. Andrzej Gardas Streszczenie
Wstęp: Białko adhezyjne NrCAM z rodziny immunoglobulinopodobnych białek adhezyjnych występujące głównie w układzie nerwowowym, jak wykazano ulega również ekspresji w innych tkankach, w tym w nowotworach. Białka adhezyjne odgrywają ważną rolę w takich procesach jak wzrost i różnicowanie komórek. Zmiany w adhezji międzykomórkowej mogą być związane ze wzrostem inwazyjności komórek nowotworowych. W związku z tym, że cząsteczka NrCAM jest coraz częściej łączona z procesami nowotworzenia w niniejszej pracy badano ekspresję NrCAM w raku brodawkowatym tarczycy, najczęściej występującym raku tarczycy. Materiał i metody: Analizie poddano grupę 46 brodawkowatych raków tarczycy i odpowiadających im tkanek prawidłowych. Badano poziom mRNA NrCAM metodą ilościowej reakcji PCR w czasie rzeczywistym (Q-RT-PCR), oraz poziom i lokalizację komórkową białka NrCAM stosując metody immunologiczne: immunohistochemię (IHC) i Western blot. Wyniki: Wykazano, że ekspresja mRNA NrCAM w rakach jest znamiennie statystycznie wyższa niż w prawidłowych tarczycach (p<0,0001). W badaniu IHC ponad 95% (44/46) przypadków raka brodawkowatego tarczycy dawało pozytywny wynik barwienia NrCAM. Białko było głównie zlokalizowane cytoplazmatycznie, a w niektórych przypadkach widoczne było znakowanie błonowe. W tkankach prawidłowych obserwowano reakcję tylko w pojedynczych pęcherzykach wykazujących cechy nadczynności. Analiza Western blot potwierdziła wyniki otrzymane metodą Q-RT-PCR i wykazała, że ekspresja białka NrCAM w rakach brodawkowatych jest wyższa niż w odpowiadających im tkankach prawidłowych. Poziom ekspresji genu i białka NrCAM w raku brodawkowatym tarczycy nie był związany z klinicznym zaawansowaniem guza. Wnioski: Uzyskane wyniki wykazały po raz pierwszy, że w rakach brodawkowatych tarczycy jest indukcja genu i białka neuronalnej czasteczki adhezyjnej NrCAM. Wysoki poziom transkryptu i jego białka nie korelował ze stopniem zaawansowania raków i ich wielkością. Nasze wyniki sugerują, że nadekspresja NrCAM może być związana z patogenezą raków brodawkowatych tarczycy. Słowa kluczowe: neuronalne cząsteczka adhezyjna (NrCAM), białka adhezyjne, rak brodawkowaty
Summary
Introduction: Neuronal cell adhesion molecule NrCAM is mostly expressed in the nervous system and as recently described is also expressed in a variety of tissues, including tumours. Cell adhesion molecules plays an important role during basal cells processes like the cell growth and differentiation. Changes in the integrity of the adhesion are involved in tumours development and may lead to invasive and metastatic behavior of these cells. NrCAM expression has been linked to tumorigenesis of some tissues, therefore in this study we examined NrCAM expression in the most common type of thyroid cancer, papillary thyroid carcinoma. Materials and methods: We analysed 46 of papillary thyroid carcinomas and paired normal tissues. NrCAM expression was analysed on both mRNA (Q-RT-PCR) and protein level and cellular localization using immunohistochemistry (IHC) an Western blot methods. Results: Expression of NrCAM transcript was significantly higher in tumours, than in normal thyroid (p<0,0001). Immunohistochemistry showed that over 95% of papillary thyroid carcinomas (44/46) were positive for NrCAM expression. The protein localized in the cytoplasm, however in some cases the membranous localization was also observed. In normal thyroid immunostaining was limited to the rare follicles showing features of hyperactivity. Western blot corroborated both Q-RT-PCR and immunohistochemistry results showing higher protein level in cancer than in paired normal thyroid. NrCAM expression is up-regulated in PTC compared to the normal thyroid on both transcript and protein level whatever the tumor grade or stage. Conclusions: This study is the first demonstration that NrCAM is over-expressed in human papillary thyroid carcinomas on both mRNA and protein levels, whatever the tumor stage and grade. Our results suggest that up-regulation of NrCAM may be involved in the pathogenesis and behavior of papillary thyroid cancer. Key words: neuronal cell adhesion molecule (NrCAM), cell adhesion molecule, papillary thyroid carcinoma (PTC)
Wstęp
Białka adhezji komórkowej (cell adhesion molecules, CAMs) z rodziny L1 są błonowymi glikoproteinami, występującymi głównie w centralnym układzie nerwowym. Jak wykazały badania ostatnich lat, białka te występują również w wielu liniach komórkowych i innych tkankach, w tym tkankach endokrynnych, oraz mysich i ludzkich nowotworach (1, 2, 3) Białka adhezji komórkowej odgrywają ważną rolę w podstawowych procesach zachodzących w komórce takich jak wzrost, różnicowanie, migracja komórek czy przekazywanie sygnału. Jednym z białek tej rodziny jest neuronalna cząsteczka adhezyjna (NrCAM), której ekspresję łączy się z procesami nowotworzenia i inwazji niektórych nowotworów (4, 5).
Cząsteczka NrCAM należy do rodziny immunoglobulinopodobnych białek adhezyjnych zawierających domeny Ig-podobne typu C2 oraz domeny typu fibronektyna III (6, 7). Cząsteczka NrCAM została zidentyfikowana po raz pierwszy w układzie nerwowym gdzie jest zaangażowana w adhezję neuron-neuron oraz bierze udział w bezpośrednim przekazywaniu sygnału podczas wzrostu stożków aksonów (2, 8). Niewiele wiadomo o ekspresji i roli NrCAM w innych tkankach, w tym w tkankach endokrynnych. Przez długi czas sądzono, że NrCAM nie występuje poza układem nerwowym. Jednakże badania ostatnich lat wykazały, że białko to występuje także w wielu innych tkankach. Jak wskazują dane doświadczalne NrCAM w powyższych tkankach uczestniczy nie tylko w komunikacji międzykomórkowej przez przesyłanie sygnału z domeny wewnątrzkomórkowej do cytoszkieletu aktynowego podczas kierunkowej migracji komórek ale również może być związany z transformacją nowotworową (4). Metodą hybrydyzacji Northern blot stwierdzono mRNA NrCAM w takich tkankach jak trzustka, łożysko, rdzeń i kora nadnerczy, tarczyca oraz jądra (1, 9). Ponadto wykazano podwyższony poziom transkryptu NrCAM i/lub białka w niektórych tkankach nowotworowych (3, 10, 11).Badania nad czynnikami aktywującymi NrCAM w nowotworowych liniach komórkowych wykazały, że w procesie tym istotną rolę odgrywają kateniny. Wymuszona ekspresja cząsteczki NrCAM w mysich fibroblastach powodowała wzrost ich ruchliwości, zwiększoną proliferację oraz nabieranie niektórych cech komórek nowotworowych (3).
Celem niniejszej pracy było zbadanie czy jedna z rodziny neuronalnych cząsteczek adhezyjnych NrCAM, białko swoiste dla układu nerwowego, występuje w zróżnicowanych rakach tarczycy.
Materiał i metody
Tkanki tarczycy pochodziły od pa-cjentów operowanych w Centrum Onko-logii, Instytucie Marii Skłodowskiej-Curie oddział w Gliwicach, z powodu raka brodawkowatego tarczycy.
Materiał do analizy Q-RT-PCR i Western blot stanowiły tkanki uzyskane w wyniku resekcji guzów tarczycy. Analizowano 46 przypadków raka brodawkowatego (37 kobiet i 9 mężczyzn w wieku od 15 do 74 lat; średnia wieku wynosiła 47,3 lata) i odpowiadające im tkanki prawidłowe. Do analizy immunohistochemicznej użyto tkanek archiwalnych obejmujących raki brodawkowate (n=46).
Reakcja Q-RT-PCR
Całkowite RNA izolowano z zamrożonych fragmentów tkanek, używając zestawu RNeasy Mini Kit (Qiagen) według zaleceń producenta. Stężenie RNA określono na podstawie pomiaru absorbancji przy długości fali 260 nm a czystość próbek stosunkiem A 260/A 280 nm.
Następnie 500 ng RNA z każdej tkanki posłużył do otrzymania cDNA przy użyciu zestawu Super Script II RT (Applied Biosystem) oraz uniwersalnych starterów.
Otrzymane cDNA poddano ilościowej reakcji PCR w czasie rzeczywistym. Sekwencje starterów do reakcji zaplanowano w oparciu o dane z banku genów;
starter sensowny: 5´-TTGTGCAAAGAGGGAGCATG-3´,
starter antysensowny: 5´-GGGCAGTTCCCTGTTGTCCT-3´.
Równocześnie z próbkami badanymi amplifikowano geny β-aktyny i GAPDH w czterech różnych stężeniach cDNA (200 ng, 50 ng, 12,5 ng, 3,125 ng), każde w dwóch powtórzeniach, celem wykreślenia krzywej standar-dowej. Ilościową reakcję PCR dla badanych genów prowadzono z wykorzystaniem detektora sekwencji GeneAmp 7500 (PE Aplied Biosystems) na płytkach 96 dołkowych.
Western Blot
Zamrożone tkanki tarczycy homogenizowano w buforze (0,25 M sacharoza, 0,02 M Tris, 0,001 M EDTA o pH 7,4) zawierającym inhibitory proteaz (PMSF-50 μM, aprotynina – 1 μg/ml, leupeptyna – 1 μg/ml, pepstatyna – 1 μg/ml). Homogenaty wirowano 15 min., 1000 x g. Otrzymany osad odrzucono a supernatanty wirowano 1h przy 100 000 x g, 4°C. Stężenie białka mierzono metodą BCA (Pierce), według standardowego protokołu.
Białka (50 μg/studzienkę) rozdzielano na 7,5% żelu poliakryloamidowym w warunkach nie redukujących (SDS-PAGE). Elektroforezę prowadzono 15 min. – 80V, następnie 1h 150V. Rozdzielone na żelu białka elektrotransferowano na membranę Immobilon P (PVDF, Bio-Rad), 1h, 100 V. Membrany wysycano 5% roztworem odtłuszczonego mleka, przez godzinę w temperaturze pokojowej, a następnie inkubowano z roztworem króliczych poliklonalnych przeciwciał anty-NrCAM w rozcieńczeniu 1:2000 (ab24344, Abcam) przez noc w 4°. Błony płukano 3 x TBST po czym inkubowano 1 godzinę z II rzędowym, kozim przeciwciałem przeciwko króliczym IgG, skoniugowanym z peroksydazą chrzanową (HRP), w stężeniu 20 ng/ml (Jackson ImmunoResearch Laboratories, Inc.). Błonę ponownie płukano 3 x TBST. Kompleksy przeciwciało-NrCAM uwidaczniano chemiluminescencyjnie z użyciem SuperSignal West Pico (Pierce). Wizualizację prążków przeprowadzono naświetlając filmy BioMax MS (Sigma-Aldrich, Corp.). We wszystkich tkankach oznaczano poziom β-aktyny, jako kontrolę integralności i jednakowego stężenia białek w poszczególnych próbkach.
Immunohistochemia (IHC)
Do badań immunohistochemicznych użyto utrwalone formaliną i zaparafinowane archiwalne tkanki tarczycy pochodzące od pacjentów operowanych z powodu raka brodawkowatego tarczycy. Skrawki tkanek tarczycy o grubości 3 μm krojono z bloczków parafinowych. Materiał odparafinowano w ksylenie i uwadniano w H2O. Antygen odkrywano stosując roztwór 0,01% proteinazy XXIV przez 10 min. w 37°C przez 10min. Preparaty trzykrotnie płukano w TBST, następnie inkubowano z kozim poliklonalnym przeciwciałem anty NrCAM (Santa Cruz Biotechnology) w rozcieńczeniu 1:100 przez noc w 4°C. Następnie preparaty płukano TBST i inkubowano z LSAB 2 Kit (Labelled Streptavidin-Biotin2 System, DACO). Reakcję wizualizowano przy pomocy chromogenu DAB (diaminobenzidine, DACO). Jądra podbarwiano hematoksyliną Mayer´a (Daco). Reakcję immunohistochemiczną oceniano używając następujących kryteriów: 0 – brak reakcji, ++ reakcja średnio pozytywna, +++ reakcja silnie pozytywna. Preparaty oceniało dwóch niezależnych patologów.
WYNIKI
Reakcja Q-RT-PCR
Metodą RT-PCR w czasie rzeczywistym analizowano 46 par tkanek rak tarczycy-prawidłowa tarczyca pochodzących od tego samego pacjenta. We wszystkich analizowanych tkankach wykryto transkrypt NrCAM. Poziom ekspresji mRNA był znamiennie statystycznie wyższy w tkankach nowotworowych w porównaniu do tkanek prawidłowych (p<0,0001) (ryc. 1A). W rakach brodawkowatych poziom transkryptu NrCAM był od 1,3 do 30 razy wyższy w porównaniu do poziomu w odpowiadających im tkankach prawidłowych, średnio 7,23-krotnie (ryc. 1B). Poziom ekspresji genu NrCAM w ra-kach nie korelował ze stopniem za-awansowania klinicznego i wielkością guza. Jakkolwiek obserwowano różnice w ekspresji genu NrCAM w zależności od wielkości guza jednak różnice te nie były znamienne statystycznie.
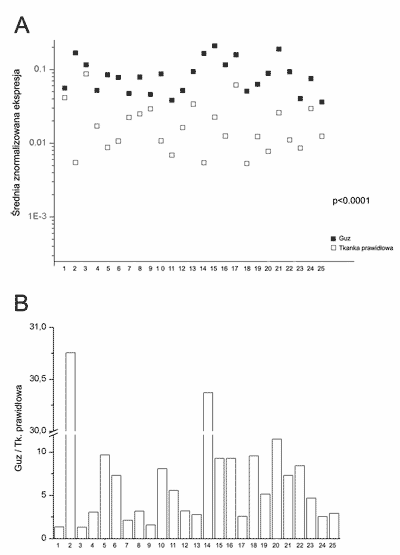 Ryc. 1. A – ekspresja mRNA NrCAM w rakach brodawkowatych tarczycy oraz w odpowiadających im tkankach prawidłowych. B – stosunek poziomu transkryptu NrCAM w rakach brodawkowatych do poziomu mRNA NrCAM w tkankach prawidłowych.
Immunohistochemia (IHC)
Analizie immunohistochemicznej poddano 46 przypadków raka brodawkowatego. Ogromna większość raków brodawkowatych charakteryzowała się ekspresją białka NrCAM. Ponad 95% (44/46) przypadków wykazywało silną lub bardzo silną immunoreakcję (ryc. 2B). Białko NrCAM w rakach brodawkowatych było zlokalizowane zarówno cytoplazmatycznie jak również w błonach podstawnych oraz szczytowych (częściowo) tyreocytów (ryc. 2A).
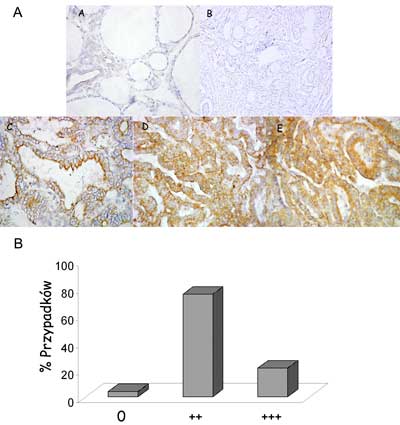 Ryc. 2. A – Immunohistochemiczna identyfikacja białka NrCAM i jego lokalizacja komórkowa w tkankach tarczycy: A – tkanka prawidłowa; B – kontrola negatywna; C, D, E – raki brodawkowate. B – poziom ekspresji NrCAM brodawkowatych rakach tarczycy oznaczony immunohistochemicznie.
Western Blot
Do potwierdzenia wyników otrzymanych na poziomie transkryptu tkanki analizowano metodą Western blot. Użyte przeciwciało rozpoznawało prążek o ciężarze ok. 220 kDa zarówno w rakach jak i tkankach prawidłowych. W rakach intensywność prążka była heterogenna, ale poziom białka był wyższy od poziomu w tkankach prawidłowych. Reprezentatywne wyniki analizy Western blot w parach zostały przedstawione na rycinie 3.
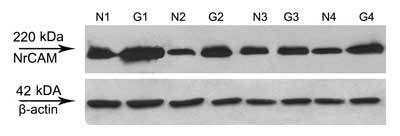 Ryc. 3. Analiza Western blot. Poziom białka NrCAM w rakach brodawkowatych tarczycy (G) oraz tkankach prawidłowych od tego samego pacjenta (N). Na tych samych membranach oznaczano β-akytnę jako kontrolę integralności białek i jednakowego stężenia analizowanych próbek.
Dyskusja
Rak brodawkowaty tarczycy jest najczęściej występującym zróżnicowanym rakiem tarczycy. Rozrost nowotworów jest wieloetapowym procesem, w którym komórki nowotworowe gromadzą różne nieprawidłowości, w tym zmiany w adhezji komórkowej, których konsekwencją miedzy innymi może być wzrost inwazyjności guzów.
Jednym z białek adhezyjnych którego ekspresję łączy się z procesami nowotworzenia i inwazji niektórych nowotworów jest neuronalna cząsteczka adhezyjna – NrCAM. Jest to błonowa glikoproteina z rodziny L1, występująca głównie w strukturach układu nerwowego (12, 13). Badania ostatnich lat wykazały że białko to występuje również w innych tkankach w tym w nowotworach (9, 14).
W niniejszej pracy wykazano że cząsteczka NrCAM jest obecna w rakach brodawkowatych tarczycy. Metodą Q-RT-PCR wykazano znamiennie statystycznie wyższy poziom transkryptu NrCAM w rakach brodawkowatych tarczycy w porównaniu do ekspresji w tkankach prawidłowych. Nadekspresja NrCAM w rakach tarczycy została również potwierdzona metodami immunologicznymi na poziomie białka. Stosując metodę IHC, w większości tkanek prawidłowych nie obserwowano znakowania NrCAM. Białko było widoczne tylko w pojedynczych pęcherzykach o wysokich komórkach i było zlokalizowane w błonie szczytowej tyreocyta. Podwyższony poziom transkryptu NrCAM w rakach brodawkowatych tarczycy obserwowano niezależnie od stopnia zaawansowania guza co sugeruje, że cząsteczka NrCAM może brać udział we wczesnych etapach rozwoju tych nowotworów.
Początkowe badania wskazywały, że cząsteczka NrCAM występuje wyłącznie w układzie nerwowym (12), gdzie może wzmacniać rozrost aksonów (8, 15) oraz ich przewodnictwo poprzez wiązanie się z aksoniną 1 (białko adhezyjne związane z aksonami) lub kontaktyną (neuronalna glikoproteina) (16). Następnie stosując metodę Northern blot wykazano, że NrCAM ulega ekspresji w mózgu ale również w wielu innych tkankach takich trzustka, łożysko, kora i rdzeń nadnerczy, tarczyca oraz jądra (1).
W ostatnich latach szczególne zainteresowanie wzbudza ekspresja i funkcja NrCAM w tkankach nowotworowych.
Dodapkar i wsp. (2001) badali ekspresję NrCAM w guzach trzustki i wykazali wysoki poziom tego białka w dobrze i średnio zróżnicowanych rakach trzustki. W słabo zróżnicowanych rakach poziom NrCAM był zredukowany lub nie wykrywano białka co sugeruje, że różnice w ekspresji NrCAM mogą być związane z patogenezą i inwazyjnością nowotworów trzustki (9). Nadekspresję NrCAM wykrywano także w różnych typach guzów mózgu takich jak gwiaździaki, złośliwe glejaki i glejaki wielopostaciowe (10). Wysoką ekspresję NrCAM obserwowano również w ludzkich komórkach czerniaka i tkance raka okrężnicy (3).
Badania na wielu ludzkich i mysich liniach komórkowych wniosły wiele istotnych informacji związanych z rolą NrCAM w procesie nowotworzenia. W celu sprawdzenia jaki efekt na komórki in vitro wywiera wzrost ekspresji NrCAM, wprowadzano ten gen do komórek NIH3T3 (linia komórkowa mysich embrionalnych fibroblastów) w których normalnie nie ulega on ekspresji. Ekspresja NrCAM stymulowała wzrost i ruchliwość komórek oraz indukowała przekształcanie się ich w komórki o cechach nowotworowych. Transfekowane genem NrCAM komórki po zaszczepieniu ich „nagim myszom” produkowały szybko rosnące nowotwory skóry. Badanie nad wpływem poszczególnych domen NrCAM na nabycie fenotypu nowotworowego komórek NIH3T3 wykazały różnice między domeną zewnątrz- i wewnątrzkomórkową. Transfekcja komórek linii NIH3T3 cDNA zawierającym tylko domenę zewnątrzkomórkową powodowało podobnie jak po wprowadzeniu całego genu NrCAM wzrost ruchliwości, transformację i przekształcenie się komórek w komórki o fenotypie nowotworowym (4). Dane te sugerują, że istotne znaczenie w procesie transformacji nowotworowej odgrywa ektodomena NrCAM, która jak wykazano może być odcinana przez metaloproteinazy (4). Wykazano również, że wyciszenie genu NrCAM poprzez wprowadzenie do komórek linii komórkowej czerniaka ludzkiego, interferujących cząsteczek RNA (siRNA) znacznie osłabiało adhezję tych komórek jak i tworzenie guza po wprowadzeniu ich do organizmu myszy (4).
Wymuszona ekspresja białka NrCAM lub innego białka z tej rodziny – L1CAM w linii NIH3T3 powodowała aktywację dwóch ważnych ścieżek sygnalizacyjnych – ścieżki indukującej wzrost komórek (MAPK/ERK), oraz ścieżki chroniącej przed apoptozą AKT, co umożliwiało tym komórkom przeżycie w warunkach głodowych. Powyższe doświadczenia sugerują, iż neuronalne białka adhezji międzykomórkowej NrCAM i L1CAM mogą być związane z procesem nowotworzenia poprzez aktywację ścieżek sygnalizacyjnych (3, 4).
Badania ostatnich lat wykazały, że NrCAM występuje nie tylko w układzie nerwowym, ale również w innych tkankach, w tym w niektórych nowotworach u ludzi, gdzie jego ekspresja jest znacznie podwyższona. Dokładna rola NrCAM w tkankach nowotworowych nie jest jeszcze poznana i wymaga wielu szczegółowych badań.
Wnioski
1. Uzyskane wyniki wykazały po raz pierwszy, że w brodawkowatych rakach tarczycy następuje indukcja genu i białka NrCAM.
2. Mimo, że obserwowano różnice w poziomie ekspresji genu NrCAM w zależności od wielkości guza, jednak nie były one znamienne statystycznie.
3. Otrzymane wyniki sugerują, że neo- i nadekspresja NrCAM może być związana z wczesnymi etapami rozwoju raków brodawkowatych tarczycy. Piśmiennictwo
1. Wang B, et al.: Alternative splicing of human NrCAM in neural and nonneural tissues. Molecular and Cellular Neuroscience 1998; 10:287-295.
2. Grumet M, et al.: Structure of a new nervous system glycoprotein, Nr-CAM, and its relationship to subgroups of neural cell adhesion molecules. The Journal of Cell Biology 1991; 113:1399-1412.
3. Conacci-Sorrell M, et al.: NrCAM is a target gene of the β-catenin/LEF-1 pathway in melanoma and colon cancer and its expression enhances motility and confers tumorigenesis. Genes & Development 2002; 16:2058-2072.
4. Conacci-Sorrell M, et al.: The Shed Ectodomain of Nr-CAM Stimulates Cell Proliferation and Motility, and Confers Cell Transformation. Cancer Res. 2005; 65:11605-11612.
5. Cavallaro U, Cristofori G: Cell adhesion and signaling by cadherins and IgCAMs in cancer. Nature Publishing Group 2004; 4:118-131.
6. Dry K, et al.: The complete sequence of human locus for NgCAM-related cell adhesion molecule reveals a novel alternative exon in chick and man and conserved genomic organization for the L1 subfamily. Gene 2001; 273:115-122.
7. Lane RP, et al.: Characterization of highly conserved human homolog to the chicken neural cell surface protein Bravo/NrCAM that maps to chromosome band 7q31. Genomics 1996; 35:456-465.
8. Volkmer H, et al.: Neurofascin induces neurites by heterophilic interactions with axonal NrCAM while NrCAM requires F11 on the axonal surface to extend neurites. J. Cell Biol. 1996; 135: 1059-1069.
9. Dhodapkar KM, et al.: Differential expression of the cell-adhesion molecule Nr-CAM in hyperplastic and neoplastic human pancreatic tissue. Hum Pathol 2001; 32:396-400.
10. Sehgal A, et al.: Antisense human neuron glia related cell adhesion molecule hNr-CAM, reduces the tumorigenic properties of human glioblastoma cells. Anticancer Res. 1999; 19:4947-4953.
11. Okegawa T, et al.: The role of cell adhesion molecule in cancer therapy. Acta Biochimica Polonica 2004; 51:445-457.
12. Grumet M.: NrCAM: a cell adhesion molecule with ligand and receptor functions. Cell Tissue Res. 1997; 290:423-428.
13. Custer AW, et al.: The role of the ankyrin-binding protein in node of Ranvier formation. The Journal of Neuroscience 2003; 23: 10032-10039.
14. Glinke J, et al.: Differential gene expression by endothelial cells in distinct angiogenic states. Eur. J. Biochem. 2000; 267:2820-2830.
15. Sakurai T, et al.: Induction of neurite outgrowth through contactin and Nr-CAM by extracellular regions of glial receptor tyrosine phosphatase. J. Cell Biol. 1997; 136:907-918.
16. Brümmendorf T, Rathjen FG.: Structure/function relationships of axon-associated adhesion receptors of the immunoglobulin superfamily. Curr. Opin. Neurobiol. 1996; 6:584-593.
otrzymano/received: 2008-03-25 zaakceptowano/accepted: 2008-05-10 Adres/address: *Barbara Czarnocka Zakład Biochemii i Biologii Molekularnej Centrum Medyczne Kształcenia Podyplomowego ul. Marymoncka 99/103, 01-813 Warszawa tel.: (0-22) 569-38-13 e-mail: barbarac@cmkp.edu.pl Pełna wersja artykułu Ekspresja NrCAM w rakach brodawkowatych tarczycy dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








