|
© Borgis - Postępy Nauk Medycznych 5, s. 285-290
Joanna Skubis-Zegadło, Barbara Górka, Jolanta Czerwińska, *Barbara Czarnocka
NIS i pendryna - białka metabolizmu jodu w zróżnicowanych rakach tarczycy
NIS and pendrin – the proteins of iodide metabolism in differentiated thyroid carcinomas
Zakład Biochemii i Biologii Molekularnej Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Zakładu: prof. dr hab. Andrzej Gardas Streszczenie
Wstęp: Transport jonów jodkowych w tyreocycie jest pierwszym etapem biosyntezy hormonów tarczycy. Proces ten jest katalizowany przez wysoko wyspecjalizowane białka i obejmuje dwa etapy. Jony jodkowe są aktywnie transportowane z krwi do wnętrza tyreocyta z udziałem symportera sodowo-jodowego, a następnie są przenoszone na interfazę błony szczytowej i koloidu. Uważa się, że jednym z białek przenoszących jony jodkowe do koloidu jest pendryna. Nieprawidłowości w transporcie jonów jodkowych mogą być w istotny sposób związane z ich nieprawidłowym metabolizmem obserwowanym w zróżnicowanych rakach tarczycy. Materiały i metody: W prezentowanej pracy używając metody PCR w czasie rzeczywistym zbadano poziom ekspresji genów kodujących NIS i pendrynę w dużej grupie tarczyc pochodzących od pacjentów ze zróżnicowanymi rakami tarczycy w porównaniu do tkanek prawidłowych. Wyniki: W analizowanej serii raków tarczycy poziom transkryptu genu NIS i PDS był znamiennie statystycznie obniżony w porównaniu do wartości tkanek prawidłowych. Poziom ekspresji badanych genów nie korelował ze sobą zarówno w zróżnicowanych rakach tarczycy jak i tkankach prawidłowych. Jak pokazały nasze wcześniejsze badania w zróżnicowanych rakach tarczycy lokalizacja obu białek była cytoplazmatyczna w przeciwieństwie do błonowej charakteryzującej tkanki prawidłowe. Wnioski: Większość zróżnicowanych raków tarczycy zachowuje zdolność ekspresji obu białek zaangażowanych w transport jonów jodkowych: NIS i pendryny. Poziom mRNA NIS i PDS jest silnie obniżony w rakach w porównaniu do tarczyc prawidłowych. W większości pozytywnych przypadków badane białka zlokalizowane są cytoplazmatycznie. Słowa kluczowe: NIS- (symporter sodowo-jodkowy), PDS (pendryna), zróżnicowane raki tarczycy
Summary
Introduction: The thyroid hormones biosynthesis involves a two-step iodide transport process: the active transport across the basolateral plasma membrane of thyrocytes and a passive transport across the apical plasma membrane. Each step is catalyzed by a high specialized protein. Initially I- ions are taken from the blood and transported into a thyrocyte via the N(+)/I(-) symporter and then moved to the colloid space of the follicle through the apical membrane transporters. Pendrin is believed to be one of these proteins. An altered iodide transport may be strongly related to the impaired iodide metabolism which is often observed in thyroid diseases. Materials and methods: Real-time PCR method was used to investigate the level of both, NIS and PDS, genes expression in a large group of control (normal) and differentiated thyroid carcinoma tissues. Results: We demonstrated that the mRNA expression of both, NIS and PDS, genes in the analyzed series of thyroid cancer tissues was significant lower in comparison to their expression in normal thyroid tissues. NIS and PDS genes´ levels in all analyzed cancers and normal thyroid were not correlated. The immunohistochemical staining showed membrane localizations of NIS and PDS in the normal thyroid thyrocyte, whereas in the cancer tissues both proteins were observed in the cytoplasm. Conclusions: Most of the examined thyroid cancers tissues are capable to express two proteins involved in iodide metabolism: NIS and PDS. However, their localization in disease state seems to be changed, from membranous to cytoplasmic. Both, NIS and PDS, mRNA levels were significantly lower in the group of thyroid cancerous samples comparing to normal thyroid tissues. Key words: NIS (Na/I symporter), PDS (pendrin), differentiated thyroid carcinoma
Wstęp
Główną fizjologiczną funkcją tarczycy jest produkcja hormonów T3 i T4. Pierwszym etapem biosyntezy hormonów tarczycy jest transport jonów jodkowych (I-) z krwioobiegu do koloidu. Transport I- w tarczycy przebiega w dwóch etapach i jest katalizowany przez NIS i pendrynę, białka zlokalizowane na przeciwnych biegunach tyreocyta. Symporter sodowo-jodowy (NIS) zlokalizowany jest w błonie podstawnej tyreocyta. Jego fizjologiczna rola polega na katalizowaniu aktywnego, sodowo-zależnego transportu jodków z krwi do wnętrza komórki tarczycy. Gen kodujący NIS znajduje się na krótkim ramieniu chromosomu 19 w pozycji 13 (19p13) i składa się z 15 egzonów oraz 14 intronów (1). Koduje białko zbudowane z 643 aminokwasów o masie molekularnej wynoszącej około 70-95 kDa. W strukturze przestrzennej tego białka występuje 13 trans-membranowych fragmentów. NIS należy do rodziny białek transportujących aniony SLC5A (ang. solute carrier family 5). Białka z tej rodziny wykazują wysoką homologię pomiędzy sobą i charakteryzują się zbliżoną funkcją. Wykorzystują elektrochemiczny gradient sodu, jako siłę napędową do transportu swoistej dla nich substancji (2, 3). Nagromadzone wewnątrz komórki jony I- są następnie transportowane przez błonę szczytową do światła koloidu. Uważa się, że jednym z białek odpowiedzialnych za ten transport jest pendryna. Pendryna należy do rodziny białek transportujących aniony zwanej SLC26 (ang. solute carrier family 26). Białka z tej rodziny charakteryzuje duża jednorodność struktury przestrzennej. Ich podstawową funkcją jest transport jonów organicznych i nieorganicznych, a proces ten jest niezależny od gradientu jonów sodowych (4). Pendryna jest silnie hydrofobową błonową glikoproteiną o masie cząsteczkowej ok. 115 kDa składającą się z 780 reszt aminokwasowych. Podobnie jak inne białka należące do rodziny transporterów SLC26 składa się z 12 dużych fragmentów przezbłonowych połączonych krótkimi pętlami ułożonymi naprzemiennie wewnątrz i zewnątrz cytoplazmatycznie. Fragmenty N- i C- końcowe białka zlokalizowane są wewnątrz komórki (5). Gen kodujący pendrynę oznaczony skrótem PDS (SLC26A4 ang. Pendred syndrome gene) sklonowano w 1997 roku (6). U ludzi gen PDS zlokalizowany jest na długim ramieniu chromosomu 7 w pozycji 31, w pobliżu genu DRA// CLT (SLC26A3) (7). Mutacje w obrębie genu PDS są odpowiedzialne za występowanie zespołu Pendreda, schorzenia charakteryzującego się wrodzoną głuchotą, częściowym defektem organifikacji jodków oraz wolem (8, 9).
Podczas transformacji nowotworowej w komórkach tarczycy obserwuje się nieprawidłowości w wewnątrzkomórkowym metabolizmie jonów jodkowych (10, 11). Wiążą się one ze zmianami lub brakiem ekspresji kluczowych białek zaangażowanych w proces biosyntezy hormonów takich, jak: TPO, Tg, NIS oraz pendryny (12,13).
W prezentowanej pracy badano poziom ekspresji NIS i pendryny w dużej grupie próbek pochodzących od pacjentów ze zróżnicowanymi rakami tarczycy w odniesieniu do tkanek prawidłowych pochodzących od tych samych pacjentów.
Materiały i metody
Tkanki tarczycy
Tkanki tarczycy otrzymano z Centrum Onkologii Instytutu im. Marii Skłodowskiej-Curie w Gliwicach. Do analizy metodą ilościowego PCR w czasie rzeczywistym (real-time) użyto 74 tkanek tarczycy pochodzących od 43 pacjentów (32 kobiet i 11 mężczyzn w wieku od 15 do 74 lat, średnia wieku 46 lat). Analizie poddano 31 tkanek prawidłowych i 43 zróżnicowane raki tarczycy z których ponad połowa (56%) była o średnicy>1 cm do ≤ 4 cm -T2. Wszystkie otrzymane pooperacyjnie skrawki tarczyc przechowywano w temperaturze -80°C.
Poziom ekspresji genu PDS
Poziom ekspresji genu PDS w tkankach tarczycy analizowano metodą ilościowego RT-PCR w czasie rzeczywistym (real-time RT-PCR).
Izolacja RNA
Do izolacji RNA wykorzystywano zestaw RNeasy Mini Kit (Qiagen). Całkowite RNA izolowano z około 100 mg tkanki zgodnie z załączoną przez producenta instrukcją.
Pomiarów stężenia otrzymanego RNA dokonywano metodą spektrofotometryczną przy długości fali 260 nm w odniesieniu do długości fali 280 nm. Stosunek pomiaru stężenia przy długości fal: A260/A280 określał czystość preparatu i w większości badanych prób wynosił od 1.7-2.0. Próby, w których wartość współczynnika nie mieściła się w wymienionym zakresie odrzucano, a RNA ponownie izolowano.
Reakcja odwrotnej transkrypcji
Do syntezy cDNA wykorzystywano zestaw Superscript II RT (GIBCO-BRL). W skład mieszaniny reakcyjnej wchodziły: heksamery o przypadkowej sekwencji (1μg), całościowe RNA (1μg), mieszanina trójfosforanów deoksyrybonukleotydów (dATP, dTTP, DTP, dGTP) o stężeniu końcowym 200μM, inhibitor RNazy (1μl), 1x stężony bufor dla polimerazy oraz 200 jednostek odwrotnej transkryptazy (Invitrogen).
Reakcję odwrotnej transkrypcji prowadzono w objętości 20 μl w temperaturze 37°C przez 1 godzinę, a następnie przez 10 minut w temperaturze 70°C. Otrzymane cDNA przechowywano w -20°C.
Reakcja real-time RT-PCR
Ilościowe oznaczenie poziomu mRNA dla NIS i pendryny oraz genu referencyjnego β-aktyny wykonano przy użyciu zestawu firmy PE Applied Biosystems.
Reakcję QRT-PCR prowadzono w aparacie GeneAmp 5700 Sequence Detection System (PE Applied Biosystems) na 96 dołkowych płytkach w objętości 25 μl. W skład mieszaniny reakcyjnej wchodziły: gotowy zestaw starterów i sond dla genów NIS i PDS oraz referencyjnego genu β-aktyny (TaqMan Assays-on-demand gene expression, PE Applied Biosystems, PDS - Id: Hs00166504_ml i β-aktyna - Id: Hs99999903_ml), 1μg cDNA, TaqMan Universal PCR Master Mix 25 μl. Po wstępnej 10 minutowej denaturacji w temperaturze 95°C reakcję amplifikacji przeprowadzono w następujących warunkach:
l 30 cykli składających się z następujących etapów:
– denaturacja (w temp. 95°C przez 15 sek.),
– przyłączanie starterów i wydłużanie (w temp. 60°C przez 1 min.).
l 1 cykl składający się z końcowego wydłużania w temperaturze 72°C przez 10 minut.
Otrzymane wyniki ekspresji genu NIS i PDS normalizowano względem genu referencyjnego β-aktyny. W tym celu poziom ekspresji genu PDS określano z krzywej standardowej i dzielono przez poziom ekspresji genu β-aktyny. Do skonstruowania krzywej standardowej dla obu genów użyto cDNA z puli sześciu tkanek prawidłowych tarczycy w czterech różnych rozcieńczeniach cDNA: 200 ng, 50 ng, 12,5 ng, 3,125 ng. Dla każdej badanej próby wykonywano dwa powtórzenia, które uśredniano.
Wyniki analizowano używając aplikacji Q-Gene do Microsoft Excel(r).
Analiza immunohistochemiczna
Poziom ekspresji białka i jego lokalizację komórkową badano metodą immunohistochemiczną. Materiał stanowiły zaparafinowane archiwalne bloczki tkanek tarczycy. Reakcję immunochistochemiczą z przeciwciałami antyNIS i antypendryna przeprowadzono zgodnie z uprzednio opisaną procedurą (14, 16).
Analiza statystyczna
W opracowaniu statystycznym wyników stosowano test Whitneya-Manna, nieparametryczną korelację Spearmana. Istotność różnic na poziomie 5% (P ≤ 0,05) uznana była za istotną, a na poziomie 0,1% (P ≤ 0,001) za wysoce istotną.
WYNIKI
Poziom ekspresji genu NIS i PDS w tkankach tarczycy badano metodą ilościowego RT-PCR w czasie rzeczywistym.
We wszystkich 31 analizowanych tarczycach prawidłowych oraz 43 zróżnicowanych rakach tarczycy wykryto transkrypt genów NIS i PDS. Obserwowany poziom ekspresji obu genów był heterogenny zarówno w analizowanych tkankach prawidłowych jak i w zróżnicowanych rakach tarczycy (ryc. 1). W części raków poziom mRNA NIS (14/33%) i PDS (2/5%) był bardzo niski (na granicy czułości metody).
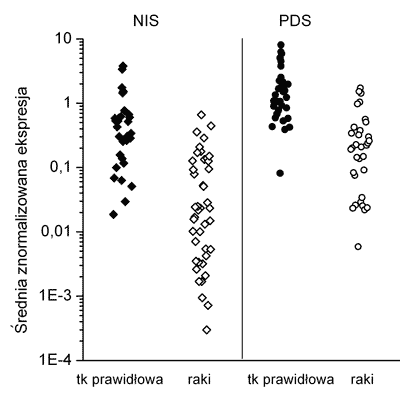 Ryc. 1. Poziom ekspresji mRNA NIS i PDS w zróżnicowanych rakach tarczycy w porównaniu do tkanek prawidłowych.
W zróżnicowanych rakach tarczycy w zależności od wartości względnego poziomu ekspresji genu NIS wyróżniono trzy grupy tkanek. Do pierwszej grupy zaliczono 22 (51%) przypadki o poziomie ekspresji obserwowanej dla tkanek prawidłowych. Drugą grupę stanowiło 7 (16%) raków o obniżonej ekspresji w porównaniu do tkanek prawidłowych i ostatnią, trzecią grupę 14 (33%) tkanek o bardzo niskiej ekspresji genu NIS (tab.1). Zakres średniej znormalizowanej ekspresji (MNE) mRNA NIS w tarczycach prawidłowych wynosił od 0,02 do 3,8 a w rakach w od 0,0003 do 0,661 MNE. Średni poziom mRNA pendryny był wyższy w tkankach prawidłowych (3-krotnie) i w rakach (4-krotnie) od średniego poziomu mRNA dla NIS i wynosił w tarczycach prawidłowych od 0,08 do 8,06 a w rakach od 0,02 do 1,73.
Tabela 1. Analiza poziomu mRNA NIS w rakach tarczycy.
Podobnie jak w przypadku genu NIS analiza poziomu mRNA PDS w rakach tarczycy pozwoliła na wyróżnienie trzech grup tkanek (tab. 2). Do pierwszej grupy zaliczono większość przypadków 30 (70 %) w drugiej grupie znalazło się 11 (25 %) raków, a tylko 2 (5 %) stanowiły trzecią grupę raków o bardzo niskiej ekspresji genu PDS (tab. 2).
Tabela 2. Analiza poziomu mRNA PDS w rakach tarczycy.
Jakkolwiek obserwowano zróżnicowaną ekspresję genów NIS i PDS to jej średni poziom w analizowanych rakach był znamiennie statystycznie ( P <0,001) obniżony w porównaniu do tkanek prawidłowych pochodzących od tych samych pacjentów (ryc. 2). Średnio mRNA NIS był 8-krotnie, a genu PDS 6-krotnie obniżony w porównaniu do poziomu w tarczycach prawidłowych.
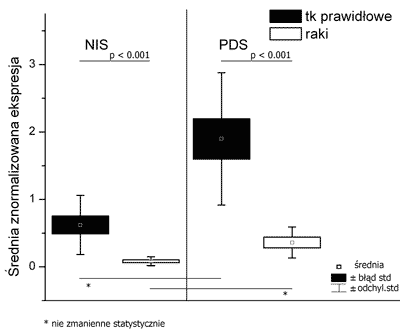 Ryc. 2. Średni poziom ekspresji genu NIS i PDS w tkankach prawidłowych w porównaniu do zróżnicowanych raków tarczycy.
Poziom ekspresji genów NIS i PDS nie korelował ze stopniem zaawanso-wania klinicznego ani z wielkością gu-za. Nie stwierdzono również istotnej statystycznie korelacji pomiędzy poziomem ekspresji genu NIS a poziomem ekspresji genu PDS w tkankach prawidło-wych i rakach tarczycy (ryc. 2). W tkankach, których utraciły ekspresję NIS obserwowano ekspresję pendryny, a w tkankach negatywnych dla pendryny obserwowano ekspresję NIS.
Stosując wysoko oczyszczone przeciwciała antyNIS oraz antypendryna w tarczycach prawidłowych obserwowano intensywną i heterogenną reakcję obu białek. NIS zlokalizowany był w błonie podstawnej a pendryna w błonie szczytowej tyreocytów (ryc. 3A, B).
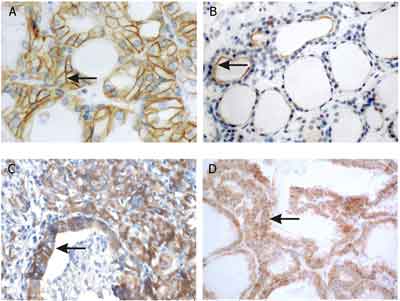 Ryc. 3. Analiza immunohistochemiczna białka NIS (A, C) i pendryny (B, D) w tarczycach prawidłowych (A, B) i zróżnicowanych rakach tarczycy (C, D).
W tkankach nowotworowych, które zachowały zdolność ekspresji symportera sodowo-jodkowego (66,7%) i pendryny (73%) obserwowano zmienioną lokalizację białek. Pozytywną reakcję o różnej intensywności dla obu badanych transporterów obserwowano głównie w cytoplazmie tyreocytów (ryc. 3 C, D).
Dyskusja
Jony jodkowe dostarczane są do koloidu w dwóch etapach. Z krwioobiegu są aktywnie transportowane do wnętrza tyreocyta a następnie przenoszone są przez błonę szczytową do koloidu, gdzie ma miejsce biosynteza hormonów tarczycy. Białkami katalizującymi transport jonów jodkowych są NIS oraz pendryna. Białka te zlokalizowane są w błonie podstawnej i szczytowej wysoko spolaryzowanej komórki nabłonka tarczycy.
W zróżnicowanych rakach tarczycy obserwuje się nieprawidłowy metabolizm jonów jodkowych a opisywany poziom ekspresji białek, które odpowiedzialne są za transport I- w tyreocycie charakteryzują często kontrowersyjne dane. Badania in vitro wykazały podwyższoną, niezmienioną lub obniżona ekspresję NIS w rakach tarczycy. Dane dotyczące ekspresji genu PDS kodującego pendrynę są również niejednoznaczne. Donoszono że w rakach tarczycy poziom ekspresji genu PDS jest niewiele obniżony lub znacznie zredukowany w porównaniu do poziomu obserwowanego w tkankach prawidłowych (14,18, 19, 20, 23, 24). Nieprawidłowości w ekspresji zarówno genu NIS jak i PDS mogą być w istotny sposób związane i współodpowiedzialne za nieprawidłowy metabolizm jodu obserwowany w rakach tarczycy.
W niniejszej pracy metodą ilościowego PCR w czasie rzeczywistym wykryto transkrypt genów NIS i PDS we wszystkich analizowanych tarczycach prawidłowych i rakach a poziom ekspresji analizowanych transporterów charakteryzowały duże indywidualne różnice. W niektórych nowotworach poziom mRNA symportera sodowo-jodkowego i pendryny był na bardzo niskim poziomie praktycznie na granicy czułości metody. Badania Tanaki i wsp. oraz Arturi i wsp. wykazały również wysoce heterogenną ekspresję NIS podobną do obserwowanej w niniejszej pracy (23, 25). Podobnie w zróżnicowanych rakach tarczycy obserwowano heterogenną ekspresję genu PDS, ale jak wykazały nasze badania oraz Porra i wsp, w większości przypadków mRNA PDS był zbliżony do poziomu obserwowanego w tarczycach prawidłowych (14, 20, 21).
Jakkolwiek poziom transkryptów NIS i PDS w zróżnicowanych rakach tarczycy jest obniżony w porównaniu do tkanek prawidłowych to jednak nie stwierdzono istotnie statystycznych korelacji pomiędzy ekspresją NIS i PDS w poszczególnych przypadkach zarówno w tarczycach prawidłowych jak i w rakach. Wyniki te sugerują, że ekspresja badanych transporterów jest niezależna od siebie, co może być w części wynikiem różnych czynników regulujących ekspresję badanych transporterów (6).
Poza obniżoną ekspresją obu bada-nych transporterów jodkowych w zróżnicowanych rakach tarczycy obserwuje się również zmiany lokalizacji komórkowej tych białek. Wykazaliśmy wcześniej, że zarówno symporter sodowo-jodkowy jak i pendryna w większości raków tarczycy, które zachowały zdolność ekspresji tych białek, lokalizują w błonach cytoplazmatycznych (14, 16). Nieprawidłowa lokalizacja NIS w zróżnicowanych rakach tarczycy była już wcześniej opisywana, natomiast cytoplazmatyczna lokalizacja pendryny została opisana po raz pierwszy przez nasz zespół (14, 26).
Zmieniona lokalizacja obu transpor-terów jodkowych w zróżnicowanych rakach tarczycy sugeruje, że białka te w komórkach nowotworowych nie funkcjonują prawidłowo. Cytoplazmatyczną lokalizację PDS obser-wuje się w przypadku niektórych mutacji genu PDS występujących w zespole Pendreda (5). Badania in vitro wykazały, że aktywność pendryny zależna jest od prawidłowej lokalizacji komórkowej białka (5). Jakkolwiek nie znany jest dokładny mechanizm powodujący zmianę lokalizacji pendryny w zróżnicowanych rakach tarczycy to jednym z nich mogłyby być mutacje. Podobnie w przypadku białka NIS nie są znane mechanizmy odpowiedzialne za jego wewnątrzkomórkową lokalizację w rakach tarczycy. Jak wykazano aktywność białka pendryny i NIS są związane z prawidłową ich lokalizacją stąd zaburzony metabolizm I- w zróżnicowanych rakach tarczycy może być wynikiem zarówno obniżonego poziomu ekspresji obu genów jak i nieprawidłowej lokalizacji białkowych produktów tych genów (5).
W przeciwieństwie do raków w prawidłowej tarczycy NIS i pendryna zlokalizowane są w błonie podstawnej i szczytowej nabłonka tarczycy (18, 17, 19, 14, 16). Taka lokalizacja białek umożliwia komórce tarczycy ukierunkowany transport jonów jodkowych z krwioobiegu do koloidu. Jak pokazały nasze wcześniejsze badania w prawidłowej tarczycy ekspresja NIS i pendryny jest heterogenna i zróżnicowana na poziomie nie tylko całych pęcherzyków ale i pojedynczych komórek (14, 16). Wydaje się zatem, że poziom ekspresji NIS i pendryny w tkankach prawidłowych tarczycy związany jest z różnym stopniem pobudzenia metabolicznego tyreocytów.
wnioski
Otrzymane przez nas wyniki wykazują, że większość zróżnicowanych raków tarczycy zachowuje zdolność ekspresji NIS i pendryny – białek zaangażowanych w transport jonów jodkowych. Poziom ich trans-kryptów jest jednak silnie obniżony w porównaniu do tkanek prawidłowych. Ponadto w większości pozytywnych przypadków oba białka zlokalizowane są cytoplazmatycznie, co sugeruje, że transformacja nowotworowa komórek tarczycy wpływa na ich prawidłową translokację do błony podstawnej i szczytowej tyreocyta.
Rola nieprawidłowej lokalizacji obu białek w zróżnicowanych rakach tarczycy wymaga dalszych badań. Piśmiennictwo
1. Smanik PA, et al.: Expression, exon-intron organization, and chromosome mapping of the human sodium iodide symporter. Endocrinology 1997; 138:3555-3558.
2. Carrasco N.: Iodide transport in the thyroid gland. Biochim Biophys Acta. 1993; 1154(1):65-82.
3. Dohan O, et al:. The Sodium/Iodide Symporter (NIS): Characterization, Regulation, and Medical Significance. Endocr Rev2003; 24(1):48-77.
4. Dawson PA, Markovich D.: Pathogenetics of the human SLC26 transporters. Curr Med Chem. 2005; 12(4):385-96.
5. Gillam MP, et al.: Functional characterization of pendrin in a polarized cell system. Evidence for pendrin-mediated apical iodide efflux. J Biol Chem. 2004 Mar 26; 279(13):13004-10.
6. Everett LA, et al:. Pendred syndrome is caused by mutations in a putative sulphate transporter gene (PDS). Nat Genet. 1997; 17(4):411-22.
7. Coyle B, et al.: Pendred syndrome (goitre and sensorineural hearing loss) maps to chromosome 7 in the region containing the nonsyndromic deafness gene DFNB4. Nat Genet. 1996 Apr;12(4):421-3.
8. Reardon W, et al.: Prevalence, age of onset, and natural history of thyroid disease in Pendred syndrome. J Med Genet. 1999; 36(8):595-8.
9. Reardon W, et al.: Pendred syndrome – 100 years of underascertainment? QJM. 1997; 90(7):443-7.
10. Dohan O, Carrasco N: Thyroidal iodide transport and thyroid cancer. Cancer Treat Res. 2004;122:221-36.
11. DeGroot L: Lack of iodide trapping in "cold” thyroid nodules. Acta Endocrinol Panam 1970; 1:27.
12. Elisei R, et al.: Expression of thyrotropin receptor (RTSH), thyroglobulin, thyroperoxidase, and calcitonin messenger ribonucleic acids in thyroid carcinomas: evidence of TSH-R gene transcript in medullary histotype. J Clin Endocrinol Metab. 1994; 78(4):867-71.
13. Ringel MD, et al.: Expression of the sodium iodide symporter and thyroglobulin genes are reduced in papillary thyroid cancer. Mod Pathol. 2001; 14(4):289-96.
14. Skubis-Zegadlo J, et al.: Expression of pendrin in benign and malignant human thyroid tissues. Br J Cancer. 2005; 11; 93(1):144-51.
15. Taylor JP, et al.: Mutations of the PDS gene, encoding pendrin, are associated with protein mislocalization and loss of iodide efflux: implications for thyroid dysfunction in Pendred syndrome. J Clin Endocrinol Metab. 2002; 87(4):1778-84.
16. Czarnocka B, i wsp.: Ekspresja symportera sodowo-jodowego w patologiach tarczycy. Endokrynol. Pol. 2002; 53 (4):63-70.
17. Royaux IE, et al.: Pendrin, the protein encoded by the Pendred syndrome gene (PDS), is an apical porter of iodide in the thyroid and is regulated by thyroglobulin in FRTL-5 cells. Endocrinology. 2000; 141(2):839-45.
18. Bidart JM, et al.: Expression of pendrin and the Pendred syndrome (PDS) gene in human thyroid tissues. J Clin Endocrinol Metab. 2000; 85(5):2028-33.
19. Kondo T, et al.: Expression of human pendrin in diseased thyroids. J Histochem Cytochem 2003; 51(2):167-73.
20. Arturi F, et al.: Expression pattern of the pendrin and sodium/iodide symporter genes in human thyroid carcinoma cell lines and human thyroid tumors. Eur J Endocrinol. 2001; 145(2):129-35.
21. Porra V, et al.: Characterization and semiquantitative analyses of pendrin expressed in normal and tumoral human thyroid tissues. J Clin Endocrinol Metab. 2002; 87(4):1700-7.
22. Saito T, et al.: Increased Expression of the Sodium/Iodide Symporter in Papillary Thyroid Carcinomas. J. Clin. Invest. 1998; 101(7): 1296-1300.
23. Tanaka K, et al.: Semi-quantitative comparison of the differentiation markers and sodium iodide symporter messenger ribonucleic acids in papillary thyroid carcinomas using RT-PCR. Eur J of Endocrinol. 2000; 142: 340-346.
24. Arturi F, et al.: Iodide Symporter Gene Expression in Human Thyroid Tumors . J Clin Endocrinol. Metab.1998; 83(7): 2493-2496.
25. Filetti S, et al.: Sodium/iodide symporter: a key transport system in thyroidcancer cell metabolism. Eur J Endocrinol. 1999; 141: 443-457.
26. Dohán O, et al.: Rapid communication: predominant intracellular overexpression of the Na(+)/I(-) symporter (NIS) in a large sampling of thyroid cancer cases. J Clin Endocrinol Metab. 2001; 86(6):2697-700.
27. Stein M, Wandinger-Ness A, Roitbak T: Altered trafficking and epithelial cell polarity in disease. Trends Cell Biol. 2002; 12(8):374-81. Review.
otrzymano/received: 2008-03-25 zaakceptowano/accepted: 2008-05-10 Adres/address: *Barbara Czarnocka Zakład Biochemii i Biologii Molekularnej Centrum Medyczne Kształcenia Podyplomowego ul. Marymoncka 99/103, 01-813 Warszawa tel.: (0-22) 569-38-13 e-mail: barbarac@cmkp.edu.pl Pełna wersja artykułu NIS i pendryna - białka metabolizmu jodu w zróżnicowanych rakach tarczycy dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








