|
© Borgis - Postępy Nauk Medycznych 3, s. 191-197
*Waldemar Misiorowski
Postępy w leczeniu osteoporozy: leczenie anaboliczne
Progress in osteoporosis treatment: anabolic treatment
Klinika Endokrynologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki Endokrynologii: prof. CMKP dr hab. med. Wojciech Zgliczyński Streszczenie
Większość leków stosowanych obecnie w terapii osteoporozy wykazuje działanie przeciwresorpcyjne, tzn. spowalnia utratę masy kostnej poprzez hamowanie resorpcji kostnej. Stanowią one idealne leczenie w celu zapobiegania postępowi osteoporozy, wykazują jednak ograniczoną przydatność, kiedy choroba jest zaawansowana, a architektura kości uszkodzona. Redukcja ryzyka złamań, uzyskiwana w trakcie leczenia antyresorpcyjnego, jest dla chorych z ciężką osteoporozą niewystarczająca, aby powstrzymać postępujący spadek jakości ich życia i rosnące zagrożenie przedwczesnym zgonem. Działanie otrzymywanego w technologii inżynierii genetycznej analogu PTH, rekombinowanego N-końcowego fragmentu 1-34 ludzkiego parathormonu (teriparatide; 1-34 rhPTH) wyraża się nasileniem obrotu kostnego i promuje tworzenie nowej kości poprzez stymulowanie aktywności osteoblastów w większym stopniu, niż aktywności osteoklastów. Badania kliniczne wykazały, że leczenie teriparatide skutecznie zapobiega wszystkim typom złamań osteoporotycznych u kobiet po menopauzie z osteoporozą. Zarówno przyrosty BMD, jak i skuteczność przeciwzłamaniowa teriparatidu są znacznie większe, niż osiągane przez ten sam okres stosowania jakiegokolwiek leku antyresorpcyjnego. Względnie krótkotrwałe leczenie teriparatide (18-24 miesiące) powinno być następnie kontynuowane leczeniem antyresorpcyjnym, zapobiegającym ubytkowi masy kostnej po odstawieniu teriparatide. Ranelinian strontu jest pierwszym lekiem przeciwosteoporotycznym, o unikalnym mechanizmie działania na tkankę kostną, charakteryzującym się jednoczasowym hamowaniem resorpcji kostnej i pobudzaniem kościotworzenia. Prowadzi to w konsekwencji do rozszczepienie cyklu remodelingu kostnego i dodatniego bilansu kostnego. Skuteczność przeciwzłamaniową ranelinianu strontu u kobiet po menopauzie potwierdzono w dwóch międzynarodowych, randomizowanych, kontrolowanych placebo badaniach klinicznych SOTI i TROPOS, dokumentując ją niezależnie od ciężkości osteoporozy (z wcześniejszymi złamaniami kręgów lub bez), lokalizacji (kręgosłup, biodro), czy wieku chorych (chorych tym u pacjentek po 80 roku życia). Po trzech latach leczenia ranelinianem strontu (2,0 g/d doustnie) uzyskano redukcję ryzyka względnego złamań kręgów o 41%, złamań pozakręgowych o 16% i złamań biodra o 36%. Ponadto udowodniono utrzymywanie się skuteczności w zapobieganiu złamaniom kręgów i złamaniom pozakręgowym w okresie pięcioletniej terapii. Leczenie ranelinianem strontu powoduje również znamienną poprawę wskaźników jakości życia pacjentek z osteoporozą. Słowa kluczowe: osteoporoza, leczenie, teriparatide, ranelinian strontu
Summary
All contemporary osteoporosis treatment agents act primarily by inhibiting bone resorption. Calcium, estrogen, calcitonin, the bisphosphonates, and the SERMs are thus described as „antiresorptive” agents. Through the operation of an unidentified coupling process, a treatment-induced decrease in bone resorption is followed by a decrease in bone formation, thus restricting the net increase in bone mass to a filling of the resorption cavities (the so-called „remodeling space”) already present in bone at the time treatment is initiated. However, clinical effect of antiresorptives, fracture risk reduction, seems to be not sufficient for patients with advanced osteoporosis. Teriparatide, amino-terminal recombinant human PTH (1-34), is the anabolic agent that is developed as a therapy for osteoporosis, with proven antifracture efficacy. In postmenopausal osteoporotic women treated with daily 20 mcg subcutaneous injections of rhPTH(1-34) for 18 months, spinal BMD increased approximately 10%, hip BMD increased by roughly 3% and more importantly, vertebral fracture risk was reduced by 65% and nonvertebral fracture risk by some 53% – larger than expected with any antiresorptive therapy. An increased bone density seen with relatively short – term treatment (18-24 months) with teriparatide may be maintained with further antiresorptive therapy. Strontium ranelate is the first antiosteoporotic agent with a dual mode of action, resulting in a simultaneous increase in bone formation and decrease in bone resorption. This dual action rebalances bone turnover in favor of the formation of new bone. Two international, randomized, double-blind, placebo-controlled clinical trials, SOTI and TROPOS confirmed the antifracture effectiveness of strontium ranelate whatever the severity of the disease (with – or without previous vertebral fractures), whatever the site (vertebra, hip) and whatever the age (including patients aged 80 and above). After 3 years of treatment, strontium ranelate 2.0 g/d orally resulted in 41% reduction in relative risk of new vertebral fracture and 16% reduction in relative risk of nonvertebral fractures in all osteoporotic postmenopausal women and 36% reduction in relative risk of hip fractures in osteoporotic patients aged 74 years and more. Moreover, sustained reduction in vertebral and non-vertebral fratures up to five years of the strontium ranelate treatment was documented. Strontium ranelate also significantly improved patients´ quality of life. Key words: osteoporosis, treatment, teriparatide, strontium ranelate
Zasadniczym celem leczenia osteoporozy jest zapobieganie złamaniom. Większość stosowanych obecnie leków wykazuje działanie przeciwresorpcyjne, tzn. spowalnia utratę masy kostnej poprzez hamowanie resorpcji kostnej. Jest to mechanizm działania zarejestrowanych do leczenia osteoporozy bisfosfonianów (alendronianu, risedronianu, etidronianu i ibandronianu), estrogenów, selektywnych modulatorów receptora estrogenowego (raloksifen) i kalcytoniny (1). Leki antyresorpcyjne (uwzględniając aktualne ograniczenia w stosowaniu HLZ, wynikające z wyników badania Women´s Health Initiative, WHI oraz badania The Million Women Study, MWS) stanowią idealne leczenie w celu zapobiegania postępowi osteoporozy, wykazują jednak ograniczoną przydatność, kiedy choroba jest zaawansowana, a architektura kości uszkodzona (2, 3).
Uważa się, że leki antyresorpcyjne nie w pełni zaspokajają potrzeby pacjentów z ciężką osteoporozą. W opublikowanych randomizowanych, kontrolowanych placebo badaniach klinicznych pacjentki z dokonanymi wcześniej złamaniami kręgów, w trakcie leczenia lekami antyresorpcyjnymi doznawały nowych złamań znamiennie rzadziej, niż otrzymujące placebo, jednak w dalszym ciągu ich doznawały. W badaniu „Fracture Intervention Trial” (FIT), w trakcie trzyletniej obserwacji 8% chorych leczonych alendronianem doznało nowego złamania kręgu (w porównaniu do 15% otrzymujących placebo) (4, 5). W trzyletnim badaniu „Multiple Outcomes of Raloxifene Evaluation” (MORE), nowe złamania kręgów stwierdzono u 14,7% leczonych raloksifenem, w porównaniu do 21,2% otrzymujących placebo (6). Chorzy z ciężką osteoporozą i licznymi złamaniami trzonów kręgowych szczególnie narażeni są na kolejne złamania osteoporotyczne, niezależnie od stosowanego leczenia antyresorpcyjnego. U tych chorych 50% redukcja ryzyka złamań, uzyskiwana w trakcie leczenia antyresorpcyjnego, jest niewystarczająca, aby powstrzymać postępujący spadek jakości życia i rosnące zagrożenie przedwczesnym zgonem (3).
Przełomem w postępowaniu z pacjentami z ciężką osteoporozą jest całkowicie nowa strategia leczenia, wykorzystująca czynniki stymulujące odbudowę kości. (m.in. analogi PTH i sole strontu). Zdolność czynników anabolicznych do znaczniejszej poprawy gęstości mineralnej kości, niż powodują to leki antyresorpcyjne sugeruje, że mogą one również w większym stopniu redukować ryzyko złamań (7-9).
Analogi parathormonu
Parathormon (PTH) jest wydzielany przez cztery gruczoły przytarczyczne, głównie jako peptyd 84-aminokwasowy (PTH (1-84)) (10). Endogenny PTH reguluje metabolizm wapnia i fosforanów w kościach i nerkach. Sekrecja PTH regulowana jest stężeniem wapnia w surowicy, z którym pozostaje w układzie ujemnego sprzężenia zwrotnego (11). W fizjologicznym zakresie stężeń PTH stymuluje w równym stopniu aktywność kościotwórczą osteoblastów, co kościogubną osteoblastów (12). Nadmierna sekrecja PTH (nadczynność przytarczyc), podobnie jak ciągłe podawanie syntetycznych preparatów PTH, nasila obrót metaboliczny kości, prowadząc do intensywnej osteoklastycznej resorbcji tkanki kostnej, z uwalnianiem dużych ilości zjonizowanego Ca++ do płynu zewnątrzkomórkowego. Jednym z mechanizmów molekularnych tłumaczących to zjawisko jest wzrost stężenia RANKL i spadek stężenia osteoprotegeryny (OPG), rozpuszczalnego receptora wiążącego RANKL, a w efekcie hamującego jego wpływ na receptor czynnościowy, RANK (13, 14). Powoduje to nasilenie różnicowania i aktywności metabolicznej dojrzałych osteoblastów, a w konsekwencji osteoklastycznej resorpcji kości. Należy jednak podkreślić, że aktywność kościotwórcza osteoblastów również ulega wówczas wybitnemu wzmożeniu. W bardzo wczesnym okresie rozwoju choroby, kiedy zachowana jest jeszcze fizjologiczna pulsacja sekrecji PTH, może owocować to paradoksalnym wzrostem gęstości mineralnej kości w okolicach szkieletu o przewadze kości gąbczastej (np. trzony kręgowe) (16, 17). Podobnie, podawanie egzogennego PTH w formie codziennych wstrzyknięć analogów PTH o krótkim czasie biologicznego półtrwania (takich jak fragment (1-34) ludzkiego PTH), wykazuje anaboliczne działanie na masę kostną (18). Zmiany w stężeniach RANKL i OPG są tu jedynie przejściowe, lub w ogóle nie występują, co owocuje znacznie mniejszym nasileniem resorpcji (14). Jednocześnie PTH stymuluje różnicowanie i dojrzewanie oraz hamuje apoptozę osteoblastów oraz wydłuża ich czas przeżycia i prawdopodobnie pobudza syntezę kolagenu kostnego (19-21).
Otrzymywany w drodze bioinżynierii N-końcowy fragment 1-34 ludzkiego parathormonu (rhPTH (1-34), teriparatide), podawany w sposób przerywany, okazał się być czynnikiem promującym formowanie nowej kości i przyrost masy kostnej w stopniu daleko silniejszym, niż leki antyresorpcyjne. Mechanizm anabolicznego działania teriparatidu obejmuje także przejściową fazę przygotowania powierzchni kości wraz z syntezą metaloproteinaz macierzy kostnej. Inne działania to modulacja wydzielanych lokalnie czynników parakrynnych (transformujący czynnik wzrostu β), enzymów i innych substancji (w tym prostaglandyn), uczestniczących w procesach replikacji komórkowej i stymulowania kościotworzenia (22-27). Nie umniejszając znaczenia tych obserwacji, należy jednak powiedzieć, że mechanizm molekularny odpowiadający za rzeczywisty efekt anaboliczny PTH pozostaje w większości nieznany.
Podsumowując, teriparatide promuje tworzenie nowej kości poprzez nasilanie aktywności osteoblatów w większym stopniu, niż aktywności osteoklastów. Ponadto, nasilając obrót i remodeling kostny oraz zwiększając przestrzeń remodelingową, teriparatide zwiększa apozycję okołokostną i śródkostną. Powoduje to korzystne zmiany geometrii kości i zwiększanie jej wymiarów oraz zwiększa liczbę beleczek kostnych i połączeń międzybeleczkowych, co w konsekwencji prowadzi do poprawy odporności mechanicznej kości (28, 29).
Badania na zwierzętach oraz wstępne wyniki badań klinicznych wykazały, że przerywane leczenie PTH powoduje znamienny wzrost masy kości gąbczastej oraz nie wpływa na kość korową, lub powoduje jej nieznaczny ubytek (30, 31). Wpływ leczenia teriparatide na ryzyko złamań osteoporotycznych kręgów i pozakręgowych u kobiet po menopauzie oceniano w badaniu klinicznym „Fracture Prevention Trial”, którym objęto 1637 kobiet po menopauzie z potwierdzoną osteoporozą (32). Po 18 miesiącach, leczenie teriparatide spowodowało znamienną redukcję ryzyka nowych złamań kręgów i pozakręgowych w porównaniu z placebo. Ponadto leczenie teriparatide spowodowało znamienny, zależny od dawki wzrost gęstości mineralnej kości kręgosłupa lędźwiowego, kości udowej i całego szkieletu w porównaniu z placebo (p <0,001 dla wszystkich wartości). Zarówno przyrosty BMD, jak i skuteczność przeciwzłamaniowa teriparatidu były znacznie większe, niż osiągane przez ten sam okres stosowania jakiegokolwiek leku antyresorpcyjnego. Planowane na trzy lata badanie zostało jednak przerwane przedwcześnie (po średnio 19 miesiącach leczenia). Przyczyną przerwania badania było wykazanie rozwoju nowotworu kości (osteosarcoma) u szczurów, którym przez prawie całe ich życie podawano ponadfizjologiczne dawki teriparatide (33). Nie odnotowano rozwoju jakichkolwiek zmian kostnych u innych traktowanych w taki sposób gatunków zwierząt (w tym małp), zaś u blisko tysiąca pacjentów, leczonych do 3 lat teriparatide i innymi fragmentami ludzkiego PTH, nie wykazano związku pomiędzy leczeniem a wzrostem ryzyka guzów kości (34). Osteosarcoma u ludzi występuje niezwykle rzadko, a częstość tego nowotworu u chorych z pierwotną lub wtórną nadczynnością przytarczyc nie jest większa niż w całej populacji. Pomimo to, wobec zaistniałych obaw onkologicznych, lek zarejestrowano do leczenia ciężkiej osteoporozy jedynie na czas określony: w USA na 18 miesięcy, a w Europie na 24 miesiące terapii. Bezwzględnym przeciwwskazaniem do stosowania teriparatide jest jakiekolwiek obciążenie onkologiczne, aktualne lub w przeszłości, zaś adresowany jest przede wszystkim do ośrodków specjalistycznych, prowadzących przedłużoną obserwację pacjentów.
Względnie krótkotrwałe leczenie anaboliczne (18-24 miesiące) rodzi oczywiste pytanie: co robić po zakończeniu terapii? Obserwacje pochodzące z dużych badań klinicznych wskazują, że zarówno u kobiet, jak i u mężczyzn, po zakończeniu leczenia teriparatide dochodzi do szybkiego ubytku masy kostnej, o ile nie podejmą oni natychmiast leczenia antyresorpcyjnego (31-35). Również w badaniu klinicznym nad leczeniem osteoporozy pomenopauzalnej rhPTH(1-84) wykazano korzystny wpływ kontynuowania terapii alendronianem po zakończeniu leczenia preparatem PTH (36). Wnioski z istniejących danych należy formułować ostrożnie, ze względu na brak badań prospektywnych, małą populację badanych, a zwłaszcza brak oceny wpływu leczenia antyresorpcyjnego po zakończeniu leczenia teriparatide na częstość złamań. Wydaje się jednak, że leczenie antyresorpcyjne, zapobiegające ubytkowi masy kostnej po odstawieniu teriparatide, powinno być rekomendowane (37).
Wprowadzenie analogów PTH do leczenia osteoporozy przynosi szczególną korzyść chorym z zaawansowaną chorobą, z wysokim ryzykiem złamań. Jednak rodzi się też szereg pytań:
– Czy lepszy skutek terapeutyczny dałoby podzielenie terapii na krótsze cykle (leczenie „przerywane”)?
– Czy leczenie teriparatide dłuższe niż 18-24 miesiące przyniosłoby większą korzyść?
– Czy pacjent odniósłby korzyść powtarzając leczenie w jakiś czas po pierwszym kursie teriparatide (leczenie „cykliczne”)?
– Czy leczenie teriparatide wpływa korzystnie na gojenie się złamań kości?
Oczywiście, wyjaśnienia wymaga także związek przeszłego, obecnego i przyszłego leczenia lekami antyresorpcyjnymi w kontekście stosowania teriparatide. Nie znamy dziś odpowiedzi na te – i na kolejne – pytania,
Sole strontu
Stront (Sr) jest pierwiastkiem śladowym, występującym szeroko w geosferze i biosferze. W zależności od lokalnej zawartości strontu w glebie i wodzie, zwierzęta lądowe i człowiek spożywają zróżnicowane jego ilości, co w konsekwencji prowadzi do obecności niewielkich fizjologicznych stężeń tego pierwiastka w płynie zewnątrzkomórkowym, tkankach miękkich i kościach. Pierwsze prace oceniające wpływ stabilnego (nieradioaktywnego) strontu na tkankę kostną opublikował w 1910 r. Lehnerdt, wykazując stymulujący wpływ strontu na produkcję osteoidu kostnego oraz hamowanie procesów resorpcji kostnej. Obserwacje te pozostały jednak na długi czas w cieniu wyników badań nad stosowaniem bardzo wysokich, farmakologicznych dawek stabilnego i radioaktywnego strontu podawanego zwierzętom utrzymywanym na diecie niskowapniowej, co w konsekwencji prowadziło do rozwoju osteomalacji. Dopiero w latach osiemdziesiątych XX wieku zwrócono uwagę, że obserwacje te nie muszą odnosić się do warunków fizjologicznego odżywiania i podjęto badania nad stosowaniem niskich dawek stabilnego strontu u zwierząt otrzymujących standardową ilość wapnia w diecie (38-40). Wyniki tych badań potwierdziły pierwsze obserwacje Lenherdta i stały się podstawą do stosowania strontu w leczeniu osteoporozy.
Ranelinian strontu jest solą dwustrontową organicznego kwasu ranelinowego (5-(bis(kaboksymetylo)amino)-2-karboksy-4-cyjano-3-fenooctowego), wybraną z pośród 26 badanych soli strontu ze względu na optymalne właściwości fizykochemiczne (rozpuszczalność, stabilność itp.) i farmakokinetyczne (biodostępność) oraz wysoką zawartość elementarnego strontu w cząsteczce, dobrą tolerancję i bezpieczeństwo. In vitro ranelinian strontu (10-3M) powoduje 3-4-krotny wzrost syntezy DNA w hodowlach szczurzych fibroblastów i preosteoblastów, oraz zwiększa o 1/3 produkcję kolagenu i białek niekolagenowych w hodowlach dojrzałych osteoblastów. Stymulujący wpływ ranelinianu strontu na kościotworzenie potwierdzono również metodami autoradiograficznymi i histomorfometrycznymi. Z kolei w badaniach na izolowanych osteoklastach wykazano hamujący wpływ ranelinianu strontu na ekspresję anhydrazy węglanowej II (CAII) i receptora vitronektyny (NR) – markerów aktywności metabolicznej komórek kościogubnych (39). Ranelinian strontu, w sposób zależny o dawki, hamuje także uwalnianianie znakowanego wapnia (45Ca) ze skrawków kostnych (38). Wszystkie opisane działania są specyficzne dla ranelinianu strontu i nie powoduje ich podawanie ranelinianu wapnia lub sodu. Wyniki badań in vitro wykazują więc unikalny mechanizm działania strontu na tkankę kostną, charakteryzujący się jednoczasowym hamowaniem resorpcji kostnej i pobudzaniem kościotworzenia.
Kolejne badania na zwierzętach potwierdziły oczekiwany wpływ strontu na tkankę kostną. U zdrowych, rosnących, młodych (21-dniowych) szczurów ranelinian strontu powoduje wzrost zawartości minerału kostnego (BMC), objętości kości beleczkowej i liczby beleczek kostnych oraz dramatyczne nasilenie aktywności kościotworzenia z jednoczesnym niewielkim zahamowaniem wskaźników resorpcji kostnej. Nie stwierdzono jakichkolwiek zaburzeń mineralizacji kości (40). U dojrzałych szczurzyc poddanych kastracji ranelinian strontu utrzymuje BMC i częściowo zapobiega utracie beleczek kostnych w porównaniu do nieleczonych (41-42). Podobne efekty uzyskano również w innym modelu osteoporozy – po unieruchomieniu. Badania biomechaniczne wykazały korzystny wpływ długotrwałego (104 tygodnie) leczenia strontem na wskaźniki wytrzymałości mechanicznej (+ 13,5%) izolowanych kości szczurów (43).
Po wstępnych, obiecujących wynikach stosowania strontu u ludzi, w 1996 r. podjęto szeroko zakrojone badania fazy III nad leczeniem zaawansowanej osteoporozy ranelinianem strontu. Badanie SOTI (The Spinal Osteoporosis Therapeutic Trial) objęło 1649 kobiet po menopauzie z osteoporozą w średnim wieku 70 (69 ± 7,2) lat i oceniało wpływ leczenia ranelinianem strontu 2,0 g/d na ryzyko złamań kręgosłupa (46). Badaniem TROPOS (The Treatment Of Pheripherial Osteoporosis Study) objęto 5091 kobiet z osteoporozą w wieku powyżej 70 lat, średnim 77 lat, zaś pierwotny punkt końcowy stanowiła ocen wpływu leczenia ranelinianem strontu 2,0 g/d na ryzyko złamań pozakręgowych (47). Po trzech latach leczenia ranelinianem strontu, w badaniu SOTI wykazano 41% redukcję ryzyka nowego złamania kręgu (RR = 0,59, 95%CI = 0,48 – 0,73, p<0,001) w porównaniu do placebo (46). W badaniu TROPOS u pacjentek leczonych ranelinianem strontu wykazano 16% redukcję ryzyka wszystkich złamań pozakręgowych (RR = 0,84, 95%CI = 0,70 – 1,00, p = 0,04), oraz 36% redukcję ryzyka złamania biodra (RR = 0,64, 95%CI = 0,41 – 1,00, P = 0,05) w porównaniu do placebo (47). W kolejnych analizach materiału z obu badań łącznie, wykazano skuteczność przeciwzłamaniową terapii ranelinianem strontu u kobiet w wieku podeszłym (powyżej 80 lat) (48) oraz u kobiet z osteopenią (49), a także korzystny wpływ leczenia na wskaźniki jakości życia i zmniejszenie dolegliwości bólowych (50-52). Potwierdzono także dobrą tolerancję i bezpieczeństwo leczenia, zaś częstość poważnych działań niepożądanych nie różniła się istotnie pomiędzy leczonymi i otrzymującymi placebo. Najczęstszymi działaniami niepożądanymi były nudności (6,6%) i biegunka (6,5%), na ogół o umiarkowanym nasileniu i przejściowym charakterze. W aktualnie przedstawionych wynikach pięcioletniego rozszerzenia obu badań wykazano utrzymywanie się skuteczności przeciwzłamaniowej leczenia strontem zarówno w odniesieniu do złamań kręgów (RR = 0,67%, p<0,001), jak i złamań pozakręgowych (RR = 0,85, p = 0,03) (53). Długotrwałą skuteczność w redukcji złamań kregów i złamań pozakręgowych udokumentowano także u kobiet w wieku 80 lat i starszych (54). Co niezwykle istotne, wykazano także, że skuteczność przeciwzłamaniowa ranelinianu strontu nie zależy od wyjściowych wartości wskaźników obrotu metabolicznego kości (55). O ile więc leki przeciwresorpcyjne są skuteczne przede wszystkim u chorych z wysokim obrotem kostnym, korzyści z leczenia ranelinianem strontu odniosą wszyscy chorzy, niezależnie od aktywności metabolicznej kości
Przedstawione wyniki badań potwierdzają, że ranelinian strontu jest skutecznym i bezpiecznym lekiem w zapobieganiu złamaniom osteoporotycznym wszystkich typów. Jest jedynym, jak dotąd, lekiem, który wykazał skuteczność przeciwzłamaniową w populacji kobiet w wieku podeszłym, po 80 roku życia. W odróżnieniu od teriparatide, leczenie ranelinianem strontu może być kontynuowane przez wiele lat. Unikalny mechanizm działania, prowadzący w konsekwencji do rozszczepienia cyklu remodelingu kostnego i dodatniego bilansu kostnego otwiera zupełnie nowe możliwości terapeutyczne w leczeniu chorób metabolicznych kości, zwłaszcza osteoporozy, zaś ranelinian strontu tworzy dla siebie zupełnie nową klasę leku: dual-action bone agent. Nie dziwi więc, że w aktualnych „Zaleceniach postępowania diagnostycznego i leczniczego w osteoporozie” (56) ranelinian strontu stanowi alternatywną (do bisfosfonianów) rekomendowaną opcję terapeutyczną u kobiet po menopauzie, zaś postępowanie z wyboru u kobiet po 80 roku życia, u kobiet z gęstością mineralną kości odpowiadającą osteopenii i niezależnie od aktywności obrotu kostnego (patrz rycina 1 – algorytm postępowania farmakoterapeutycznego).
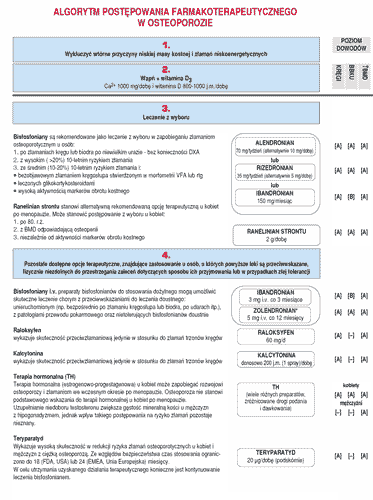 Ryc. 1. Algorytm postępowania farmakoterapeutycznego w osteoporozie. Piśmiennictwo
1. Cummings SR, et al.: Improvements in spine bone density and reduction in risk of vertebral fractures during treatment with antiresorptive drugs. Am. J. Med., 2002; 112: 281-289.
2. Lewiecki EM: Non-responders to osteoporosis therapy. J. Clin. Densit., 2003; 6: 307-314.
3. Miller PD: Greater risk, greater benefis: true or false (editorial). J. Clin. Endocrinol. Metab., 2003; 88: 538-541.
4. Black DM, et al.: Fracture risk reduction with alendronate in women with osteoporosis: The Fracture Intervention Trial. J. Clin. Endocrinol. Metab., 2000; 85: 4118-4124.
5. Ensrud KE, et al.: Treatment with alendronate prevents fractures in women at highest risk. Arch. Intern. Med., 1997; 157: 2617-2624.
6. Ettinger B, et al.: Reduction of vertebral risk in postmenopausal women with osteoporosis treated with raloxifene. Results from a 3-year randomized clinical trial. JAMA. 1999; 282: 637-645.
7. Wasnish RD, Miller PD: Antifracture efficacy of antiresorptive agents are related to changes in bone density. J. Clin. Endocrinol. Metab., 2001; 85: 231-236.
8. Hochberg MC, et al.: Changes in bone desnity and turnover explain the reductions in incidence of nonvertebral fractures that occur during teratment with antiresorptive agents. J. Clin. Endocrinol. Metab., 2002; 87: 1586-1592.
9. Mosekilde L, et al.: PTH has a more pronounced effect on vertebral bone mass and biochemical competence than antiresorptive agents (estrogen and bisphosphonate) - assessed in sexually mature, ovariectomized rats. Bone. 1994; 15: 401-408.
10. Kronenberg HM, et al.: Parathyroid hormone biosynthesis and metabolism. In: Bilezikian JP, Marcus R, Levine MA (eds). The Parathyroids: Basic and Clinical Concepts. New York, NY: Raven Press; 1994: 125-137.
11. Brown EM: Homeostatic mechanisms regulating extracellular and intracellular calcium metabolism. In: Bilezikian JP, Marcus R, Levine MA (eds). The Parathyroids: Basic and Clinical Concepts. New York, NY: Raven Press; 1994: 15-54.
12. Chambers TJ, Hall IJ: Cellular and molecular mechanisms in the regulation and function of osteoclasts. Vit Hormones. 1991;46:86.
13. Ma YL, et al.: Catabolic effects of continuous human PTH(1-38) in vivo is associated with sustained stimulation of RANK.L and inhibition of osteoporotegerin and gene-associated bone formation. Endocrinology 2001; 142: 4047-4054.
14. Onyia JE, et al.: In vivo demonstration that human parathyroid hormone 1-38 inhibits the expression of osteoprotegerin in bone with the kinetics of an immediate early gene. J. Bone Miner. Res., 2000; 15: 863-871.
15. Guo CY, et al.: Longitudinal changes in bone mineral density and bone turnover in postmenopausal women with primary hyperparathyroidism. J. Clin. Endocrinol. Metab., 1996; 81: 3487-3491.
16. Dempster DW, et al.: On the mechanism of cancellous bone preservation in postmenopausal women with mild primary hyperparathyroidism. J. Clin. Endocrinol. Metab., 1999; 84:1562-1566.
17. Parisien M, et al.: The histomorphometry of bone in primary hyperparathyroidism: preservation of cancellous bone. J. Clin. Endocrinol. Metab., 1990; 70: 930-938.
18. Hock JM, Gera I: Effects of continuous and intermittent administration and inhibition of the anabolic response of bone to parathyroid hormone. J. Bone. Miner. Res., 1992; 7: 65-72.
19. Jilka RL, et al.: Increased bone formation by prevention of osteoblast apoptosis with parathyroid hormone. J. Clin. Invest., 1999; 104: 439-446.
20. Nishida S, et al.: Increased bone formation by intermittent parathyroid hormone administration is due to the stimulation of proliferation and differentiation of osteoprogenitor cells in bone marrow. Bone. 1994; 15: 717-723.
21. Isogai Y, et al.: Parathyroid hormone regulates osteoblast differentiation positively or negatively depending on the differentiation stages. J. Bone Miner. Res., 1996; 11: 1384-1393.
22. Canalis E, et al.: Anabolic and catabolic effects of parathyroid hormone on bone and interactions within growth factors. In: Bilezikian JP, Marcus R, Levine MA (eds). The Parathyroids: Basic and Clinical Concepts. New York, NY: Raven Press; 1994.
23. Canalis E, et al.: Insulin-like growth factor I mediates selective anabolic effects of parathyroid hormone in bone cultures. J. Clin. Invest., 1989; 83: 60-S.
24. McCarthy TL, et al.: Parathyroid hormone enhances the transcript and polypeptide levels of insuline-like growth factor in osteoblast-enriched cultures from fetal rat bone. Endocrinology. 1989; 124: 1247-1253.
25. Mori S, et al.: Production of new trabecular bone in osteopenic ovariectomized rats by prostaglandin E2. Calcif Tissue Int. 1992; 50: 80-87.
26. Centrella M, et al.: Parathyroid hormone modulates transforming growth factor-beta activity and binding in osteoblast-enriched cell cultures from fetal rat parietal bone. Proc. Natl. Acad. Sci USA, 1988; 85: 5889-5893.
27. Van Leeuw JPTM, et al.: Parathyroid hormone-induced ornithine decarboxylase activity in fetal rat osteoblasts. J. Bone Miner. Res., 1989; 4: 485-492.
28. Uusi-Rasi K, et al.: Teriparatide (rhPTH 1-34) improves the stuctural geometry of the hip. J. Bone Miner. Res., 2002; 17: 139S.
29. Dempster DW, et al.: Effects of daily treatment of parathyroid hormone on bone microarchitecture and turnover in patients with osteoporosis: a paired biopsy study. J. Bone Miner. Res., 2001; 16: 1846-1853.
30. Lindsay R, et al.: Randomised controlled study of effect of parathyroid hormone on vertebral-bone mass and fracture incidence among postmenopausal women on oestrogen with osteoporosis. Lancet 1997; 350: 550-556.
31. Cosman F, et al.: parathyroid hormone added to established hormone therapy: effects on vertebral fracture and maintenance of bone mass after parathyroid hormone withdrawal. J. Bone Miner. Res., 2001; 16: 925-931.
32. Neer RM, et al.: Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N. Engl. J. Med., 2001; 344: 1434-1441.
33. Vahle JL, et al.: Skeletal changes in rats given daily subcutaneus injections of recombinant human parathyroid hormone (1-34) for 2 years and revelance to human data. Toxicol. Pathol., 2002; 30: 312-321.
34. Tashjian AH, Chabner BA: Clinical safety of recombinant human parathyroid hormone (1-34) in the treatment of osteoporosis in postmenopausal women and men. J. Bone Miner. Res., 2002; 17: 1151-1161.
35. Orwoll ES, et al.: The effect of teriparatide (human parathyroid hormone (1-34)) therapy on bone mineral density in men with osteoporosis. J. Bone Miner. Res., 2003; 18: 9-17.
36. Hodsman AB, et al.: Efficacy and safety of human parathyroid hormone (1-84) in increasing BMD in postmenopausal osteoporosis. J. Clin. Endocrinol. Metab., 2003; 88: 5212-5220.
37. Miller PD, et al.: Clinical use of teriparatide in the real world: Initial insights. Endocrine Practice 2004; 10: 139-148.
38. Su Y, et al.: The strontium salt S12911 inhibits bone resorption in mouse calvaria and isolated rat osteoclasts cultures. Bone and Mineral, 1992; 17: 188.
39. Su Y, et al.: The strontium salt S12911 inhibits the expression of carbonic anhydrase and the vitronectin receptor in chicken bone marrow cultures and bone resorption in mouse calvaria and isolated rat osteoclasts. J. Bone Miner. Res., 1992; 7, (suppl. 1): 306.
40. Marie PJ, et al.: A new agent containing strontium ranelate (S12911) increases bone mass in normal and ovariectomized rats. J. Bone Miner. Res., 1991; 6, (suppl. 1): 249.
41. Ammann P, et al.: Long-term administration of a high dose of the strontium salt S12911 has no toxic effect on bone biomechanics in female rats and may improve bone strength of the midshaft humerus. J. Bone Miner. Res., 1995; 10, (suppl. 1): 358.
42. Morohashi T, et al.: Effects of strontium on calcium metabolism in rats II. Strontium prevents the increased rate of bone turnover in ovariectomized rats. Jpn J. Pharmacol., 1995; 68: 153-159.
43. Ammann P, et al.: The increase in vertebral bone mass induced in intact rats by long-term administration of the strontium salt S12911 is directly correlated with vertebral bone strength. Osteoporosis Int., 1996; 6, (suppl. 1): 259.
44. Marie PJ, et al.: An uncoupling agent containing strontium prevents bone loss by depressing bone resorption and maintining bone formation in estrogen-deficient rats. J. Bone Miner. Res., 1993; 8: 607-615.
45. Reginster JY, et al.: Prevention of early postmenopausal bone loss by strontium ranelate: a randomized, two-year, double-blind, dose-ranging, placebo-controlled trial. Osteoporos Int., 2002; 13: 925-931.
46. Meunier PJ, et al.: The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N. Engl. J. Med., 2004, 350; 459-468.
47. Register JY, et al.: Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis; treatment of peripherial osteoporosis (TROPOS) study. J. Clin. Endocrinol. Metab., 2005; 90; 2816-2822.
48. Seeman E, et al.: Strontium ranelate reduces the risk of vertebral and nonvertebral fractures in aged eighty years and over. J. Bone Miner. Res., 2006; 21: 1113-1120.
49. Sawicki A, et al.: Strontium ranelate reduces the risk of vertebral fractures in postmenopausal women with osteopenia. Calc Ttissue Int 2004; 74, (suppl. 1): S84. Abstract P153
50. Marquis P, et al.: Development and validation of a specific quality of life module in post-menopausal women with osteoporosis. The QUALIOST. Qual Life Res., 2001; 10: 555-566.
51. Marquis P, et al.: Beneficial effects of strontium ranelate on the quality of life in patients with vertebral osteoporosis. Osteoporosis Int., 2005; 16: 54.
52. Marquis P, et al.: Long-term beneficial effects of strontium ranelate on the quality of life in patients with vertebral osteoporosis (SOTI study). Calc. Tissue Int., 2007; 80, (suppl. 1): P 377.
53. Reginster JY, et al.: Strontium ranelate: an anti-osteoporotic treatment demostrated vertebral and nonverterbral anti fracture efficacy over 5 years in post menopausal osteoporotic women. Osteoporosis Int. 2006; 17, (suppl. 2): OC31.
54. Seeman E, et al.: Sustained 5-year vertebral and non-vertebral fracture risk reduction with strontium ranelate in elderly women with osteoporosis. Osteoporosis Int. 2006; 17, (suppl. 2): (OC39).
55. Colette J, et al.: Strontium ranelate decreases vertebral fracture risk whatever the level of pretreatment bone turnover markers. Calc. Tissue Int., 2007; 80, (suppl. 1): OC 023.
56. Lorenc RS, et al.: Zalecenia postepowania diagnostycznego i terapeutycznego w osteoporozie. Obniżenie częstości złamań poprzez efektywną profilaktykę i leczenie. Terapia 2007; 9, z. 3 (200): 11-39.
otrzymano/received: 2007-12-21 zaakceptowano/accepted: 2008-01-28 Adres/address: *Waldemar Misiorowski Klinika Endokrynologii CMKP Szpital Bielański ul. Cegłowska 80, 01-809 Warszawa tel.: (0-22) 56 90 302, tel./fax: (0-22) 834 31 31 e-mail: klinendo@cmkp.edu.pl Pełna wersja artykułu Postępy w leczeniu osteoporozy: leczenie anaboliczne dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








