|
© Borgis - Postępy Nauk Medycznych 4, s. 163-167
*Wojciech Bik, Ewa Wolińska-Witort, Magdalena Chmielowska, Lidia Martyńska, Agnieszka Baranowska-Bik, Bogusława Baranowska
Wpływ VIP i PACAP 38 na wydzielanie cytokin i kortykosteronu w warunkach ostrego zapalenia indukowanego przez lipopolisacharydy (LPS) bakterii Gram-ujemnych
Effects of VIP and PACAP 38 on serum concentration and corticosteron during lipopolisaccharide (LPS) – induced acute inflammation
Zakład Neuroendokrynologii Klinicznej CMKP
Kierownik Zakładu: prof. Bogusława Baranowska Streszczenie
Liczne badania wskazują, że VIP i PACAP 38 są neuropeptydami odgrywającymi istotne znaczenie w modulacji odpowiedzi immunologicznej w ostrych i przewlekłych reakcjach zapalnych. Celem pracy była ocena wpływu VIP i PACAP 38 na wydzielanie cytokin prozapalnych i przeciwzapalnych oraz kortykosteronu w czasie ostrego zapalenia indukowanego przez lipopolisacharydy (LPS) bakterii Gram-ujemnych. Metody: Szczury samce rasy Wistar-Kyoto otrzymywały dootrzewnowo odpowiednio: 0,9% NaCl, LPS, VIP, PACAP 38, LPS+VIP lub LPS+PACAP 38. Po 2 godzinach od podania badanych substancji oznaczano w surowicy stężenie TNFa, IL6 i kortykosteronu a po 4 godzinach IL10 i kortykosteronu. Wyniki: Podanie LPS w stosunku do grupy kontrolnej (0,9% NaCl) spowodowało znamienny statystycznie wzrost poziomu TNFa, IL 6 i kortykosteronu po 2 godzinach oraz IL10 i kortykosteronu po 4 godzinach. Podanie łącznie LPS+VIP obniżyło poziom IL6 po 2 godzinach i kortykosteronu po 2 i 4 godzinach w stosunku do zwierząt otrzymujących LPS. Analogiczna jednoczasowa iniekcja LPS+PACAP 38 wywołała obniżenie TNFa i kortykostreonu po 2 godzinach w porównaniu do grupy otrzymującej LPS. Wnioski: VIP i PACAP 38 modulują odpowiedź układu immunologicznego i endokrynnego w czasie ostrego zapalenia jednakże PACAP 38 wywiera swoje działanie krócej niż VIP. Słowa kluczowe: VIP, PACAP38, zapalenie, hormony
Summary
In many studies it has been reported that VIP and PACAP 38 may play an important role in modulation of the immunological response. The aim of our study was to estimate the effects of the administration of exogenous VIP or PACAP 38 on serum concentrations of TNFa, IL6, IL10 and corticosterone during lipopolisaccharide (LPS)-induced acute inflammation. Metods: Male Wistar-Kyoto rats were divided into groups which received respectively: placebo (0.9% NaCl), LPS, VIP, PACAP 38, LPS+VIP or LPS+PACAP 38. The TNFa and IL6 serum concentrations were measured after 2 h from the time of the administration of the agents. IL10 was measured after 4 h. Corticosterone serum concentration was estimated after 2 and 4 h. Results: LPS administration increased serum proinflammatory (TNFa and IL6) and antiinflammatory (IL10) concentrations as well caused increasing of corticosterone concentrations after 2 and 4 h. VIP administration simultaneously with LPS decreased the LPS-induced increase in IL6 after 2 h and corticosterone after 2 and 4 h. whereas PACAP 38 with LPS injections reduced serum TNFa concentration after 2 h accompanied with decreasing of corticosterone concentration only after 2 h. Conclusions: We conclude that VIP and PACAP 38 can modulate not only immune responses but also hormonal responses during acute inflammation. PACAP 38 anti-inflammatory effect is shorter-lasting than that observed for VIP. Key words: VIP, PACAP38, inflammations, hormones
WSTĘP
VIP (naczynioruchowy peptyd jelitowy) i PACAP 38 (przysadkowy peptyd aktywujący cyklazę adenylową) są neuropeptydami zaliczanymi do nadrodziny glukagonu, wywierającymi szereg istotnych działań ogólnoustrojowych takich jak rozkurcz mięśni gładkich, modulujący wpływ na wydzielanie hormonów (między innymi przysadkowych i nadnerczowych), hamowanie apoptozy, a w przypadku PACAP 38 działanie neuroprotekcyjne (1, 2)
Efekty te przekazywane są przez receptory VPAC1 i VPAC2 wiążące zarówno VIP oraz PACAP oraz poprzez receptor PAC1 wiążący selektywnie PACAP. Receptory te sprzężone są z białkami G (3, 4).
W badaniach eksperymentalnych wykazano wpływ VIP i PACAP 38 na układ immunologiczny zarówno w warunkach podstawowych oraz w czasie procesu zapalnego. Wpływ ten manifestuje się poprzez obecność receptorów dla tych peptydów na komórkach immunologicznie kompetentnych, jak również możliwością syntezy VIP i PACAP 38 w komórkach układu odpornościowego. Ekspresje receptorów VPAC1 i PAC1 wykazano w spoczynkowych makrofagach, natomiast makrofagi pobudzone antygenami wykazują obecność receptora VPAC2. W limfocytach Th1 wykazano obecność receptorów VPAC1 i VPAC2, a w limfocytach Th2 stwierdzono receptory VPAC2 (5, 6, 7).
Wyniki badań sugerują także protekcyjny wpływ VIP i PACAP 38 podawanych egzogennie na przebieg ostrych (wywołanych lipopolisacharydami bakterii Gram-ujemnych) i przewlekłych reakcji zapalnych (w modelach eksperymentalnych reumatoidalnego zapalenia stawów i choroby Crohna) (7, 8). W przypadku ostrego zapalenia wywołanego iniekcją LPS bakterii Gram-ujemnych wykazano, że podanie zwierzętom doświadczalnym VIP lub PACAP 38 zmniejsza śmiertelność zwierząt co może być spowodowane obniżeniem syntezy cytokin prozapalnych (TNFα, IL6, IL12, IFNα, NO) oraz wzrostem produkcji cytokin przeciwzapalnych (IL10) przez komórki immunologicznie kompetentne (5, 6, 9, 10, 11). Poza wpływem na syntezę cytokin VIP i PACAP hamują także aktywność makrofagów poprzez zjawisko „down regulation” czasteczki CD 14 makrofagów, która jest receptorem błonowym dla LPS i odgrywa istotna role w procesie fagocytozy (12, 13). Wydaje się, że VIP swoje przeciwzapalne działanie wywiera głównie poprzez receptor VPAC1, a PACAP 38 poprzez receptor PAC1 (5, 6, 14).
Poza układem immunologicznym istotny wpływ na przebieg procesu zapalnego wywiera układ endokrynny poprzez, przede wszystkim, pobudzenie osi podwzgórze-przysadka-nadnercza i zahamowanie aktywności układów: podwzgórze-przysadka-tarczyca oraz podwzgórze-przysadka-gonady (15, 16, 17). Wzrost wydzielania kortykosteroidów pod wpływem wzrostu syntezy cytokin prozapalnych nasila ich immunosupresyjne działanie, co stanowi istotny czynnik ograniczający przebieg reakcji zapalnej. Wzajemne interakcje pomiędzy układem immunologicznym i endokrynnym odgrywają istotną rolę w utrzymaniu równowagi pomiędzy procesami pro- i przeciwzaplnymi.
Celem pracy była ocena wpływu VIP i PACAP 38 na wydzielanie cytokin prozapalnych i przeciwzapalnych oraz kortykosteronu podczas ostrego eksperymentalnego zapalenia wywołanego przez lipopolisacharydy bakterii Gram-ujemnych.
MATERIAŁ I METODY
Doświadczenia przeprowadzono na szczurach samcach rasy Wistar-Kyoto o masie 250-300 g. Zwierzęta przebywały w pomieszczeniu z kontrolą długości dnia (14 godzin światła i 10 godzin ciemności) i temperatury (220C) oraz ze stałym dostępem do wody i pożywienia. Każdy eksperyment, w którym badano VIP lub PACAP 38 przeprowadzano w jednym dniu w tych samych godzinach. LPS, VIP, 0,9% NaCl i PACAP 38 podawane były dootrzewnowo. Krew z pnia mózgu pobierana była po 2 lub 4 godzinach od dootrzewnowej iniekcji badanej substancji a uzyskaną po odwirowaniu surowicę przechowywano w temperaturze -600 C.
Projekt badań i wszystkie procedury badawcze zostały zaakceptowane przez pierwszą Warszawską Komisję Bioetyczną ds. Badań na Zwierzętach przy Instytucie Biologii Doświadczalnej im. M. Nenckiego w Warszawie.
I EKSPERYMENT – ocena działania VIP
Eksperyment przeprowadzono łącznie na 71 zwierzętach wg poniższego protokołu:
1. 20 zwierząt otrzymało 150 μl 0,9% NaCl (grupa kontrolna). Od 10 zwierząt pobrano krew po 2 godzinach i od 10 po 4 godzinach.
2. 20 zwierząt otrzymało 600 μg LPS (Escherichia coli; 055: BT Sigma). Od 10 zwierząt pobrano krew po 2 godzinach i od 10 po 4 godzinach.
3. 15 zwierząt otrzymało 30 nmol VIP (Sigma Chemical Co). Od 7 zwierząt pobrano krew po 2 godzinach a od 8 po 4 godzinach.
4. 16 zwierząt otrzymało równocześnie 600 μg LPS ( Escherichia coli; 055: BT Sigma) oraz 30 nmol VIP (Sigma Chemical Co). Od 8 zwierząt pobrano krew po 2 godzinach i od 8 po 4 godzinach.
II EKSPERYMENT – ocena działania PACAP 38
Eksperyment przeprowadzono łącznie na 67 zwierzętach wg poniższego protokołu:
1. 20 zwierząt otrzymało 150 μl 0,9% NaCl (grupa kontrolna). Od 10 zwierząt pobrano krew po 2 godzinach i od 10 po 4 godzinach.
2. 19 zwierząt otrzymało 600 μg LPS (Escherichia coli; 055: BT Sigma). Od 10 zwierząt pobrano krew po 2 godzinach i od 9 po 4 godzinach.
3. 14 zwierząt otrzymało 30 nmol PACAP 38 (Sigma Chemical Co). Od 7 zwierząt pobrano krew po 2 godzinach i od 7 po 4 godzinach.
4. 14 zwierząt otrzymało równocześnie 600 μg LPS ( Escherichia coli; 055: BT Sigma) oraz 30 nmol PACAP 38 (Sigma Chemical Co). Od 7 zwierząt pobrano krew po 2 godzinach i od 7 po 4 godzinach.
W obu eksperymentach po 2 godzinach oznaczano w surowicy stężenia: IL 6 i TNFα a po 4 godzinach IL10. Natomiast 2 i po 4 godzinach oznaczano stężenia kortykosteronu w surowicy.
Cytokiny oznaczano metodą immunoenzymatyczną (ELISA) przy użyciu zestawów komercyjnych specyficznych gatunkowo:
1. TNFα – firmy Amersham Pharmacia Biotech (UK).
2. IL6 i IL10 – firmy Endogen (USA).
Kortykosteron oznaczano metodą radioimmunologiczną (RIA) za pomocą komercyjnego zestawu firmy ICN Biomedicals Inc (USA).
ANALIZA STATYSTYCZNA
Analizę statystyczną wykonano przy użyciu pakietu STATISTICA ver. 5.1 PL. Do analizy więcej niż dwóch grup stosowano test Kruskala-Wallisa, a przy porównaniu dwóch grup stosowano test U Manna-Whitneya. Korelacje pomiędzy stężeniem cytokin i kortykosteronu badano testem Spearmana. Istotność statystyczną ustalono na poziomie p <0,05.
WYNIKI
I eksperyment – ocena działania VIP.
Podanie 600 μg LPS zwierzętom doświadczalnym spowodowało w stosunku do grupy kontrolnej zwierząt (otrzymujących 0,9% NaCl) znamienny statystycznie wzrost poziomu cytokin prozapalnych (TNFα i IL6) po 2 godzinach i cytokiny przeciwzapalnej (IL10) po 4 godzinach (ryc. 1). Wzrostowi syntezy cytokin towarzyszył wzrost wydzielania kortykosteronu po 2 i 4 godzinach (ryc. 2).
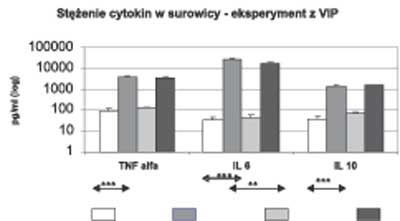 Ryc. 1. Stężenia cytokin w surowicy po 2 lub 4 godzinach – eksperyment I (VIP)
** p<0,01 *** p<0,001 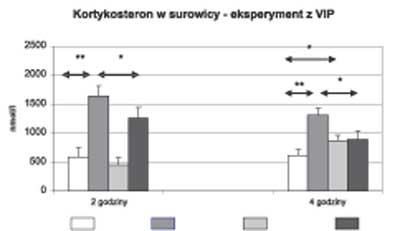 Ryc. 2. Stężenie kortykosteronu w surowicy po 2 i po 4 godzinach – eksperyment I (VIP)
** p<0,01 * p<0,05 Podanie VIP w dawce 30 nmol/zwierzę w stosunku do grupy kontrolnej nie wpłynęło na stężenie badanych cytokin, natomiast spowodowało statystycznie znamienny wzrost poziomu kortykosteronu po 4 godzinach (ryc. 2).
Podanie łącznie 600 μg LPS i 30 nmol VIP zmniejszyło istotnie statystycznie stężenie IL6 po 2 godzinach (ryc. 1) i kortykosteronu po 2 i 4 godzinach w porównaniu do zwierząt, które otrzymały tylko LPS (ryc. 2).
II eksperyment – ocena działania PACAP 38.
W eksperymencie tym podanie 600 μg LPS w stosunku do grupy kontrolnej wywołało podobną reakcję zapalną jak w I eksperymencie – wzrost poziomu cytokin prozapalnych po 2 godzinach i przeciwzapalnej po 4 godzinach (ryc. 3) oraz zwiększenie stężenia kortykosteronu po 2 i 4 godzinach (ryc. 4).
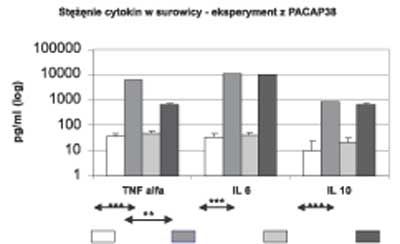 Ryc. 3. Stężenia cytokin w surowicy po 2 lub 4 godzinach – eksperyment II (PACAP 38)
** p<0,01 *** p<0,001 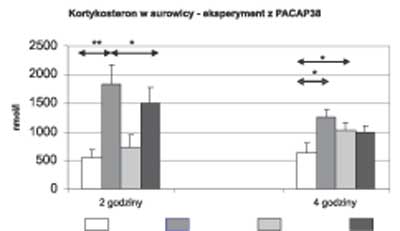 Ryc. 4. Stężenie kortykosteronu w surowicy po 2 i po 4 godzinach – eksperyment II (PACAP 38)
** p<0,01 * p<0,05 Iniekcja PACAP 38 nie wpłynęła na zmiany stężeń cytokin prozapalnych i przeciwzapalnej w porównaniu z grupą kontrolną ale podobnie jak VIP spowodowała istotny statystycznie wzrost poziomu kortykosteronu po 4 godzinach (ryc. 4).
Podanie łącznie 600 μg LPS i 30 nmol PACAP 38 zmniejszyło istotnie statystycznie stężenie TNFα po 2 godzinach (ryc. 3) i kortykosteronu po 2 godzinach w porównaniu do zwierząt, które otrzymały tylko LPS (ryc. 4).
W celu ustalenia korelacji pomiędzy poziomem cytokin a kortykosteronem wykonano test Spearmana, który wykazał w I eksperymencie dodatnią korelację pomiędzy kortykosteronem, a TNFα (R= 0,62; p<0,01) oraz kortykosteronem a IL6 (R= 0,73; p<0,01). W eksperymencie II stwierdzono podobne zależności: kortykosteron vs TNFα (R= 0,75; p<0,01) oraz kortykosteron vs IL6 (R= 0,69; p<0,01). W obu eksperymentach nie stwierdzono istotnych statystycznie korelacji pomiędzy kortykosteronem a IL 10.
DYSKUSJA
Bakteryjne endotoksyny takie jak lipopolisacharydy bakterii Gram ujemnych stymulują syntezę cytokin prozapalnych przez komórki immunologicznie kompetentne w czasie zapalenia. W sytuacji niekontrolowanego przebiegu zapalenia dochodzić może do wstrząsu septycznego będącego stanem bezpośredniego zagrożenia życia.
W licznych badaniach eksperymentalnych udokumentowano przeciwzapalne działanie VIP i PACAP 38, które manifestowało się wpływem na odpowiedź immunologiczną poprzez hamowanie syntezy cytokin prozapalnych i pobudzaniem syntezy cytokin przeciwzaplnych przez komórki immunologicznie kompetentne oraz zmniejszeniem aktywności makrofagów (5, 6, 7, 8). Dlatego też VIP i PACAP 38 określane są jako czynniki deaktywujące makrofagi. Poza tym oba neuropeptydy wpływają na swoistą odpowiedź immunologiczną w przebiegu ostrego zapalenia w mechanizmie hamowania proliferacji limfocytów T, zmniejszenia cytotoksyczności limfocytów T oraz ekspresji Fas ligand (FasL) (18, 19).
W badaniach własnych wykazano, że w warunkach ostrego zapalenia indukowanego przez LPS bakterii Gram ujemnych VIP podany równocześnie z LPS zmniejszał istotnie statystycznie syntezę IL6 po 2 godzinach jak również obniżał o ok. 25% stężenie TNFα po 2 godzinach (różnice nie były jednak znamienne statystycznie) w porównaniu do grupy zwierząt poddanych dzialaniu tylko LPS. W przypadku PACAP 38 stwierdziliśmy, że hamujące działanie tego neuropeptydu na wydzielanie cytokin prozapalnych podczas wywołanego przez LPS ostrego zapalenia manifestowało się obniżeniem stężenia TNFα po 2 godzinach.
VIP i PACAP 38 modulują układ immunologiczny w czasie zapalenia poprzez szlaki: cAMP zależny i cAMP niezależny, co prowadzi do obniżenia aktywności NF-κB w komorkach immunologicznie kompetentnych jak również poprzez wpływ na ekspresję c-Jun, IRF-1 (czynniki regulujący gen dla interferonu 1) czy CREB ( cAMP response binding protein) (6, 7, 20, 21). Wymienione mechanizmy prowadzą do zahamowania syntezy cytokin prozapalnych i ograniczenia przebiegu reakcji zapalnej.
Poza układem immunologicznym w czasie zapalenia ulega pobudzeniu oś podwzgórze-przysadka-nadnercza. Cytokiny prozapalne pobudzają wydzielanie kortykosteronu działając bezpośrednio na nadnercza jak również poprzez pobudzenie osi CRH/ACTH (17). Zwiększenie wydzielania glikokortykoidów stanowi kolejny czynnik ochronny przed niekontrolowanym rozwojem reakcji zapalnej. Glikokortykoidy wywierają swoje immunosupresyjne działanie poprzez między innymi zmniejszenie aktywności limfocytów T i NK oraz obniżenie właściwości fagocytarnych makrofagów (22).
VIP i PACAP 38 wykazują pobudzający wpływ na wydzielanie kortykosteronu w warunkach podstawowych co potwierdziły także wyniki naszych badań. W obu przeprowadzonych eksperymentach stwierdziliśmy zwiększenie wydzielania kortykostreonu po 4 godzinach po podaniu VIP lub PACAP 38 w stosunku do kontrolnej grupy zwierząt (0,9% NaCl).
Równoczesne podanie zwierzętom doświadczalnym VIP + LPS powodowało znamienne statystycznie obniżenie poziomu kortykosteronu po 2 i 4 godzinach, natomiast iniekcja PACAP 38 wraz z LPS w analogicznych warunkach spowodowała obniżenie poziomu kortykostreonu tylko po 2 godzinach w porównaniu do zwierząt, którym podano tylko LPS. Biorąc pod uwagę znamienne statystycznie dodatnie korelacje pomiędzy poziomem kortykosteronu a stężeniami cytokin prozapalnych w obu przeprowadzonych eksperymentach można stwierdzić, że modulacja wydzielania kortykosteronu przez VIP lub PACAP 38 w czasie ostrego zapalenia była wynikiem obniżenia syntezy cytokin prozapalnych przez oba badane neuropeptydy.
Przedstawione powyżej wyniki potwierdzają przeciwzapalne działanie VIP i PACAP 38 jak również istotne interakcje pomiędzy układem immunologicznym i endokrynnym w przebiegu ostrej reakcji zapalnej. Wzajemne oddziaływania pomiędzy tymi dwoma układami są niezbędne do utrzymania homeostazy ogólnoustrojowej.
Podsumowując stwierdzamy, że VIP i PACAP 38 są modulatorami odpowiedzi immunologicznej w warunkach ostrego zapalenia indukowanego przez LPS bakterii Gram- ujemnych, jednakże działanie VIP trwa dłużej niż PACAP 38
Badania były finansowane z grantu CMKP 501-2-2-25-28/00 Piśmiennictwo
1. Sherwood N.M.i wsp.: The origin and function of Pituitary Adenylate Cyclase Activating Polypeptide (PACAP)/glucagon superfamily. Endocr. Rev. 2000; 21, 619-70.
2. Vaudry D. i wsp.: Pituitary adenylate cyclase-activating polypeptide and its receptors: from structure to functions. Pharmacol. Rev. 2000; 52, 269-324.
3. Harmar A.J. i wsp.: Nomenclature of receptors for vasoactive intestinal peptide (VIP) and pituitary adenylate cyclase activating polypeptide (PACAP). Pharmacol. Rev. 1998; 50, 625-27.
4. Reubi J.C.: In vitro evaluation of VIP/PACAP receptors in healthy and diseased human tissues: clinical implications. Ann. NY Ac. Sci. 2000; 921, 1-25.
5. Ganea D., Delgado M. Neuropeptides as modulators of macrophage functions. Regulation of cytokine production and antigen presentation by VIP and PACAP. Archiv. Immunol. et Therap. Exp. 2001; 49, 101-10.
6. Ganea D., Delgado M.: VIP and PACAP as modulators of both innate and adaptive immunity. Crit. Rev. Oral. Biol. Med. 2002; 13, 229-37.
7. Pozo D.: VIP and PACAP-mediated immunomodulation as prospective therapeutic tools. Trends in Mol. Med. 2003; 9, 211-17.
8. Delgado M. i wsp.: PACAP in immunity and inflammation. Ann. NY. Acad. Sci. 2003; 992, 141-57.
9. Delgado M. i wsp.: Vasoactive Intestinal Peptide (VIP) and Pituitary Adenylate Cyclase-Activating Polypeptide (PACAP) protect mice from lethal endotoxemia through the inhibition of TNFá and IL6. J. Immunol. 1999; 162, 1200-05.
10. Delgado M. i wsp.: Vasoactive Intestinal Peptide and Pituitary Adenylate Cyclase-Activating Polypeptide enhance IL10 production by murine macrophages: in vitro and in vivo studies. J. Immunol. 1999; 162, 1707-16.
11. Delgado M. i wsp.: VIP and PACAP inhibit IL12 production in LPS-stimulated macrophages. Subsequent effects on INFă synthesis by T cells. J.Neuroimunol. 1999; 96, 167-81.
12. Delgado M. i wsp.: Shedding of membrane-bound CD14 from LPS-stimulated macrophages by VIP and PACAP. J. Neuroimmunol. 1999; 99, 61-71.
13. Delgado M., Ganea D. Inhibition of endotoxin-induced macrophage and chemokine production by VIP and PACAP in vitro and in vivo. J Immunol. 2001; 167, 966-75.
14. Brabet P., Laceta J., Gomariz R.P. Anti-inflammatory role in septic shock of pituitary adenylate cyclase-activating polypeptide receptor. PNAS. 2002; 99, 1053-8.
15. Basedovsky H.O., Del Rey A. Immune-Neuro-Endocrine Interactions: Facts and hypothesis. Endocrine Rev. 1996; 17, 64-102.
16. McCann S.M. i wsp.: The mechanism of action of cytokines to control the release of hypothalamic and pituitary hormones in infection. Ann.NY Acad. Sci. 2000; 917, 4-18.
17. Turnbull A.V., River C.L. Regulation of the hypothalamic-pituitary-adrenal axis by cytokines: action and mechanisms of action. Physiol. Rev. 1999; 79, 1-71.
18. Delgado M., Ganea D. Vasoactive Intestinal Peptide and Pituitary Adenylate Cyclase-Activating Polypeptide inhibit T cell mediated cytotoxicity by inhibiting Fas Ligand expression. J. Immunol. 2000; 165, 114-23.
19. Delgado M., Ganea D. Vasoactive Intestinal Peptide and Pituitary Adenylate Cyclase-Activating Polypeptide inhibit antigen-induced apoptosis of mature T lymphocytes by inhibiting Fas Ligand expression. J. Immunol. 2000; 164, 1200-10.
20. Delgado M. i wsp.: VIP and PACAP inhibit Tumor Necrosis Factor a transcriptional activation by regulating nuclear factor-kb and cAMP response element-binding protein/c Jun. J.Biol. Chem. 1998; 273, 31427-36.
21. Delgado M. i wsp.: Vasoactive Intestinal Peptide and Pituitary Adenylate Cyclase Activating Polypeptide prevent inducible nitric oxide synthase transcription in macrophages by inhibiting NF-ęB and IFN regulatory factor 1 activation. J.Immunol. 1999; 162, 4685-96.
22. Elenkov I.J. i wsp.: Stress, corticotropin-releasing hormone, glucocorticoids and the immune/inflammatory response: acute and chronic effects. Ann. N.Y Acad. Sci. 1999; 876, 1-11.
otrzymano/received: 2006-02-01 zaakceptowano/accepted: 2006-04-22 Adres/address: *Wojciech Bik Zakład Neuroendokrynologii Klinicznej CMKP ul. Marymoncka 99, 01-813 Warszawa tel 22 569 38 50, fax 22 569 38 59 e-mail: zncmkp@op.pl Pełna wersja artykułu Wpływ VIP i PACAP 38 na wydzielanie cytokin i kortykosteronu w warunkach ostrego zapalenia indukowanego przez lipopolisacharydy (LPS) bakterii Gram-ujemnych dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








