|
© Borgis - Postępy Nauk Medycznych 2, s. 126-131
*Lucyna Papierska, Anna Kasperlik-Załuska
Przypadkowo wykryte guzy (incydentaloma) nadnerczy. Kogo operować?
Incidentally discovered adrenal masses. Who should be operated?
Klinika Endokrynologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. CMKP dr hab. med. Wojciech Zgliczyński Streszczenie
Jako incydentaloma określane są nieme klinicznie guzy stwierdzane przypadkowo podczas badań obrazowych prowadzonych z innych wskazań niż ocena nadnerczy. Wykrycie guza powinno pociągnąć za sobą wnikliwą diagnostykę przeprowadzoną w celu ustalenia ewentualnych wskazań do leczenia operacyjnego (są nimi potencjalna złośliwość lub czynność hormonalna). Tomografia komputerowa (zdjęcia przed i po podaniu środka kontrastowego) jest najważniejszą metodą oceny guzów nadnerczy. Guzy złośliwe mają densyjność wyższą niż 10 J.; po zakontrastowaniu spada ona wolno (<50%/10 min.). Inne badania wykorzystywane do oceny guzów nadnerczy to badanie rezonansu magnetycznego (MRI) i techniki izotopowe (SPECT, PET). Podstawowe badania hormonalne to ocena dobowego wydalania katecholamin i ich metabolitów z moczem i ich stężeń w krwi, kortyzolemii przed i po hamowaniu deksametazonem, aktywności reninowej osocza, stężeń potasu i aldosteronu. Jeżeli nie kierujemy chorego na operację, powinien pozostawać on pod kontrolą, z powtórzeniem powyższych badań po 6, 12 i 24 miesiącach. Jeżeli guz w ciągu roku zwiększy się o centymetr lub więcej, zaleca się leczenie operacyjne. Słowa kluczowe: przypadkowo wykryte guzy nadnerczy, subkliniczny zespół Cushinga, rak nadnercza, pheochromocytoma
Summary
The term „adrenal incidentaloma” means clinically unapparent adrenal mass, incidentally detected during imaging studies conducted for reasons other than the evaluation of the adrenal glands. These tumors have to be accurately examined to assess the indication to surgical treatment (malignancy and/or hormonal activity). Computed tomography (unenhanced, followed by contrast-enhanced scans) is the main way to assessment of adrenal tumors. Malignant lesion´s density is higher than 10 HU, and the relative percentage washout is lower than 50% at 10 min. Other useful methods using in tumor assessment are magnetic resonance imaging (MRI) and scintigraphy techniques (SPECT and PET). Basal hormonal investigations include urine and plasma catecholamines and their metabolites, plasma cortisol before and after the dexamethasone, renin plasma activity, aldosterone level and plasma potassium. If non-operated, the patient should be followed with repeated imaging and hormonal testing – recommended at 6, 12, and 24 months. If tumor size growths more than 1 cm per year, the operation should be performed. Key words: adrenal incydentaloma, praecushing syndrome, adrenal cancer, pheochromocytoma
Wstęp
Incydentaloma są to guzy o rozmiarach powyżej 1 cm wykrywane w nadnerczach podczas badań obrazowych wykonywanych w innym celu niż ocena nadnerczy. Wraz z rozwojem technik obrazowych stwierdzane są coraz częściej i stanowią istotny problem kliniczny. Guzy nadnercza wykrywa się przy okazji około 0,4% badań USG brzucha wykonanych z różnych wskazań, a dziesięciokrotnie częściej u chorych z wywiadem nowotworowym. Ostatnie doniesienia dotyczące badań CT jamy brzusznej wykonywanych ze wskazań „pozaendokrynologicznych” wskazują, że guzy nadnercza stwierdzane są przypadkowo u 4% chorych (1).
„Starzenie się” nadnerczy zachodzi nierównomiernie w różnych ich częściach i różnych warstwach kory, co powoduje mikro i makroskopowe zmiany ich morfologii (2). Zmiany o średnicy poniżej 1 cm można odnaleźć aż w 65% zbadanych pośmiertnie nadnerczy (3). Pięćdziesiąt lat temu pojedyncze guzki o średnicy ponad 1 cm stwierdzono u 8,7% badań autopsyjnych zmarłych po 65 roku życia (4). Nowsze badania donoszą o ich obecności u średnio 6% populacji, a odnotowywana częstość waha się od 1 do 32% w badaniach sekcyjnych, i 0,2-7% w badaniach obrazowych, zależąc głównie od wieku chorych (5, 6). Leczenia operacyjnego wymagałby jedynie niewielki procent tych zmian, gdyż w przeważającym procencie są łagodne i nieczynne hormonalnie. Wnikliwa diagnostyka przeprowadzona po przypadkowym wykryciu guza nadnercza musi więc doprowadzić do odpowiedzi na pytanie: operować, czy obserwować?
Wskazania do operacyjnego leczenia incydentaloma nadnercza mogą wynikać z jego złośliwości lub czynności hormonalnej. Potencjalną złośliwość guza można ocenić na podstawie badań obrazowych (7). Badania hormonalne to oznaczenie stężeń hormonów w krwi i moczu dobowym – podstawowe i w testach dynamicznych.
Badania obrazowe
Ultrasonografia (USG)
Guzy nadnerczy są najczęściej stwierdzane podczas ultrasonografii jamy brzusznej. Podczas tego badania nie zawsze dają się uwidocznić zdrowe nadnercza (szczególnie lewe) (8, 9), ale czułość metody wobec nawet małych (<2 cm średnicy) guzów przekracza 90% (10,11). Podczas ultrasonografii, poza zmierzeniem zmiany, można ocenić zwapnienia, ogniska martwicy lub torbiele.
Tomografia komputerowa (TK)
Badaniem obrazowym najbardziej przydatnym do oceny incydentaloma nadnerczy jest rentgenowska tomografia komputerowa, wykonana przed i po dożylnym podaniu środka kontrastowego. Przy zalecanych warstwach co 3-5 mm, można zobrazować guzy o wymiarach powyżej 5 mm. Pozwala ona na określenie tak zwanego fenotypu obrazowego guza. Łagodne gruczolaki wywodzące się z kory nadnerczy są zazwyczaj homogenne i okrągłe, dobrze odgraniczone od otaczających tkanek (12). Rak nadnercza to z reguły guz większy niż 5 cm, o nieregularnym kształcie, niehomogenny, z obszarami martwicy, ogniskami pokrwotocznymi i zwapnieniami (7). Najważniejszym elementem badania tomograficznego nadnerczy, pozwalającym na różnicowanie łagodnych gruczolaków kory od guzów złośliwych jest ocena ich densyjności. Densyjność (podawana w jednostkach Hounsfielda – j.H.) wyraża wartość liniowego współczynnika osłabienia promieniowania rentgenowskiego dla badanej tkanki, w porównaniu do tego współczynnika zmierzonego dla wody. Rozpiętość skali wynosi 2000 jednostek: woda ma współczynnik 0 j.H., powietrze (-)1000 j.H, tkanka tłuszczowa około (-)100 j.H, tkanki miękkie (+)20 do (+)70 j.H. (13). Przy diagnostyce guzów nadnerczy densyjność powinno się ocenić przed wstrzyknięciem środka cieniującego, następnie po 2 minutach (ocena wzmocnienia) i po 10 minutach (prędkość wypłukiwania – washout) od podania środka kontrastowego.
Większość łagodnych gruczolaków kory nadnerczy jest bogata w lipidy, stąd też mają gęstość niższą niż bardzo ubogolipidowe raki. Przyjęto, że współczynnik pochłaniania w gruczolakach nie powinien przekraczać 10 j.H. (z reguły wynosi -20 / -30) j.H. do +10 j.H.). Jednak prawie 30% z nich, określone jako gruczolaki ubogolipidowe, ma densyjność wyższą (do 20 a nawet 30 j.H.) (7, 14). W takim wypadku do zróżnicowania z rakiem kory nadnercza konieczna jest ocena densyjności po dożylnym podaniu środka cieniującego. W przypadku gruczolaka następuje umiarkowane wzmocnienie z następowym szybkim wypłukiwaniem z guza. Po 10 minutach densyjność gruczolaka powinna obniżyć się przynajmniej do 50% wartości maksymalnej (można wyliczać też tak zwaną bezwzględną i względną prędkość wypłukiwania kontrastu, która powinna wynosić odpowiednio 60 i 40%) (15, 16, 17) . Pierwotny rak kory nadnerczy, który z natury zawiera jedynie niewielką ilość lipidów ma wyjściową densyjność wyższą niż 10 j.H. i nieregularny kształt. Jest niehomogenny i w związku z tym można w nim wyróżnić obszary o densyjności niższej (ogniska martwicy) i bardzo wysokiej (zwapnienia). Bezpośrednio po wstrzyknięciu środka kontrastującego densyjność guza nowotworowego wzrasta w różnym stopniu – zależnie od stopnia w jakim rozwinęło się unaczynienie patologiczne. Różnice densyjności różnych obszarów guza, stwierdzane w fazie wyjściowej, mogą czasem się zmniejszyć i guz może sprawiać wrażenie homogennego, choć może też uwidocznić się centralnie położone ognisko rozpadu (16, 17). Podobny fenotyp mają guzy przerzutowe, choć rzadziej występują w nich zwapnienia, a w momencie wystąpienia przerzutów do nadnerczy choroba podstawowa jest już najczęściej rozpoznana (18). Równie wysoką densyjność i zwapnienia mogą mieć wywodzące się z rdzenia nadnerczy guzy chromochłonne. Rzadko występujące w nadnerczach, często wyjątkowo dużych rozmiarów, a więc budzące niepokój, myelolipoma są heterogenne i mają skrajnie niską densyjność. Charakterystyczna dla tego łagodnego guza jest obecność tłuszczowych ognisk o wartościach współczynnika osłabienia poniżej -30 j.H., aż do -100 j.H. Myelolipoma mogą również zawierać drobne zwapnienia (19).
Badanie rezonansu magnetycznego (MRI)
Uzupełnieniem tomografii komputerowej jest obrazowanie metodą rezonansu magnetycznego. Ocena obejmuje badanie w obrazach T1 i T2 zależnych, ocenę zawartości lipidów metodą przesunięcia chemicznego i wzmocnienia po podaniu środka kontrastowego. Obraz MRI gruczolaków nadnerczy jest homogeny, intensywność sygnału niska – zbliżona do sygnału z wątroby i często niższa niż pozostałej tkanki nadnerczowej (12). W obrazach T1 i T2 zależnych intensywność sygnału w obrębie raka kory nadnerczy i pheochromocytoma jest znamiennie wyższa i niejednorodna. Lipidy stwierdzane są w gruczolakach (najczęściej wysoka lub średnia zawartość), śladowe ich ilości mogą występować w rakach nadnercza, natomiast pheochromocytoma nigdy nie zawierają lipidów (7, 12). Różnice w wypłukiwaniu środka kontrastowego, między guzami złośliwymi a gruczolakami, są podobne jak w badaniu CT.
Badania izotopowe
W przypadkach, w których badaniami CT i MRI nie udało się jednoznacznie określić charakteru guza można rozważyć wykonanie badań izotopowych – tomografii emisyjnej pojedynczego fotonu (SPECT) lub pozytronowej tomografii emisyjnej (PET).
Znacznikiem wychwytywanym wybiórczo przez korę nadnerczy jest pochodna cholesterolu – 131I-6-jodometylnorcholesterol (NP-59). Gromadzony jest on obustronnie w zdrowych nadnerczach, a jednostronnie w przypadku czynnego gruczolaka lub raka. Komórki pheochromocytoma wychwytują znakowaną 131I lub 123I meta-jodobenzylguanidynę (MIBG) (20). Złośliwe pheochromocytoma lub paraganglioma mogą mieć również receptory dla somatostatyny, co pozwala na uwidocznienie ich w badaniu SPECT z zastosowaniem Octreoscanu (21).
W metodzie PET, dla specyficznego zobrazowania guza produkującego hormony steroidowe stosuje się 11C-metiomidat (inhibitor steroidogenezy) wychwytywany przez gruczolaki z równomiernym rozkładem. Rak nadnercza wychwytuje metiomidat intensywnie, ale jego rozkład w guzie jest nierównomierny (22). Znacznikiem pozwalającym na niezwykle dokładne obrazowania guzów rdzenia jest 11C-metahydroksyefedryna, amina o budowie zbliżonej do noradrenaliny, ale nie podlegająca degradacji przez MAO (11). Ma ona jednak bardzo krótki okres półtrwania, co ogranicza zastosowanie znakowanych nią substratów (7, 23). W obrazowaniu pheochromocytoma metodą PET wykorzystywane są też znakowana 11C adrenalina oraz znakowane 18F dopamina i dihydroksyfenyloalanina (7).
(18F)-fluorodezoksyglukoza (FDG) jest niespecyficznym znacznikiem służącym do badań różnych narządów metodą pozytronowej tomografii emisyjnej. Nie wychwytują jej łagodne gruczolaki, ale uwidacznia przerzuty do nadnerczy i pheochromocytoma (szczególnie szybko rosnące) (7, 16, 24).
Jak widać, główną zaletą badań obrazowych jest możliwość odróżnienia z bardzo wysokim prawdopodobieństwem łagodnych gruczolaków od wymagających szybkiego leczenia operacyjnego guzów złośliwych – pierwotnych lub przerzutowych. W praktyce najczęściej obrazujemy guzy metodą tomografii komputerowej promieniowania rentgenowskiego, nieco rzadziej metodą rezonansu magnetycznego. Dobrej jakości ocena nadnerczy badaniem CT wymaga podania środka cieniującego strzykawką automatyczną – pozwala to na standaryzację czasu wykonania zdjęć względem zakontrastowania zmiany. Ocena zawartości lipidów w MRI wymaga rozszerzenia standardowo wykonywanego badania i dodatkowego oprogramowania – w żaden sposób nie można ocenić tego parametru w rutynowym badaniu rezonansu magnetycznego nadnerczy w obrazach T1 i T2 zależnych.
Nie można zapomnieć o znaczeniu najprostszego parametru, jakim jest wielkość guza. 90% raków nadnercza ma średnicę powyżej 4 cm (25). W przypadkowo wykrytych guzach nadnercza o średnicy mniejszej niż 4 cm stwierdza się około 2% przypadków raka, w guzach 4-6 cm już 6%. Co czwarty guz o średnicy większej niż 6 cm jest rakiem nadnercza (26). Dotychczas zalecało się usuwanie właśnie guzów o średnicy powyżej 6 cm (5), jednak granica ta, szczególnie u osób młodych ulega przesunięciu i niektórzy zalecają operację już przy guzie 4 cm (27, 28). Szybkie powiększanie się rozmiarów guza, (>1 cm/rok), nawet przy „łagodnym fenotypie”, stanowi wskazanie do jego usunięcia.
Ocena czynności hormonalnej guza
Incydentaloma są wykrywane podczas diagnostyki innej niż endokrynologiczna – z jego definicji wynika, że u pacjenta nie powinniśmy stwierdzać klinicznych cech nadmiaru hormonów nadnerczowych. Przypadkowo wykrytego guza nadnercza u chorego z zaniedbaną diagnostyką napadowego nadciśnienia tętniczego lub z dotąd nie dostrzeganymi ewidentnymi cechami hiperkortyzolemii nie można uznać za incydentaloma. Istnieją jednak przypadki subklinicznej czynności hormonalnej, która powoduje konieczność usunięcia guza nadnercza, choć nie daje jawnych objawów klinicznych.
Subkliniczny zespół Cushinga
Autonomiczna sekrecja kortyzolu ma miejsce średnio w 5% przypadków incydentaloma nadnerczy (6). Subkliniczny zespół Cushinga, mimo sugestii zawartej w nazwie, nie jest w gruncie rzeczy całkiem bezobjawowy. Stwierdzono, że w przypadku „subtelnej” nadczynności hormonalnej, bez widocznych cech somatycznych zespołu Cushinga, i ewidentnych narządowych skutków hiperkortyzolemii, można jednak stwierdzić szereg zaburzeń. Są to: wyższy wskaźnik masy ciała, wyższy wskaźnik talia biodro i zwiększona częstość występowania otyłości, wyższe stężenia lipidów i częstsze występowanie nietolerancji glukozy lub wręcz cukrzycy typu II (29). U większości chorych z pozornie niemym klinicznie gruczolakiem stwierdza się podwyższone wartości ciśnienia tętniczego krwi skurczowego i rozkurczowego, insulinooporność, znamiennie grubszą ścianę naczyniową i więcej zmian miażdżycowych w naczyniach (26, 30). Mają też niższą gęstość mineralną kości (31, 32). Podsumowując, nawet pozornie niemy klinicznie gruczolak nadnercza może być przyczyną zespołu metabolicznego, zwiększać ryzyko wystąpienia cukrzycy, nadciśnienia tętniczego i osteoporozy (32). Nie ulega więc wątpliwości, że nawet subkliniczna nadczynność hormonalna guza jest wskazaniem do leczenia operacyjnego (33).
Chorzy z subkliniczną hiperkortyzolemią mają prawidłowe wartości porannego stężenia kortyzolu i dobowego wydalania kortyzolu i metabolitów. Mogą jednak wystąpić u nich zaburzenia rytmu dobowego wydzielania kortyzolu, w którym fizjologicznie wieczorne wartości kortyzolemii powinny wynosić mniej niż 50% wartości porannych. Zaburzenia rytmu dobowego mogą ujawniać się jako dyskretnie zwiększenie stężeń kortyzolu w nocy – do wartości granicznych. Stwierdzono, że przydatnym badaniem wskazującym na subkliniczną hiperkortyzolemię może być oznaczenie kortyzolemii o północy. Za graniczną uznano wartość 5,4 μg% (150 nmol/l). W wyodrębnionej na podstawie tego kryterium grupie stwierdzono złą kontrolę nadciśnienia tętniczego i cukrzycy (34).
Kolejnym prostym testem stosowanym w ocenie hormonalnej incydentaloma jest próba hamowania deksametazonem. W najprostszej wersji polega na podaniu 1 mg Dexametazonu o godzinie 23.00, a następnie oznaczeniu porannego (8.00) stężenia kortyzolu w surowicy. W większości zaleceń za prawidłowe uznaje się zahamowanie kortyzolemii do stężenia poniżej 5 μg% (138 nmol/l) (35). Według niektórych badaczy jednak, kortyzolemia w krótkim teście hamowania deksametazonem nie powinna przekraczać 1,8 μg% (50 mmol/l) (36). W wyodrębnionej według tego ostrzejszego kryterium grupie chorych z przedklinicznym zespołem Cushinga i cukrzycą uzyskiwano poprawę kontroli cukrzycy po leczeniu operacyjnym (32, 37,38). W razie stwierdzenia braku hamowania w teście z 1 mg deksametazonu zaleca się potwierdzenie autonomizacji guza. Należy wówczas wykonać trwający dwie doby test z zastosowaniem dawki 4 x 2 mg deksametazonu i ocenić dobowe wydalanie wolnego kortyzolu z moczem (wydalanie w II dobie powinno obniżyć się poniżej dolnej granicy normy pracowni) (17). Dodatkowo podejrzenie subklinicznej hiperkortyzolemii potwierdza stwierdzenie niskich (zahamowanych) stężeń ACTH i niskich (na skutek braku stymulacji ACTH) stężeń DHEA i DHEAS. Potwierdzeniem „ex post” jest wtórna niedoczynność drugiego nadnercza po skutecznym leczeniu operacyjnym guza.
Subkliniczna sekrecja androgenów
Androgenami typowymi dla nadnerczy są dehydroepiandrosteron (DHEA), siarczan DHEA (DHEAS) i 17-hydroksyprogesteron (17OHPG). Ulegają one dalszej konwersji, między innymi do testosteronu i dihydrotestosteronu. Zwiększone wydzielanie androgenów może świadczyć o złośliwości guza, choć co najmniej połowa raków nadnercza przebiega z szybko narastającą, pełnoobjawową hiperkortyzolemią. Hiperandrogenizm u kobiety z incydentaloma należy różnicować z bardzo częstym zespołem policystycznych jajników (39).
Bezobjawowy guz chromochłonny
Pheochromocytoma, guz, który stanowi aż do 5% przypadków incydentaloma nie zawsze powoduje napadowe zwyżki ciśnienia tętniczego. Może przebiegać ze stale, łagodnie podwyższonymi wartościami ciśnienia tętniczego, bez nadciśnienia, albo wręcz z hipotonią ortostatyczną (40). Pierwszym objawem tego guza może być przełom nadciśnieniowy lub katecholaminowy i zgon chorego (41). Paradoksalnie, nieme klinicznie pheochromocytoma mają często większe rozmiary niż guzy dające napadowe zwyżki ciśnienia (42). U co trzeciego chorego z guzem chromochłonnym można stwierdzić nieprawidłową tolerancję glukozy lub cukrzycę (43).
W celu oceny czynności hormonalnej przy podejrzeniu pheochromocytoma należy wykonać oznaczenie dobowego wydalania metoksykatecholamin i katecholamin z moczem. Badanie jest łatwiej dostępne niż zalecane przez niektóre ośrodki, jako nieco bardziej czułe, oznaczenie frakcji katecholamin w krwi. U większości chorych z guzem chromochłonnym stwierdza się podwyższone stężenie chromograniny A w surowicy; jest to badanie przydatne, ale nie rutynowe (44).
Subkliniczny hiperaldosteronizm
Jedynym objawem nadmiaru mineralokortykoidów może być łagodne, dobrze reagujące na leki nadciśnienie tętnicze. Nawracające ale okresowe i często bezobjawowe spadki stężenia potasu w surowicy mogą pozostać niezauważone (17). Zalecane badania to pomiar aktywności reminowej osocza i stężenia aldosteronu w surowicy ARO/ALDO i stężenie potasu w surowicy. Oznaczenie dobowego wydalania aldosteronu z moczem nie jest niezbędne (45).
Subkliniczna niedoczynność kory nadnerczy
Obustronne guzy nadnerczy, które nasuwają podejrzenie przerzutów, mogą powodować subkliniczną (lub długo nierozpoznaną) pierwotną niedoczynność kory. Dzieje się tak w wypadku zniszczenia co najmniej 90% czynnej wydzielniczo tkanki. W wypadku subklinicznego przebiegu choroby pierwszymi stwierdzanymi zmianami jest podwyższone stężenie ACTH i reniny. Zmniejsza się rezerwa nadnerczowa po stymulacji syntetycznym 1-24ACTH (46).
Biopsja cienkoigłowa (BACC)
Znaczenie BACC w diagnostyce guzów kory nadnerczy jest ograniczone i praktycznie sprowadza się do różnicowania między tkanką nadnerczową, a pozanadnerczową. Badanie rozstrzyga, czy badany guz jest rakiem nadnercza, czy przerzutem (47,48). Jednak biopsja niesie za sobą ponad 3-procentowe ryzyko powikłań. Najpoważniejszym jest przełom katecholaminowy wywołany nakłuciem nierozpoznanego przedtem guza chromochłonnego (49). Rak nadnercza z kolei należy do nielicznych nowotworów, które mogą rozsiewać się za igłą (50). Stąd też biopsję nadnercza należy zarezerwować dla diagnostyki nieczynnego hormonalnie guza o wysokiej densyjności. Wstępne zróżnicowanie między niewydzielającym rakiem nadnercza a przerzutem oraz zidentyfikowanie punktu wyjścia tego ostatniego pozwala na lepsze zaplanowanie zabiegu operacyjnego i dalszego postępowania terapeutycznego.
Podsumowanie
Diagnostyka przeprowadzona po przypadkowym wykryciu guza nadnercza musi odpowiedzieć na pytanie, czy należy go leczyć operacyjnie, czy obserwować.
Wskazaniem do usunięcia zmiany jest jej złośliwość lub czynność hormonalna. Podejrzenie złośliwości nie dającego objawów klinicznych guza nasuwa jego niehomogenność, wysoka densyjność i wolne wypłukiwanie środka kontrastowego w badaniu CT, niska zawartość lipidów w MRI. Na leczenie operacyjne należy się również decydować przy dużych rozmiarach guza – najbezpieczniejsza wydaje się granica 4 cm.
O niemym klinicznie pheochromocytoma należy myśleć w przypadku niehomogennej zmiany o wysokiej densyjności, która nie zawiera lipidów. Podejrzenie potwierdza stwierdzenie podwyższonego wydalania katecholamin i ich metabolitów z moczem dobowym oraz podwyższone stężenie katecholamin w krwi.
Inne zespoły powodowane przez incydentaloma nadnerczy to subkliniczna hiperkortyzolemia i subkliniczny hiperaldosteronizm. W przypadku obustronnych przerzutów stwierdza się subkliniczną pierwotną niedoczynność kory nadnerczy, ze zmniejszoną rezerwą nadnerczową.
Nawet w przypadku gdy guz nie wymaga leczenia operacyjnego konieczna jest obserwacja z powtarzanymi badaniami obrazowymi i hormonalnymi. Zalecane wizyty kontrolne powinny odbyć się po 6, 12 i 24 miesiącach od stwierdzenia zmiany, choć w wypadku pacjentów młodych lub guzów granicznej wielkości wskazana byłaby kontrola już po 3 miesiącach. Powiększenie się guza o ponad centymetr w ciągu roku kwalifikuje chorego do zabiegu.
Propozycję algorytmu diagnostyczno-terapeutycznego dla przypadkowo wykrytego guza nadnercza przedstawiono na rycinie 1.
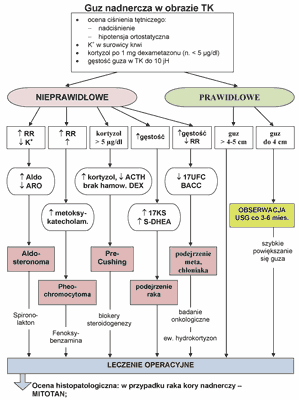 Ryc. 1. Algorytm postępowania w przypadkowo wykrytych guzach nadnerczy (incydentaloma) (E27). Piśmiennictwo
1. Bovio S, et al.: Prevalence of adrenal incidentaloma in a contemporary computerized tomography series. J. Endocrinol. Invest., 2006; 29: 298-302.
2. Hornsby PJ: Ageing of the Human Adrenal Cortex. Sci. Aging. Knowl. Environ., 2004; 35 (re6): 1-8.
3. Dobble JW: Adrenocortical nodular hyperplasia: The aging adrenal. J. Pathol., 1969; 99: 1-18.
4. Hedeland H, et al.: On the prevalence of Adrenocortical adenomas in an autopsy material in relation to hypertension and diabetes. Acta. Med. Scand., 1968; 184(3): 211-214.
5. Grumbach MM, et al.: Management of the clinically inaparrent adrenal mass („Incydentaloma”). Annals of Internal Medicine 2003; 138: 424-429.
6. Young WF Jr.: Management approaches to adrenal incidentalomas: a view from Rochester, Minnesota. Endocrinol. Metab. Clin. North. Am., 2000; 29: 159-85.
7. Ilias I, et al.: The optimal imaging of adrenal tumors: a comparison of different methods. Endocrine-Related Cancer (2007) 14: 587-599.
8. Günther RW, et al.: Real-time ultrasound of normal adrenal glands and small tumors. J. Clin. Ultrasound., 1984; 12(4): 211-7.
9. Dietrich CF, et al.: Detection of the adrenal glands by endoscopic or transabdominal ultrasound. Endoscopy. 1997; 29(9): 859-64.
10. Trojan J, et al.: Role of ultrasonography in the detection of small adrenal masses. Ultraschall Med., 2002; 23(2): 96-100.
11. Hsu-Chong Yeh: Sonography of the Adrenal Glands: Normal Glands and Small Masses. AJR 1980; 135: 1167-1177.
12. Thompson GB & Young WF Jr.: Adrenal incidentaloma. Current Opinion in Oncology 2003; 15: 84-90.
13. Weir J, Abrahams P: Wstęp – Tomografia Komputerowa” str. IX-XI w. Atlas Obrazowy Anatomii Człowieka. – wydanie polskie Urban & Partner Wrocław 2005.
14. Ziaja J, et al.: Rak kory nadnerczy w przedoperacyjnych badaniach obrazowych. Pol. J. Radiol., 2006; 71(3): 28-35.
15. Sahdev A, et al.: Imaging evaluation of the nonfunctioning indeterminate adrenal mass. Trends In Endocrinology and Metabolism 2004; 15: 271-276.
16. Dunnick NR & Korobkin M: Imaging of adrenal incidentalomas: current status. AJR 2002; 179: 559-568.
17. Young WF Jr.: The incidentally discovered adrenal mass. NEJM 2007; 356: 601-610.
18. Lenert JT, et al.: Evaluation and surgical resection of adrenal masses in patients with a history of extra-adrenal malignancy. Surgery 2001; 130: 1060-7.
19. Adusumilli S, Ramchandani P: Adrenal Myelolipoma. eMedicine – Radiology online: www.emedicine.com/radio/topic18.htm.
20. Bravo EL & Tagle R: Pheochromocytoma: state-of-the-art and future prospects. Endocrine Reviews 2003; 24: 539-553.
21. van der Harst E, et al.: ((123)I)metaiodobenzylguanidine and ((111)In)octreotide uptake in benign and malignant pheochromocytomas”. JCEM 2001; 86: 685-693.
22. Eriksson B, et al.: Developments in PET for the detection of endocrine tumours. Tumour Biology 2005; 19: 311-324.
23. Mann GN, et al.: ((11)C)metahydroxyephedrine and ((18)f)fluorodeoxyglucose positron emission tomography improve clinical decision making in suspected pheochromocytoma. Annals of Surgical Oncology 2006 13 187-197.
24. Mijin Yun, et al.: 18F-FDG PET in Characterizing Adrenal Lesions Detected on CT or MRI. J. Nucl. Med., 2001; 42:1795-179.
25. Angeli A, et al.: Adrenal incidentaloma: an overview of clinical and epidemiological data from the National Italian Study Group. Horm. Res., 1997; 47: 279-83.
26. Schteingart D i wsp.: Management of patients with adrenal cancer: recommendations of an international consensus conference. Endocrine-Related Cancer 2005; 12: 667-680.
27. Kasperlik-Załuska AA, et al.: Incidentally discovered adrenal mass (incidentaloma): investigation and management of 208 patients. Clinical Endocrinology 1997; 46: 29-37.
28. Anna Kasperlik-Załuska: Przypadkowo wykryte guzy nadnercza – Incydentaloma. (w): Standardy endokrynologii Warszawa, 2002, pod red. Stefana Zgliczyńskiego i Wojciecha Zgliczyńskiego.
29. R. Rossi, et al.: Subclinical Cushing´s Syndrome in Patients with Adrenal Incidentaloma: Clinical and Biochemical Features. JCEM 2000; 85: 1440-1448.
30. Tauchmanova L, et al.: Patients with Subclinical Cushing´s Syndrome due to Adrenal Adenoma Have Increased Cardiovascular Risk. JCEM 2002; 87: 4872-4878.
31. Chiodini I, et al.: Bone Involvement in Eugonadal Male Patients with Adrenal Incidentaloma and Subclinical Hypercortisolism. JCEM 2002; 87: 5491-5494.
32. Terzolo M, et al.: Adrenal Incidentaloma: A New Cause of the Metabolic Syndrome? JCEM 2002; 87: 998-1003.
33. Erbil Y, et al.: Evaluation of the cardiovascular risk in patients with subclinical Cushing syndrome before and after surgery. World J. Surg., 2006; 30: 1665-71.
34. Terzolo M, et al.: Midnight serum cortisol as a marker of increased cardiovascular risk in patients with a clinically inaparrent adrenal adenoma. EJE 2005; 153: 307-315.
35. Tsagarakis S, et al.: Endogenous subclinical hypercortisolism: diagnostic uncertainties and clinical implications. J. Endocrinol. Invest., 2006; 29: 471-82.
36. Catargi B, et al.: Occult Cushing´s Syndrome in Type-2 Diabetes. JCEM 2003; 88: 5808-5813.
37. Leibowitz G, et al.: Pre-clinical Cushing´s syndrome: an unexpected frequent cause of poor glycaemic control in obese diabetic patients. Clin. Endocrinol., (Oxf) 1996; 44:717-722.
38. Midorikawa S, et al.: The improvement of insulin resistance in patients with adrenal incidentaloma by surgical resection. Clin. Endocrinol., (Oxf) 2001; 54: 797-804.
39. Kasperlik-Załuska AA: Przypadkowo wykryte guzy nadnerczy – zasady postępowania. Endokrynol. Pl. 2002; supl. 1/ 2; 53: 88-92.
40. Kasperlik-Załuska AA, et al.: 1,111 Patients with Adrenal Incidentalomas Observed at a Single Endocrinological Center. Incidence of Chromaffin Tumors. Annals of the New York Academy of Sciences 2006; 1073 (1), 38-46.
41. Sutton MG, et al.: Prevalence of clinically unsuspected pheochromocytoma: review of a 50-year autopsy series. Mayo Clin. Proc., 1981; 56: 354-60.
42. Michael A, et al.: Pheochromocytoma: An Imaging Chameleon. Radiographics 2004; Vol 24: 87-99.
43. Georg Mansmann, et al.: The Clinically Inapparent Adrenal Mass: Update In Diagnosis and Management. Endocrine Rev., 2004; 25: 309-340.
44. Sowers KM Sowers JR: Pheochromocytomas. s. 139-143 (w): Manual of Endocrinology and Metabolism pod red Lavin N. Lipincott W&W 2002.
45. National Institutes of Health. Management of the Clinically Inapparent Arenal Mass (Incidentaloma). Final Statement. July 16, 2002.
46. Lutz A, et al.: Adrenocortical function in patients with macrometastases of the adrenal gland. EJE 2000; vol. 143, 1: 91-97.
47. Harisinghani MG, et al.: Predictive value of benign percutaneous adrenal biopsies in oncology patients. Clin. Radiol., 2002; 57: 898-901.
48. Nirag C, et al.: Endoscopic Ultrasound-Guided Fine-Needle Aspiration Biopsy of the Adrenal Glans. Cancer 2004; 102 (5): 308-314.
49. Casola G, et al.: Unsuspected pheochromocytoma: risk of blood-pressure alterations during percutaneous adrenal biosy. Radiology 1986; 159: 733-5.
50. Welch TJ, et al.: Percutaneous adrenal biopsy: review of a 10-year experience. Radiology 1994; 193: 341-4.
otrzymano/received: 2007-11-28 zaakceptowano/accepted: 2007-12-29 Adres/address: *Lucyna Papierska Klinika Endokrynologii CMKP, Szpital Bielański ul. Cegłowska 80, 01-809 Warszawa tel./fax: (0-22) 834-31-31 e-mail: klinendo@cmkp.edu.pl Pełna wersja artykułu Przypadkowo wykryte guzy (incydentaloma) nadnerczy. Kogo operować? dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








