|
© Borgis - Postępy Nauk Medycznych 2, s. 105-114
*Helena Jastrzębska
Postępy w rozpoznawaniu i leczeniu chorób tarczycy u kobiety ciężarnej i w okresie poporodowym
Progress in the diagnosis and treatment of thyroid dysfunction during pregnancy and postpartum period
Klinika Endokrynologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. CMKP dr hab. med. Wojciech Zgliczyński Streszczenie
W okresie ciąży dochodzi do zmian czynności tarczycy, a choroby tarczycy u matki mogą mieć niekorzystny wpływ na przebieg ciąży i rozwój płodu. Niedobór jodu i niedoczynność tarczycy matki może wiązać się z ryzykiem porodów przedwczesnych i upośledzenia rozwoju mózgu płodu. Nadczynność tarczycy u kobiety ciężarnej stanowi zagrożenie dla matki i dla dziecka. Autoimmunologiczna choroba tarczycy wiąże się z ryzykiem poronienia i wystąpienia poporodowych zaburzeń czynności tarczycy. W ciąży nie ma przeciwwskazań do wykonania usg tarczycy i biopsji guzów tarczycy, natomiast przeciwwskazane są badania z użyciem izotopów promieniotwórczych. Słowa kluczowe: ciąża, profilaktyka jodowa, wole proste, nadczynność tarczycy, niedoczynność tarczycy
Summary
Pregnancy physiologicaly induces major changes in the thyroid function and metabolism. Besides, thyroid disturbances can negatively influence the pregnancy outcome and the fetus growth. The iodine deficiency, and maternal and fetal hypothyroidism may cause an impropriate fetal neural development as well as may increase the number of miscarriage and preterm delivery. Therefore, the iodine prophylaxis and thyroxine therapy should be immediately introduced when necessary. On the other hand, maternal hyperthyroidism and anti-thyroid treatment may also influence the rate of miscarriages and could disturb fetal thyroid function. Autoimmune thyroid disease is connected with risk of abortion and higher rate of postpartum thyroiditis. Use of radioisotope must be excluded in the process of diagnosis and therapy during pregnancy and lactation. Ultrasonography and fine needle biopsy are not contraindicated during pregnancy. Key words: pregnancy, iodine prophylaxis, goiter, hyperthyroidism, hypothyroidism
Regulacja czynności tarczycy u kobiety ciężarnej
Czynność tarczycy u kobiety ciężarnej regulowana jest przez TSH, ale ponadto modyfikowana:
1. pośrednio wpływem wysokich stężeń TBG (Thyroxine Binding Globulin) w surowicy,
2. bezpośrednim wpływem hCG (human Chorionic Gonadotropin) na tarczycę i pośrednim na stężenia TSH (Thyroid Stimulating Hormone),
3. zmienionym metabolizmem jodu ze zmniejszeniem dostępności jodu do tarczycy matki (1).
W pierwszym trymestrze ciąży wzrasta stężenie białka TBG wiążącego hormony tarczycy zarówno tyroksynę jak i trijodotyroninę. Wzrost ten dokonuje się w następstwie wysokich stężeń estrogenów, które zarówno stymulują wątrobową syntezę TBG jak i modyfikują budowę jej cząsteczki. Wpływa to na wydłużenie okresu półtrwania. Wzrost stężenia TBG jest 2-3-krotny w porównaniu z wyjściowym, co skutkuje zwiększeniem puli hormonów tarczycy związanych i obniżeniem puli hormonów wolnych. Stężenie całkowitej tyroksyny wzrasta średnio o 40% w pierwszym trymestrze, o 60% w drugim i o 75% w trzecim trymestrze ciąży. Celem utrzymania stanu wyrównania czynności tarczycy, w tym prawidłowych stężeń hormonów wolnych dostępnych biologicznie, uruchomiony zostaje mechanizm sprzężenia zwrotnego tarczyca-przysadka i stymulacja tarczycy przez TSH. W sytuacji niedoboru jodu nawet niewielkiego stopnia, odpowiadającego podaży dobowej 100 μg/d, dochodzi do obniżenia stężeń fT4 i fT3 sięgającego 30% wartości wyjściowych. Należy dodać, że stężenie albuminy, innego białka transportującego hormony tarczycy, o mniejszym znaczeniu klinicznym, obniża się w ciąży o 16%.
Kolejnym czynnikiem regulującym czynność tarczycy u kobiety ciężarnej jest hCG, hormon pojawiający się po zapłodnieniu, narastający w miarę rozwoju ciąży do szczytowej wartości pod koniec pierwszego trymestru, między 8-12 tyg. ciąży i obniżający się do koncentracji niskiego plateau około 18 tyg. ciąży. hCG wykazuje w stosunku do tarczycy aktywność zbliżoną do TSH (TSH like) z uwagi na podobieństwo budowy związane z obecnością wspólnej podjednostki α. Wpływ hCG na tarczycę dokonuje się poprzez bezpośrednie działanie na receptor TSH w tyreocycie. Następstwem tego działania jest powiększenie gruczołu tarczowego i zwiększenie syntezy hormonów tarczycy. Aktywność tyreotropowa hCG koreluje ze stężeniem hCG w surowicy. W prawidłowej ciąży stymulujący wpływ hCG jest stosunkowo słaby, wykazano jednak liniową zależność między stężeniem hCG a stężeniem fT4 w okresie 8-14 tydzień ciąży. Wzrost stężenia hCG o 10 000 IU/l wiąże się ze wzrostem stężenia fT4 o 0,6 pmol/l i obniżeniem stężenia TSH o 0,1 mU/l. W pierwszym trymestrze, u 14-20% zdrowych kobiet dochodzi do obniżenia stężenia TSH do wartości <0,4 mU/l na skutek podwyższonego stężenia hCG. Obniżone stężenie TSH notuje się w drugim trymestrze u 4% i w trzecim u <1% kobiet ciężarnych. Stwierdzono, że wartości hCG u tych kobiet są statystycznie wyższe niż w populacji 80% kobiet z prawidłowym stężeniem TSH. Znaczenie kliniczne wzrostu stężenia hCG zaznacza się przy wartościach w surowicy powyżej 50 000-75 000 IU/l. U większości kobiet stymulujący wpływ hCG na tarczycę jest niewielki, krótkotrwały i nie wykrywany rutynowo.
Zmiany w metabolizmie jodu w czasie ciąży dokonują się w następstwie:
a) zwiększonej produkcji hormonów tarczycy, dla których substratem jest jod,
b) transportu jodu od matki do płodu przez łożysko,
c) zmian w nerkowej utracie jodu.
W ciąży dochodzi do modyfikacji aktywności enzymów dejodynaz, metabolizujących hormony tarczycy. Aktywność dejodynazy typu I nie zmienia się w czasie ciąży. Aktywność dejodynazy typu II obecnej w łożysku prowadzi do utrzymania lokalnej produkcji T3 w sytuacji gdy matczyna koncentracja T4 obniża się. Łożysko zawiera duże ilości dejodynazy typu III, która metabolizuje T4 do rT3 i T3 do T2. Wyjątkowo wysoka aktywność dejodynazy typu III u płodu zapewnia niskie stężenie T3 i wysokie rT3, co jest typowe dla stanu metabolicznego płodu.
Łożysko przekazuje jod i część hormonów tarczycy od matki do dziecka. Przez łożysko przenikają, poza jodem zarówno elementarnym jak i izotopami jodu oraz tyroksyną, także przeciwciała tarczycowe p/peroksydazie tarczycowej (TPO), p/tyreoglobulinowe (Tg), p/receptorowi TSH (TRAb) oraz TRH, tyreostatyki i βblokery. Nie przenika TSH. Około 15 tyg. ciąży nerkowy klirens jodu zwiększa się z 25 ml/min do 45 ml/min, a filtracja kłębkowa wzrasta o 50%. Zapewnienie dostatecznej podaży jodu umożliwia adaptację prawidłowej tarczycy do zmienionego zapotrzebowania na jod i hormony tarczycy w okresie ciąży (2).
Profilaktyka jodowa u kobiety ciężarnej
Rekomendowana dobowa podaż jodu dla kobiety ciężarnej i karmiącej wynosi wg zaleceń WHO z 2005 r. średnio 250 μg i zawiera się w przedziale 200-500 μg/d (3). Należy dążyć zarówno do zapewnienia prawidłowej podaży jak i nieprzekraczania górnej wartości, z uwagi na potencjalne ryzyko niekorzystnego wpływu zbyt wysokich dawek jodu na tarczycę płodu. Tarczyca płodu nie ma bowiem w pełni wykształconego mechanizmu adaptacji do nadmiaru jodu zwanego mechanizmem Wolfa-Chaicoffa i w tej sytuacji nadmiar jodu może prowadzić do niedoczynności tarczycy i wola u płodu. Polska Komisja ds. Kontroli Zaburzeń z Niedoboru Jodu zalecała w 2004 r. stosowania dodatkowej dawki jodu w ciągu całej ciąży i okresu karmienia, podawanej w postaci preparatów zawierających jod w ilości 150 μg jodu/dobę wraz z niezbędnymi witaminami i innymi składnikami mineralnymi. Zalecenie to uwzględniało trudności w zapewnieniu codziennej dawki jodu jedynie w oparciu o model profilaktyki jodowania soli, zwłaszcza, że w wielu przypadkach zaleca się ograniczenie spożycia soli kuchennej w ciąży. Obligatoryjne jodowanie soli obowiązuje w Polsce od 24.01.1997 r. i zapewnia przy zwykłej diecie, bez dodatkowego dosalania, podaż około 150 μg jodu/d (4). Wydaje się, że dodatkowe uzupełnienie o 150 μg/d w postaci tabletek zalecanych kobietom ciężarnym i karmiącym sprosta wymaganiom stawianym przez WHO.
Cel profilaktyki jodowej
Profilaktyka jodowa zapobiega wolotwórczemu działaniu ciąży u kobiety i zapewnia prawidłowy rozwój centralnego układu nerwowego dziecka. Powiększenie tarczycy u kobiet ciężarnych otrzymujących prawidłową podaż jodu, polegające na zwiększeniu objętości narządu średnio o 10%, ustępuje po porodzie. Wynika bowiem ze zwiększonego ukrwienia narządu i wysokich stężeń innych czynników wzrostowych w ciąży w tym IGF-1(Insuline Growth Factor 1).
W grupie kobiet pozostających w sytuacji umiarkowanego niedoboru jodu, z podażą dobową 100 μg/d dochodzi do zwiększenia objętości tarczycy u 73% kobiet ciężarnych średnio o 30% i w 10% przypadków powiększenie to utrzymuje się po porodzie. Rozwija się względna hypotyroksynemia, czyli obniżenia stężenia fT4 na skutek niedoboru tyroksyny w stosunku do wzrostu białka wiążącego TBG, zwiększenie stosunku T3/T4>0,025 w następstwie preferencyjnej produkcji T3, ponadto wzrost stężenia TSH o 150% i tyreoglobuliny o 40% u 60% kobiet przed rozwiązaniem. Zmniejsza się wydalanie jodu z moczem. Zmiany te cofają się po zapewnieniu prawidłowej podaży jodu. Hormony tarczycy niezbędne są w życiu płodowym do prawidłowego rozwoju centralnego układu nerwowego, płuc i kości. Niedobór hormonów tarczycy w życiu płodowym prowadzi do nieodwracalnego uszkodzenia centralnego układu nerwowego. Tarczyca płodu zaczyna syntetyzować hormony tarczycy od 10-12 tyg. ciąży wykorzystując od matki substrat jakim jest jod przenikający przez łożysko. We wcześniejszych tygodniach ciąży dojrzewanie mózgu zależy od stężeń tyroksyny we krwi matki. Niedobór tyroksyny u ciężarnej w pierwszym trymestrze na obszarach głębokiego niedoboru jodu prowadzi do przypadków kretynizmu endemicznego. TSH wykrywa się w przysadce płodu od 10-17 tyg. ciąży. Stężenie TSH w surowicy płodu jest niskie <2 mU/l do 20 tyg. ciąży, wzrasta do stężenia 15 mU/l między 20-30 tyg. ciąży i następnie obniża się do 10 mU/l około 40 tyg. ciąży. Stężenie T4 u płodu jest niskie do 18 tyg. ciąży i wzrasta około 34-36 tyg. ciąży. Pierwsze godziny po urodzeniu charakteryzują się wzrostem stężenia TSH oraz T3 i T4. Stymulowany zimnem wzrost stężenia TSH utrzymuje się do 72-96 godz. po urodzeniu. Znaczenie przejściowej hipertyroksynemii po urodzeniu nie jest jasne, ale może wskazywać na udział hormonów tarczycy w procesie termogenezy i przystosowaniu od życia wewnątrzmacicznego do pozamacicznego.
Hypotyroksynemia sporadyczna u ciężarnej, niezwiązana z niedoborem jodu, prowadzi do poronień, porodów przedwczesnych, oraz wiąże się z możliwością gorszego rozwoju intelektualnego i neurologicznego dziecka, co omówiono w rozdziale „niedoczynność tarczycy”, ale nie koreluje z odsetkiem wrodzonej niedoczynności tarczycy. Hypotyroksynemia endemiczna u ciężarnej żyjącej na obszarze głębokiego niedoboru jodu wiąże się z niedoczynnością tarczycy dziecka. Endemiczna matczyna i płodowa hypotyroksynemia z powodu niedoboru jodu skutkuje większą częstością poronień i porodów przedwczesnych, niższą wagą urodzeniową i większą śmiertelnością okołoporodową noworodków (5).
Wole proste u kobiety ciężarnej
Wole proste u kobiety ciężarnej stanowi wskazanie do podania jodu podobnie jak w profilaktyce jodowej i 100 μg tyroksyny/d (2).
Wpływ autoimmunologicznych chorób tarczycy na ciążę
Zaburzenia czynności i budowy tarczycy u płodu i noworodka związane z autoimmunologiczną chorobą tarczycy matki mogą być następstwem przekazania przez łożysko przeciwciał TRAb. Przeciwciała te działają na tarczycę dziecka tak jak na tarczycę matki tzn. stymulujące pobudzają wzrost tarczycy i produkcję hormonów natomiast blokujące prowadzą do niedoczynności tarczycy. Przeciwciała TRAb przekraczają łożysko, jak wspomniano w rozdziale „regulacja czynności tarczycy u kobiety ciężarnej”, a tarczyca płodu zdolna jest do odpowiedzi na działanie tych przeciwciał od 25 tygodnia ciąży. Dzieci urodzone przez kobiety z chorobą Gravesa aktywną w czasie ciąży lub nawet w fazie eutyreozy lub niedoczynności po przebytym leczeniu nadczynności tarczycy radiojodem lub po leczeniu operacyjnym zagrożone są w odsetku 2% wystąpieniem płodowej nadczynności tarczycy na skutek przekazania p/c stymulujących receptor TSH. Przeciwciała blokujące receptor TSH stwierdzono natomiast u ponad 50% matek, które urodziły dzieci z wrodzoną sporadyczną niedoczynnością tarczycy. Matki te nie miały zaburzeń czynności tarczycy. Należy zaznaczyć, że p/c TPO i p/c Tg chociaż przenikają przez łożysko, nie uszkadzają tarczycy płodu. Obecność przeciwciał TPO w I trymestrze ciąży koreluje ze zwiększoną częstością poronień i wystąpienia poporodowych zaburzeń czynności tarczycy. U kobiet z obecnymi p/ciałami TPO nawet bez zaburzeń czynności tarczycy kilkakrotnie wzrasta ryzyko poronień. Nie udowodniono, aby p/ciała tarczycowe były czynnikiem sprawczym, są raczej wyrazem złożonych zaburzeń immunologicznych prowadzących do poronień. Nie wykazano korzystnego wpływu tyroksyny, stosowanej u kobiet w stanie wyrównanej czynności tarczycy, na te zaburzenia. Nie stwierdzono korelacji miedzy występowaniem p/ciał antyfosfolipidowych i p/ciał tarczycowych (2, 6). W ostatnich latach podkreśla się korzystny wpływ selenu podawanego w dawce 200 μg/d na procesy autoimmunologiczne tarczycy (7). Dotychczas jednak żadne rekomendacje nie uwzględniają stosowania selenu u kobiet ciężarnych.
Ocena czynności tarczycy u kobiety ciężarnej
Ocena czynności tarczycy u kobiety ciężarnej opiera się na badaniu stężeń TSH, fT4 i fT3 w surowicy. Obecnie nie dysponujemy normami stężeń fT4 i fT3 dla określonych przedziałów ciąży, a komercyjne automatyczne oznaczenia mogą być nieścisłe z uwagi na trudny do wyeliminowania wpływ białek wiążących. Przyjmuje się jednak, że stężenia fT4 i fT3 w ciąży mieszczą się w granicach normy populacyjnej, z wyjątkiem I trymestru ciąży, w którym można odnotować przejściowy wzrost fT4 i trzeciego trymestru, w którym stężenie może być o 30% niższe niż referencyjne wartości populacyjne. Podobną tendencję wykazuje stężenie fT3, przy czym wartości mieszczą się zwykle w granicach normy. Z uwagi na przewidywalne zmiany stężeń całkowitych hormonów tarczycy można posługiwać się u ciężarnej tymi oznaczeniami. Zakres normy uzyskuje się po zastosowaniu przelicznika 1,5 wobec referencyjnego zakresu populacyjnego. Za fizjologię należy przyjąć, jak wspomniano w rozdziale „regulacja czynności tarczycy u kobiety ciężarnej”, obniżenie stężenia TSH poniżej 0,4 mU/l aż do 18 tygodnia ciąży u 20% ciężarnych. Wynika to z wpływu βhCG na czynność tarczycy. Stężenie TSH w pierwszej połowie ciąży wynosi średnio około 0,8 mU/l. Stwierdzenie wartości TSH w górnym zakresie dotychczas przyjmowanej normy 3-5,0 mU/l nakazuje konieczność badania p/c tarczycowych w I trymestrze cięży. Obecność przeciwciał tarczycowych TPO w I trymestrze ciąży koreluje, jak wspomniano, ze zwiększoną częstością poronień i wystąpienia poporodowych zaburzeń czynności tarczycy. U większości chorych z chorobą Gravesa stwierdza się przeciwciała TRAb. Ocena tych przeciwciał w pierwszym trymestrze ciąży jest użyteczna w różnicowaniu przyczyn nadczynności tarczycy, w szczególności różnicowaniu choroby Gravesa i tyreotoksykozy ciężarnych. Ocena w 26-30 tygodniu ciąży pozwala natomiast określić ryzyko płodowej nadczynności tarczycy. Badanie należy wykonać zarówno u kobiet leczonych z powodu nadczynności tarczycy w czasie ciąży jak i pozostających w stanie wyrównanej czynności tarczycy po przebytej operacji tarczycy lub leczeniu radiojodem. W przypadkach wysokiego miana tych przeciwciał pod koniec ciąży u matki należy zbadać noworodka pod kątem nadczynności tarczycy (rycina 1 przedstawia algorytm diagnostyczno-terapeutyczny). W ciąży bezwzględnie przeciwwskazane są badania izotopowe tarczycy. Nie ma p/wskazań do badania usg tarczycy. Nie ma p/wskazań do badania cytologicznego guzów tarczycy (2).
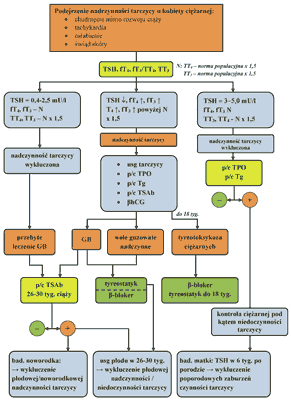 Ryc. 1. Algorytm diagnostyczno-terapeutyczny w przypadku podejrzenia nadczynności tarczycy u kobiety ciężarnej (E05).
Nadczynność tarczycy u ciężarnej
Etiologia
Przyczyny nadczynności tarczycy u kobiety ciężarnej nie różnią się od spotykanych w ogólnej populacji, z wyjątkiem specyficznej dla ciąży tzw. tyreotoksykozy ciężarnych. Najczęściej, bo w 85% przypadków przyczyną nadczynności tarczycy u ciężarnej jest choroba Gravesa, sporadycznie wole guzowate nadczynne, podostre zapalenie tarczycy czy nadmiar egzogennych hormonów tarczycy. Zaostrzenie procesu immunologicznego w chorobie Gravesa zwykle następuje na początku ciąży. Łagodnieje w drugiej połowie ciąży i nasila się po porodzie w postaci poporodowych zaburzeń czynności tarczycy trwających do12 miesięcy. Tyreotoksykoza ciężarnych (gestational thyreotoxicosis) jest to samoograniczająca się około 18 tyg. ciąży postać nadczynności tarczycy, zwykle o niewielkim nasileniu, niezwiązana z pierwotną chorobą tarczycy, spowodowana nadmiarem hCG. Towarzyszą jej niepowściągliwe wymioty ciężarnych (hyperemesis gravidarum). W grupie kobiet z niepowściągliwymi wymiotami ciężarnych stwierdza się w 60% przypadków zahamowanie wydzielania TSH, w 46% przypadków podwyższenie stężenia fT4 i w 12% podwyższenie stężenia fT3. Prawdopodobnie z uwagi na ograniczenie kaloryczne dochodzi w tym stanie do upośledzenia konwersji T4 do T3 (8).
Epidemiologia
Nadczynność tarczycy dotyczy obecnie w USA 1% kobiet ciężarnych w tym u 0,4% jest to nadczynność jawna, u 0,6% subkliniczna. Dotychczas określano ten odsetek na <0,2% ciężarnych. Odrębną jednostką jest, jak wspomniano, tyreotoksykoza ciężarnych wywołana nadmiarem hCG, która występuje w 1% ciąż u Europejek ale aż w 11% ciąż u Azjatek (9).
Rozpoznanie
Rozpoznanie kliniczne nadczynności powinno uwzględniać różnicowanie szeregu objawów wspólnych dla ciąży i nadczynności tarczycy. Należą do nich cechy krążenia hiperkinetycznego ze zwiększeniem rzutu minutowego i gradientu ciśnienia tętniczego krwi, tachykardią, zwiększone ucieplenie skóry i nietolerancja ciepła, a także nadpobudliwość emocjonalna. Kobiety ciężarne dobrze tolerują umiarkowaną nadczynność tarczycy. Nadczynność tarczycy nie upośledza płodności, sporadycznie dochodzi do cyklów bezowulacyjnych. Charakterystyczny dla nadczynności tarczycy u ciężarnych są brak adekwatnego przyrostu masy ciała lub chudnięcie pomimo rozwoju ciąży. Współistnieją cechy choroby tarczycy, która jest przyczyną nadczynności. W przypadku choroby Gravesa stwierdza się wole naczyniowe i zmiany oczne, sporadycznie obrzęk przedgoleniowy i akropachię tarczycową, natomiast w przypadku wola guzowatego nadczynnego zmiany guzowate w gruczole tarczowym. U większości ciężarnych z chorobą Gravesa największe nasilenie nadczynności tarczycy dotyczy I trymestru ciąży, podczas którego dołącza się działanie dodatkowego czynnika stymulującego tarczycę jakim jest hCG. W trakcie rozwoju ciąży, dzięki immunosupresyjnemu działaniu łożyska dochodzi do obniżenia poziomu przeciwciał TRAb i złagodzenia lub ustąpienia objawów tyreotoksykozy. Oznaczenie miana p/c TRAb nie jest przydatne do stwierdzenia nadczynności tarczycy, ale konieczne celem oceny ryzyka płodowej nadczynności tarczycy.
Nieleczona nadczynność tarczycy w okresie ciąży stanowi zagrożenie dla matki i dziecka. Zagrożenie dla kobiet wyraża się ryzykiem wystąpienia zastoinowej niewydolności serca, nadciśnienia tętniczego, rzucawki okołoporodowej, poronień samoistnych i porodów przedwczesnych, infekcji, anemii oraz w przypadku działania dodatkowego czynnika obciążającego jakim jest np. poród także przełomu tarczycowego z zagrożeniem śmiertelnością okołoporodową. Niekorzystny wpływ nadczynności tarczycy na dziecko prowadzi do niższej wagi urodzeniowej, możliwości wad wrodzonych dotyczących głównie układu kostnego (microcrania, przedwczesna kraniosynostosa i brachydaktylia), większej śmiertelności okołoporodowej związanej z płodową nadczynnością tarczycy. Ogółem częstość wad wrodzonych sięga 6% dzieci urodzonych przez nieleczone matki z nadczynnością tarczycy, w porównaniu z odsetkiem 1,7% dzieci, których matki leczono tiamazolem i z 0,2% dzieci z grupy kontrolnej. Podkreśla się, że częstość wad wrodzonych nie koreluje ani ze stopniem nadczynności tarczycy ani czasem trwania tyrotoksykozy. Tyreotoksykoza płodowa rozwija się w następstwie przechodzenia przez łożysko immunoglobulin stymulujących receptor TSH. Ryzyko płodowej nadczynności tarczycy dotyczy około 1-2% dzieci, których matki mają chorobę Gravesa. Częstość tego powikłania wynosi 1:50 000 ciąż. Płodową nadczynność tarczycy rozpoznaje się przy częstości tętna płodu powyżej 160/min. w połączeniu z obecnością wola u płodu i wysokim mianem p/c stymulujących receptor TSH we krwi matki. Przyjmuje się, że obecność przeciwciał u matki w stężeniu przekraczającym 5-krotnie normę, stanowi ryzyko zaburzeń czynności tarczycy noworodka i płodu. W 26-30 tyg. ciąży zaleca się w przypadku autoimmunologicznej choroby tarczycy kontrolne badanie ultrasonograficzne płodu z oceną rozmiarów tarczycy i czynności serca (ryc. 1). Tyreotoksykoza może ujawnić się w okresie życia płodowego, zaraz po urodzeniu lub po upływie około 10 dni od porodu, kiedy wygasa działanie tyreostatyków podawanych matce. Płodowa nadczynność tarczycy rozwija się najczęściej na skutek przezłożyskowego pasażu matczynych przeciwciał TRAb, ale może wynikać też z mutacji receptora TSH lub białka G czy wystąpienia de novo choroby Gravesa (10).
Leczenie nadczynności tarczycy u ciężarnej
Konieczność leczenia nadczynności tarczycy u ciężarnej wynika zarówno z potrzeby zmniejszenia ryzyka matczynego jak i płodowego. Leczenie uwzględnia stosowanie tyreostatyków, βblokerów i w sporadycznych przypadkach operację tarczycy. Bezwzględnie przeciwwskazana jest radiojodoterapia. Tyreostatyki są to pochodne tiamazolu lub tiouracylu. Preparaty obu grup są jednakowo skuteczne u ciężarnej. W oparciu o przesłanki teoretyczne lekiem preferowanym powinien być tiouracyl, ponieważ wykazuje najsłabszą zdolność przechodzenia przez łożysko i prawdopodobnie mniejsze ryzyko wywołania efektu teratogennego, jakim jest aplasia cutis congenita. Nie wywołuje też zespołu immunologicznej hypoglikemii – zespołu Hirata. Decyzja o zastosowaniu pochodnej tiouracylu powinna być podjęta na początku ciąży, w okresie organogenezy. Poważnym objawem ubocznym tyreostatyków jest agranulocytoza, której ryzyko dotyczy poniżej 0,5% leczonych zarówno preparatami tiouracylu jak i tiamazolu. Inne poważne objawy uboczne, występujące w odsetku poniżej 0,2% wyrażają się toksycznym uszkodzeniem wątroby, zapaleniem naczyń i zespołem rzekomotoczniowym częściej opisywanym u chorych leczonych tiouracylem. Do łagodnych objawów ubocznych dotyczących 1-5% leczonych, niezależnie od rodzaju tyreostatyku, należą: pokrzywka, objawy dyspeptyczne, zaburzenia smaku czy wypadanie włosów. Wyjątkowo pochodne tiamazolu mogą wywołać powstawanie p/ciał tarczycowych z objawami hipoglikemii, co określa się mianem zespołu Hirata. Tyreostatyki docierają przez łożysko do płodu i hamują syntezę hormonów tarczycy u płodu podobnie jak u matki. W tym mechanizmie mogą leczyć płodową nadczynność tarczycy ale także prowadzić do powstania wola albo jatrogennej płodowej niedoczynności tarczycy. Stosowanie tyreostatyków w ciąży nie upośledza somatycznego i intelektualnego rozwoju dziecka, jeżeli doprowadza do stanu wyrównanej czynności tarczycy u ciężarnej. Należy dążyć do utrzymania stężenia fT4 u kobiety na górnej granicy normy. Postępowanie takie ma na celu ochronę płodu przed niedoczynnością tarczycy. Kontrola czynności tarczycy u leczonej tyreostatykami powinna odbywać się co 4 tygodnie. Możliwe jest skojarzenie tyreostatyku z tyroksyną, jeżeli jest to konieczne do utrzymania wyrównanej czynności tarczycy. Leczenie nadczynności tarczycy u ciężarnej rozpoczyna się zwykle od dawki dobowej 300 mg tiouracylu np. Propycilu, Thyrosanu lub 30 mg tiamazolu np. Metizolu, Thyrozolu, dzielonej co 8 godzin. Większe dawki stosowane są w przypadku nasilonych objawów klinicznych, dużego wola lub kontaminacji jodem. Dawkę tyreostatyku stopniowo zmniejsza się do podtrzymującej. Dawka podtrzymująca wynosi odpowiednio15-2,5 mg tiamazolu lub 150-25 mg tiouracylu /d. βblokery stosowane są w nadczynności tarczycy celem kontrolowania aktywności adrenergicznej, nie wpływają natomiast na syntezę hormonów tarczycy. βblokery niekorzystnie wpływają na rozwój łożyska i płodu, prowokują czynność skurczową macicy, prowadzą do hipoglikemii, bradykardii i zaburzeń oddychania noworodków. Należy ograniczyć ich stosowanie u ciężarnej do przypadków ciężkiej nadczynności, której rozpoznanie nakazuje zastosowanie intensywnego leczenia w tym także dużych dawek βblokera lub w przypadkach tyreotoksykozy ciężarnych, kiedy wystarczające są niewielkie dawki leku stosowane krótkotrwale.
Nadczynność tarczycy w przebiegu wola guzowatego nadczynnego wymaga stosowania tyreostatyków przez całą ciążę, natomiast w przypadkach choroby Gravesa można liczyć się z ustąpieniem nadczynności tarczycy na skutek stłumienia zjawisk immunologicznych w czasie ciąży. Ciężarna leczona tyreostatykami, u której uzyskano wyrównanie czynności tarczycy, może odbyć poród siłami natury. Nieleczona lub nieskutecznie leczona nadczynność tarczycy u kobiety ciężarnej, stwarza, w sytuacji wystąpienia dodatkowego czynnika obciążającego jakim jest poród lub poronienie, zagrożenie wystąpienia przełomu tarczycowego. W tych przypadkach obowiązuje postępowanie jak w zagrażającym przełomie tarczycowym. Konieczne jest podanie 1) sterydów dożylnie – Hydrocorticon 200-100 mg co 6 godzin; 2) tyreostatyków dożylnie – Favistan lub Thiamazol 40 mg co 6 godz., albo doustnie Metizol, Thyrozol 20 mg co 4 godz. lub Propycil, Thyrosan 200-250 mg co 4 godz.; 3) dowolnego βblokera celem zwolnienia czynności serca do poniżej 90/min. np. Propranololu 40-60 mg co 6 godz. doustnie lub dożylnie, wstępnie 0,5-1 mg, a następnie 2-3 mg co 6 godzin. Niewyrównana czynność tarczycy u rodzącej jest wskazaniem do rozwiązania cięciem cesarskim lub skrócenia II okresu porodu.
Operacja tarczycy u kobiety ciężarnej wykonywana jest sporadycznie i dotyczy przypadków poważnych objawów ubocznych w czasie leczenia tyreostatykami, konieczności stosowania dużych dawek tyreostatyku i współistnienia wola znacznych rozmiarów, a także trudności w uzyskaniu dobrej kontroli czynności tarczycy. Optymalnym okresem do operacji jest drugi trymestr ciąży.
Przygotowanie do operacji uwzględnia stosowanie tyreostatyków, propranololu i płynu Lugola według ogólnie obowiązujących zasad. W okresie ciąży farmakologiczne dawki jodu można stosować wyłącznie krótkotrwale, w przygotowaniu do strumektomii lub leczeniu przełomu tyreotoksycznego. Jod przechodzi przez łożysko i podawany w ponadfizjologicznych dawkach może zahamować czynność tarczycy płodu, powodując wole z uciskiem i zwężeniem dróg oddechowych oraz hipotyreozę. Tarczyca płodu nie ma bowiem wykształconego mechanizmu adaptacji do nadmiaru jodu – brak mechanizmu „escape” co skutkuje zahamowaniem syntezy hormonów tarczycy przy podaży ponadfizjologicznych dawek jodu. Obecność zmiany złośliwej w tarczycy lub podejrzanej o złośliwość jest zdaniem części autorów wskazaniem do przeprowadzenia operacji w czasie ciąży, zdaniem innych, możliwe jest odroczenie operacji do rozwiązania.
U ciężarnej nie stosuje się radiojodu ani do badań diagnostycznych, ani do leczenia chorób tarczycy. Kobiety po przebytym leczeniu radiojodem z powodu nadczynności tarczycy, powinny być poinformowane, że optymalny okres dla planowania ciąży to stan wyrównanej czynności tarczycy, przy zachowanym co najmniej 6-miesięcznym okresie karencji po zażyciu leczniczej dawki radiojodu. W oparciu o nieliczne doniesienia informujące o niezamierzonym podaniu radiojodu ciężarnej, wnioskuje się, że aktywność nie przekraczająca 15 mCi zaaplikowana do 10 tyg. ciąży, nie uszkadza funkcji tarczycy a napromienianie całego ciała płodu jest na tyle niskie, że nie stanowi wskazania do terminacji ciąży. Niezamierzone podanie radiojdu po 10-12 tyg. ciąży, kiedy tarczyca płodu zaczyna wychwytywać jod, stwarza ryzyko niedoczynności tarczycy płodu i noworodka. Konieczne jest w takim przypadku utrzymanie stężeń tyroksyny u matki na górnej granicy normy i bezzwłoczne leczenie tyroksyną noworodka (2, 8).
W okresie laktacji dopuszczalne jest leczenie tyreostatykami: propyltiouracylem w dawce dobowej nie przekraczającej 450 mg/d lub tiamazolem w dawce dobowej nie przekraczającej 20 mg/d. Leki należy podawać tuż po karmieniu, z 3-4-godzinną przerwą przed kolejnym karmieniem. Z uwagi na potencjalne ryzyko zahamowania syntezy hormonów tarczycy zalecano uprzednio kontrolę stężenia TSH i fT4 u karmionego dziecka co 2-4 tyg. Współcześnie przyjmuje się, że kontrola taka nie jest konieczna (11).
Nadczynność tarczycy u noworodka stanowi wskazanie do stosowaniu tyreostatyków: propyltiouracylu w dawce 5-10 mg/kg/dobę lub tiamazolu 0,5-1,0 mg/kg/dobę w dawkach podzielonych co 8 godzin. W ciężkich przypadkach należy dodatkowo podawać propranolol 2 mg/kg /dobę, płyn Lugola 1 kropla (8 mg I) co 8 godzin lub organiczny związek jodu np. kwas iopanoinowy 100-200 mg/dobę i sterydy. Choroba trwa zwykle do 3 miesięcy. Stosowanie tyreostatyków rozciąga się na ten okres, natomiast preparaty jodowe stosuje się nie dłużej niż 3 tygodnie. W piśmiennictwie można znaleźć jednak doniesienia o konieczności leczenia tyreostatykami przez okres 7 miesięcy (8).
W Klinice Endokrynologii CMKP i Klinice Położnictwa i Ginekologii CMKP w Warszawie obserwowano w latach 1995-98 47 kobiet ciężarnych w wieku 22-43 lat, z nadczynnością tarczycy w przebiegu choroby Gravesa (n=22) i wola guzowatego nadczynnego (n=25). Metizol stosowano w grupie 24 kobiet, do której należało 12 kobiet z chorobą Gravesa i 12 kobiet z wolem guzowatym nadczynnym; Propycil w grupie 23 kobiet, do której należało 12 kobiet z chorobą Gravesa 11 z wolem guzowatym nadczynnym. U wszystkich leczonych osiągnięto stan wyrównanej czynności tarczycy przed porodem. Poród siłami natury odbyło 45 kobiet, rozwiązanie cięciem cesarskim z powodów położniczych 3, co stanowi 6,6% badanych. W tym czasie odsetek cięć cesarskich wykonanych w Klinice Położnictwa stanowił 27% ogólnej liczby porodów. Średni czas trwania ciąży wynosił 38,67 tygodni i nie różnił się w obydwu grupach. Wszystkie dzieci urodziły się żywe, bez wad. Ocena stanu noworodka w skali Apgar wykazała, że osiągnęły one średnio w 5 minucie 9,38 punktów i nie stwierdzono różnic w obydwu leczonych grupach. Średnie stężenie TSH u noworodków urodzonych przez kobiety leczone Metizolem wynosiło 6,03 mU/l, a średnie stężenie T4 160,33 nmol/l. W grupie leczonej Propycilem średnie stężenia u noworodków wynosiły: TSH – 13,31 mU/l, T4 – 102,26 nmol/l. Wartości te mieszczą się w granicach normy dla noworodków. Średnia waga noworodków nie różniła się w obydwu grupach i wynosiła 3265,27 g. Uznano, że stosowanie tyreostatyków u ciężarnej z nadczynnością tarczycy jest bezpieczną metodą leczenia, doprowadzającą do wyrównania czynności tarczycy u ciężarnej i dobrego stanu noworodka. Nie powoduje uszkodzenia płodu. Zarówno Propycil jak i Metizol są lekami skutecznymi. Zastanawiające, że w grupie leczonej Propycilem, który trudniej przechodzi przez łożysko, stwierdzono wyższe średnie stężenie TSH u noworodków (12).
Niedoczynność tarczycy u ciężarnej
Etiologia
Niedoczynność tarczycy u kobiety ciężarnej spowodowana jest najczęściej limfocytarnym zapaleniem tarczycy lub jest następstwem leczenia radiojodem nadczynności tarczycy czy operacji tarczycy. Może wiązać się z nadmierną dawką tyreostatyków podawanych ciężarnej z nadczynnością tarczycy. Na obszarach ciężkiej endemii wola główną przyczyną niedoczynności jest niedobór jodu (13).
Epidemiologia
Subkliniczna niedoczynność tarczycy rozpoznawana w przypadkach podwyższonego stężenia TSH powyżej 5mU/l wobec prawidłowych stężeń fT4 i fT3 dotyczy 1-2,5% kobiet w 12-13 tyg. ciąży. Jawna niedoczynność tarczycy TSH, fT4, fT3 rozpoznawana jest u 0,4% kobiet ciężarnych. W grupie tych kobiet stwierdza się obecność p/c TPO w odsetku 6,5-58% (13, 14).
Rozpoznanie
Rozpoznanie niedoczynności u ciężarnej sporadycznie opiera się na obrazie klinicznym.
Najczęściej ustalane jest w następstwie oznaczeń hormonalnych w grupach ryzyka niedoczynności, do których należą: przebyte leczenie nadczynności tarczycy tyreostatykami, radiojodem lub operacyjne, przebyte leczenie operacyjne lub radiojodoterapia z powodu wola nietoksycznego, przebyte napromienienie szyi, obecność wola, ustalone rozpoznanie autoimmunologicznej choroby tarczycy bez zaburzeń czynności przed ciążą, urodzenie dziecka z wrodzoną niedoczynnością tarczycy spowodowaną obecnością p/ciał blokujących TRAb, występowanie w rodzinie chorób tarczycy, przebyte samoistne poronienie, czy współistnienie chorób autoimmunologcznych w tym cukrzycy typu 1.
Niedoczynność tarczycy prowadzi do występowania cyklów bezowulacyjnych i hiperprolaktynemii co przyczynia się do upośledzenia płodności. U kobiety ciężarnej z niedoczynnością tarczycy wzrasta ryzyko wystąpienia nadciśnienia tętniczego z odsetka 7,6% spotykanego w stanie wyrównanej czynności tarczycy, do 15% u kobiet z utajoną niedoczynnością tarczycy i 22% u kobiet z jawną niedoczynnością. Niedoczynność tarczycy wiąże się także z niską wagą urodzeniową, wadą szpotawości stóp, ryzykiem poronień i porodów przedwczesnych, niedokrwistości, przedwczesnego odklejenia łożyska, stanu przedrzucawkowego, martwych porodów i krwotoków poporodowych. Niedoczynność tarczycy i związana z tym hypotyroksynemia matki w pierwszym trymestrze ciąży może mieć nieodwracalne skutki dla rozwoju mózgu dziecka (8).
Leczenie
U kobiet z niedoczynnością tarczycy należy wyrównać czynność tarczycy przed planowaną ciążą. Leczenia w czasie ciąży wymagają przypadki zarówno jawnej jak i utajonej niedoczynności. Niedoczynność tarczycy u kobiety ciężarnej leczona jest, podobnie jak w innych przypadkach, preparatami soli sodowej lewoskrętnej tyroksyny- l-tyroxin, stosowanymi 1x dziennie, na czczo. Przyjmuje się za optymalną taką dawkę tyroksyny, która pozwala uzyskać stężenie TSH w zakresie 0,5-2,5 mU/l. Zaleca się zażywanie tyroksyny na czczo, z uwzględnieniem, że preparaty żelaza, wapnia i mleko sojowe upośledzają wchłanianie tego leku. Konieczna jest 4-godzina przerwa w stosowaniu wymienionych preparatów. Zaleca się zwiększenie dawki tyroksyny już od 5 tyg. ciąży o 30% w stosunku do stosowanej przed ciążą. Dalsze leczenie ustalane jest w oparciu o stężenie TSH. Badanie TSH powinno być wykonywane co 4 tygodnie. W przypadku rozpoznania niedoczynności tarczycy w ciąży zleca się od razu należną dawkę substytucyjną tyroksyny, około 2 μg/kg/d, z pominięciem zwykle stosowanej zasady stopniowego zwiększania dawki w długich odstępach czasu. Postępowanie takie jest bezpieczne w sytuacji wysokich stężeń białka wiążącego hormony tarczycy, w grupie młodych kobiet. Po porodzie zaleca się taką dawkę tyroksyny, która wyrównywała czynność tarczycy przed ciążą, a kontrolę stężenia TSH należy wykonać w 6 tygodni po porodzie. Nie ma przeciwwskazań u kobiety leczonej tyroksyną do karmienia piersią (15).
U kobiet z rakiem tarczycy zaleca się utrzymanie supresji TSH przez całą ciążę, część autorów dopuszcza jednak zaniechanie pełnej supresji TSH, z uwagi na minimalne ryzyko wpływu podwyższonego krótkotrwałego stężenia TSH na przebieg raka tarczycy (16).
Niedoczynność tarczycy płodu może być rozpoznana w oparciu o badanie stężenia TSH i T4 we krwi pępowinowej pobranej drogą kordocentezy. Podejrzenie niedoczynności tarczycy płodu sugeruje obecność wola u płodu i wielowodzia. Leczenie może polegać na doowodniowych wstrzyknięciach tyroksyny. Z uwagi na dyskusyjną celowość i ryzyko zabiegu kordocentezy, możliwe jest rozpoczęcie leczenia po urodzeniu (8).
Niedoczynność tarczycy u noworodków stwierdzana jest z częstością 1/4000 żywych porodów. Zwykle nie obserwuje się związku niedoczynności tarczycy u matki i u płodu. Wyjątek stanowią obszary ciężkiej endemii wola, gdzie na skutek niedoboru jodu występuje niedoczynność tarczycy zarówno u kobiety ciężarnej jak i u płodu i noworodka. Przezłożyskowy transport przeciwciał blokujacych receptor TSH oraz podaż tyreostatyków matce, mogą prowadzić do przejściowej niedoczynności tarczycy u płodu i noworodka. Zastosowanie promieniotwórczego izotopu jodu kobiecie ciężarnej po 12 tyg. ciąży prowadzi do trwałego uszkodzenia tarczycy dziecka.
Leczenie wrodzonej niedoczynności tarczycy polega na stosowaniu soli sodowej lewoskrętnej tyroksyny w dawce wstępnej 10-15 μg/kg/d . Dawki te są następnie zmniejszane. W przypadkach przejściowej niedoczynności tarczycy podejmowana jest próba odstawienia tyroksyny, zwykle w 3 roku życia (8).
Poporodowe zapalenie tarczycy
Poporodowe zapalenie tarczycy jest to zaostrzenie lub ujawnienie się autoimmunologicznej choroby tarczycy, do których dochodzi po porodzie na skutek przestrojenia systemu immunologicznego. Obejmuje zaburzenia czynności tarczycy w okresie 12 miesięcy po porodzie. Częstość występowania sięga wg różnych autorów od 1,1 do16,7% (najczęściej 4-9%). Charakteryzuje się wystąpieniem faz zaburzeń czynności tarczycy: 1) przejściowa nadczynność, 2) przejściowa niedoczynność albo 3) przejściowa nadczynność z następową niedoczynnością. W większości przypadków, ale nie we wszystkich, po upływie roku od porodu dochodzi do wyrównania czynności tarczycy. Nadczynność ujawnia się średnio w 13 tyg. po porodzie, niedoczynność średnio w 19 tyg. po porodzie. Czynniki predysponujące do wystąpienia poporodowego zapalenia tarczycy to przede wszystkim obecność przeciwciał przeciw TPO, przebyty uprzednio epizod poporodowego zapalenia tarczycy, cukrzyca typu 1 i dodatnie wywiady rodzinnego występowania chorób autoimmunologicznych. Dotyczy 50% kobiet, u których stwierdzono p/ciała przeciw TPO w 14-16 tyg. ciąży. W obrazie morfologicznym tarczycy dominuje nacieczenie limfocytarne i destrukcja, podobnie jak w chorobie Hashimoto czy bezbolesnym zapaleniu tarczycy. Rozpoznanie ustala się w oparciu o standardowe oznaczenia hormonalne TSH, fT4 /fT3 i obecność p/ciał anty TPO lub obraz kliniczny przejściowych zaburzeń czynności tarczycy po porodzie u kobiet bez obecnych p/ciał TPO. Niezwykle przydatnym badaniem w diagnostyce fazy nadczynności jest stwierdzenie zahamowania jodochwytności tarczycy (rycina 2 przedstawia algorytm diagnostyczno-terapeutyczny). Leczenie fazy nadczynności polega na stosowaniu β blokera np. Propranololu w dawce 3 x 10-3 x 20 mg celem złagodzenia objawów ze strony układu współczulnego. Zdaniem większości autorów jest to postępowanie wystarczające. Stosowanie Propranololu w czasie laktacji jest dopuszczalne przez FAD (Food and Drug Administration). Leczenie trwa zwykle około 3 miesięcy. Tyreostatyki nie są wskazane z uwagi na mechanizm nadczynności polegający, jak wspomniano, na destrukcji tarczycy. Uzasadnienie patogenetyczne znajdują sterydy. Faza niedoczynności wymaga stosowania l-tyroksyny w dawce dobowej 25-100 μ/d, z koniecznością kontrolowania stężenia TSH co 4-8 tyg. Z przesłanek patogenetycznych wynika uzasadnienie stosowania l-tyroksyny przez okres 1 roku, a następnie podjęcie próby odstawienia leku poprzez redukcje dawki o 50% i ocenę stężenia TSH. Pozwoli to wyłonić grupę chorych u których doszło do rozwinięcia się trwałej niedoczynności tarczycy. Odsetek ten może sięgać 25-30%. Badanie przesiewowe w kierunku poporodowych zaburzeń czynności tarczycy wydają się o tyle uzasadnione, że ich wykrycie pozwala na leczenie stanów skąpoobjawowych, a beneficjentami leczenia są zarówno kobiety jak i ich dzieci. Parametry przydatne w badaniach przesiewowych to oznaczenie miana przeciwciał przeciw TPO w I trymestrze ciąży i badanie stężenia TSH w 6 tyg. po porodzie (ryc. 2). Współcześnie nie obowiązują badania przesiewowe u wszystkich kobiet. Wydaje się, że badaniami tymi powinny być objęte kobiety z cukrzycą typu I, przebytym epizodem poporodowych zaburzeń czynności tarczycy, udokumentowaną przed ciążą obecnością p/c przeciw TPO, przebytym poronieniem, depresją poporodową, współistniejącymi chorobami autoimmunologicznymi i rodzinnym występowaniem autoimmunologicznych chorób tarczycy (17).
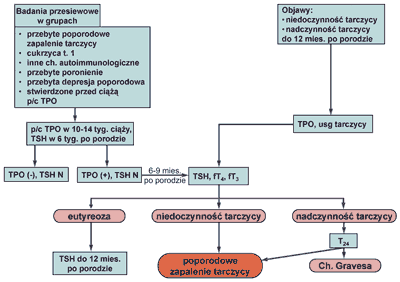 Ryc. 2. Algorytm diagnostyczno-terapeutyczny w przypadku podejrzenia poporodowego zapalenia tarczycy (E06).
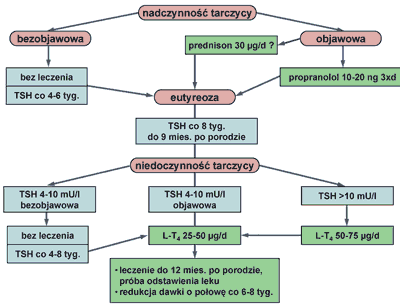 Ryc. 3. Algorytm diagnostyczno-terapeutyczny leczenia i monitorowania poporodowego zapalenia tarczycy (E06). Piśmiennictwo
1. Glinoger D, et al.: Regulation of maternal thyroid during pregnancy. J. Clin. Endocrinol. Metab., 1990; 71: 276-287.
2. Lazarus JH: Thyroid disorders associated with pregnancy. Treat Edocrinol. 2005; 4, 1: 31-41.
3. World Health Organization. Technical consultation of experts in Geneva January 2005. The prevention and control of iodine deficiency in pregnant and lactating woman and in children under two years: recommendations of a WHO Technical Consultation. Public Health Nutr., 2007.
4. Szybiński Z, et al.: Prevalence of goiter, iodine deficiency and iodine prophylaxis in Poland. The results of nation-wide study. Endokrynol. Polska 1993, 44, 373.
5. Nohr SB, et al.: Opposite varations in maternal and neonatal thyroid function induced by iodine supplementation during pregnancy. J. Clin. Endocrinol. Metab. 2000, 85: 623-627.
6. Bagis T, et al.: Autoimmune thyroid disease in pregnancy and the postpartum period: relationship to spontaneous abortion. Thyroid 2001, 11: 1049-1053.
7. Negro R, et al.: The influence of selenium supplementation on postpartum thyroid status in pregnant women with thyroid peroxidase autoantibodies. J. Clin. Endocrinol. Metab., 2007, 92, 4, 1263-1268.
8. Abalovich et al.: Management of thyroid dysfunction during pregnancy and postpartum: an endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab., 92, 2007, S1-S47.
9. Mestman JH: Hyperthyroidism in pregnancy. Best Pract. Res. Clin. Endocrinol. Metab., 2004, 18, 267-288.
10. Fisher DA: Fetal thyroid function: diagnosis and menagement of fetal thyroid disorders. Clinical Obstetrics and Gynecology 1997, 40, 16-20
11. Mandel S, Cooper DS: The use of antithyroid drugs in pregnancy and lactation. J. Clin. Endocrinol. Metab., 2001, 86: 2354-2359.
12. Jastrzębska H, et al.: Treatment of hyperthyroidism in pregnancy. J. Endocrinol. Invest 1999; 22, suppl to No 7, 52.
13. Klein RZ, et al.: Prevalence of thyroid deficiency in pregnant women. Clin. Endcorinol. (Oxf) 1991, 35, 41-46.
14. Spong CY: Subclinical hypothyroidism:should all pregnant women be screened? Obstet. Gynecol., 2005, 105, 235-236.
15. Abalovich M, et al.: Overt and subclinical hypothyroidism complicating pregnancy. Thyroid 2002, 12, 63-68.
16. Jastrzębska H, et al.: Ciąża u kobiet z rakiem tarczycy leczonych supresyjną dawką tyroksyny. Wiadomości Lek. 2001, L IV, supl. 1, 389-393.
17. Premawardhana LD, et al.: Postpartum thyroiditis and long-term thyroid status:prognostic influence of thyroid peroxidase antibodies and ultrasound echogenicity. J. Clin. Endcorinol. Metab., 2000, 85, 71-75.
otrzymano/received: 2007-11-28 zaakceptowano/accepted: 2007-12-29 Adres/address: *Helena Jastrzębska Klinika Endokrynologii CMKP, Szpital Bielański ul. Cegłowska 80, 01-809 Warszawa tel./fax: (0-22) 834-31-31 e-mail: klinendo@cmkp.edu.pl Pełna wersja artykułu Postępy w rozpoznawaniu i leczeniu chorób tarczycy u kobiety ciężarnej i w okresie poporodowym dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








