|
© Borgis - Postępy Nauk Medycznych 2, s. 92-104
*Małgorzata Gietka-Czernel
Postępy w rozpoznawaniu i leczeniu zapaleń tarczycy
Progress in diagnosis and treatment of thyroiditis
Klinika Endokrynologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. CMKP dr hab. med. Wojciech Zgliczyński Streszczenie
Zapalenia tarczycy stanowią niejednorodną grupę chorób, charakteryzujących się bólem szyi, powiększeniem tarczycy i zaburzeniami czynności gruczołu tarczowego. Najczęściej występującym rodzajem zapalenia tarczycy jest choroba Hashimoto, która może dotyczyć 14% dorosłej populacji; pozostałe zdarzają się rzadko, a wole Riedla jest wręcz ewenementem w skali światowej. Czynniki etiologiczne zapaleń tarczycy są różnorodne: infekcyjne, autoimmunologiczne, fizyczne tj. uraz i napromienienie oraz toksyczne, np. polekowe. Zaburzenia czynności tarczycy towarzyszące chorobom zapalnym gruczołu tarczowego wyrażają się często krótkotrwałą tyreotoksykozą, przebiegającą z zahamowaniem jodochwytności tarczycy, po której następuje przejściowa niedoczynność. Hipotyreoza w przebiegu choroby Hashimoto ma z reguły charakter trwały. W diagnostyce zapaleń tarczycy pomocne jest określenie stężenia TSH, fT4, przeciwciał antyperoksydazowych, OB i leukocytozy, badania obrazowe tj.: ultrasonografia i scyntygrafia tarczycy oraz biopsja aspiracyjna cienkoigłowa. Leczenie zapaleń tarczycy jest zwykle objawowe i obejmuje postępowanie przeciwbólowe, stosowanie β-adrenolityków i prednizonu w fazie tyreotoksykozy oraz l-tyroksyny w okresie niedoczynności tarczycy. W przypadku zapaleń infekcyjnych – bakteryjnych i grzybiczych, leczenie jest przyczynowe; polega na stosowaniu antybiotyków i drenażu ewentualnego ropnia. Słowa kluczowe: zapalenie tarczycy, ból szyi, tyreotoksykoza, hipotyreoza, wole
Summary
The term thyroiditis encompasses many variable thyroid disorders which can manifest as painful thyroid enlargement with transient thyrotoxicosis followed by hypothyroid phase. Some of the inflammatory thyroid diseases are relatively common like Hashimoto disease which occurs in about 14% of population. The others are rare or extremely rare as Riedel´s thyroiditis. Etiological factors are variable: autoimmunity, infections, radiation or drug toxicity. Thyrotoxic phase is usually short, accompanied by low thyroid 131I uptake. Then hypothyroidism occurs which can be intermittent or permanent. In diagnosis laboratory tests: erythrocyte sedimentation rate, leukocyte count, serum thyrotropin, thyroxine, anti- peroxidase antibodies are helpful as well as thyroid sonography, scintigraphy and fine-needle aspiration biopsy. The treatment is usually symptomatic. In thyrotoxic phase beta-blockers and prednisone are useful. Antithyroid drugs and radioiodine therapy are contraindicated. In the hypothyroid phase l-thyroxine should be instituted. The therapy of suppurative thyroiditis; bacterial or fungal consists of appropriate antibiotics and drainage of the abscess. Key words: thyroiditis, cervical pain, thyrotoxicosis, hypothyroidism
Charakterystyka
Zapalenie tarczycy objawia się zwykle powiększeniem gruczołu tarczowego, bólem szyi promieniującym do uszu i żuchwy oraz zaburzeniami czynności tarczycy.
Etiologia, częstość występowania
Zapalenia tarczycy mogą być spowodowane czynnikami infekcyjnymi tj. wirusy, bakterie i grzyby, autoimmunologicznymi, fizycznymi – urazem lub napromienieniem oraz toksycznymi – zapalenia polekowe.
Są chorobami rzadko występującymi; wyjątek stanowi choroba Hashimoto – definiowana dodatnim mianem a-TPO w surowicy – dotyczy około 14% dorosłej populacji.
Zgodnie z propozycją Jacksona i Cobba (1) zapalenia tarczycy można podzielić w zależności od skutków procesu zapalnego, na:
– ropne,
– nieropne,
oraz uwzględniając czas trwania na:
– ostre; toczące się przez kilka do kilkunastu dni,
– podostre; utrzymujące się od kilku tygodni do kilku miesięcy,
– przewlekłe.
Podział zapaleń tarczycy przedstawia tabela 1.
Tabela 1. Podział zapaleń tarczycy.
Podana w charakterystyce symptomatologia nie przystaje w jednakowym stopniu do wszystkich zapaleń tarczycy; jest typowa przede wszystkim dla ostrego bakteryjnego i podostrego wirusowego zapalenia gruczołu tarczowego. W zapaleniu typu Hashimoto ból jest zjawiskiem dość rzadkim. I odwrotnie; bolesność może towarzyszyć takim niezapalnym schorzeniom tarczycy jak rak, chłoniak oraz choroba Gravesa. Przyczyny bólu tarczycy w zależności od częstości występowania wymienione są w tabeli 2.
Tabela 2. Przyczyny bólu tarczycy.
Zaburzenia czynności tarczycy towarzyszące procesom zapalnym w sposób charakterystyczny manifestują się krótkotrwałą fazą tyreostoksykozy wywołaną destrukcją gruczołu tarczowego, po której następuje faza hipotyreozy a następnie restitutio ad integrum. Uderzającą cechą tyreotoksykozy wynikającej z destrukcji tarczycy jest zahamowanie jodochwytności gruczołu tarczowego. Innymi, charakterystycznymi objawami tego procesu są: wysoki stosunek T4 do T3, wysokie stężenie tyreoglobuliny (Tg) i interleukiny-6 (Il-6) w surowicy oraz zmniejszenie ukrwienia tarczycy oceniane badaniem Dopplerowskim.
Faza niedoczynności może w części przypadków mieć charakter trwały.
Typową konstelację zaburzeń czynnościowych tarczycy towarzyszących zapaleniom przedstawia rycina 1.
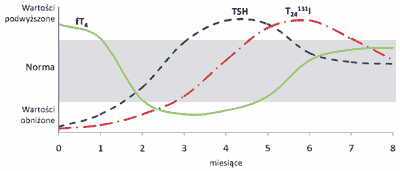 Ryc. 1. Zaburzenia czynności tarczycy w przebiegu zapalenia wirusowego, poporodowego, bezobjawowego i polekowego.
fT4 – wolna tyroksyna; TSH – hormon tyreotropowy; T24131I – jodochwytność tarczycy po 24 h. W diagnostyce zapaleń tarczycy przydatne są następujące badania:
– laboratoryjne: OB, leukocytoza ze wzorem, TSH, przeciwciała antyperoksydazowe (a-TPO),
– obrazowe: ultrasonografia z funkcją Dopplera, scyntygrafia tarczycy i test jodochwytności,
– cytologiczne: biopsja aspiracyjna cienkoigłowa kontrolowana (BACC),
– posiew bakteriologiczny.
Ogólne zasady leczenia zapaleń tarczycy przedstawia rycina 2.
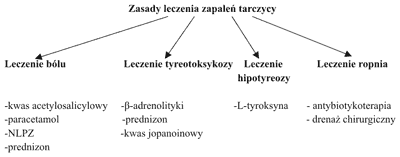 Ryc. 2. Zasady leczenia zapaleń tarczycy.
1. Nieropne zapalenia tarczycy
1.1. Ostre nieropne zapalenia tarczycy
W tej grupie największe znaczenie ze względu na częstość występowania, ma zapalenie spowodowane udarem krwotocznym guza tarczycy.
Wylew krwi do guza jest zjawiskiem częstym, ale objawy zapalne z nim związane są rzadkie i prawdopodobnie zależą od dużej objętości gwałtownie wynaczynionej krwi. Udar może dotyczyć zarówno nienowotworowego guza koloidowego, jak i rozrostów nowotworowych.
Choroba ma przebieg mało nasilony i samoograniczający. Charakterystycznymi objawami są: nagłe pojawienie się guza w obrębie szyi z towarzyszącym bólem promieniującym do uszu i żuchwy oraz gorączka. Brak jest wzmożonego ocieplenia skóry nad tarczycą i odczynu węzłowego. Udar krwotoczny nie powoduje per se zaburzeń czynności tarczycy, ale może dotyczyć również guza autonomicznego.
Największą wartość w ustaleniu rozpoznania ma ultrasonografia tarczycy, uwidaczniająca ognisko z przestrzenią płynową (ryc. 3) oraz BACC ustalająca łagodny lub złośliwy charakter guza.
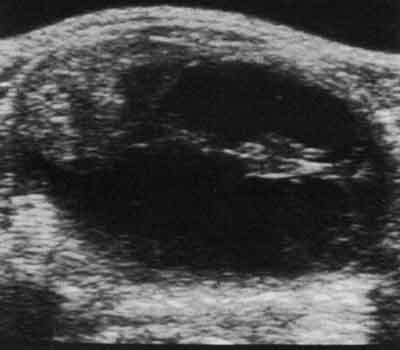 Ryc. 3. Obraz ultrasonograficzny udaru krwotocznego guza tarczycy – przekrój podłużny przez prawy płat.
Leczenie nie zawsze jest konieczne. W razie nasilonych dolegliwości można stosować kwas acetylosalicylowy w dawce 2,0-4,0 g/dobę lub paracetamol w dawce 2,0 g/dobę, ewentualnie inne niesteroidowe leki przeciwzapalne. Zmniejszenie bólu daje również aspiracja wynaczynionej krwi doprowadzająca do zmniejszenia guza.
Popromienne zapalenie tarczycy
Ten typ zapalenia ma bezpośredni związek z leczeniem radiojodem łagodnych i złośliwych chorób tarczycy lub z brachyterapią nowotworów głowy i szyi. Jest rzadkim powikłaniem wspomnianych procedur leczniczych: w Klinice Endokrynologii CMKP popromienne zapalenie tarczycy obserwowano u 2% leczonych radiojodem z powodu nadczynności tarczycy.
W ciągu kilku dni od przebytej terapii dochodzi do bolesnego obrzmienia tarczycy z charakterystycznym promieniowaniem bólu do uszu i żuchwy, któremu może towarzyszyć gorączka, duszność, dysfagia oraz objawy tyreotoksykozy, zależne od destrukcji gruczołu tarczowego.
Choroba ma zwykle przebieg mało nasilony i samoograniczający; skuteczne jest leczenie przeciwzapalne i przeciwbólowe jak w udarze krwotocznym guza. Objawy tyreotoksykozy ustępują pod wpływem β-adrenolityków zarówno selektywnych jak i propranololu. W rzadkich przypadkach nasilenie dolegliwości jest tak duże, że wymaga stosowania prednizonu w dawce 30-60 mg/dobę przez kilka dni (2).
1.2. Podostre nieropne zapalenie tarczycy
W tej grupie zapaleń znajduje się choroba de Quervaine´a, której synonimami są: podostre, ziarninowe, olbrzymiokomórkowe i psedugruźlicze zapalenie tarczycy.
Według badań amerykańskich opublikowanych w 2003 r, zapadalność na chorobę de Quervaine´a wynosi 4,9 przypadków/100 000/rok, a kobiety chorują 4-5-krotnie częściej niż mężczyźni. Typowy wiek zachorowań to 4-5 dekada życia. Nie wykazano jednoznacznie sezonowości zachorowań (3).
Etiopatogeneza
Mnogość synonimów choroby de Quervaine´a odzwierciedla ewolucję poglądów na temat jej etiologii. Obecnie wiąże się ją z infekcją wirusową spowodowaną najczęściej adenowirusami, ale także wirusem świnki, odry, grypy, Epsteina-Barra i coxackie.Do rozwoju choroby prawdopodobnie niezbędny jest defekt układu immunologicznego, którego wykładnikiem jest obecność antygenu zgodności tkankowej HLA B35.
Proces autoimmunologiczny towarzyszący podostremu zapaleniu tarczycy wydaje się być zjawiskiem wtórnym i przemijającym, nie odgrywającym istotnej roli w patogenezie choroby. Może jednak przyczyniać się do rozwoju trwałej hipotyreozy jako zejścia zapalenia. Obecność przeciwciał stymulujących receptor TSH (TSAb – Thyroid Stimulating Antibodies)stwierdzano u 7% chorych w fazie tyreotoksykozy, obecność przeciwciał blokujących receptor TSH (TBAb – Thyroid Blocking Antibodies) obserwowano u 3% w fazie wczesnej, przemijającej hipotyreozy i u 20% w fazie późnej, trwałej niedoczynności gruczołu tarczowego (3, 4).
Cechy histologiczne
Miejscowa infekcja wirusowa prowadzi do destrukcji pęcherzyków tarczycowych oraz do nacieku podścieliska przez granulocyty, limfocyty i histiocyty. Histiocyty mogą tworzyć wielojądrowe syncytia określane jako komórki olbrzymie. W efekcie powstaje charakterystyczna ziarnina, będąca w przeszłości przyczyną mylnego traktowania choroby jako gruźlicy lub sarkoidozy tarczycy.
Objawy kliniczne
Choroba de Quervaine´a manifestuje się ogólnoustrojowymi dolegliwościami typowymi dla infekcji wirusowej tj: wysoka gorączka, osłabienie, mialgia oraz miejscowymi, związanymi z tarczycą. Chorzy skarżą się na ból szyi o charakterystycznym promieniowaniu do uszu, żuchwy i górnej części klatki piersiowej oraz dysfagię. Tarczyca jest bolesna, powiększona i stwardniała. Proces zapalny może obejmować cały gruczoł tarczowy lub jeden z płatów. Nie stwierdza się wzmożonego ucieplenia skóry ani odczynu węzłowego. Wstępnej fazie choroby towarzyszy tyreotoksykoza trwająca 4-6 tygodni, zależna od destrukcji gruczołu tarczowego. U części chorych dochodzi do przejściowego wzrostu enzymów wątrobowych, co nie wymaga specyficznego leczenia.
W 30% przypadków w dalszym etapie choroby rozwija się przemijająca hipotyreoza. Podostre zapalenie tarczycy trwa przeciętnie od 6 tygodni do 6 miesięcy, opisywano jednak przypadki przeciągające się do 2 lat. U większości chorych następuje restitutio ad integrum, ale w 10-15% przypadków rozwija się trwała niedoczynność tarczycy (2, 3, 5). Nawroty choroby odnotowuje się jedynie u 1-4%, chociaż wznowa dolegliwości po zmniejszeniu dawki lub odstawieniu steroidów jest dość częsta i dotyczy 11-47% leczonych.
Do nietypowych obrazów choroby należy bezbolesny przebieg, charakteryzujący się jedynie powiększeniem i stwardnieniem tarczycy oraz przemijającymi zaburzeniami jej funkcji. Rozpoznanie podostrego zapalenia tarczycy następuje wówczas nieoczekiwanie, po wykonaniu BACC.
Rozpoznanie choroby de Quervaine´a ustala się w oparciu o typowe objawy kliniczne i wyniki badań dodatkowych:
– laboratoryjnych
– wysokie, często 3-cyfrowe OB., niecharakterystyczna leukocytoza,
– obniżone stężenie TSH i podwyższone stężenie fT4, fT3 w początkowej fazie choroby,
– podwyższone stężenie TSH i obniżone stężenie fT4 w końcowym etapie zapalenia,
– ultrasonograficznego
– powiększenie tarczycy często asymetryczne, obniżenie echogeniczności w miejscu objętym procesem zapalnym
– scyntygraficznego (rycina 4)
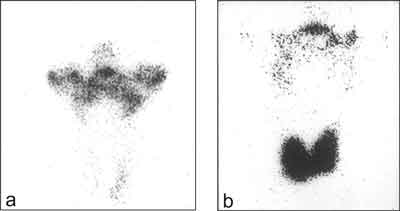 Ryc. 4. Badanie scyntygraficzne tarczycy w przypadku choroby de Quervaine´a:
a. początkowa faza choroby: brak gromadzenia 99mTc w rzucie tarczycy, wychwytywanie znacznika przez ślinianki b. faza zdrowienia: prawidłowe gromadzenie 99mTc w obrębie tarczycy – zahamowanie jodochwytności
– cytologicznego
– obecność komórek nacieku zapalnego, zwłaszcza komórek olbrzymich.
Wydaje się, że w przypadkach typowych, kiedy zapalenie obejmuje cały gruczoł tarczowy, a badanie USG wykazuje jednolite obniżenie echogeniczności, wykazanie zahamowania jodochwytności jest wystarczające dla ustalenia rozpoznania.
W przypadkach, gdy proces zapalny przebiega ogniskowo, konieczne jest wykonanie BACC celem różnicowania z ropniem lub rakiem tarczycy.
Mimo ustąpienia objawów klinicznych, normalizacji badań hormonalnych i radioizotopowych, nieprawidłowy obraz USG gruczołu tarczowego może utrzymywać się długotrwale.
Leczenie
W przypadkach o ciężkim przebiegu zalecane jest stosowanie prednizonu we wstępnej dawce 40-60 mg/dobę przez kilka dni, a następnie w dawkach podtrzymujących 5-10 mg/dobę przez przynajmniej 4 tygodnie. Reakcja na leczenie prednizonem jest natychmiastowa: u większości chorych ból szyi i gorączka ustępują przed upływem 72 godzin. Brak tego efektu nakazuje zweryfikowanie rozpoznania. Okres leczenia steroidami jest trudny do określenia z uwagi na brak przesłanek klinicznych i biochemicznych, na podstawie których leczenie można zakończyć. Nawrót dolegliwości po zmniejszeniu dawki lub odstawieniu prednizonu jest wskazaniem do kolejnej, przedłużonej kortykoterapii. Według niektórych obserwacji w grupie leczonych prednizonem odsetek trwałej hipotyreozy jest większy niż u przyjmujących NLPZ: 25% vs.10%. W interpretacji tego zjawiska należy brać pod uwagę częstsze występowanie trwałej niedoczynności tarczycy jako zejścia burzliwego procesu zapalnego.
W przypadkach przebiegających z umiarkowanym nasileniem dolegliwości można stosować salicylany, paracetamol lub inne NLPZ.
Leczenie tyreotoksykozy polega na stosowaniu β-adrenolityków lub prednizonu. Tyreostatyki i radiojod nie znajdują w tych przypadkach zastosowania. W fazie niedoczynności tarczycy stosuje się l-tyroksynę w dawce normalizującej stężenie TSH, przeciętnie 50-100 ?g/dobę przez 3-4 miesiące.
W przypadkach uporczywych nawrotów choroby podejmowana jest strumektomia lub ablacja tarczycy 131I (2, 3, 5).
1.3. Przewlekłe nieropne zapalenia tarczycy
W tej grupie zapaleń znajduje się choroba Hashimoto i wole Riedla.
Choroba Hashimoto (synonimy: przewlekłe limfocytarne zapalenie tarczycy, przewlekłe autoimmunologiczne zapalenie tarczycy) jest najczęściej występującym zapaleniem tarczycy i najczęstszą niejatrogenną przyczyną hipotyreozy.
Częstość występowania
Choroba Hashimoto z jawną klinicznie niedoczynnością tarczycy dotyczy 1% populacji.
U 14% bezobjawowych dorosłych i u 30% kobiet po 70 r.ż. stwierdza się obecność podwyższonego stężenia przeciwciał antyperoksydazowych, świadczącego o utajonym istnieniu choroby (6). Przewlekłe limfocytarne zapalenie tarczycy może występować w każdym wieku i szerokości geograficznej, ale szczególnie często dotyczy starszych kobiet z terenów o wysokiej podaży jodu.
Etiopatogeneza
Etiologia choroby Hashimoto jest autoimmunologiczna, na co wskazuje obecność nacieków limfocytarnych w tarczycy i autoprzeciwciał w surowicy skierowanych przeciwko antygenom tarczycowym. Patogeneza choroby pozostaje niejasna. Prawdopodobnie proces autoimmunologiczny zapoczątkowuje aktywizacja wewnątrztarczycowych limfocytów T typu pomocniczego (CD4+) wskutek:
– nieprawidłowego nadzoru limfocytów T supresorowych, spowodowanego ich niedoborem lub dysfunkcją,
– patologicznej ekspresji antygenów HLA klasy II na powierzchni tyreocytów, co czyni je celem ataku immunologicznego,
– miejscowej infekcji bakteryjnej Yersinia enterocolitica? Helicobacter pylori? (7, 8) wiodącej do reakcji krzyżowych z antygenem tarczycowym lub wirusowej (retrowirusy) zmieniającej antygenowość tyreocytów.
Aktywizacja limfocytów typu pomocniczego indukuje następnie odpowiedź humoralną i reakcje niszczenia tyreocytów w mechanizmie cytotoksyczności zależnej od dopełniacza lub cytotoksyczności komórkowej zależnej od przeciwciała z udziałem limfocytów zabójców. Istotną rolę w destrukcji gruczołu tarczowego odgrywa także bezpośrednie działanie limfocytów cytotoksycznych.
Badania ostatnich lat wskazują na udział zjawiska apoptozy w procesie niszczenia tarczycy.
Prawdopodobnie cytokiny produkowane przez naciekające tarczycę limfocyty aktywują układ Fas/FasL w obrębie tyreocytów wiodący do apoptozy, a jednocześnie zmniejszają aktywność czynnika Bcl-2 hamującego proces samobójczej śmierci komórki.
Głównymi autoantygenami w przebiegu choroby Hashimoto stają się: peroksydaza tarczycowa, tyreoglobulina, receptor TSH i symporter sodowo-jodowy.
Czynniki predysponujące do rozwoju przewlekłego limfocytarnego zapalenia tarczycy mają charakter genetyczny i środowiskowy. Na udział czynników genetycznych wskazują:
– obecność przeciwciał tarczycowych u 50% krewnych I stopnia,
– częstsze niż w pozostałej populacji występowanie antygenów zgodności tkankowej HLA- B8, DR3, DR5, DR2, DQ1 i polimorfizmu genu kodującego antygen-4 związany z cytotoksycznym limfocytem T (CTLA-4 – cytotoxic T lymphocyte associated antygen-4),
– oraz większa częstość występowania zaburzeń chromosomalnych – zespołu Downa, Turnera, Klinefeltera i rodzinnej postaci choroby Alzheimera. Stwierdzono, że choroba Hashimoto współistnieje z zespołem Downa w 16-28%, a z zespołem Turnera w 50% przypadków.
Wśród czynników środowiskowych wymienia się wysokie spożycie jodu, infekcje wirusowe, nikotynizm, stres i leki: amiodaron, sole litu, interferon α, interleukiny, czynnik wzrostowy granulocytów.
Cechy histologiczne
W obrazie histologicznym tarczycy stwierdza się nacieki limfocytów i plazmocytów, grudki chłonne z ośrodkami rozmnażania, zanikowe pęcherzyki ze skąpym koloidem, komórki oksyfilne oraz tkankę łączną.
Objawy kliniczne
Klasyczny opis choroby przedstawiony w 1912 r. przez Hakuru Hashimoto wskazuje na obecność wola o wzmożonej spoistości, nierównej powierzchni z obecnym płatem piramidowym i niedoczynności tarczycy. Obecnie wiadomo, że choroba Hashimoto może również przebiegać z zanikiem gruczołu tarczowego. Istotny udział patogenetyczny w rozwoju tej postaci przewlekłego limfocytarnego zapalenia tarczycy mają TBAb stwierdzane u 33% chorych. W bardzo rzadkich przypadkach wygaśnięcia ich aktywności obserwowano remisję niedoczynności tarczycy.
Choroba Hashimoto może być elementem autoimmunologicznego zespołu wielogruczołowego (APS – Autoimmune Polyglandular Syndrom) typu 1 (kandidiaza skóry i błon śluzowych, niedoczynność przytarczyc, kory nadnerczy, inne choroby z autoagresji) oraz typu 2 (autoimmunologiczna choroba tarczycy, niedoczynność kory nadnerczy, cukrzyca typu 1, inne choroby z autoagresji).
Mimo, że w większości przypadków przewlekłe limfocytarne zapalenie tarczycy prowadzi do hipotyreozy, sporadycznie rozwija się nadczynność tarczycy określana jako Hashitoxicosis.
Jej przyczyny są dwojakie:
– destrukcja gruczołu tarczowego,
– pojawienie się TSAb.
W przypadku destrukcji tarczycy tyreotoksykoza jest samoograniczająca i ma niewielkie nasilenie. Jodochwytność gruczołu tarczowego jest charakterystycznie obniżona.
W drugim przypadku nasilenie nadczynności tarczycy może być duże, a jodochwytność prawidłowa lub zwiększona.
Do bardzo rzadkich objawów choroby Hashimoto należy wytrzeszcz i ból tarczycy.
Choroba Hashimoto, niezależnie od stanu czynnościowego tarczycy, wiąże się ze zwiększoną 3-6-krotnie częstością poronień samoistnych. U 2% noworodków pochodzących od chorych matek stwierdza się wrodzoną przemijającą niedoczynność tarczycy wskutek przechodzenia przez łożysko TBAb.
Wariantami klinicznymi choroby Hashimoto są poporodowe i bezobjawowe zapalenia tarczycy.
Poporodowe zapalenie tarczycy
Poporodowe zapalenie tarczycy (PZT) jest szczególną postacią choroby Hashimoto ujawniającą się w ciągu pierwszego roku po porodzie, poronieniu samoistnym lub sztucznym u kobiet, które wcześniej były w stanie eutyreozy (9).
Częstość występowania PZT jest różnie odnotowywana na świecie; od 1% w Tajlandii do 16,7% w Wielkiej Brytanii. Ogólnie przyjmuje się, że częstość występowania choroby dotyczy 10% kobiet. PZT występuje szczególnie często w następujący grupach:
1. u kobiet z cukrzycą typu 1 – w 25% przypadków
2. u kobiet, które w I trymestrze ciąży miały dodatnie miano przeciwciał antyperoksydazowych – w 50% przypadków,
3. u kobiet, które przebyły wcześniej epizod PZT – częstość występowania choroby po kolejnym porodzie wynosi ok.70%.
W etiopatogenezie PZT rozważano udział mikrochimeryzmu płodowego, bowiem w tarczycach kobiet z autoimmunologiczną chorobą gruczołu tarczowego stwierdzano obecność komórek płodu częściej niż w grupie kontrolnej. Zjawisko mikrochimeryzmu płodowego, czyli obecności komórek płodu w tkankach i krwi obwodowej matki nawet po upływie wielu lat od porodu jest częściowo naturalną konsekwencją ciąży, ale może również inicjować proces autoimmunologiczny. Teorii powyższej nie potwierdza brak zależności pomiędzy dzietnością a częstością występowania autoimmunologicznych chorób tarczycy (10).
Wydaje się, że poporodowa manifestacja choroby Hashimoto jest związana z ustaniem immunosupresyjnego działania czynników łożyskowych i przebytym stresem porodowym.
Klinicznie choroba cechuje się występowaniem niewielkiego spoistego wola i zaburzeniami czynności tarczycy, mogącymi przybrać trzy formy:
1. niedoczynności tarczycy w 40%,
2. tyreotoksykozy związanej z destrukcją gruczołu tarczowego w 30%,
3. tyreotoksykozy z następową niedoczynnością tarczycy w 30% przypadków.
U 70% chorych zaburzenia czynności tarczycy ustępują spontanicznie w ciągu roku od ich pojawienia, ale pacjentki wymagają corocznego oznaczania stężenia TSH, bowiem trwała niedoczynność tarczycy rozwija się u 50% w ciągu kolejnych 7 lat.
U 30% kobiet z PZT hipotyreoza rozwijająca się po porodzie ma od początku charakter trwały.
Objawy PZT są trudno uchwytne; zwykle złe samopoczucie, zaburzenia nastroju, wahania masy ciała i stan wyczerpania przypisywane są szczególnej sytuacji kobiety będącej po porodzie. W ubiegłych latach sądzono, że u kobiet z PZT częściej występuje depresja, co obecnie wydaje się kontrowersyjne.
Tyreotoksykoza w przebiegu PZT wymaga różnicowania z poporodową manifestacją choroby Gravesa. Na PZT wskazują: brak wola naczyniowego, wytrzeszczu, obrzęku przedgoleniowego oraz niewielkie nasilenie tyreotoksykozy, negatywne TSAb i niska jodochwytność tarczycy wynosząca poniżej 5% po 24 godzinach. Należy zwrócić uwagę, że wykonanie scyntygrafii tarczycy z użyciem 99mTc nakazuje przerwanie karmienia piersią na 2 dni, a z wykorzystaniem 131I na 3 tygodnie. To sprawia, że badanie scyntygraficzne mimo dużej mocy różnicującej praktycznie nie znajduje zastosowania.
Bezobjawowe zapalenie tarczycy (synonimy – ciche, bezbolesne zapalenie tarczycy, silent thyroiditis, painless thyroiditis)przypomina w przebiegu klinicznym PZT, ale nie ma związku z porodem i występuje zarówno u kobiet jak i mężczyzn.
Jego częstość jest trudna do określenia. W latach 70. i 80. stwierdzano, że bezobjawowe zapalenie tarczycy było przyczyną aż 20% przypadków tyreotoksykozy w niektórych stanach USA. Obecnie choroba rozpoznawana jest rzadziej (5).
Obraz histologiczny, obecność a-TPO i a-Tg oraz większa częstość występowania antygenów zgodności tkankowej HLA DR3 są wspólne z chorobą Hashimoto. Obserwowana natomiast przez niektórych sezonowość występowania i zachorowania grupowe sugerują udział czynnika infekcyjnego.
Bezobjawowe zapalenie tarczycy charakteryzuje się obecnością niewielkiego wola o wzmożonej spoistości, bez szmeru naczyniowego. Obraz kliniczny może być dwojaki:
– tyreotoksykoza trwająca 2-10 tygodni w 60% przypadków,
– tyreotoksykoza z następową niedoczynnością tarczycy trwającą 4-10 tygodni w 40% przypadków.
Tyreotoksykoza jest zależna od destrukcji tarczycy, ma typowo niewielkie nasilenie i przebiega z niską jodochwytnością, co odróżnia ją od choroby Gravesa. Wymaga także różnicowania z nadczynnością tarczycy indukowaną jodem. Jeśli wywiady nie dostarczają pewnych informacji o stosowaniu preparatów zawierających jod (najczęściej amiodaron, krople do oczu) lub przebytych badaniach z użyciem jodowych środków kontrastowych, użyteczne jest określenie wydalania jodków w moczu dobowym lub ich stężenia w surowicy. Wydalanie jodków przekraczające 1000-1500 ?g/dl, lub ich stężenie w surowicy> 1,5 ?g/dl wskazuje na indukowaną jodem nadczynność tarczycy.
Choroba Hashimoto wiąże się z większą częstością występowania chłoniaka tarczycy (2). W badaniach szwedzkich obecność chłoniaka stwierdzono u 4 na 829 chorych (współczynnik ryzyka 67), a w obserwacji autorów japońskich jego częstość wynosiła 0,1% (współczynnik ryzyka 80).
Rozpoznanie przewlekłego limfocytarnego zapalenia tarczycy ustala się na podstawie obrazu klinicznego i wyników badań diagnostycznych:
– laboratoryjnych
– podwyższone stężenie TSH, obniżone stężenie fT4, dodatnie miano a-TPO i a-Tg,
– ultrasonograficznego
– obniżona echogeniczność tarczycy u 60-77% chorych z jawną hipotyreozą,
– cytologicznego
– obecność limfocytów, plazmocytów, komórek oksyfilnych.
W praktyce, o chorobie Hashimoto należy myśleć w każdym przypadku niedoczynności tarczycy rozwijającej się u osoby dorosłej, która nie przebyła operacji ani napromienienia tarczycy. Typowy obraz ultrasonograficzny gruczołu i dodatnie miano a-TPO są wystarczające dla rozpoznania. Ze względów ekonomicznych ocenia się jeden rodzaj przeciwciał tarczycowych, a-TPO, które są najbardziej czułym wskaźnikiem procesu autoimmunologicznego w tarczycy, dobrze korelują z intensywnością nacieków limfocytarnych w gruczole tarczowym i destrukcją tarczycy. BACC jest zarezerwowana dla przypadków trudnych diagnostycznie.
Leczenie
W przypadku niedoczynności tarczycy stosuje się l-tyroksynę w dawkach dobranych indywidualnie, normalizujących stężenie TSH. Leczenie ma najczęściej charakter całożyciowy.
Niedoczynność tarczycy towarzysząca poporodowemu i bezobjawowemu zapaleniu tarczycy jest w większości przypadków przemijająca, toteż leczenie l-tyroksyną można przerwać po 6-10 miesiącach. W odniesieniu do PZT postuluje się, aby leczenie substytucyjne włączać wówczas, gdy występują kliniczne objawy hipotyreozy, gdy kobieta planuje w niedługim czasie kolejną ciążę lub gdy stężenie TSH wynosi powyżej 10,0 mIU/l (9).
Leczenie l-tyroksyną znajduje również zastosowanie w przypadkach przebiegających z eutyreozą i dodatnim mianem a-TPO:
– u kobiet planujących ciążę lub ciężarnych; podawanie l-tyroksyny może zmniejszyć ryzyko poronienia samoistnego lub porodu przedwczesnego (11, 12),
– u pacjentów z wolem – leczenie zmniejsza wielkość tarczycy zarówno u dzieci jak i dorosłych (13).
Tyreotoksykoza towarzysząca chorobie Hashimoto jest wskazaniem do oceny jodochwytności tarczycy. Niska jodochwytność wskazuje na proces destrukcyjny i wymaga stosowania β-adrenolityków, a w przypadkach nasilonych prednizonu w dawce 40-60 mg/dobę. Tyreotoksykozę przebiegającą z prawidłową lub podwyższoną jodochwytnością, zależną od TSAb, należy leczyć β-adrenolitykami i tyreostatykami (tiamazol 20-30 mg/dobę lub propylotiouracyl 200-300 mg/dobę). W niektórych przypadkach wskazane jest leczenie radykalne – radiojodem.
Choroba Hashimoto przebiegająca z dużym wolem lub nasiloną bolesnością tarczycy może być wskazaniem do leczenia radiojodem lub strumektomii (14, 15).
W ostatnim czasie zainteresowanie budzi stosowanie selenu, pierwiastka wchodzącego w skład dejodynaz i peroksydazy glutationu. Selenoenzymy działają jako antyoksydanty i wpływają na syntezę hormonów tarczycy. Podawanie selenu w dawce 200 ?g/dobę może wpływać na obniżenie stężenia a-TPO, zmniejszenie częstości występowania PZT i ryzyka trwałej niedoczynności tarczycy w przebiegu PZT (11, 16).
Wole Riedla (synonimy: wole drewnowate, włókniste, naciekające) jest niezwykle rzadką chorobą przebiegającą z burzliwym rozplemem tkanki łącznej włóknistej w obrębie tarczycy i otaczających tkanek, prowadzącym do zrośnięcia się gruczołu tarczowego w konglomerat kamiennej twardości i stopniowej destrukcji tkanki gruczołowej.
Pierwszy opis choroby został opublikowany przez Bernharda Riedla w 1893 r.
Według doświadczenia Mayo Clinic obejmującego lata 1920-1984,choroba występowała z częstością 1/ 100 000, stanowiła 0,06% przypadków operowanych, dotyczyła 4-krotnie częściej kobiet niż mężczyzn, a typowy wiek zachorowań był pomiędzy 30-50 r.ż (17, 18).
Etiologia choroby jest nieznana. Obecność nacieków z komórek jednojądrowych w gruczole tarczowym, przeciwciał tarczycowych w surowicy, dobra reakcja na leczenie steroidami w części przypadków oraz współistnienie innych chorób z autoagresji, są podstawą koncepcji o autoimmunologicznym charakterze wola Riedla. Bardziej prawdopodobna jest hipoteza o wolu Riedla jako pierwotnej chorobie tkanki łącznej, w której dochodzi do proliferacji fibroblastów pod wpływem cytokin wydzielanych przez limfocyty B i T. Zgodnie z tą koncepcją wole Riedla jest lokalną manifestacją zespołu inwazyjnego włóknienia, który może dotyczyć także oczodołów, śródpiersia, przestrzeni zaotrzewnowej i dróg żółciowych. Według niektórych obserwacji u jednej trzeciej pacjentów z wolem Riedla w ciągu 10 lat obserwacji rozwija się kolejny element zespołu.
Cechy histologiczne
Badaniem histopatologicznym wykrywa się w obrębie tarczycy burzliwy rozplem tkanki łącznej, obecność fibroblastów, limfocytów, plazmocytów i eozynofili. Elementy tkanki tarczycowej tj: tyreocyty i koloid są skąpe. Włóknienie przekracza torebkę gruczołu i obejmuje otaczającą tkankę tłuszczową, mięśnie i naczynia krwionośne.
Klinicznie choroba manifestuje się obecnością niewielkiego wola o kamiennej twardości, któremu towarzyszy duszność, stridor, dysfagia i chrypa.
Zmiany chorobowe najczęściej dotyczą całej tarczycy, rzadziej obejmują jeden płat. Większość chorych jest w stanie eutyreozy, ale u 30% stwierdza się niedoczynność tarczycy, a u 4% tyreotoksykozę zależną od destrukcji.
U chorych z wolem Riedla obserwowano również: porażenie nerwu krtaniowego wstecznego, pierwotną niedoczynność przytarczyc z napadami tężyczki, zespół Hornera, zespół żyły głównej górnej, zapalenie przyusznic, zakrzepowe zapalenie żył szyjnych.
Konsekwencjami procesu włóknienia o innej niż szyja lokalizacji mogą być: pseudoguz oczodołu, zapalenie trzustki, wodonercze, żółtaczka cholestatyczna.
Rozpoznanie wola Riedla jest trudne; choroba wymaga różnicowania z rakiem anaplastycznym i chłoniakiem tarczycy.
Wartość OB jest prawidłowa lub przyspieszona, przeciwciała tarczycowe są obecne w 40-70% przypadków. Badanie ultrasonograficzne wykazuje obniżenie echogeniczności gruczołu, a jodochwytność tarczycy jest zahamowana. W tomografii komputerowej tarczyca ma prawidłową lub obniżoną densyjność, która wzmacnia się po podaniu kontrastu. W badaniu rezonansu magnetycznego gruczoł jest hipointensywny w obrazach T1 i T2 zależnych. TK i MR oceniają jednocześnie rozległość procesu włóknienia.
Badanie cytologiczne bywa niediagnostyczne; uzyskiwany materiał jest skąpokomórkowy, zawiera elementy tkanki łącznej, mięśni szkieletowych, fibroblasty, limfocyty i eozynofile. Podstawą rozpoznania jest biopsja chirurgiczna połączona z klinowym wycięciem cieśni.
Kryteria diagnostyczne wola Riedla sformułowane przez Woolnera i wsp. oraz Schwaegerle i wsp. (17, 18) są następujące:
1. makroskopowo widoczny proces zapalno-włóknisty obejmujący częściowo lub całkowicie tarczycę,
2. makroskopowe lub histologiczne dowody naciekania otaczających struktur,
3. brak cech choroby ziarniniakowej,
4. brak nowotworu.
W rzadkich przypadkach może nastąpić spontaniczna remisja choroby, jednak większość pacjentów wymaga intensywnego leczenia.
Leczenie
Zalecenia dotyczące leczenia opierają się na skąpym materiale klinicznym.
Istnieje zgodność, że w przypadku zajęcia całej tarczycy i występowania duszności należy przeprowadzić resekcję klinową cieśni. Rozległe wycięcie tarczycy nie jest zalecane z uwagi na trudności techniczne i duże ryzyko powikłań.
Większość autorów zaleca stosowanie steroidów jako leków pierwszego rzutu, np. prednizonu 40-100 mg/dobę wstępnie, stopniowej redukcji do dawki podtrzymującej 10 mg/dobę i kontynuowania leczenia przez okres 4-6 miesięcy. W części przypadków poprawa jest dramatyczna i następuje trwała remisja, w innych dolegliwości nawracają po przerwaniu kortykoterapii. Według większości opinii należy również niezależnie od stanu czynnościowego tarczycy stosować l-tyroksynę w dawkach supresyjnych.
Istnieją doniesienia odnośnie dobrych efektów stosowania tamoxifenu w dawce 2 x 20 mg/dobę. Postulowany korzystny wpływ tego antyestrogenu odbywa się poprzez stymulowanie syntezy TGF β ( Transforming Growth Factor-β – transformujący czynnik wzrostowy β), będącego silnym inhibitorem fibroblastów.
Polekowe zapalenia tarczycy
Wiele leków wpływa na funkcję gruczołu tarczowego oraz metabolizm i transport hormonów tarczycy, ale tylko amiodaron, interferon α i lit mogą wywołać autoimmunologiczne lub toksyczne zapalenie tarczycy.
Amiodaron
Amiodaron jest lekiem należącym do III klasy leków antyarytmicznych według Williamsa. Stosowany jest w leczeniu tachyarytmii nadkomorowych i komorowych, zapobiega również nagłym zgonom sercowym.
Jest jodową pochodną benzofuranu; w 200-miligramowej tabletce jod stanowi 75 mg, z czego w wyniku metabolizmu leku uwalnia się dziennie 7-21 mg tego pierwiastka. Jest lekiem lipofilnym; zarówno amiodaron, jak i jego metabolity kumulują się m.in. w tkance tłuszczowej, mięśniach szkieletowych, mięśniu sercowym i tyreocytach (2).
Mechanizm oddziaływania amiodaronu na tarczycę, oś przysadkowo-tarczycową i metabolizm hormonów tarczycy jest bardzo złożony. Dla potrzeb tego omówienia należy wspomnieć o proimmunogennym i prozapalnym działaniu preparatu w wyniku:
– uwalniania nadmiaru jodu, co sprzyja rozwojowi autoimmunologicznych chorób tarczycy, wywołuje niedoczynność tarczycy u osób z zaburzonym mechanizmem ucieczki od efektu Wolffa- Chaikoffa ( escape fenomenon) oraz w następstwie indukowania procesu apoptozy tyreocytów,
– toksycznego działania amiodaronu i jego metabolitu – mono-N-desethyloamiodaronu (MDEA) w wyniku trwałego związania z fosfolipidami lizosomów i indukowania apoptozy.
Zaburzenia czynności tarczycy występują u 20% leczonych amiodaronem; w trakcie jego stosowania lub po upływie kilku-kilkunastu miesięcy po odstawieniu leku.
Nadczynność tarczycy indukowana amiodaronem
Występuje głównie na obszarach niedoboru jodu (Europa), 3-krotnie częściej u mężczyzn. Rozwija się przeciętnie po 2-3 latach przyjmowania amiodaronu, rzadziej wkrótce po rozpoczęciu leczenia lub po jego zakończeniu.
Klinicznie manifestuje się przede wszystkim objawami zespołu tarczycowo-sercowego pod postacią tachyarytmii komorowych i nadkomorowych, nasilenia stenokardii lub zastoinowej niewydolności krążenia.
Wyróżnia się 2 zasadnicze postaci nadczynności tarczycy indukowanej amiodaronem (19):
– typ I – przebiega z nadprodukcją hormonów tarczycy spowodowaną rozwojem choroby Gravesa lub wola guzowatego nadczynnego w wyniku nadmiernej podaży jodu,
– typ II – przebiega z tyreotoksykozą wywołaną destrukcją w następstwie toksycznego działania amiodaronu i MDEA.
Tabela 3 zawiera podział, cechy charakterystyczne i sposób leczenia obu typów nadczynności tarczycy indukowanej amiodaronem.
Tabela 3. Nadczynność tarczycy indukowana amiodaronem; podział, charakterystyka, leczenie.
* - a-TPO – przeciwciała antyperoksydazowe
** - T24131I – wychwyt 131I po 24 h. Typ III nadczynności tarczycy wywołanej amiodaronem ma charakter mieszany, łączy cechy obu powyższych, zarówno hipermetabolizmu jak i destrukcji gruczołu tarczowego.
W jego leczeniu stosuje się zarówno wysokie dawki tyreostatyków, nadchloran potasu jak i steroidy.
Istniejąca przed leczeniem lub wywołana amiodaronem nadczynność tarczycy jest przeciwwskazaniem do podawania leku. W typie II nadczynności, po ustąpieniu objawów tyreotoksykozy leczenie amiodaronem można przywrócić; nawroty zaburzeń czynności tarczycy są w tej grupie niezwykle rzadkie.
Niedoczynność tarczycy indukowana amiodaronem
Występuje częściej na terenach dostatecznej lub dużej podaży jodu (USA, Japonia), u osób powyżej 60 r.ż., 1,5-krotnie częściej u kobiet. Czynnikiem ryzyka jest dodatnie miano a-TPO. Rozwija się wcześnie po wdrożeniu leczenia antyarytmicznego i przybiera typowe objawy hipotyreozy. Odstawienie amiodaronu może spowodować spontaniczną remisję niedoczynności tarczycy. Zwykle jednak zachodzi konieczność kontynuowania leczenia i wówczas należy stosować l-tyroksynę według ogólnych zasad, uwzględniających fakt, że pacjenci należą do grupy ryzyka kardiologicznego. Z uwagi na zaburzoną konwersję T4 do T3 wywołaną amiodaronem, docelowe dawki l-tyroksyny są z reguły wysokie i wynoszą 100-150 ?g/dobę.
Duża częstość występowania zaburzeń czynności tarczycy w następstwie leczenia amiodaronem nakazuje przeprowadzenie u każdego pacjenta badań wstępnych, obejmujących ocenę stężenia TSH, fT4, fT3 i a-TPO w surowicy oraz ultrasonografię gruczołu tarczowego.
W trakcie leczenia należy kontrolować stężenie TSH, fT4 i fT3 co 6 miesięcy lub częściej w razie wystąpienia nieprawidłowości.
Niedoczynność tarczycy istniejąca przed leczeniem antyarytmicznym lub rozwijająca się pod jego wpływem nie wymaga odstawienia amiodaronu.
Obecnie trwają prace nad wprowadzeniem nowego leku antyarytmicznego – dronedaronu, pochodnej amiodaronu nie zawierającej jodu i pozbawionej jego toksycznego działania.
Interferon α
Interferon α (INF α) jest cytokiną wytwarzaną przez monocyty, limfocyty i makrofagi, mającą działanie przeciwwirusowe, przeciwnowotworowe i immunomodulujące.
Przeciwwirusowe właściwości INF α polegają na hamowaniu wnikania wirusa do komórki, blokowaniu enzymów litycznych otoczki, hamowaniu translacji kwasów nukleinowych i uniemożliwianiu scalania elementów wirusa. Działanie immunomodulujące i przeciwnowotworowe odbywa się przez pobudzanie aktywności komórek efektorowych układu immunologicznego i nasilanie ekspresji antygenów powierzchniowych komórek nowotworowych.
Dzięki tym właściwościom INF α jako monoterapia lub w skojarzeniu z rybawiryną znalazł zastosowanie w leczeniu przewlekłych aktywnych zapaleń wirusowych wątroby typu B, C i D. Jest również stosowany jako monoterapia i w skojarzeniu z interleukiną-2 (Il-2) w leczeniu paliatywnym niektórych nowotworów, m.in.: raka sutka, guzów neuroendokrynnych, białaczki kosmatokomórkowej, przewlekłej białaczki szpikowej, szpiczaka mnogiego, chłoniaka typu non-Hodgkin.
Dostępne w lecznictwie preparaty INF α są produktami naturalnymi uzyskiwanymi z hodowli stymulowanych ludzkich leukocytów lub rekombinowanymi, wytwarzanymi metodami inżynierii genetycznej.
INF α może wywierać szereg działań ubocznych, między innymi zaburzać czynność tarczycy.
Wpływ na tarczycę odbywa się poprzez 2 mechanizmy:
1. indukowania autoimmunologicznych chorób gruczołu tarczowego u osób predysponowanych genetycznie wskutek nasilenia na powierzchni tyreocytów antygenów zgodności tkankowej klasy I i nieprawidłowej ekspresji antygenów klasy II.
2. bezpośredniego cytotoksycznego działania INF α na tyreocyty.
Częstość występowania zaburzeń czynności tarczycy pod wpływem INF α jest różna; od 0 do 38%, średnio 15%. Mogą ujawniać się po upływie 1,5-23 miesięcy od rozpoczęcia leczenia; w trakcie jego trwania lub po zakończeniu. Grupę ryzyka stanowią kobiety, przebyta autoimmunologiczna choroba tarczycy, obecność choroby nowotworowej, wirusowego zapalenia wątroby typu C, dodatnie miano przeciwciał tarczycowych, duże dawki leku oraz terapia skojarzona z IL-2 i rybawiryną (20, 21).
Charakter obserwowanych zaburzeń czynności tarczycy jest następujący:
1. niedoczynność tarczycy w 62% przypadków,
2. bezobjawowe zapalenie tarczycy ( silent thyroiditis) w 16%,
3. nadczynność tarczycy w 22%
– choroba Gravesa w 11%
– destrukcyjne toksyczne zapalenie tarczycy w 11%.
Opisywano przypadki, w których choroba tarczycy rozpoczęła się hipotyreozą, a następnie rozwinęła się nadczynność gruczołu tarczowego, co należy tłumaczyć zmiennym, okresowym występowaniem TBAb i TSAb.
Charakter zaburzeń czynności tarczycy jest przemijający: u ponad 50% chorych ustępują po przerwaniu leczenia INF α, ale opisywano przypadki niedoczynności trwającej 3,5-4,5 roku. Wczesne rozpoznanie kliniczne zaburzeń czynności tarczycy jest niełatwe, bowiem do działań ubocznych INF α należą także: uczucie zmęczenia, wypadanie włosów, biegunki, chudnięcie, bóle mięśniowe, zaburzenia nastroju i psychozy. Stąd istotna rola okresowych oznaczeń TSH i fT4 w surowicy.
Istotnym problemem terapeutycznym jest nadczynność tarczycy. Należy w tych przypadkach określić jej mechanizm poprzez ocenę jodochwytności. Niska jodochwytność gruczołu tarczowego poniżej 5% po 24 godzinach wskazuje na bezobjawowe lub toksyczne zapalenie tarczycy; jest wskazaniem do stosowania β-adrenolityków i ewentualnie glikokortykoidów. Przerwanie leczenia INF α nie jest konieczne.
Prawidłowa lub zwiększona jodochwytność tarczycy jest charakterystyczna dla choroby Gravesa: znaczne nasilenie nadczynności stanowi uzasadnienie do przerwania leczenia INF α i podania tyreostatyków. W razie niewielkiej hipertyreozy należy stosować tyreostatyki i kontynuować terapię INF α. Mimo potencjalnego ryzyka stosowania leków przeciwtarczycowych w tych przypadkach, wynikającego z istniejącej choroby wątroby lub szpiku, wyniki leczenia tyreostatycznego są dobre. Alternatywą jest podanie radiojodu.
Niedoczynność tarczycy rozwijająca się pod wpływem INF α nie wymaga odstawienia leku. Należy wówczas podawać l-tyroksynę według ogólnie przyjętych zasad i podjąć próbę odstawienia po zakończeniu leczenia INF α.
Podobnie jak w przypadku amiodaronu, przed przystąpieniem do terapii INF α należy wstępnie oznaczyć stężenie TSH, fT4, fT3 i a-TPO w surowicy i wykonywać badania kontrolne co 6 miesięcy.
Węglan litu
Łac. Lithium carbonicum jest lekiem stosowanym w profilaktyce choroby afektywnej dwubiegunowej i charakteryzującym się wysoką skutecznością. Mechanizm działania terapeutycznego polega m.in. na blokowaniu zwrotnym wychwytu noradrenaliny i dopaminy w centralnym układzie nerwowym.
Ma szereg działań ubocznych, w tym również w odniesieniu do gruczołu tarczowego:
– hamuje syntezę hormonów tarczycy wskutek blokowania sprzęgania reszt tyrozynowych do monojodo- i dwujodotyronin,
– hamuje sekrecję hormonów tarczycy,
– zwiększa wewnątrztarczycowe zasoby jodu.
Wymienione działania leku mogą być jego zaletą: jako tyreostatyk lit znalazł zastosowanie w leczeniu wybranych przypadków nadczynności tarczycy. Mając właściwości wydłużania retencji jodu w tarczycy jest wykorzystywany jako uzupełnienie terapii 131-I łagodnych i złośliwych chorób gruczołu tarczowego.
Niekorzystne aspekty leczenia litem są następujące:
– rozwój wola obojętnego wskutek wzrostu stężenia TSH spowodowanego hamowaniem syntezy i wydzielania hormonów tarczycy,
– hipotyreoza, mechanizm jak wyżej,
– przewlekłe limfocytarne zapalenie tarczycy, prawdopodobnie spowodowane zwiększeniem wewnątrztarczycowych zasobów jodu,
– tyreotoksykoza związana z destrukcyjnym zapaleniem tarczycy.
Częstość występowania powyższych zaburzeń jest trudna do określenia.
Tyreotoksykoza ustępuje po odstawieniu litu.
W przypadkach hipotyreozy oraz wola należy podawać l-tyroksynę według ogólnych zasad bez konieczności odstawiania litu.
2. Ropne zapalenia tarczycy
Ropne zapalenia tarczycy występują niezwykle rzadko. Tarczycę chronią przed zakażeniem bakteryjnym bądź grzybiczym następujące czynniki: bardzo dobre ukrwienie, duża koncentracja działającego antyseptycznie jodu i bariera mechaniczna w postaci torebki łącznotkankowej.
2.1. Ostre ropne zapalenia tarczycy
Etiologia
Czynnikiem etiologicznym mogą być: Staphylococcus aureus, Streptococcus pyogenes, Pneumococcus,beztlenowce, pałeczki z grupy Salmonella i Escherichia coli. U chorych na AIDS czynnikiem patogennym może być Pneumocystis carinii.
Zakażenie szerzy się najczęściej drogą krwiopochodną, rzadziej przez ciągłość. Może być efektem jatrogennym, np. powikłaniem przezskórnych aspiracji zawartości torbieli lub wstrzyknięć etanolu do guzków tarczycy. Ostre bakteryjne zapalenie tarczycy u dzieci i młodzieży, oraz nawracające epizody u dorosłych mogą być wynikiem zaburzeń rozwojowych; przetrwałego przewodu tarczowo-językowego lub przetoki zachyłka gruszkowatego i szerzenia się beztlenowców z jamy ustnej do gruczołu tarczowego.
Objawy kliniczne
Proces zapalny dotyczy przeważnie osób z istniejącym wcześniej wolem i rozwija się zazwyczaj miejscowo. Choroba manifestuje się gorączką, rozwojem bolesnego guza w obrębie tarczycy z charakterystycznym promieniowaniem bólu do uszu, żuchwy i potylicy. W części przypadków występuje także chrypa i dysfagia. Guz początkowo jest twardy, ale po utworzeniu ropnia pojawia się objaw chełbotanie. Charakterystyczną cechą ostrego ropnego zapalenia tarczycy jest wzmożone ocieplenie i zaczerwienienie skóry, powiększenie regionalnych węzłów chłonnych i prawidłowo zachowana funkcja tarczycy.
W przypadkach zaniedbanych dochodzi do wytworzenia przetoki skórnej, a bardzo rzadko przetoki wewnętrznej – przełykowej lub tchawiczej.
W ustaleniu rozpoznania przydatne są wyniki następujących badań:
– laboratoryjnych
– umiarkowanie przyspieszone OB, zwiększona leukocytoza z przesunięciem w lewo,
– prawidłowe stężenie TSH i fT4,
– ultrasonograficznego (patrz rycina 5)
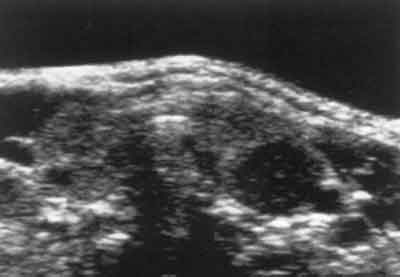 Ryc. 5. Badanie ultrasonograficzne tarczycy w przypadku ropnia lewego płata: ognisko hipoechogeniczne.
– ognisko o obniżonej echogeniczności w miejscu ropnia,
– scyntygraficznego (patrz rycina 6)
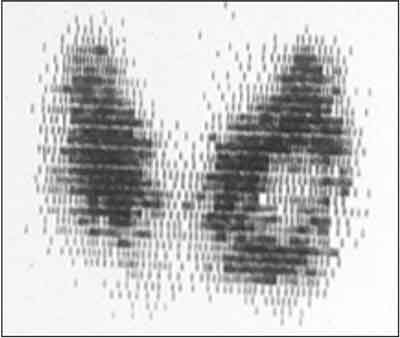 Ryc. 6. Badanie scyntygraficzne tarczycy w przypadku ropnia lewego płata tarczycy: guz zimny w miejscu ropnia, prawidłowe gromadzenie znacznika w pozostałym miąższu tarczycy.
– guz zimny w miejscu zapalenia,
– cytologicznego
– obecność granulocytów obojętnochłonnych, krwi i włóknika.
Spośród wymienionych badań największe znaczenie ma BACC pozwalająca ustalić jednoznaczną diagnozę w ciągu kilkunastu minut. W trakcie wykonywania BACC należy jednocześnie pobrać materiał do posiewu bakteriologicznego uwzględniającego beztlenowce i określić antybiotykowrażliwość.
Leczenie
Leczenie ostrego bakteryjnego zapalenia tarczycy powinno się odbywać w warunkach szpitalnych. Zasadą postępowania jest stosowanie antybiotyków o szerokim spektrum działania, uwzględniając fakt, że najczęstszym czynnikiem etiologicznym są gronkowce. Zaleca się zatem antybiotyk przeciwgronkowcowy: kloksacylinę lub nafcylinę w połączeniu z gentamicyną albo cefalosporyną III generacji. W przypadkach podejrzenia infekcji beztlenowcami wskazana jest klindamycyna. Jeśli doszło do uformowania ropnia konieczny jest drenaż chirurgiczny.
U ludzi młodych lub w razie nawrotowości choroby wskazana jest diagnostyka obrazowa w kierunku zaburzeń rozwojowych – przetrwałego przewodu tarczowo-językowego lub przetoki zachyłka gruszkowatego. Należy wykonać badanie radiologiczne z barytem górnego odcinka przewodu pokarmowego, ewentualnie usg, CT lub MR szyi. W razie potwierdzenia konieczne jest wycięcie chirurgiczne przetoki lub cysty po wyleczeniu stanu zapalnego tarczycy (2, 5).
2.2. Podostre i przewlekłe ropne zapalenia tarczycy
Etiologia
Choroby te występują rzadko. Mogą mieć etiologię gruźliczą, kiłową lub grzybiczą. Zakażenia grzybicze wywołane są najczęściej przez Aspergillus species, Coccidioides species, Histoplasma capsulatum oraz Candida albicans i dotyczą wyłącznie osób z ciężkim upośledzeniem odporności: chorych na AIDS, choroby rozrostowe układu limforetikularnego, leczonych steroidami i innymi lekami immunosupresyjnymi.
Objawy kliniczne
Przebieg choroby jest powolny i bezbolesny; zwykle dochodzi do rozwoju wola. Czynność tarczycy może być prawidłowa, w części przypadków rozwija się hipotyreoza.
Rozpoznanie
W ustaleniu rozpoznania największe znaczenie ma BACC, wskazująca na proces zapalny i posiew materiału pozwalający ustalić czynnik zakaźny: bakteryjny lub grzybiczy.
Leczenie
Leczenie ma charakter zachowawczy: przeciwprątkowy, przeciwkiłowy i przeciwgrzybiczny.
Szczegółowy algorytm postępowania w zapaleniach tarczycy przedstawiony jest na rycinie 7.
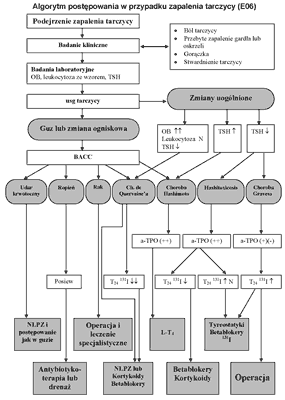 Ryc. 7. Algorytm postępowania w zapaleniach tarczycy (22). Piśmiennictwo
1. Jackson I, Cobb W: Disorders of the Thyroid. [in]: Clinical Endocrinology, edited by P.O. Kohler. A Wiley Medical Publication, New York, 1986, p.73.
2. Gietka-Czernel M, Jastrzębska H: Rozpoznawanie i leczenie chorób tarczycy. Ośrodek Informacji Naukowej Polfa Sp. zo.o. Warszawa 2002.
3. Fatourechi V, et al.: Clinical Features and Outcome of Subacute Thyroiditis In an Incidence Kohort: Olmsted County, Minnesota, Study. J. Clin. Endocrinol. Metab., 2003; 88: 2100-2105.
4. Iitaka M, et al.: TSH receptor antibody-associated thyroid dysfunction following subacute thyroiditis. Clin. Endocrinol., 1998; 48: 445-453.
5. Braverman L, Utiger R: Werner and Ingbar´s: The Thyroid. Lippincott-Raven, Philadelphia 1966.
6. Pierce E, et al.: Thyroiditis. N. Engl. J. Med., 2003; 348: 2646-55.
7. Centanni M, et al.: Thyroxine In Goiter, Helicobacter pylori Infection, and Chronic Gastritis. N. Engl. J. Med., 2006; 354:1787-95.
8. Larizza D, et al.: Helicobacter pylori Infection and Autoimmune Thyroid Disease in Young Patients: The Disadvantage of Carrying the Human Leukocyte Antigen-DRB1 0301 Allele. J. Clin. Endocrinol. Metab., 2006; 91: 176-179.
9. Abalovich M, et al.: Management of Thyroid Dysfunction during Pregnancy and Postpartum: An Endocrine Society Clinical Practice Guideline. J. Clin.Endocrinol. Metab., 2007; 92: S1-S47.
10. Walsh J, et al.: Parity and the Risk of Autoimmune Thyroid Disease: A Community-Based Study. J. Clin. Endocrinol. Metab., 2005; 90: 5309-5312.
11. Negro R, et al.: The Influence of Selenium Supplementation on Postpartum Thyroid Status in Pregnant Women with Thyroid Peroxidase Autoantibodies. J. Clin. Endocrinol. Metab., 2007; 92: 1263-1268.
12. Glinoer D: Miscarriage In Women with Positive Anti-TPO Antibodies: Is Thyroxine the Answer? J. Clin. Endocrinol. Metab., 2006; 91: 2500-2502.
13. Svensson J, et al.: Levothyroxine Treatment Reduces Thyroid Size in Children and Adolescens with Chronic Autoimmune Thyroiditis. J. Clin. Endocrinol. Metab., 2006; 91: 1729-1734.
14. Kon Y, DeGroot L: Painful Hashimoto´s Thyroiditis as an Indication for Thyroidectomy: Clinical Characteristics and Outcome in Seven Patients. J. Clin. Endocrinol.Metab., 2003; 88: 2667-2672.
15. Tajiri J: Radioactive Iodine Therapy for Goitrous Hashimoto´s Thyroiditis. J. Clin. Endocrinol. Metab., 2006; 91: 4497-4500.
16. Gartner R, et al.: Selenium Supplementation in Patients with Autoimmune Thyroiditis Decreases Thyroid Peroxidase Antibodies Concentrations. J. Clin. Endocrinol. Metab., 2002; 87: 1687-1691.
17. Lo J, et al.: Riedel´s thyroiditis presenting with hypothyroidism and hypoparathyroidism: dramatic response to glucocorticoid and thyroxine therapy. Clin. Endocrinol., 1998; 48: 815-818.
18. Yasmeen T, et al.: Riedel´s Thyroiditis: Report of a Case Complicated by Sontaneous Hypoparathyrodism, Recurrent Laryngeal Nerve Injury, and Horner´s Syndrome. J. Clin. Endocrinol. Metab., 2002; 87: 3543-3547.
19. Bogazzi F, et al.: Treatment of Type II Amiodarone-Induced Thyrotoxicosis by Either Iopanoic Acid or Glucocorticoids: A Prospective, Randomized Study. J. Clin. Endocrinol. Metab., 2003; 88: 1999-2002.
20. Carella C, et al.: Interferon-α Related Thyroid Disease: Pathophysiological, Epidemiological, and Clinical Aspects. J. Clin. Endocrinol. Metab., 2004; 89: 3656-3661.
21. Mazziotti G, et al.: Innate and Acquired Immune System in Patients Developing Interferon-α-Related Autoimmune Thyroiditis: A Prospective Study. J. Clin. Endocrinol. Metab., 2005; 90: 4138-4144.
22. Gietka-Czernel M: Algorytm postępowania w zapaleniu tarczycy i procedury diagnostyczno-terapeutyczne. W: Standardy Endokrynologii (red. Zgliczyński S. Zgliczyński W.) StudioPin Warszawa, wyd. II, 2002 r. oraz Endokrynol. Pol., 2003; 54(3).
otrzymano/received: 2007-11-28 zaakceptowano/accepted: 2007-12-29 Adres/address: *Małgorzata Godziejewska-Zawada Klinika Endokrynologii CMKP Szpital Bielański ul. Cegłowska 80, 01-809 Warszawa tel.: (0-22) 56 90 302, tel./fax: (0-22) 834 31 31 e-mail: klinendo@cmkp.edu.pl Pełna wersja artykułu Postępy w rozpoznawaniu i leczeniu zapaleń tarczycy dostępna w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








