|
© Borgis - Postępy Nauk Medycznych 11, s. 819-825
*Lucyna Papierska, Karolina Nowak
Morfologiczne i czynnościowe obrazowanie nadnerczy
Morphological and functional imaging of adrenal glands
Klinika Endokrynologii, Centrum Medyczne Kształcenia Podyplomowego, Szpital Bielański, Warszawa
Kierownik: prof. dr hab. med. Wojciech Zgliczyński Streszczenie
W artykule przedstawiamy krótki przegląd dostępnych technik stosowanych w obrazowaniu nadnerczy oraz omawiamy podstawowe cechy obrazowe pozwalające na odróżnienie zmian złośliwych od łagodnych. Badanie ultrasonograficzne nadaje się jedynie do wstępnej oceny gruczołów nadnerczowych i nie może pozostać jedynym badaniem w przypadku stwierdzenia zmian ogniskowych. Najczęściej stosowana i najbardziej przydatna w obrazowaniu guzów nadnerczy jest tomografia komputerowa (TK), w której można ocenić tak zwany fenotyp obrazowy guza (łagodny lub podejrzany). Najważniejszym elementem opisu badania TK jest ocena współczynnika osłabienia promieniowania rentgenowskiego, czyli tak zwanej densyjności. Guz nadnercza o łagodnym fenotypie obrazowym to guz o niskiej densyjności (< 10 HU) – oznacza ona, że zmiana zawiera znaczny odsetek lipidów i jest bogatolipidowym gruczolakiem albo myelolipoma. W przypadkach guzów o wyższej densyjności konieczne jest rozszerzenie oceny o badanie po dożylnym podaniu środka kontrastującego. Umiarkowane wzmocnienie, z następowym szybkim wypłukiwaniem kontrastu cechuje łagodne ubogolipidowe gruczolaki, brak wzmocnienia jest charakterystyczny dla (również łagodnych) torbieli. Obrazowanie rezonansu magnetycznego jest stosowane w przypadkach, gdy za pomocą TK nie udaje się określić charakteru guza. Metoda ta, obrazując dokładnie lipidy wewnątrzkomórkowe, pomaga w różnicowaniu raka kory nadnerczy (śladowa zawartość lipidów) od guzów chromochłonnych lub przerzutów (nie zawierają lipidów). Badania scyntygraficzne mają charakter czynnościowy – posługując się specyficznymi znacznikami, możemy określić charakter i tempo przemian metabolicznych zachodzących w guzie lub obecność w nim specyficznych receptorów. Słowa kluczowe: nadnercza, USG nadnerczy, TK nadnerczy, MR nadnerczy, scyntygrafia nadnerczy
Summary
In this article we present a short review of available techniques used in adrenal imaging and discuss basal imaging features enabling differentiation between malignant and benign lesions. Ultrasound examination is usable only for preliminary assessment of adrenal glands and it can’t be used alone when focal lesions are found. The most often used and the most useful method for assessment of adrenal lesions is computed tomography (CT), in which so called imaging phenotype of tumor can be assessed (benign or suspicious). The evaluation of the radiation attenuation coefficient, i.e. so-called density, is the most important element of the description of CT scans of the tumor. A tumour with a benign imaging phenotype has a low density (≤ 10 HU) – it means that the lipids percentage in it is high and the lesion is lipid-rich adenoma or myelolipoma. In the tumors with higher density further assessment after intravenous administration of contrast medium is necessary. A moderate enhancement, followed by a rapid contrast medium washout from the tumour occurs in benign adenomas, lack of enhancement is typical for also benign cysts. Magnetic resonance imaging is used in cases when in CT the character of tumor can’t be evaluated. This method, showing accurately intracellular lipids, may help distinguishing adrenal carcinomas (trace amount of lipids) from phaeochromocytomas or metastases (no lipids at all). Scintigrapic methods are functional – using the specific tracers we can assess the character and rate of metabolic processes in tumor or presence of specific receptors in it. Key words: adrenal glands, adrenal ultrasonography, adrenal CT, adrenal MRI, adrenal scintigraphy
Wstęp
Nadnercza to dwa symetryczne narządy położone zaotrzewnowo nad górnymi biegunami nerek. Mają kształt litery V lub Y, można w nich wyróżnić trzon i dwie odnogi – boczną i przyśrodkową. Rozmiary nadnerczy bardzo duże u płodu i noworodka (w II trymestrze przewyższają rozmiary nerek), zmniejszają się w pierwszych 12 miesiącach życia. U człowieka dorosłego długość nadnerczy to 2-5 cm, a grubość ich odnóg sięga aż 6-10 mm (1). Większość chorób nadnerczy przebiega z ich powiększeniem lub pojawieniem się w nich zmian ogniskowych, a w autoimmunizacyjnym zapaleniu kory nadnerczy (adrenalitis), prowadzącym do ich pierwotnej niedoczynności, gruczoły zmniejszają się (2).
Badaniami służącymi do oceny morfologii nadnerczy są: ultrasonografia, tomografia komputerowa oraz obrazowanie rezonansu magnetycznego. Na podstawie obrazów uzyskanych tymi metodami możemy jedynie domniemywać o charakterze, a więc w tym czynności hormonalnej zmian ogniskowych stwierdzonych w nadnerczach. Badania scyntygraficzne natomiast (z obrazowaniem metodą planarną lub SPECT) można określić mianem badań „czynnościowych” (w przypadkach gdy obrazowanie zależy od szlaków metabolicznych, jak np. w badaniu znakowanym norcholesterolem) oraz badań „receptorowych” (jeżeli wychwyt zależy od obecności receptorów, np. somatostatynowych w badaniu znakowanym tektreotydem). Poniżej omówimy poszczególne badania wykorzystywane do diagnostyki obrazowej i czynnościowej nadnerczy, a przy tym przedstawimy przegląd najbardziej charakterystycznych cech stwierdzanych w poszczególnych chorobach nadnerczy w najczęściej wykonywanych badaniach obrazowych.
Badanie ultrasonograficzne (USG)
Zdrowe nadnercza u człowieka dorosłego mogą być niewidoczne w badaniu USG. Łatwiejsze do zobrazowania jest nadnercze prawe – dzięki bezpośredniemu sąsiedztwu prawego płata wątroby, który stanowi „okno akustyczne” ułatwiające badanie. Lewe nadnercze może zostać przysłonięte przez powietrze zawarte w żołądku i stąd jest trudniejsze do zobrazowania (z reguły bada się je przez przestrzenie międzyżebrowe). Można je natomiast uwidocznić przy okazji ultrasonografii przezprzełykowej (EUS), podczas gdy prawe nadnercze jest wykrywane jedynie w 30-40% EUS (1). W badaniu USG trudno jest wykryć zmiany o średnicy poniżej 1,5 cm, ale już wobec guzów o średnicy 2 cm czułość metody wynosi ponad 90% (3, 4). W badaniu ultrasonograficznym można uwidocznić zwapnienia, ogniska martwicy i torbiele. Ogniska martwicy i zwapnienia występują częściej w guzach złośliwych i chromochłonnych; podejrzane o złośliwość są poza tym zmiany o nieregularnym kształcie. „Czujność onkologiczną” powinny budzić też duże rozmiary guza: w przypadkowo wykrytych guzach nadnercza o średnicy mniejszej niż 4 cm stwierdza się około 2% przypadków raka, w guzach 4-6 cm już 6%. 90% raków nadnercza ma średnicę powyżej 4 cm. Z drugiej strony jedynie co czwarty guz o średnicy większej niż 6 cm jest rakiem nadnercza (5-7). Należy też pamiętać o tym, że każdy nowotwór złośliwy w swojej „historii naturalnej” był na początku zmianą o małych rozmiarach. Dążąc do jak najwcześniejszego wykrycia i leczenia raka nadnerczy, nie możemy więc, nawet w przypadku wykrycia bardzo małego guza, poprzestać na badaniu USG, które nie różnicuje zmian złośliwych od łagodnych.
Badaniami uzupełniającymi w stosunku do klasycznej ultrasonografii mogą być: badanie dopplerowskie, USG 3D oraz badanie ultrasonograficzne z użyciem środka kontrastującego. Badanie metodą Dopplera pozwala na uwidocznienie przepływu krwi w guzach nadnercza – ma to znaczenie w diagnostyce guzów nowotworowych, które mogą wykazywać patologiczne unaczynienie. Obrazowanie naczyń poprawia ponadto zastosowanie środków kontrastujących. Powyższe metody jednak również nie pozwalają na pewne zróżnicowanie zmian łagodnych i złośliwych (8). Do tego celu najbardziej przydatnym badaniem jest radiologiczna tomografia komputerowa.
Tomografia komputerowa (TK)
W obrazach TK prawe nadnercze uwidacznia się do tyłu od żyły głównej dolnej i przyśrodkowo do prawego płata wątroby. Lewe nadnercze położone jest bocznie od aorty, za trzustką i żyłą śledzionową. Mimo swojej nazwy gruczoły nie zawsze zlokalizowane są nad górnymi biegunami nerek, zdarza się, że stwierdzamy je (częściej lewe) do przodu od nich. W przypadku aplazji lub ektopowego położenia nerek nadnercza rozwijają się prawidłowo i z reguły można je odnaleźć w typowej lokalizacji (9).
Stosując w TK warstwy co 3-5 mm, można w nadnerczach uwidocznić zmiany ogniskowe o średnicy już od 5 mm. Parametrami „jakościowymi” ocenianymi w badaniu TK są: kształt nadnerczy bądź obecnego w nich guza, charakter granic zmiany ogniskowej i jej homogenność. Podobnie jak w badaniu USG, można uwidocznić zwapnienia i ogniska rozpadu w guzie. Parametry „ilościowe” to wymiary nadnerczy, stwierdzonego guza oraz tak zwana densyjność – czyli współczynnik osłabienia promieniowania rentgenowskiego, mierzony w jednostkach Hounsfielda (jH; HU).
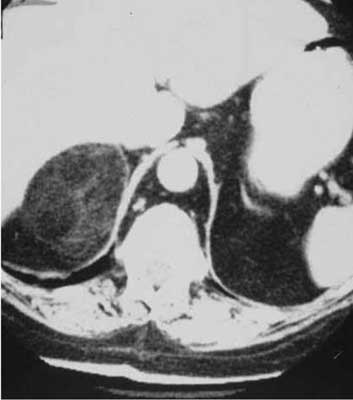
Jak już wspomniano we wstępie, nadnercza są położone zaotrzewnowo, mają kształt litery V lub Y i można w nich wyróżnić trzon i dwie odnogi (ryc. 1). Duża zmienność osobnicza długości (2-5 cm) i grubości (6-10 mm) odnóg powoduje, że przy pierwszym badaniu CT z reguły trudno jest określić, czy nadnercza się zmniejszyły, czego można by oczekiwać w przypadku choroby Addisona o podłożu autoimmunizacyjnym. Według niektórych autorów w niedoczynności nadnerczy na podłożu adrenalitis można opisać atroficzne, cienkie nadnercza o zwiększonej densyjności (2, 10, 11). Z kolei równomiernie powiększone (najczęściej pogrubiałe) obustronnie nadnercza bez obecności ewidentnych guzów opisywane są we wrodzonym przeroście kory nadnerczy i chorobach spichrzeniowych (choroba Niemanna-Picka, ksantomatozy). Taki obraz może dawać również naciek w chorobach zapalnych, na przykład sarkoidozie (11). Jednak częściej przy obustronnym pogrubieniu nadnerczy można w nich uwidocznić również zmiany o charakterze guzów (ryc. 2) – ma to miejsce najczęściej w ACTH niezależnym wielkoguzkowym rozroście nadnerczy (AIMAH), przeroście barwnikowym (drobnoguzkowym), a często również we wrodzonym przeroście kory nadnerczy (12). Powiększenie nadnerczy w chorobach dotyczących obu gruczołów nie musi być symetryczne – opisywano na przykład przypadki rozrostu guzkowego manifestującego się w postaci powiększenia jedynie jednego z nich albo wręcz przebiegające w postaci guza nadnercza (11).
 Ryc. 1. Zdrowe nadnercza w obrazie TK.
 Ryc. 2. AIAMH – obustronnie pogrubiałe nadnercza.
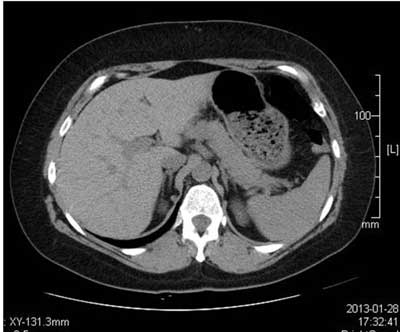
Guzy nadnerczy to najczęściej opisywane nieprawidłowości ich morfologii. Wraz z postępem technik obrazowania coraz częściej wykrywane są przypadkowo, podczas badań wykonywanych z innych przyczyn niż diagnostyka chorób nadnerczy. Tomografia komputerowa pozwala na precyzyjne odróżnienie zmian łagodnych, operowanych jedynie w przypadkach autonomicznej czynności hormonalnej, od zmian podejrzanych o złośliwość lub phaeochromocytoma, które bezwzględnie wymagają usunięcia. Rozmiar, kształt i homogenność guza w obrazie CT, podobnie jak przy ocenie ultrasonograficznej, stanowią wskazówkę odnośnie charakteru zmiany. Guz o nieregularnym kształcie, niehomogenny, z obszarami martwicy, ogniskami pokrwotocznymi i zwapnieniami to raczej zmiana złośliwa (13). Jednak łagodny guz chromochłonny może być również niehomogenny i zawierać zwapnienia lub ogniska rozpadu; tak samo może wyglądać łagodny gruczolak, z ogniskiem po przebytym krwawieniu (14, 15). Wybitnie niehomogenne i bardzo duże są też łagodne myelolipoma (16) (ryc. 3). Guzy o średnicy do 3 cm są w większości zmianami łagodnymi, a te większe – od 6 cm, najczęściej zmianami złośliwymi (17, 18). Nie jest to oczywiście reguła – potwórzmy raz jeszcze, że oczywiste jest, iż każdy z guzów złośliwych na początku swojej „historii naturalnej” ma średnicę niższą niż 3 cm. Z drugiej strony łagodny gruczolak bez czynności wydzielniczej może rosnąć bardzo długo, przekraczając 6 cm; takie rozmiary osiągają też myelolipoma i łagodne guzy chromochłonne. Tak więc rozmiar guza nie może służyć za jedyną podstawę do decyzji terapeutycznej. Należy podkreślić, że niezbędnym elementem opisu badania CT nadnerczy jest wartość współczynnika osłabienia promieniowania (densyjności) stwierdzonych zmian ogniskowych.
 Ryc. 3. Myelolipoma prawego nadnercza.
Densyjność (podawana w jednostkach Hounsfielda – jH/HU) wyraża wartość współczynnika osłabienia promieniowania rentgenowskiego dla badanej tkanki, w porównaniu do tego współczynnika zmierzonego dla wody, dla której współczynnik przyjmuje wartość 0 jH. Powietrze ma współczynnik około (–)1000 jH, tkanka tłuszczowa od (–)80 do (–)100 jH, tkanki miękkie (+)20 do (+)70 jH, zwapnienia > (+)130 jH (19). Przy obrazowaniu zmian w nadnerczach ich densyjność należy ocenić przed wstrzyknięciem środka cieniującego, po 1 minucie (ocena wzmocnienia) i po 10 lub 15 minutach (prędkość wypłukiwania – washout). Densyjność wyjściowa niższa niż 10 jH świadczy o łagodnym charakterze guza (tzw. łagodny fenotyp obrazowy). Taki niski współczynnik osłabienia promieniowania oznacza, że guz zawiera dużo lipidów – jest to obraz charakterystyczny dla łagodnego gruczolaka bogatolipidowego. Stwierdzenie wyjściowej densyjności < 10 jH zwalnia od jej oceny po podaniu kontrastu (15). Jednak co trzeci łagodny gruczolak ma wysoką densyjność wyjściową (najczęściej do 20, a w pojedynczych przypadkach nawet do 30 jH) – są to tak zwane gruczolaki ubogolipidowe. Konieczna jest wówczas ocena ich densyjności po dożylnym podaniu środka cieniującego. Na podstawie różnic w wartościach tych pomiarów wylicza się tak zwane współczynniki wypłukiwania kontrastu (wyrażone w %). Współczynnik bezwzględny to iloraz mający w liczniku różnicę między densyjnością maksymalną (po 1 minucie) a densyjnością po 10 lub 15 minutach, a w mianowniku różnicę między wartością maksymalną a wartością wyjściową (wynik mnożymy przez 100%) (ryc. 4). Współczynnik względny natomiast wyraża proporcję między obniżeniem densyjności od 1 do 10 minuty badania a densyjnością w 1 minucie (ryc. 5). Charakterystyczne dla łagodnych gruczolaków ubogolipidowych są: bezwzględny współczynnik wypłukiwania wyższy niż 50% po 10 minutach, 60% po 15 minutach i względny współczynnik wypłukiwania wyższy niż 40% (ryc. 6) (9, 15, 20). Charakterystyczna dla najczęściej bardzo dużego, ale łagodnego myelolipoma jest obecność tłuszczowych ognisk o wartościach współczynnika osłabienia od (-)30 jH aż do (-)100 jH. Myelolipoma mogą również zawierać drobne zwapnienia, a więc ogniska o bardzo wysokiej densyjności (16). W przypadkach torbieli nadnerczy wyjściowa densyjność wynosi najczęściej < 10 jH, jednak w opisanej w 1996 roku serii 13 przypadków aż w 5 z nich przekraczała ona 15 jH (21, 22). Charakterystyczne dla torbieli są natomiast „sztywne” wartości współczynnika osłabienia promieniowania – densyjność praktycznie nie wzrasta po kontraście (z czego wynikają też bliskie zeru współczynniki wypłukiwania względnego (21). Należy jednak pamiętać, że w przypadkach raka nadnerczy lub guza chromochłonnego z dużymi ogniskami rozpadu w nadnerczu może powstać torbiel rzekoma – bardzo ważna jest więc ocena ewentualnego „rąbka tkankowego” otaczającego taką zmianę.
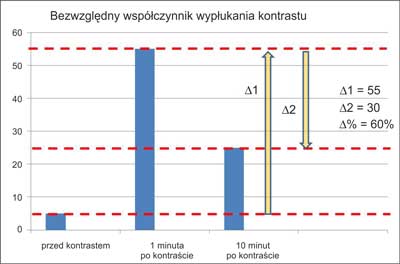 Ryc. 4. Graficzne zobrazowanie bezwzględnego współczynnika wypłukiwania kontrastu.
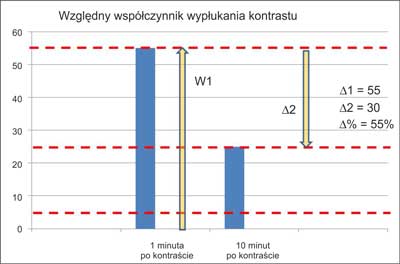 Ryc. 5. Graficzne zobrazowanie względnego współczynnika wypłukiwania kontrastu.
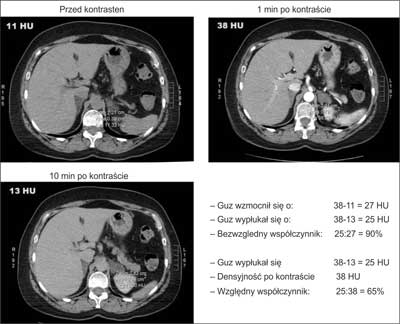 Ryc. 6. Przykład wyliczenia współczynników wypłukiwania kontrastu dla guza o wyjściowej densyjności > 10 HU: gruczolak ubogolipidowy.
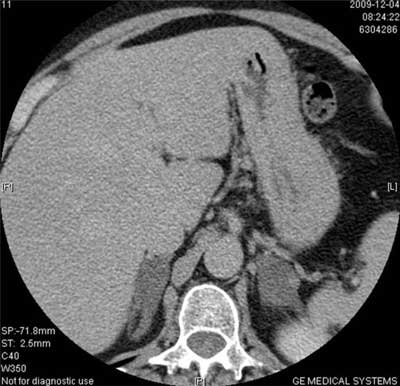
Pierwotny rak kory nadnerczy jest niehomogenny, można więc w nim wyróżnić obszary o densyjności niższej (ogniska martwicy) i bardzo wysokiej (zwapnienia). Średnia wyjściowa densyjność w takim guzie przekracza 20 jH, a najczęściej wynosi powyżej 30 jH (ryc. 7). Po wstrzyknięciu środka kontrastującego densyjność guza nowotworowego wzrasta w różnym stopniu – zależnie od stopnia, w jakim rozwinęło się unaczynienie patologiczne, a wypłukiwanie jest wolniejsze niż w gruczolaku – bezwzględny współczynnik wypłukiwania kontrastu po 10 minutach wynosi < 50%, a względny < 40% (9, 15, 20). Podobny fenotyp mają guzy przerzutowe, ale rzadziej występują w nich zwapnienia. Równie wysoką densyjność mają guzy chromochłonne, w których mogą też występować zwapnienia i ogniska rozpadu o niskiej densyjności (ryc. 8, 9). Po dożylnym podaniu środka kontrastującego pheochromocytoma ulegają bardzo silnemu wzmocnieniu, a wypłukiwanie jest z reguły (choć nie zawsze) wolniejsze niż w gruczolakach, podobnie jak w raku nadnerczy. W badaniu radiologicznym fenotyp obrazowy guza chromochłonnego najczęściej naśladuje więc fenotyp raka kory nadnercza, a czasem (choć rzadziej – przy szybszym wypłukiwaniu) może przypominać gruczolaka ubogolipidowego – dlatego też guz ten nazywany jest czasem „radiologicznym kameleonem” (14).
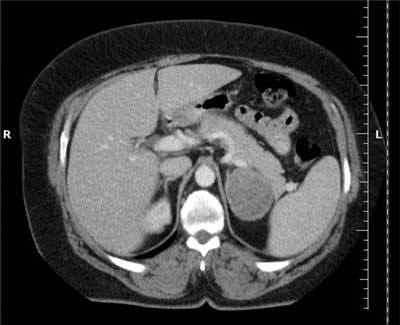 Ryc. 7. Rak lewego nadnercza: homogenny guz, ale duży i o wysokiej wyjściowej densyjności.
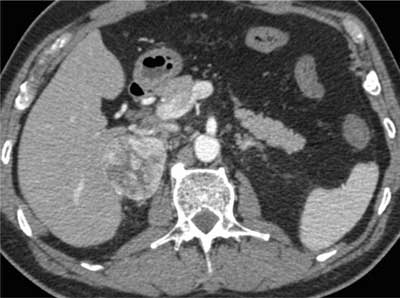 Ryc. 8. Guz chromochłonny prawego nadnercza, wysoce niehomogenny.
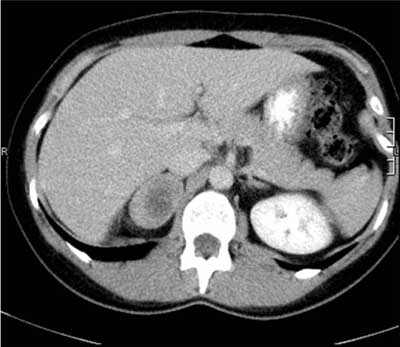 Ryc. 9. Guz chromochłonny prawego nadnercza z centralnie położonym ogniskiem rozpadu.
Obrazowanie rezonansu magnetycznego (MR)
Badanie MR jest z reguły badaniem drugiego rzutu w diagnostyce chorób nadnerczy. Pozwala na dodatkową ocenę w sytuacjach, gdy badanie TK z kontrastem nie daje jednoznacznej odpowiedzi, czy zmiana ogniskowa ma charakter łagodny, czy złośliwy. Protokół obejmuje badanie w obrazach T1 i T2 zależnych, ocenę zawartości lipidów metodą przesunięcia chemicznego i wzmocnienia po podaniu środka kontrastowego. W obrazach T1 i T2 zależnych intensywność sygnału w gruczolakach kory nadnerczy jest niska (zbliżona do sygnału z wątroby i najczęściej niższa niż pozostałej tkanki nadnerczowej) i jednorodna, natomiast w raku kory nadnerczy i guzie chromochłonnym jest znamiennie wyższa i niejednorodna (13, 23, 24). Szczególnie silnym sygnałem w obrazach T2 zależnych cechują się phaeochromocytoma. Na dalsze różnicowanie między rakiem a guzem chromochłonnym pozwala badanie metodą przesunięcia chemicznego, polegające na ocenie obrazów T1 w tzw. fazie i przeciwfazie. Dla zmian łagodnych: gruczolaka, rozrostu kory nadnerczy i myelolipoma charakterystyczne jest wyraźne obniżenie intensywności sygnału w przeciwfazie, ponieważ zawierają one lipidy (ryc. 10). Śladowe ilości lipidów mogą występować też w raku nadnerczy oraz niektórych przerzutach (z raka nerki, wątroby oraz liposarcoma), natomiast pheochromocytoma nigdy ich nie zawierają. Metoda ta może więc pomóc w różnicowaniu między nowotworem złośliwym a guzem chromochłonnym, należy jednak pamiętać, że opisywano również guzy mieszane o utkaniu z kory i rdzenia nadnerczy, a więc zawierające lipidy, ale jednocześnie będące źródłem nadmiaru katecholamin (25). W obrazowaniu MR, podobnie jak w TK, możliwa jest (choć rzadko stosowana), ocena wypłukiwania środka kontrastującego (gadolinium). Różnice w wypłukiwaniu kontrastu między guzami złośliwymi a gruczolakami są podobne jak w badaniu TK (24).
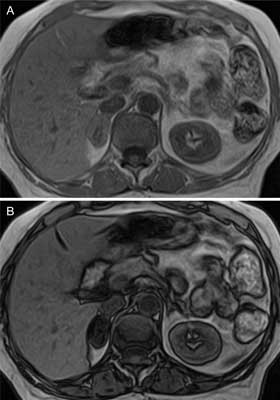 Ryc. 10. Gruczolak prawego nadnercza – obrazowanie MR w fazie i przeciwfazie.
Badania scyntygraficzne
W przypadkach, w których badaniami CT i MRI nie udało się jednoznacznie określić charakteru guza, należy rozważyć wykonanie badań izotopowych – tomografii emisyjnej pojedynczego fotonu (SPECT) lub pozytronowej tomografii emisyjnej (PET).
Znacznikiem wychwytywanym wybiórczo przez korę nadnerczy jest pochodna cholesterolu – 131I-6-jodometylnorcholesterol (NP-59). Gromadzony jest przez czynne hormonalnie gruczolaki lub raki kory nadnerczy (26) (ryc. 11). Jednostronny wychwyt znakowanego jodem norcholesterolu potwierdza autonomizację wydzielania kortyzolu i pełną supresję drugiego nadnercza, ponadto prognozuje niedoczynność drugiego nadnercza po usunięciu guza czynnego hormonalnie. W związku z tym niektórzy autorzy uznają to badanie za złoty standard w ocenie incydentaloma nadnerczy (27-29). Opisano też zastosowanie scyntygrafii NP-59 do potwierdzenia czynności wydzielniczej aldosteronoma; w tym badaniu, w celu zahamowania wychwytu znacznika przez warstwę pasmowatą stosuje się jej supresję deksametazonem (30) (niektóre ośrodki stosują podawanie deksametazonu również w ocenie guzów przebiegających z hiperkortyzolemią, aczkolwiek nie jest ona w tych przypadkach bezwzględnie konieczna).
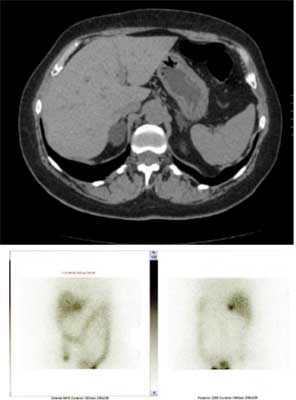 Ryc. 11. Scyntygrafia NP-59 – jednostronny wychwyt, świadczący o autonomizacji wydzielania kortyzolu w gruczolaku prawego nadnercza.
W metodzie PET, dla specyficznego zobrazowania guza produkującego hormony steroidowe stosuje się inhibitor steroidogenezy – 11C-metiomidat, intensywnie wychwytywany przez gruczolaki, z równomiernym rozkładem znacznika. Rak nadnercza wychwytuje metiomidat równie intensywnie, ale jego rozkład w guzie jest nierównomierny (31).
Guzy chromochłonne wychwytują znakowaną 131I lub 123I meta-jodobenzylguanidynę (MIBG) (ryc. 12). Innym znacznikiem pozwalającym na niezwykle dokładne obrazowania guzów rdzenia jest 11C-metahydroksyefedryna, amina o budowie zbliżonej do noradrenaliny, ale niepodlegająca degradacji przez MAO. Ma ona jednak bardzo krótki okres półtrwania, co ogranicza jej zastosowanie w obrazowaniu nadnerczy. W obrazowaniu phaeochromocytoma metodą PET wykorzystywane są też: znakowana 11C adrenalina oraz znakowane 18F-dopamina i dihydroksyfenyloalanina (32-34). Metody te są szczególnie przydatne przy poszukiwaniu pozanadnerczowych guzów wydzielających katecholaminy (przerzuty ze złośliwych phaeochromocytoma, pozanadnerczowe guzy chromochłonne oraz przyzwojaki).
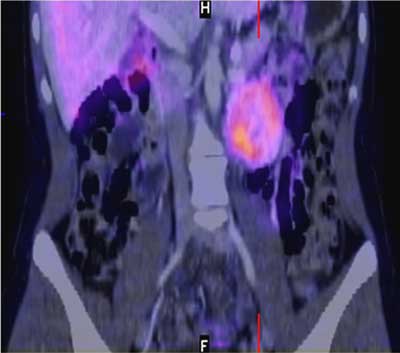 Ryc. 12. Fuzja obrazów MR i MIBG w przypadku guza chromochłonnego lewego nadnercza.
[18F]-fluorodezoksyglukoza (FDG) jest niespecyficznym znacznikiem służącym do badań różnych narządów metodą pozytronowej tomografii emisyjnej. PET z jej zastosowaniem uznany jest za najlepszą metodę różnicowania zmian łagodnych od złośliwych, które najczęściej cechuje intensywny metabolizm glukozy. FDG z reguły nie wychwytują łagodne gruczolaki, a wychwytują raki kory nadnerczy. Uwidacznia też przerzuty do nadnerczy (13, 20, 35). Opisywano jednak wzmożony wychwyt znacznika w łagodnych phaeochromocytoma (szczególnie szybko rosnących); zmiany łagodne kory nadnerczy o dużej aktywności wydzielniczej mogą również wykazywać intensywny wychwyt FDG (36).
Guzy chromochłonne i przyzwojaki (szczególnie złośliwe) mogą mieć również receptory dla somatostatyny, co pozwala na uwidocznienie ich w badaniu SPECT z zastosowaniem 99mTc-[HYNIC,Tyr3]-oktreotydu (SRS). Podobnie guzy z receptorami somatostatynowymi można uwidocznić metodą PET z zastosowaniem analogów somatostatyny znakowanych galem pozytonowym 68Ga (33, 35).
Podsumowanie
Jak widać, badania obrazowe nadnerczy pozwalają z bardzo wysokim prawdopodobieństwem odróżnić łagodne gruczolaki od wymagających szybkiego leczenia operacyjnego guzów złośliwych – pierwotnych lub przerzutowych oraz guzów chromochłonnych. W praktyce do diagnostyki zmian w nadnerczach najczęściej wykorzystujemy metodę tomografii komputerowej promieniowania rentgenowskiego, nieco rzadziej obrazowanie rezonansu magnetycznego. Dobrej jakości ocena nadnerczy w badaniu TK wymaga zawarcia w opisie oceny densyjności zmian guzów stwierdzonych w nadnerczach w punktach czasowych określonych w tzw. protokole nadnerczowym. Ocena zawartości lipidów w MRI wymaga rozszerzenia standardowo wykonywanego badania narządów jamy brzusznej o badania w fazie i przeciwfazie. Badania scyntygraficzne natomiast pozwalają na ocenę czynności wydzielniczej guza (NP-59, MIBG) albo obecności w nim receptorów (SRS), co pomaga szczególnie w różnicowaniu zmian o podejrzanym fenotypie obrazowym w obrazie TK. Piśmiennictwo
1. Nürnberg D, Szebeni A, Záťura F: Ultrasound of the adrenals glands EFSUMB. European Course Book Budapest 2011.
2. Ribeiro C, Ribeiro N, Oliveira J: CT and MRI help evaluate adrenal gland disorders 2010, http://www.diagnosticimaging.com.
3. Trojan J, Schwarz W, Sarrazin C et al.: Role of ultrasonography in the detection of small adrenal masses. Ultraschall Med 2002; 23(2): 96-100.
4. Hsu-Chong Y: Sonography of the Adrenal Glands: Normal Glands and Small Masses. AJR 1980; 135: 1167-1177.
5. Mansmann G, Lau J, Balk E et al.: The Clinically Inapparent Adrenal Mass: Update In Diagnosis and Management. Endocrine Rev 2004; 25: 309-340.
6. Schteingart DE, Doherty GM, Gauger PG et al.: Management of patients with adrenal cancer: recommendations of an international consensus conference. Endocrine-Related Cancer 2005; 12: 667-680.
7. Nawar R, Aron D: Adrenal incidentalomas – a continuing management dilemma. Endocrine-Related Cancer 2005; 12: 585-598.
8. Słonina J, Nienartowicz E, Kumar Agrawal A et al.: The usefulness of contrast-enhanced sonography in the differential diagnostic of adrenal tumors. Pol J Endocrinol 2006; 3(57): 230-236.
9. Podgórska J, Cieszanowski A, Bednarczuk T: Adrenal imaging. Pol J Endocrinol 2012; 63(1): 71-81.
10. Kawashima A, Sandler CM, Fishman EK et al.: Spectrum of CT findings in nonmalignant disease of the adrenal gland. Radiographics 1998; 18(2): 393-412.
11. Blake M, Boland G: Hypofunctional states in „Adrenal Imaging”. Humana Press/Springer 2009: 29-30.
12. Rockall AG, Babar SA, Sohaib SA et al.: CT and MR imaging of the adrenal glands in ACTH-independent cushing syndrome. Radiographics 2004; 24(2): 435-452.
13. Ilias I, Sahdev A, Reznek R et al.: The optimal imaging of adrenal tumors: a comparison of different methods. Endocrine-Related Cancer 2007; 14: 587-599.
14. Blake MA, Kalra MK, Maher MM et al.: Pheochromocytoma: An Imaging Chameleon. RadioGraphics 2004; 24: 87-99.
15. Stajgis M, Stajgis M, Guzikowska-Ruszkowska I et al.: CT diagnostic imaging of adrenal adenomas. Pol J Radiol 2005; 70(2): 62-68.
16. Cyran KM, Kenney PJ, Memel DS, Yacoub I: Adrenal myelolipoma. AJR Am J Roentgenol 1996; 166(2): 395-400.
17. Johnson PT, Horton KM, Fishman EK: Adrenal mass imaging with multidetector CT: pathologic conditions, pearls, and pitfalls. Radiographics 2009; 29(5): 1333-1351.
18. Androulakis II, Kaltsas G, Piaditis G, Grossman AB: The clinical significance of adrenal incidentalomas. Eur J Clin Invest 2011; 41(5): 552-560.
19. Weir J, Abrahams P, Spratt JD, Salkowski L: Introduction: Computed Tomography. [W:] Imaging Atlas of Human Anatomy. Fourth Edition, Mosby 2010: IX-XI.
20. Dunnick NR, Korobkin M: Imaging of adrenal incidentalomas: current status. AJR 2002; 179: 559-568.
21. Boland GW, Blake MA, Hahn PF, Mayo-Smith WW: Incidental adrenal lesions: principles, techniques, and algorithms for imaging characterization. Radiology 2008 Dec; 249(3): 756-775.
22. Rozenblit A, Morehouse HT, Amis ES Jr: Cystic adrenal lesions: CT features. Radiology 1996 Nov; 201(2): 541-548.
23. Thompson GB, Young WF Jr: Adrenal incidentaloma. Current Opinion in Oncology 2003; 15: 84-90.
24. Zielonko J, Studniarek M, Rzepko R et al.: Value of MRI in differentiating adrenal masses: Quantitative analysis of tumor signal intensity. Pol J Radiol 2008; 73(2): 7-12.
25. Kimura T, Usui T, Inamoto S et al.: Image in endocrinology. Pheochromocytoma with subclinical Cushing’s syndrome caused by corticomedullary mixed tumor of the adrenal gland. J Clin Endocrinol Metab 2009; 94(3): 746-747.
26. La Cava G, Imperiale A, Olianti C et al.: SPECT semiquantitative analysis of adrenocortical (131)I-6 beta iodomethyl-norcholesterol uptake to discriminate subclinical and preclinical functioning adrenal incidentaloma. J Nucl Med 2003; 44(7): 1057-1064.
27. Barzon L, Scaroni C, Sonino N et al.: Incidentally discovered adrenal tumors: endocrine and scintigraphic correlates. J Clin Endocrinol Metab 1998; 83: 55-62.
28. Barzon L, Fallo F, Sonino N, Boscaro M: Overnight dexametasone suppression of cortisol is associated with radiocholesterol uptake patterns in adrenal incidentalomas. Eur J Endocrinol 2001; 145: 223-224.
29. Yoh T, Hosono M, Komeya Y et al.: Quantitative evaluation of norcholesterol scintigraphy, CT attenuation value, and chemical-shift MR imaging for characterizing adrenal adenomas. Ann Nucl Med 2008; 22(6): 513-519.
30. Rubello D, Bui C, Casara D et al.: Functional scintigraphy of the adrenal gland. European Journal of Endocrinology 2002; 147: 13-28.
31. Eriksson B, Orlefors H, Oberg K et al.: Developments in PET for the detection of endocrine tumours. Tumour Biology 2005; 19: 311-324.
32. Bravo EL, Tagle R: Pheochromocytoma: state-of-the-art and future prospects. Endocrine Reviews 2003; 24: 539-553.
33. Van der Harst E: [(123)I]metaiodobenzylguanidine and [(111)In]octreotide uptake in benign and malignant pheochromocytomas. JCEM 2001; 86: 685-693.
34. Mann GN, Link JM, Pham P et al.: [(11)C]metahydroxyephedrine and [(18)f]fluorodeoxyglucose positron emission tomography improve clinical decision making in suspected pheochromocytoma. Annals of Surgical Oncology 2006; 13: 187-197.
35. Eriksson B, Orlefors H, Oberg K et al.: Developments in PET for the detection of endocrine tumours. Tumour Biology 2005; 19: 311-324.
36. Alencar GA, Barisson Villares Fragoso MC, Itaya Yamaga L et al.: Image in Endocrinology: 18F-FDG-PET/CT Imaging of ACTH-Independent Macronodular Adrenocortical Hyperplasia (AIMAH) Demonstrating Increased 18F-FDG Uptake. JCEM 2011; 96: 3300-3301.
otrzymano/received: 2013-09-17 zaakceptowano/accepted: 2013-10-30 Adres/address: *Lucyna Papierska Klinika Endokrynologii CMKP ul. Cegłowska 80, 01-809 Warszawa tel.: +48 (22) 569 05 29 e-mail: klinendo@cmkp.edu.pl Artykuł Morfologiczne i czynnościowe obrazowanie nadnerczy w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








