|
© Borgis - Postępy Nauk Medycznych 10, s. 737-742
*Monika Podhorecka1, Agnieszka Szymczyk2, Justyna Markowicz2, Johannes Pawlowski2, Arkadiusz Macheta1
Ocena skuteczności leczenia chorych na ostrą białaczkę promielocytową w materiale własnym Kliniki Hematoonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie – doniesienie wstępne
Effectiveness of acute promyelocytic leukemia treatment in Department of Hematooncology and Bone Marrow Transplantation Medical University of Lublin – preliminary study
1Klinika Hematoonkologii i Transplantacji Szpiku, Uniwersytet Medyczny, Lublin
Kierownik Kliniki: prof. dr hab. med. Anna Dmoszyńska 2Studenckie Koło Naukowe, Klinika Hematoonkologii i Transplantacji Szpiku, Uniwersytet Medyczny, Lublin Opiekun Koła: dr hab. med. Monika Podhorecka Streszczenie
Wstęp. Ostra białaczka promielocytowa (OBP) jest rzadko występującym, jednakże szczególnym podtypem ostrej białaczki szpikowej o specyficznych cechach klinicznych, morfologicznych, immunofenotypowych i genetycznych. U podstaw klasycznej postaci choroby leży występowanie wzajemnej translokacji pomiędzy chromosomem 15 a 17, prowadzącej do powstania białka fuzyjnego PML-RARα, którego obecność blokuje różnicowanie promielocytów do dojrzałych granulocytów. Rokowanie w grupie chorych z OBP uległo w ostatnich latach diametralnej zmianie w związku z wprowadzeniem do terapii kwasu all-trans retinoinowego (ATRA), który stymuluje różnicowanie komórek białaczkowych. Cel pracy. Celem prezentowanej pracy była ocena skuteczności leczenia OBP z zastosowaniem chemioterapii wg schematu PETHEMA, łączącego zastosowanie ATRA i klasycznej chemioterapii. Materiał i metody. Badania przeprowadzono w grupie pacjentów hospitalizowanych w Klinice Hematoonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie w latach 2006-2012. Wyniki. W grupie badanej liczącej 8 osób, jeden chory zmarł w trakcie pierwszego etapu leczenia (indukcja remisji), pozostałe osoby uzyskały całkowitą remisję choroby. Po zakończeniu leczenia konsolidującego u wszystkich chorych utrzymywała się całkowita remisja choroby. Najczęstszym powikłaniem obserwowanym w trakcie terapii były gorączka oraz powikłania infekcyjne. Wnioski. Pomimo analizy niewielkiej grupy chorych uzyskane wyniki wskazują niewątpliwie na wysoką skuteczność schematu PETHEMA w leczeniu OBP, skuteczność niespotykaną w innych typach ostrych białaczek. Słowa kluczowe: ostra białaczka promielocytowa, chemioterapia według PETHEMA, remisja całkowita choroby
Summary
Introduction. Acute promyelocytic leukemia (APL) is a not frequent type of acute myeloid leukemia with distinctive clinical, morphological, immunophenotypic and genetic features. The karyotype hallmark of the disease is a balanced reciprocal translocation between chromosomes 15 and 17, that gives rise to PML-RARa fusion proteins, which leads to a block of cells at the promyelocyte stage of differentiation. During the last years APL, once considered the deadly disease, has evolved to the most treatable of all subtypes of acute myeloid leukemias – the use of the differentiating agent all-trans-retinoic acid has proven to be effective first-line therapy. Aim. The aim of the study was the assessment of effectiveness of treatment proposed by PETHEMA Group (chemotherapy + all-trans-retinoic acid) in patients with APL. Material and methods. We analyzed the group of patients with APL treated in Department of Hematooncology and Bone Marrow Transplantation Medical University of Lublin in 2006-2012. Results. In the analyzed group of 8 patients, one person died during first period of treatment (induction chemotherapy), others obtained complete remission of the disease. After the third cycle of consolidation therapy the complete remission was still observed in all analyzed patients. Fever and infections were the most frequent complications observed during therapy. Conclusions. Despite the small group of analyzed persons, the obtained results undoubtedly show the high effectiveness of PETHEMA treatment in APL, that is not observed in other types of acute myeloblastic leukemia. Key words: acute promyelocytic leukemia, chemotherapy according to PETHEMA protocol, complete remission
WSTĘP
Ostra białaczka promielocytowa (OBP) jest szczególnym podtypem ostrej białaczki szpikowej (OBSz) o specyficznych cechach klinicznych, morfologicznych, immunofenotypowych i genetycznych. Rozpoznawana jest stosunkowo rzadko, stanowiąc ok. 10-15% wszystkich ostrych białaczek. Została po raz pierwszy opisana w 1957 roku przez szwedzkiego uczonego Hilstada (1). Istotą tego procesu nowotworowego jest akumulacja komórek blastycznych odpowiadających stadium promielocyta w szeregu mielopoezy (2). U podstaw choroby leży występowanie zrównoważonej wzajemnej translokacji pomiędzy chromosomem 15 a 17, która prowadzi do powstania białka fuzyjnego PML-RARα, którego obecność wpływa zarówno na proces różnicowania komórek, jak i ich samoodnawianie się i wzrost (2, 3). Postać OBP z t(15;17)(q22;q21)-PML-RARα uważana jest za klasyczną postać choroby występującą u ponad 90% pacjentów. Bardzo rzadko diagnozowane są postaci z obecnością innych translokacji, np. t(11;17)(q23;q21)-PLZF-RARα czy t(5;17)(q35;q21)-NPM-RARα, w które zawsze jednak zaangażowany jest gen RARα znajdujący się na chromosomie 17 (4).
W obrazie klinicznym OBP charakteryzuje się zaburzeniami krzepnięcia krwi o cechach zespołu wewnątrznaczyniowego rozsianego wykrzepiania (DIC). Diagnoza stawiana w oparciu o obraz kliniczny i ocenę szpiku kostnego wymaga potwierdzenia cytogenetycznego i molekularnego najczęściej z wykorzystaniem metod FISH lub RT-PCR. Postawienie właściwego rozpoznania jest niezwykle istotne ze względu na odmienny, niż w przypadku innych ostrych białaczek szpikowych, schemat postępowania (4).
W ciągu ostatnich lat rokowanie w grupie pacjentów z OBP uległo radykalnej zmianie, a choroba z nieuleczalnej jeszcze dwadzieścia lat temu stała się przykładem białaczki o bardzo dobrym rokowaniu. Przemiana ta wiąże się z wprowadzeniem do terapii leku o mechanizmie działania ukierunkowanym na patogenezę choroby – kwasu all-trans retinowego (ATRA). Pierwsze doniesienia na temat skuteczności ATRA opublikowała grupa badaczy z Szanghaju w 1988 roku (5). Zaobserwowano, że zastosowanie ATRA prowadzi do wyraźnych zmian w fenotypie komórek białaczkowych OBP, które w szybkim tempie przekształcają się z niedojrzałych promielocytów do w pełni zróżnicowanych granulocytów, zarówno w warunkach ex vivo, jak i in vivo (5, 6). ATRA w dawkach stosowanych terapeutycznie prowadzi do zmian w konformacji białka fuzyjnego PML-RARα poprzez bezpośrednie połączenie z RARα, co prowadzi do „przesunięcia” w układzie białka fuzyjnego pozwalającego na aktywację transkrypcji genów, wcześniej zablokowanych przez PML-RARα. Rezultatem tego typu zmian jest różnicowanie promielocytów, a pod względem klinicznym remisja choroby (2, 7, 8). Powodzenie terapii z zastosowaniem tego leku spowodowało, że bardzo szybko opracowano liczne schematy terapeutyczne z zastosowaniem różnego rodzaju cytostatyków i ATRA (9-11).
Obecnie prowadzone są długoletnie, wieloośrodkowe metaanalizy mające za zadanie ocenić skuteczność w uzyskaniu remisji i przeciwdziałaniu nawrotom choroby przy zastosowaniu różnych protokołów chemioterapii. Daje to szansę na poznanie najbardziej efektywnego i obarczonego nie mniejszą szkodliwością schematu postępowania w tej grupie chorych (12).
CEL PRACY
Celem prezentowanej pracy była retrospektywna ocena skuteczności chemioterapii według schematu zaproponowanego przez Hiszpańską Grupę ds. Leczenia Białaczek PETHEMA, zastosowanego w grupie pacjentów z rozpoznaną ostrą białaczką promielocytową hospitalizowanych w Klinice Hematoonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie w latach 2006-2012.
MATERIAŁ I METODY
Analizą objęto 8 chorych z klasyczna postacią OBP, z cytogenetycznym i/lub molekularnym potwierdzeniem choroby – obecność fuzji PML/RARa lub translokacji t(15;17). Badaną grupę stanowiło 6 kobiet i 2 mężczyzn w wieku od 20 do 79 lat (mediana: 42). Charakterystykę grupy badanej przedstawiono w tabeli 1. U wszystkich chorych, u których oznaczono poziom D-dimerów, były one podwyższone (śr. 6804,8 μg/l), natomiast wydłużenie czasu częściowej tromboplastyny po aktywacji (APTT) i czasu protrombinowego (PT) zaobserwowano jedynie u dwojga chorych. Czworo pacjentów zakwalifikowano do grupy wysokiego ryzyka (HR), dwoje do grupy średniego ryzyka (IR), dwoje pacjentów do grupy niskiego ryzyka (LR).
Tabela 1. Charakterystyka badanej grupy chorych z ostrą białaczką promielocytową poddanych chemioterapii opartej na schemacie PETHEMA (wartości w momencie ustalenia diagnozy, WBC – liczba krwinek białych, PLT – liczba krwinek płytkowych).
HR – wysokie ryzyko (WBC > 10G/l), IR – pośrednie ryzyko (WBC < 10G/l, PLT < 40G/l), LR – niskie ryzyko (WBC < 10G/l, PLT > 40G/l)
Dane pacjentów zebrane zostały na podstawie ankiet obejmujących dane demograficzne, stopień ryzyka i zaawansowania choroby w momencie diagnozy, schemat leczenia oraz odsetek uzyskanych remisji. Obliczenia przeprowadzono z wykorzystaniem programu Statistica 10.0. U wszystkich chorych zastosowano leczenie cytostatyczne w oparciu o schemat Hiszpańskiej Grupy ds. Leczenia Białaczki PETHEMA. Charakterystykę schematu PETHEMA przedstawiono w tabeli 2.
Tabela 2. Schemat leczenia ostrej białaczki promielocytowej według Hiszpańskiej Grupy PETHEMA (CR – całkowita remisja).
ATRA – kwas all-trans retinoinowy; Ida – idarubicyna; Mit – mitoxantron; MTX – metotrexat; 6-MP – merkaptopuryna
WYNIKI
Czas trwania leczenia indukującego w badanej grupie wahał się od 14 do 47 dni (śr. 32,6). Najczęstszym typem powikłania w trakcie jego trwania była gorączka (7 chorych). U jednego chorego gorączka była spowodowana zakażeniem układu moczowego potwierdzonym bakteriologicznie, u dwóch chorych była spowodowana infekcją dróg oddechowych, w pozostałych przypadkach była to gorączka neutropeniczna. Rzadziej obserwowanym powikłaniem było krwawienie z błon śluzowych (2 chorych) oraz zmiany uczuleniowe na skórze (2 chorych). Średni czas regeneracji neurocytów (poziom powyżej 0,5 G/l) wynosił 27 dni, natomiast średni czas regeneracji trombocytów (powyżej 20 G/l) był nieco krótszy – 24,5 dnia. Wszyscy chorzy wymagali przetoczenia koncentratu krwinek czerwonych (KKCz) i koncentratu płytek krwi (KP) (ryc. 1). Jeden chory zmarł w trakcie leczenia indukującego, natomiast u pozostałych uzyskano całkowitą remisję.
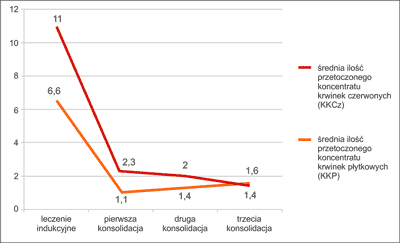 Ryc. 1. Zastosowanie preparatów krwi w grupie chorych z ostrą białaczką promielocytową w trakcie chemioterapii opartej na schemacie PETHEMA.
W trakcie pierwszego leczenia konsolidującego zaobserwowano mniej powikłań niż w trakcie podawania chemioterapii indukującej – jedynie u 2 chorych wystąpiła gorączka (gorączka neutropeniczna), a u 2 krwawienie z błon śluzowych. Także średni czas regeneracji układu białokrwinkowego był krótszy i wynosił 4,9 dnia. Jedynie 3 chorych wymagało transfuzji KKCz i KP. Najczęstszym typem powikłań w trakcie drugiego cyklu leczenia konsolidującego były gorączka (2 chorych – gorączka neutropeniczna i o podłożu infekcyjnym) i krwawienie (1 chory). Średni czas regeneracji neutrocytów wynosił 13,7 dnia, a trombocytów 13,3 dnia. Czworo chorych wymagało przetoczenia KKCz i KP. U dwóch pacjentów, ze względu na powikłania w trakcie drugiego leczenia konsolidującego nie podano trzeciej chemioterapii konsolidującej. Powikłania w trakcie trzeciego etapu leczenia konsolidującego remisję nie były częste (gorączka o podłożu infekcyjnym – 1 chory, bóle głowy – 1 badany). Średni czas regeneracji neurocytów i płytek krwi wynosił 10,2 dnia. Tylko dwóch chorych wymagało transfuzji preparatów krwi (ryc. 1). U wszystkich chorych uzyskano całkowitą remisję.
Najczęstsze powikłania oraz czas regeneracji układu krwiotwórczego występujące na poszczególnych etapach leczenia schematem PETHEMA w badanej grupie chorych zaprezentowano odpowiednio na rycinach 2 i 3.
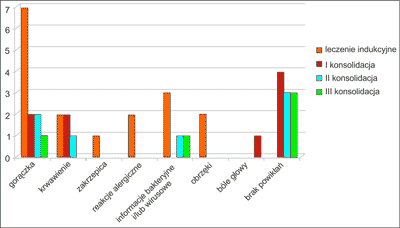 Ryc. 2. Najczęstsze powikłania w grupie chorych z ostrą białaczką promielocytową w trakcie chemioterapii według schematu PETHEMA.
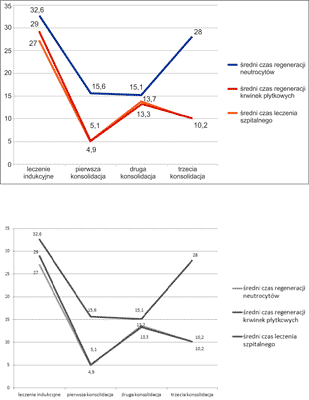 Ryc. 3. Czas regeneracji układu krwiotwórczego na poszczególnych etapach chemioterapii w grupie badanych chorych z ostrą białaczką promielocytową.
DYSKUSJA
Rokowanie dla pacjentów z rozpoznaną OBP uległo w ostatnich latach diametralnej zmianie – przed wprowadzeniem do terapii kwasu all-trans retinoinowego (ATRA) była ona chorobą nieuleczalną. W latach siedemdziesiątych XX wieku, gdy w leczeniu stosowano jedynie daunorubicynę (DRB), uzyskiwano całkowitą remisję (CR) u 30-50% chorych. Połączenie w terapii antracyklin z arabidozydem C (Ara-C), które skutkowało uzyskaniem remisji u ok. 75% chorych, stało się od tego czasu leczeniem pierwszego rzutu w OBP. Nie było ono jednak leczeniem nieobarczonym powikłaniami – zaburzenia hemostazy prowadziły do dużej wczesnej śmiertelności (9, 11).
Nową kartę w historii leczenia białaczki promielocytowej było zastosowanie ATRA w połączeniu z antracyklinami (2, 13). Włączenie do terapii w latach dziewięćdziesiątych ubiegłego stulecia trójtlenku arsenu (ATO) przyniosło poprawę wyników klinicznych w przypadku pierwotnie opornej na ATRA i nawrotowej białaczki promielocytowej (14, 15).
Większość chorych, u których stosowana jest ATRA, uzyskuje odpowiedź na leczenie pod postacią całkowitej lub znacznie rzadziej częściowej remisji. Niewielka grupa pacjentów, u których stwierdzono pierwotną oporność na ATRA, to chorzy, u których obserwowano brak wydzielania czynnika martwicy nowotworu (TNF-α) lub wydzielanie interleukiny 3 (IL-3), czynnika stymulującego tworzenie kolonii granulocytów i makrofagów (GM-CSF) oraz czynnika stymulującego wytwarzanie kolonii granulocytów (G-CSF). Drugą grupę chorych stanowią osoby, u których rozpoznawane są inne niż klasyczna zmiany genetyczne (9, 10).
OBP jest obecnie zaliczana do nowotworów charakteryzujących się dobrym rokowaniem, a podstawą terapii jest zastosowanie ATRA w skojarzeniu z cytostatykami według różnych schematów terapeutycznych (4). Schemat leczenia zalecany przez Polską Grupę Białaczkową oparty jest na protokole PETHEMA. W wyniku leczenia blisko 90% chorych uzyskuje remisję całkowitą (CR), a spośród nich 90% przeżywa bez nawrotu powyżej 2 lat (16-18). W analizowanej przez nas grupie po zakończeniu leczenia konsolidującego u 7 chorych (87,5%) uzyskano całkowitą remisję, natomiast jeden (12,5%) z leczonych zmarł w trakcie chemioterapii indukującej remisję z powodu powikłań infekcyjnych. Uzyskane wyniki korespondują więc z wynikami innych autorów.
Terapia OBP nie jest jednak pozbawiona działań niepożądanych. Zastosowanie ATRA wiąże się z możliwością występowanie zespołu „różnicowania” nazywanego także zespołem kwasu retinoinowego (ang. differentiation syndrome – DS). Do objawów klinicznych DS można zaliczyć: duszność, gorączkę o niewyjaśnionej etiologii, utratę masy ciała powyżej 5 kg, hipotensję o nieznanej etiologii, ostrą niewydolność nerek, nacieki płucne. Dane literaturowe donoszą o występowaniu DS u 2 do 27% chorych (19). W badanej grupie chorych nie obserwowaliśmy tego typu powikłania, być może z uwagi na fakt, iż pacjenci z grupy wysokiego ryzyka otrzymywali łącznie z ATRA sterydoterapię zalecaną w profilaktyce i leczeniu DS.
Kolejnym powikłaniem w grupie chorych z OBP, pojawiającym się niejednokrotnie jeszcze przed rozpoczęciem leczenia różnicującego i podczas leczenia indukującego, jest ciężka koagulopatia. Powikłanie to stanowi najczęstszą przyczynę wczesnych zgonów w tym okresie terapii, przede wszystkim w przypadkach wystąpienia krwawienia śródmózgowego lub płucnego. Mechanizm koagulopatii jest złożony, a wynika m.in. z faktu aktywacji układu krzepnięcia poprzez szereg mediatorów uwalnianych z komórek nowotworowych. Dane literaturowe wskazują na różną częstość powikłań krwotocznych w grupie chorych z OBP. Pagoni i wsp. (12) donoszą, że aż w 57% przypadków obserwowali zaburzenia funkcji układu hemostazy, które u 27% chorych manifestowały się klinicznie krwawieniem (w tym krwawieniem wewnątrzczaszkowym). Bajpai i wsp. (20) zaobserwowali epizody krwawienia u 58% badanych, jednak najcięższa ich postać, czyli krwawienie śródczaszkowe, zanotowano tylko u dwóch chorych (6%).
Do częstych powikłań obserwowanych w trakcie leczenia OBP należą powikłania infekcyjne i gorączka. W badaniach Pagoni i wsp. (12) u 65,2% pacjentów obserwowano powikłania infekcyjne. Z uwagi na ryzyko tego typu powikłań jedynie 68,4% chorych otrzymało trzeci cykl leczenia konsolidującego, po którym nie obserwowano zgonów oraz ciężkich powikłań (12). Bajpai i wsp. obserwowali gorączkę u 63,6% badanych pacjentów. W większości przypadków (90,4% chorych) udało się ustalić miejsce toczącego się procesu zapalnego. W badanej przez nas grupie chorych gorączka i infekcje należały do najczęściej występujących powikłań chemioterapii według schematu PETHEMA.
WNIOSKI
Badana przez nas grupa chorych z rozpoznaniem OBP była różnorodna – pacjenci zakwalifikowani do różnych grup ryzyka, zarówno mężczyźni, jak i kobiety w różnym wieku. Ze względu jednak na małą jej liczebność, uzyskane wyniki wymagają rozszerzenia badań na większą grupę chorych. Niezbędna także wydaje się dłuższa obserwacja chorych pozwalająca ocenić liczbę nawrotów. Rzadkość występowania OBP w populacji ogólnej sprawia, że uzasadnione wydaje się prowadzenie badań wieloośrodkowych. Pomimo tych ograniczeń, prezentowane w niniejszej pracy wyniki wskazują niewątpliwie na wysoką skuteczność schematu PETHEMA u chorych z OBP, skuteczność niespotykaną w innych typach ostrych białaczek. Piśmiennictwo
1. Wang Z: Acute promyelocytic leukemia: from highly fatal to highly curable. Blood 2000; 111: 2505-2515.
2. Ablain J, de The H: Revisiting the differentiation paradigm in acute promyelocytic leukemia. Blood 2011; 117: 5795-5802.
3. Nasr R, Lallemand-Breitenbach V, Zhu J et al.: Therapy-induced PML/RARA proteolysis and acute promyelocytic leukemia cure. Clin Cancer Res 2009; 15: 6321-6326.
4. Sanz MA, Grimwade D, Tallman MS et al.: Management of acute promyelocytic leukemia: recommendations from an expert panel on behalf of the European Leukemia Net. Blood 2009; 113: 1875-1891.
5. Huang ME, Ye YC, Chen SR et al.: Use of all-trans retinoic acid in the treatment of acute promyelocytic leukemia. Blood 1988; 72: 567-572.
6. Chomienne C, Ballerini P, Balitrand N et al.: All-trans retinoic acid in acute promyelocytic leukemias. II. In vitro studies: structure-function relationship. Blood 1990; 76: 1710-1717.
7. Hoffman E, Mielicki WP: Kwas całkowicie trans-retinowy (ATRA) w prewencji i terapii nowotworów. Postepy Hig Med Dosw 2010; 64: 284-290.
8. Brown G, Hughes P: Retinoid differentiation therapy for common types of acute myeloid leukemia. Leuk Res Treatment 2012; 2012: e939021.
9. Cioch M: Ostra białaczka promielocytowa – postępy w diagnostyce i leczeniu. Acta Hematologica Polonica 2003; 34: 313-323.
10. Hus I, Jawniak D, Salamanczuk Z et al.: Nietypowy przebieg ostrej białaczki promielocytowej z translokacją 15:17, opornej na kwas all-trans retinoinowy. Acta Hematologica Polonica 2001; 32: 207-213.
11. Kamimura T, Miyamoto T, Harada M, Akashi K: Advances in therapies for acute promyelocytic leukemia. Cancer Sci 2011; 102: 1929-1937.
12. Pagoni M, Garofalaki M, Panitsas F et al.: Acute Promyelocytic Leukemia: an Experience on 95 Greek Patients Treated in the All-Trans-Retinoic Acid Era. Mediterr J Hematol Infect Dis 2011; 3: e2011053.
13. Avvisati G: Newly Diagnosed Acute Promyelocytic Leukemia. Mediterr J Hematol Infect Dis 2011; 3: e2011064.
14. Chen GQ, Shi XG, Tang W et al.: Use of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia (APL). I. As2O3 exerts dose-dependent dual effects on APL cells. Bood 1997; 89: 3345-3353.
15. Chen G-Q, Zhu J, Shi X-G et al.: In vitro studies on cellular and molecular mechanisms of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia. As2O3 induces NB4 cell apoptosis with down regulation of Bcl-2 expression and modulation of PML-RAR alpha/PML proteins. Blood 1996; 88: 1052-1061.
16. Sanz MA, Martín G, Rayón C et al.: A modified AIDA protocol with anthracycline-based consolidation results in high antileukemic efficacy and reduced toxicity in newly diagnosed PML/RARalpha-positive acute promyelocytic leukemia. PETHEMA group. Blood 1999; 94: 3015-3021.
17. Hernández JM, Martín G, Gutiérrez NC et al.: Additional cytogenetic changes do not influence the outcome of patients with newly diagnosed acute promyelocytic leukemia treated with an ATRA plus anthracyclin based protocol. A report of the Spanish group PETHEMA. Haematologica 2001; 86: 807-813.
18. Serefhanoglu S, Buyukasik Y, Goker H et al.: Clinical features and outcomes of 49 Turkish patients with acute promyelocytic leukemia who received ATRA and anthracyclines (PETHEMA protocol) therapy. Leuk Res 2010; 34: 317-319.
19. Montesinos P, Sanz MA: The Differentiation Syndrome in Patients with Acute Promyelocytic Leukemia: Experience of the Pethema Group and Review of the Literature. Mediterr J Hematol Infect Dis 2011; 3: e2011059.
20. Bajpai J, Sharma A, Kumar L et al.: Acute promyelocytic leukemia: An experience from a tertiary care centre in north India. Indian J Cancer 2011; 48: 316-322.
otrzymano/received: 2013-07-17 zaakceptowano/accepted: 2013-09-04 Adres/address: *Monika Podhorecka Klinika Hematoonkologii i Transplantacji Szpiku UM ul. Staszica 11, 20-081 Lublin tel.: +48 (81) 534-23-97; fax: +48 (81) 534-56-05 e-mail: monika.podhorecka@onet.pl |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








