|
© Borgis - Postępy Nauk Medycznych 9, s. 651-655
Barbara Sikorska-Fic1, Iwona Malinowska1, Michał Matysiak1, Elżbieta Chmarzyńska-Mróz2, Ewa Bocian3
Przemijający zespół mieloproliferacyjny u noworodka z prawidłowym kariotypem
Transient myeloproliferative disorder in newborn with normal karyotype
1Katedra i Klinika Pediatrii, Hematologii i Onkologii, Akademia Medyczna, Warszawa
Kierownik Kliniki: prof. dr hab. med. Michał Matysiak 2Pracownia Cytogenetyczna Zakładu Patomorfologii Wieku Rozwojowego, Akademia Medyczna, Warszawa Kierownik Pracowni/Zakładu: mgr biol. Elżbieta Chmarzyńska-Mróz 3Zakład Genetyki Medycznej Instytutu Matki i Dziecka, Warszawa Kierownik Zakładu: prof. dr hab. Ewa Bocian Streszczenie
Przemijający zespół mieloproliferacyjny (ang. transient myeloprolferative disorder – TMD) jest rozpoznawany u ok. 10-20% noworodków z trisomią 21, a tylko pojedyncze opisy przypadków TMD dotyczą noworodków z prawidłowym fenotypem. Przedstawiono przypadek noworodka płci męskiej bez fenotypowych cech zespołu Downa, który został przyjęty do Kliniki w 9. dobie życia w stanie ogólnym dobrym. Powodem przyjęcia były obserwowane w oddziale noworodkowym od 4. doby życia i utrzymujące się pomimo antybiotykoterapii hepatosplenomegalia oraz hiperleukocytoza. W morfologii krwi obwodowej stwierdzono leukocytozę 48 000/μL oraz prawidłową liczbę erytrocytów i płytek. W rozmazie leukocytów 60% stanowiły komórki blastyczne. W mielogramie opisano szpik średniobogatokomórkowy z hipoplastycznym układem czerwonokrwinkowym oraz granulocytarnym i obecnością 48% dużych komórek blastycznych. Badanie cytogenetyczne komórek szpiku wykazało nieprawidłowy kariotyp męski 47,XY,+21. W badaniu komórek krwi stwierdzono kariotyp mozaikowy 47,XY,+21/47,XY, a w hodowli fibroblastów skóry prawidłowy kariotyp 46,XY. W badaniach biochemicznych krwi poza podwyższonymi wartościami GGTP (505 IU) i LDH (3371 IU) nie stwierdzono innych odchyleń. Badania mikrobiologiczne pozwoliły wykluczyć infekcję wrodzoną. Sześciotygodniowa obserwacja ze spontaniczną remisją objawów klinicznych i stopniową normalizacją liczby oraz rozmazu leukocytów potwierdziła rozpoznanie TMD. Badanie cytogenetyczne wykonane z fibroblastów skóry pozwoliło wyjaśnić, że opisywany przypadek TMD dotyczył noworodka z prawidłowym kariotypem, a nie dziecka bez fenotypowych cech trisomii 21 z konstytucjonalnym kariotypem mozaikowym. Obecnie w wieku 7 lat dziecko jest w dobrym stanie, a parametry krwi obwodowej przedstawiają się prawidłowo. Słowa kluczowe: przemijający zespół mieloproliferacyjny, białaczka wrodzona, zespół Downa, noworodek
Summary
Transient myeloproliferative disorder (TMD) occurs in 10-20% of infants with trisomy 21. Only single cases of TMD were described in children with normal phenotype. We present a case of a newborn boy without phenotypic features of Down syndrome, who was admitted to our Clinic with hyperleukocytosis and hepatosplenomegaly. Blood tests revealed a white blood cell (WBC) count of 48 000/μL containing 60% blasts, a red blood cells count and a platelet count were normal. Bone morrow examination revealed normo cellular marrow with hypoplastic erythroid and granulocytic lineages and 48% of blasts. Cytogenetic analysis of the bone marrow cells demonstrated abnormal male karyotype (47,XY,+21). Cytogenetic analysis of peripheral blood showed mosaic karyotype 47,XY,+21/46,XY. Karyotype of skin fibroblasts was normal 46,XY. Follow-up studies showed resolution of hepatomegaly and elevated WBC. Diagnosis of TDM was established. Seven years after TAM he remains under observation with normal blood counts. Key words: transient myeloproliferative disorder, leukaemia congenita, Down syndrome, newborn
Wstęp
Przemijający zespół mieloproliferacyjny (ang. transient myeloproliferative disorder – TMD) jest rozpoznawany u ok. 10-20% noworodków z trisomią 21 lub konstytucjonalnym mozaicyzmem z trisomią 21 (zespół Downa) (1-4). Tylko pojedyncze opisy przypadków TMD dotyczą noworodków z prawidłowym fenotypem (5-7).
TMD charakteryzuje się obecnością we krwi obwodowej młodych niedojrzałych komórek hematopoetycznych, które naciekają narządy hematopoezy pozaszpikowej, a ich obecność także w innych ważnych dla życia narządach i układach może stanowić źródło zagrażających życiu powikłań (3, 8). Początkowy obraz kliniczny zespołu nie pozwala na zróżnicowanie z białaczką wrodzoną. Do charakterystycznych objawów klinicznych obu jednostek chorobowych należą zmiany na skórze (bladość, wybroczyny), limfadenopatia, hepatosplenomegalia. W badaniu morfologii krwi obwodowej stwierdza się hiperleukocytozę blastyczną, obecna może być niedokrwistość, małopłytkowość. W przypadku TMD odsetek komórek blastycznych często przekracza odsetek blastów w szpiku. Rozpoznanie wstępne oparte jest na ocenie cytomorfologicznej, immunofenotypowej komórek krwi obwodowej i szpiku (2, 9). Immunofenotyp blastów w TMD odpowiada najczęściej megakarioblastom, czyli podtypowi M7 według klasyfikacji FAB (10). O rozpoznaniu ostatecznym TMD decyduje przebieg kliniczny, tj. spontaniczna remisja w ciągu kilkutygodniowej bądź kilkumiesięcznej obserwacji. U około 30% dzieci z zespołem Downa i TMD w wywiadzie dochodzi w okresie od kilku miesięcy do kilku lat do rozwoju ostrej białaczki megakarioblastycznej (AMKL) (2, 3, 10).
Do rozwoju TMD i AMKL u dzieci z zespołem Downa przyczynia się mutacja somatyczna genu kodującego czynnik transkrypcyjny GATA1 (11, 12). W przypadkach TMD i następującej po niej AMKL z nabytą trisomią 21 występujących niezwykle rzadko u fenotypowo i cytogenetycznie zdrowych niemowląt mutacja GATA1 była badana sporadycznie (13).
Przedstawiamy przypadek noworodka przyjętego do Kliniki w 9. dobie życia z podejrzeniem białaczki wrodzonej.
CEL PRACY
Przedstawienie i przeanalizowanie przypadku przemijającego zespołu mieloproliferacyjnego u noworodka z prawidłowym kariotypem jako jednego z nielicznych podobnych doniesień w piśmiennictwie.
Opis przypadku
Noworodek płci męskiej z ciąży I porodu I urodzony siłami natury w 39 Hbd na 7 pkt Apgar, z masą ciała 3250 g został przyjęty do Kliniki z Oddziału Noworodkowego w 9. dobie życia z podejrzeniem białaczki wrodzonej. Rodzice dziecka byli młodzi, zdrowi, a matka była leczona objawowo w III trymestrze ciąży z powodu infekcji górnych dróg oddechowych. Od 4. doby życia dziecko otrzymywało antybiotyki (Taromentin, Netromycyna) z powodu hepatosplenomegalii, hiperleukocytozy (L-50 x 103/ul) i podejrzenia infekcji wewnątrzmacicznej. Przy przyjęciu do Kliniki stwierdzono stan ogólny dobry, prawidłowy fenotyp oraz hepatosplenomegalię (+5 cm/+4 cm). W rozpoznaniu wstępnym brano pod uwagę białaczkę wrodzoną oraz przemijający zespół mieloproliferacyjny u noworodka bez fenotypowych cech zespołu Downa.
W badaniach dodatkowych w morfologii krwi obwodowej stwierdzono hiperleukocytozę blastyczną (L-48 x 103/ul, w rozmazie blasty 60%) z prawidłowymi pozostałymi parametrami (Hb – 14,1 g/dl, E – 4,5 x 106/ul, pł – 400 x 103/ul). W mielogramie szpik był średniobogatokomórkowy z hipoplastycznym układem czerwonokrwinkowym oraz granulocytarnym i obecnością 58% dużych blastów. W badaniu cytochemicznym szpiku stwierdzono: POX 100% (-), Sudan 10% (+), PAS 100% (-), Esteraza 45% (+++), 26% (++++), fosfataza kwaśna 28% (+), 6% (++). Badanie immunofenotypu komórek szpiku wykazało nieprawidłową populację komórek o fenotypie CD7, CD4, CD34 z koekspresją antygenów linii mieloidalnej CD33. W badaniu cytogenetycznym komórek szpiku stwierdzono nieprawidłowy kariotyp męski 47,XY,+21 [25], a we krwi obwodowej nieprawidłowy, mozaikowy kariotyp męski 47,XY,+21 [4]/46,XY [21] (ryc. 1). W celu wykluczenia u dziecka konstytucjonalnego kariotypu mozaikowego wykonano biopsję skóry, stwierdzając w badaniu cytogenetycznym fibroblastów prawidłowy kariotyp męski 46,XY (ryc. 2). W badaniach biochemicznych krwi poza podwyższonymi wartościami GGTP (505 IU) i LDH (3371 IU) nie stwierdzono innych odchyleń. Badania mikrobiologiczne oraz w kierunku toksoplazmozy, CMV, EBV, HBV, HCV były ujemne. Postawienie ostatecznego rozpoznania wymagało dalszej obserwacji pacjenta, jego stanu klinicznego oraz dynamiki zmian parametrów morfologii krwi obwodowej i szpiku.
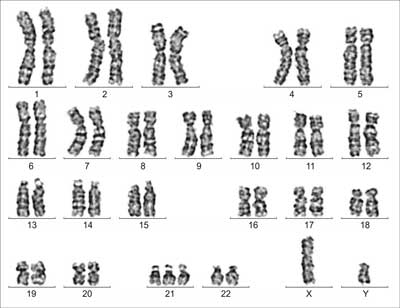 Ryc. 1. Badanie cytogenetyczne komórek ze szpiku i krwi obwodowej: szpik – nieprawidłowy kariotyp męski 47,XY,+21 [25]; krew obwodowa – nieprawidłowy, mozaikowy kariotyp męski 47,XY,+21 [4]/46,XY [21].
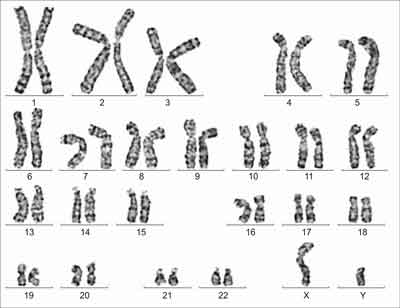 Ryc. 2. Badanie cytogenetyczne z fibroblastów skóry – prawidłowy kariotyp męski 46,XY.
Stan kliniczny pacjenta w okresie hospitalizacji był stabilny, nie wymagał żadnych poważnych interwencji. W ciągu 5 tygodni ustąpiła hepatosplenomegalia, liczba krwinek białych i rozmaz znormalizowały się po 6 tygodniach (ryc. 3 i 4). Z powodu anemizacji w 4. tygodniu życia (Hb – 8,8 g/dl, E – 2,37 x 106/ul) zastosowano erytropoetynę. Po 4 tygodniach leczenia (10 dawek po 500 j.) zaobserwowano pojawiający się stopniowo spadek liczby płytek do 47 x 103/ul (ryc. 5). Objaw nietypowy dla leczenia erytropoetyną ustąpił w okresie tygodnia po odstawieniu leku. W kontrolnym mielogramie wykonanym w tym momencie, tj. po 6 tygodniach obserwacji stwierdzono szpik bogatokomórkowy z odsetkiem blastów 3%, a badanie cytogenetyczne wykazało prawidłowy kariotyp komórek szpiku. Taki przebieg kliniczny ze spontaniczną normalizacją liczby leukocytów i blastów we krwi obwodowej w trakcie 5-tygodniowej obserwacji, wynik badania kontrolnego szpiku, wynik badania cytogenetycznego fibroblastów skóry pozwolił wykluczyć białaczkę wrodzoną i rozpoznać ostatecznie TMD u noworodka z prawidłowym kariotypem.
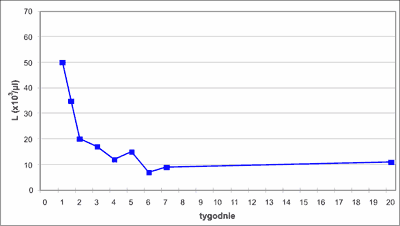 Ryc. 3. Zmiany liczby leukocytów we krwi obwodowej w trakcie obserwacji.
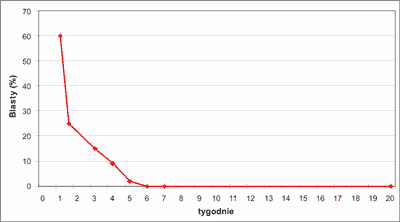 Ryc. 4. Zmiany liczby blastów we krwi obwodowej w trakcie obserwacji.
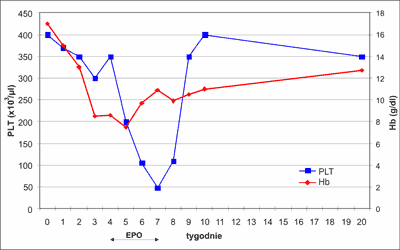 Ryc. 5. Niedokrwistość I kwartału z towarzyszącą małopłytkowością w trakcie obserwacji.
Dziecko pozostawało pod ścisłą kontrolą Poradni Hematologicznej, a obecnie po 7 latach obserwacji jest w dobrym stanie ogólnym i pozostaje w remisji hematologicznej.
Dyskusja
Przejściowy zespół mieloproliferacyjny jest opisywany głównie u noworodków z zespołem Downa (1-4). Tylko pojedyncze opisy dotyczą TMD u dzieci bez fenotypowych cech zespołu Downa, u których trisomia chromosomu 21 występuje wyłącznie w komórkach blastycznych (5-7). Wstępne rozpoznanie TMD w oparciu o objawy kliniczne, ocenę cytomorfologii, immunofenotypu i kariotypu komórek szpiku wymaga różnicowania z białaczką wrodzoną. Objawy kliniczne towarzyszące TMD mogą niekiedy, podobnie jak w białaczce wrodzonej, wiązać się ze stanem zagrożenia życia. Do takich powikłań TMD wymagających pilnej interwencji należą niewydolność wątroby, niewydolność nerek, zespół lizy guza, zespół leukostazy, zespół wykrzepiania wewnątrznaczyniowego, posocznica (2, 5, 8). W większości przypadków TMD dochodzi jednak bez leczenia do samoistnej spontanicznej remisji w ciągu kilkutygodniowej lub kilkumiesięcznej obserwacji, co decyduje o ostatecznej diagnozie. Taki przebieg kliniczny opisaliśmy właśnie u naszego pacjenta. Nietypowe było rozpoznanie TMD u dziecka z prawidłowym fenotypem. Wykonanie badania cytogenetycznego z fibroblastów skóry pozwoliło jednoznacznie wyjaśnić, że opisywany przypadek dotyczył noworodka z prawidłowym kariotypem, a nie dziecka bez fenotypowych cech trisomii 21 z konstytucjonalnym kariotypem mozaikowym. Takie rozpoznanie zostało potwierdzone również przez kontrolne badanie cytogenetyczne szpiku w momencie remisji, które wykazało prawidłowy kariotyp równoznaczny z wycofaniem się klonu komórek z trisomią 21.
W przypadku TMD u noworodków z zespołem Downa pomimo spontanicznej remisji u około 20-30% z nich dochodzi w okresie od kilku miesięcy do kilku lat do rozwoju AMKL (2, 3, 10). Częstość występowania w późniejszym wieku choroby rozrostowej układu krwiotwórczego u noworodków z TMD i prawidłowym fenotypem, ze względu na wyjątkowo niską liczbę opisywanych przypadków nie jest znana. W przypadku naszego pacjenta po spontanicznej remisji TMD 7-letnia obserwacja nie wykazała w badaniu klinicznym i w kontrolnych badaniach morfologii krwi obwodowej i szpiku żadnych cech choroby rozrostowej.
Wnioski
Za rozpoznaniem przemijającego zespołu mieloproliferacyjnego (TMD) u noworodka z prawidłowym kariotypem przemawiały:
1. początkowy obraz kliniczny, wynik mielogramu i rozmazu leukocytów,
2. spontaniczna normalizacja liczby leukocytów i blastów we krwi obwodowej w trakcie 6-tygodniowej obserwacji,
3. wykluczenie konstytucjonalnego kariotypu mozaikowego w oparciu o wynik badania cytogenetycznego fibroblastów skóry. Piśmiennictwo
1. Sobol G, Mizia A, Wilk-Tyl J et al.: Przemijający zespół mieloproliferacyjny u noworodka z zespołem Downa. Przegląd Pediatryczny 2002; 32(2): 158-162.
2. Brink DS: Transient leukemia (transient myeloproliferative disorder, transient abnormal myelopoiesis) of Down syndrome. Adv Anat Pathol 2006; 13(5): 256-262.
3. Hasle H, Clemmensen IH, Mikkelsen M: Risks of leukaemia and solid tumours in individuals with Down’s syndrome. The Lancet 2000; 355:165-169.
4. Bozner P: Transient myeloproliferative disorder with erythroid differentiation in Down syndrome. Arch Pathol Lab Med 2002; 126: 474-477.
5. Cufhing T, Clericuzio CL, Wilson CS et al.: Risk for leukemia in infants without Down syndrome who have transient myeloproliferative disorder. The Journal of Pediatrics 2006 May; 148(5): 687-689.
6. Solky BA, Yang FC, Xu X et al.: Transient myeloproliferative disorder causing a vesiculopustular eruption in a phenotypically normal neonate. Pediatr Dermatol 2004; 21(5): 551-554.
7. Richards M, Welch J, Watmore A et al.: Trisomy 21 associated transient neonatal myeloproliferation in the absence of Down’s syndrome. Childhood 1998; 79(3): 215-217.
8. Abe Y, Mizuno K, Horie H et al.: Transient abnormal myelopoiesis complicated by tumor lysis syndrome. Pediatrics International 2006; 48: 489-492.
9. Sońta-Jakimczyk D, Szczepański T: Białaczka u noworodków i niemowląt. Przegląd Lekarski 2003; 60(5):9-12.
10. Lngebrake C, Creutzig U, Reinhardt D: Immunophenotype of Down syndrome acute myeloid leukemia and transient myeloproliferative disease differs significantly from other diseases with morphologically identical or similar blasts. Klin Padiatr 2005; 217(3): 126-134.
11. Ahmed M, Sternberg A, Hall G et al.: Natural history of GATA1 mutations in Down syndrome. Blood 2004; 103(7): 2480-2489.
12. Vyas P, Crispino JD: Molecular insights into Down syndrome-associated leukemia. Curr Opin Pediatr 2007; 19(1): 9-14.
13. Magalhães IQ, Splendore A, Emerenciano M et al.: Transient neonatal disorder without Down syndrome and detection of GATA1 mutation. J Pediatr Hematol Oncol 2005; 27(1): 50-52.
otrzymano/received: 2013-07-22 zaakceptowano/accepted: 2013-08-26 Adres/address: *Barbara Sikorska-Fic Klinika Pediatrii, Hematologii i Onkologii WUM ul. Marszałkowska 24, 00-576 Warszawa tel.: +48 (22) 621-53-62 e-mail: basiasf@poczta.onet.pl Artykuł Przemijający zespół mieloproliferacyjny u noworodka z prawidłowym kariotypem w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








