|
© Borgis - Postępy Nauk Medycznych 8, s. 565-571
*Jacek Piłat1, Sławomir Rudzki1, Jacek Bicki1, Tadeusz Dryka1, Wojciech Dąbrowski2
Diagnostyka zmian nienowotworowych kanału odbytu z zastosowaniem ultrasonografii 3D
Diagnosis of non-neoplastic changes in the anal canal using 3D ultrasound
1I Katedra i I Klinika Chirurgii Ogólnej, Transplantacyjnej i Leczenia Żywieniowego, Uniwersytet Medyczny, Lublin
Kierownik Katedry: dr hab. med. Sławomir Rudzki, prof. nadzw. UM 2Katedra i I Klinika Anestezjologii i Intensywnej Terapii, Uniwersytet Medyczny, Lublin Kierownik Katedry: prof. dr hab. med. Andrzej Nestorowicz Streszczenie
Autorzy przedstawiają anatomię kanału odbytu wraz z instrumentami używanymi we współczesnej diagnostyce najczęściej spotykanych nienowotworowych chorób kanału odbytu. W pracy podają podstawowe zasady wykonywania badania usg kanału odbytu, przy użyciu doodbytniczej sondy rotacyjnej, oraz wymagania sprzętowe. Opisują anatomię ultrasonograficzną struktur kanału odbytu z zastosowaniem metody 3D i zalety obrazowania przestrzennego, oraz nomenklaturę stosowaną w opisach badania usg. Przedstawiają różnice w budowie kanału odbytu w zależności od płci i zmiany zachodzące w kompleksie zwieraczy wraz z wiekiem. W dalszej części pracy przedstawiono etiologię powstawania ropni i przetok okołoodbytniczych i cechy charakterystyczne w badaniu usg tych zmian chorobowych. Różne metody dokładnego ich obrazowania, szczególnie z użyciem wody utlenionej i inne stosowane techniki ułatwiające prawidłową diagnostykę usg tych zmian. Porównują różne metody używane w diagnostyce ropni i przetok okołoodbytniczych, ich dokładność w odnajdywaniu ujścia wewnętrznego i kryteria jego odnalezienia w badaniu usg odnosząc to do historycznych metod diagnostycznych. W dalszej części artykułu przedstawiają problemy uszkodzenia zwieraczy odbytu i nietrzymania stolca. Porównują metody używane w diagnostyce uszkodzeń zwieraczy odbytu ich wady i zalety. Przedstawiają cechy charakterystyczne w badaniu usg dla uszkodzeń zwieraczy, trudności interpretacyjne i popełniane błędy. Wskazują na celowość badań określających uszkodzenie zwieraczy odbytu w aspekcie roszczeń pacjentów po różnych procedurach proktologicznych i ginekologicznych. Słowa kluczowe: EAUS (ultrasonografia kanału odbytu), ropień okołoodbytniczy, przetoka okołoodbytnicza, zwieracze odbytu
Summary
The authors describe the anatomy of the anal canal, along with the instruments used in modern diagnosis of the most common non-cancerous anal canal diseases. In this paper give the principal performing ultrasound examination of the anal canal using a rectal probe rotational and hardware requirements. We describe the sonographic anatomy of the anal canal structures using the method of 3D imaging and benefits planning, and the nomenclature used in the descriptions of ultrasound examination. The differences in the construction of the anal canal, depending on gender and the evolution of the sphincter complex with age. Later in the paper the etiology of abscesses and anal fistulas and characteristics of the ultrasound examination. these lesions. Various methods of thorough imaging, particularly with the use of hydrogen peroxide and other techniques used to facilitate the correct ultrasound diagnosis of these changes. Compare the different methods used in the diagnosis of perianal abscesses and fistulas, their accuracy in finding the internal enterance and the criteria for its finding on ultrasound examination with reference to the historical methods of diagnosis. Later in this article show the damage to the anal sphincter and problems with incontinence. Compared to the methods used in the diagnosis of anal sphincter damage their advantages and disadvantages. They represent the characteristics of the ultrasound examination of the anal sphincter damage, difficulties of interpretation and mistakes. They point to the desirability of tests to determine the damage to the anal sphincter in the context of claims of patients with different proctologic and gynecological procedures. Key words: EAUS (endoanal ultrasound), abscessus perianalis, fistula perianalis, anal sphincters
Wstęp
Nienowotworowe choroby kanału odbytu są częstymi dolegliwościami, z którymi spotykamy się w codziennej praktyce lekarskiej. Możliwości diagnostyczne wraz z coraz większymi osiągnięciami techniki stają się coraz bardziej wyrafinowane. W protokole badania proktologicznego badanie fizykalne jest zawsze podstawowe, a metody obrazowania uściślają i poszerzają nasze metody diagnostyki. Tak więc w diagnostyce chorób kanału odbytu możemy wspierać się badaniami manometrycznymi, defekograficznymi, CT, MR i badaniem usg kanału odbytu (EAUS). Stworzenie sondy ultrasonograficznej z wirującym w płaszczyźnie 360 stopni kryształem o średnicy umożliwiającej komfortowe badania kanału odbytu dało możliwość badania wszystkich struktur kanału odbytu jednocześnie, bez ich zniekształcenia, z możliwością ich wzajemnego porównywania. Dodatkowo opcja obrazowania w trzech wymiarach dała możliwość oceny każdej części kanału z dowolnej perspektywy. Powtarzalność metody bez obciążania i narażania chorego w przypadku badania usg stawia tę metodę jako jedną z ważniejszych w diagnostyce uzupełniającej chorób kanału odbytu, mimo pewnych jej ograniczeń.
Badanie wymaga użycia sondy o wysokiej częstotliwości 10-16 MHz i dającej możliwość obrazowania w 360 stopniach. Takie wymagania spełnia sonda z głowicą rotacyjną firmy Bruel i Kjaer (B-K) o symbolu 20-50 i aparat B-K Pro-Focus.
Badanie wykonuje się w pozycji leżącej na plecach lub Simsa (na lewym boku). Zawsze należy „zorientować” sondę tak, aby na górze (godzina 12.) było krocze, a na dole (godzina 6.) kość ogonowa. W takim położeniu sondy po prawej stronie ekranu będzie lewa strona pacjenta i odwrotnie. Prawidłowe położenie sondy jest bardzo ważnym elementem wpływającym na ostateczny wynik badania i dodatkowo pomaga w prawidłowej ocenie symetrii struktur kanału odbytu. Wprowadzenie sondy per vaginam u kobiet daje dodatkowo możliwość oceny kanału odbytu, a szczególnie symetrię poszczególnych struktur mięśniowych (1).
Kanał odbytu utworzony jest ze zwieracza zewnętrznego zbudowanego z mięśni poprzecznie prążkowanych okrężnie obejmującego odbyt i zwieracza wewnętrznego zbudowanego z mięśniówki gładkiej pochodzącej z mięśniówki jelita, składającej się z dwóch warstw: podłużnej (nie zawsze widocznej w badaniu usg) i okrężnej – leżącej najbliżej światła kanału odbytu. Dodatkowo odbyt otoczony jest pętlą mięśnia łonowo- -odbytniczego okrężnie od strony kości ogonowej, obejmującą najwyższą część kanału odbytu i z przodu przyczepami łączącą się z kością łonową. Włókna zwieracza zewnętrznego w najwyższej części kanału odbytu łączą się z mięśniem łonowo-odbytniczym, tworząc pierścień anorektalny. Od przodu (od strony odkroczowej) pierścień mięśniowy jest najsłabszy – brak otoczenia przez mięsień łonowo-odbytniczy MŁO i u kobiet krótszy, co zostało udowodnione już w życiu płodowym, płodów żeńskich (2, 3). Dodatkowo od przodu nakłada się mięsień poprzeczny krocza. Wszystkie opisane struktury stanowią czynnościową całość wzajemnie współpracującą i zawsze muszą być tak rozpatrywane (ryc. 1).
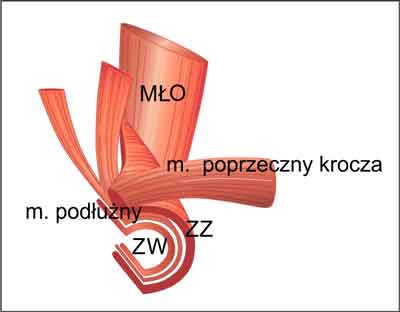 Ryc. 1. Przestrzenny układ mięśni odbytu: ZW – zwieracz wewnętrzny, ZZ – zwieracz zawietrzny, MŁO – mięsień łonowo-odbytniczy.
Dla potrzeb usg kanału odbytu (EAUS) ustalono (Bertram) trzy poziomy różniące się między sobą budową anatomiczną:
– poziom powierzchowny – w badaniu usg widoczna podskórna część zwieracza zewnętrznego (ZZ) (ryc. 2),
 Ryc. 2. Część powierzchowna.
– poziom środkowy – w badaniu usg widoczne: więzadło odbytniczo-ogonowe (LAC), powierzchowna część zwieracza zewnętrznego, zwieracz wewnętrzny (ZW), centrum ścięgniste krocza i pochwa u kobiet (ryc. 3),
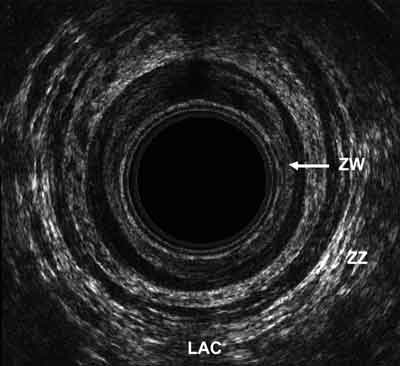 Ryc. 3. Część środkowa.
– poziom głęboki – w badaniu usg widoczna głęboka część zwieracza zewnętrznego, zwieracz wewnętrzny i pierścień mięśnia łonowo-odbytniczego (MŁO) (ryc. 4) (4).
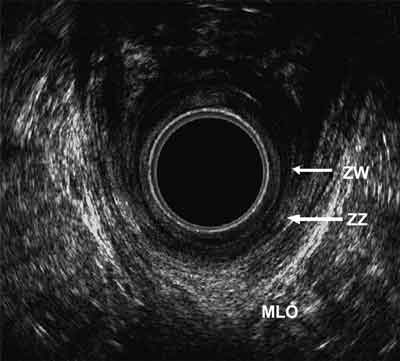 Ryc. 4. Część głęboka.
Mięśnie otaczające kanał odbytu różnią się w części niskiej i wysokiej kanału odbytu, również różnią się w zależności od płci i wieku. Część niska otoczona jest zwieraczem wewnętrznym (wraz z warstwą podłużną mięśni) i zewnętrznym, a część głęboka przez zwieracz wewnętrzny (również z podłużną warstwą mięśniową) i przez MŁO. W części głębokiej po stronie odkroczowej zwieracz zewnętrzny jest skrócony u kobiet, ponieważ włókna te przechodząc od tylnej części kanału do przodu (kierunek odkroczowy), skupiają się. Dodatkowo od strony odkroczowej jest mięsień poprzeczny krocza, który przesłania odkroczową część kanału odbytu. U mężczyzn zwieracz zewnętrzny jest symetryczny (5).
Grubość zwieraczy określa się w środkowej części kanału odbytu na godzinie trzeciej i szóstej prawidłowo zorientowanej sondy, tj. po stronie lewej i odogonowej. Średnia grubość zwieracza zewnętrznego to 8,6 mm ± 1,1 mm u mężczyzn i 7,7 mm ± 1,1 mm u kobiet. Grubość zwieracza wewnętrznego waha się od 1,5 do 4 mm (średnio 3,5 mm ± 0,5 mm) (4).
Wraz z wiekiem kanał odbytu zmienia swoją „echogeniczność” z powodu coraz większej ilości tkanki łącznej, która przerasta zwieracze. Hypoechogeniczny zwieracz wewnętrzny staje się bardziej zbliżony do hyperechogenicznego zwieracza zewnętrznego i nieco grubszy. Daje to efekt, że wraz z wiekiem zwieracz staje się grubszy, ale ma też mniej funkcjonujących włókien mięśniowych. Mięśnie stają się słabsze, a objawy ich niewydolności pojawiają się i nasilają wraz z wiekiem (5, 6).
Kontrowersyjnym i niewyjaśnionym pozostaje korelacja echogeniczności i grubości zwieraczy z badaniami manometrycznymi (7, 8).
Diagnostyka
Ropnie i przetoki okołoodbytnicze
W kanale odbytu na wysokości linii grzebieniastej w zatokach Morgagniego znajdują się odbytowe gruczoły cewkowe. Ich zadaniem jest nawilżanie kanału odbytu. Sięgają one do przestrzeni międzyzwieraczowej, przebijając zwieracz wewnętrzny odbytu, jest ich od 4 do 10. W przypadku gdy dojdzie do zastoju wydzieliny i jej zakażenia, rozwija się proces zapalny – jest to kryptoglandularna teoria powstawania ropni/przetok okołoodbytniczych (ryc. 5).
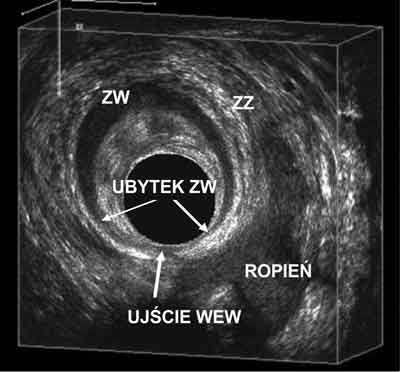 Ryc. 5. Duży ropień ponadzwieraczowy z widocznym ujściem wewnętrznym w okolicy krypty odogonowej z ubytkiem zwieracza wewnętrznego i jego kompensacyjnym przerostem odkroczowo.
W zależności od kierunku rozprzestrzeniania się ostrego zakażenia, ropień powstaje w przestrzeni: miedniczno-odbytniczej (ponaddźwigaczowej), kulszowo-odbytniczej (poddźwigaczowej), międzyzwieraczowej (niskie i wysokie) i powierzchownej (podskórne i podśluzówkowe). Rozpoznanie ropnia okołoodbytniczego z reguły w badaniu fizykalnym nie przedstawia problemu (ból, podwyższona temperatura, chełbotanie, zaczerwienienie i tkliwe uwypuklenie w okolicy odbytu). Im wyżej – głębiej leżący ropień, tym jego objawy miejscowe mogą być dyskretniejsze lub nieuchwytne przy braku manifestacji objawów w okolicy odbytu (9). Jednak w przypadku małych ropni leżących głęboko lub ropni klepsydrowatych, nie zawsze samo badanie fizykalne jest wystarczające, aby skutecznie zdrenować ropień. Według danych literaturowych blisko 10% ropni okołoodbytniczych wymaga reoperacji z powodu złego drenażu ropnia (10). Ropień widoczny jest jako zmiana normo-hypoechogeniczna z obecnością gazu. Jednak w przypadku ropni leżących głęboko i/lub podkowiastych problemem jest różnicowanie ropnia z otaczającą tkanką tłuszczową (ryc. 6) (11).
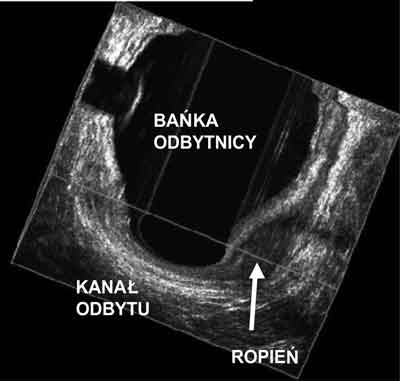 Ryc. 6. Mały ropień tuż za kanałem odbytu w bańce odbytnicy (nadzwieraczowy) – badanie bańki odbytnicy z balonem wodnym.
Dane literaturowe przedstawiają przewagę badania MR nad EAUS w ocenie retencji płynowej w przestrzeni ponadzwieraczowej (12). Jednak w ocenie samego kanału odbytu i ropni tam umiejscowionych EAUS wydaje się mieć lepsze efekty, szczególnie w opcji 3D (13, 14).
Przetoka jest zdefiniowana jako patologiczne połączenie między jelitem a pęcherzem lub innym jelitem (wewnętrzna przetoka), lub skórą, pochwą (zewnętrzne przetoka) (15).
Według obecnych teorii ropień okołoodbytniczy i przetoka są tą samą chorobą tylko w fazie ostrej i przewlekłej (16, 17). Prawidłowo leczone ropnie okołoodbytnicze w około 40% kończą się przetoką okołoodbytniczą (18).
Według Parksa wyróżnia się cztery główne typy przetok okołoodbytniczych:
– międzyzwieraczowa (najczęstsza) – 70%,
– przezzwieraczowa – 23%,
– nadzwieraczowa – 2%,
– pozazwieraczowa – 5%.
Przetoka może opróżniać się do kanału odbytu przez ujście wewnętrzne z reguły w krypcie odbytniczej (niekompletna) lub przez ujście zewnętrzne umiejscowione na skórze w okolicy odbytu (kompletna). Umiejscowienie ujścia zewnętrznego stało się podstawą do utworzenia teorii Salomona, która pozwala w ponad 50% przypadków trafnie określić ujście wewnętrzne przetoki w przedniej części kanału, a do 80% w ujściu tylnym. Odnalezienie ujścia wewnętrznego i rozgałęzień przetoki ma fundamentalne znaczenie w planowaniu i powodzeniu zabiegu operacyjnego. W chwili obecnej badania MR i EAUS są uznawane jako badania z wyboru w diagnostyce przetok okołoodbytniczych (14, 19).
W ultrasonografii przetoka opisywana jest jako hypoechogeniczny kanał z reguły wychodzący z jednej z krypt odbytniczych i łączący się różnie przebiegającą drogą z ujściem zewnętrznym. Jeżeli w przetoce znajduje się gaz, w jej obrębie pojawiają się hyperechogeniczne echa. W diagnozowaniu wysokich przetok obecność powietrza między sondą a dystalną częścią kanału odbytu daje artefakty utrudniające prawidłową ocenę. Czasami w celu potwierdzenia ujścia wewnętrznego i/lub obecności rozgałęzień przetoki stosuje się wodę utlenioną jako środka kontrastującego w ultrasonografii, która przy dodatkowym zastosowaniu opcji 3D zwiększa czułość i swoistość metody, stawiając ją prawie na równi z badaniem MR (20, 21). Niektórzy autorzy wykazują przewagę EAUS 3D w wykrywaniu zbiorników płynowych i okrężnych odgałęzień przetoki w porównaniu do badania MR (ryc. 7 i 8) (14).
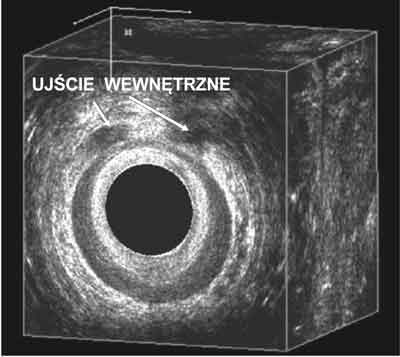 Ryc. 7. Przetoka z dwoma ujściami wewnętrznymi po stronie odkroczowej.
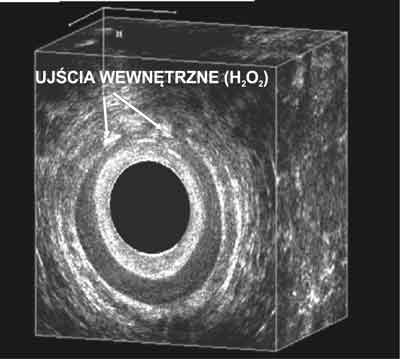 Ryc. 8. To samo badanie z użyciem wody utlenionej.
W celu identyfikacji ujścia wewnętrznego przetoki stosuje się kryteria wprowadzone przez Cho:
– hipoechogeniczny cień, kanał dochodzący do warstwy międzyzwieraczowej,
– hipoechogeniczny cień, kanał dochodzący do warstwy międzyzwieraczowej połączony z uszkodzeniem zwieracza wewnętrznego odbytu,
– hipoechogeniczny cień, kanał dochodzący do warstwy podśluzówkowej.
Odnalezienie jednego z ww. kryteriów upoważnia nas do rozpoznania ujścia wewnętrznego przetoki, a ich połączenie zwiększa czułość badania (22).
Dodatkowo opcja Volume Render Mode (VRM) pozwala na wyraźniejsze zobrazowanie płynnej zawartości w kanale przetoki, co pomaga w różnicowaniu blizn z czynną chorobą – bardzo ważne przy przetokach nawrotowych. Opcja ta jest również bardzo pomocna, gdy mamy przetokę niekompletną, z brakiem możliwości podania kontrastu (23).
Szczególne miejsce w diagnostyce ultrasonograficznej mają przetoki odbytniczo-pochwowe, gdzie zalety ultrasonografii są dyskusyjne, a doniesienia sprzeczne (13, 24).
Na uwagę zasługuje metoda z wprowadzanie palca do pochwy, którego zadaniem jest wprowadzenie powietrza (dobrze identyfikowalnego w badaniu usg) do przetoki z pochwy (25).
Uszkodzenia zwieraczy
Wielu pacjentów z zaburzeniami utrzymywania stolca ma nieuszkodzone zwieracze, a ich dolegliwości związane są z zaburzeniami neurologicznymi lub włóknieniem zwieraczy (26).
Zaburzenia utrzymywania stolca pojawiają się w około 7% przypadków pacjentek, u których podczas porodu drogami naturalnymi dochodzi do uszkodzenia zwieraczy odbytu i jest to najczęstsza przyczyna nietrzymania stolca (27).
Statystyki nietrzymania stolca po operacjach proktologicznych, w czasie których dochodzi do konfliktu z kompleksem zwieraczy odbytu, są trudne do oszacowania. W większości przypadków dopiero wraz z wiekiem dochodzi do powstawania objawów nietrzymania stolca, z powodu osłabienia mniej lub bardziej uszkodzonych zwieraczy i przerastania ich tkanką łączną. Autorzy podają, że nawet do 30% pacjentów ma problemy z utrzymywaniem stolca (28).
Jako standard w diagnostyce rozmiaru i miejsca uszkodzenia kompleksu zwieraczy uważa się badania EAUS i MR (29, 30). Według niektórych autorów obie metody wzajemnie się uzupełniają diagnostycznie (31). Mają one swoje zalety i wady. MR jest dokładne, ale drogie, trudno dostępne, niedostępne dla pacjentów z klaustrofobią, mało komfortowe. Usg jest dobrze tolerowane przez pacjentów, niedrogie, łatwo osiągalne i równie dobrze określa miejsce uszkodzenia zwieraczy. Usg w opcji 3D jest oceniane na podobnym poziomie czułości i swoistości co badanie MR w wykrywaniu uszkodzonych zwieraczy (ryc. 9) (32).
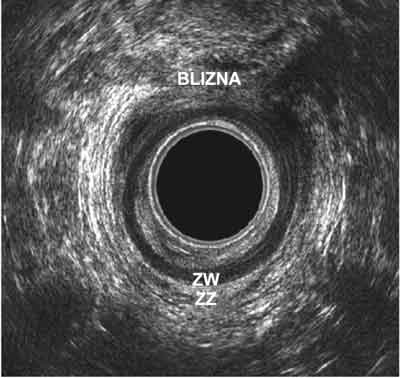 Ryc. 9. Blizna dochodząca odkroczowo do ZW (uraz okołoporodowy).
Zwieracz wewnętrzny odbytu jest bardzo dobrze zdefiniowany w badaniu usg, jako hypoechogeniczne echo i każde jego przerwanie jest wyraźnie widoczne, czasami możemy obserwować kompensacyjny przerost mięśnia – zgrubienie po przeciwnej stronie od uszkodzenia (ryc. 10). W uszkodzeniach zwieracza zewnętrznego można zauważyć pewną przewagę MR nad EAUS (lepsza możliwość definiowania mięśnia, blizny i tkanki tłuszczowej). Jednak sama blizna z reguły jest dobrze widoczna w badaniu usg (32). Niektórzy autorzy przywiązują dużą uwagę do pomiarów centrum ścięgnistego krocza, uważając, że jeżeli jest mniejsze niż 10 mm, to świadczy to o uszkodzeniu odkroczowej części zwieraczy (32, 33).
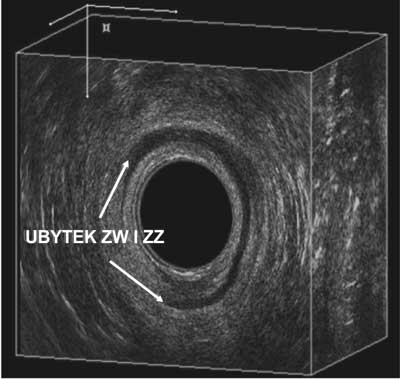 Ryc. 10. Ubytek ZW i ZZ prawostronny w około 1/3 obwodu (stan po operacji przetoki okołoodbytniczej).
Należy również zwrócić uwagę na błędną interpretację w trakcie badania usg odkroczowej części zwieracza zewnętrznego, gdzie w części głębokiej poniżej mięśnia łonowo-odbytniczego może być jego ubytek (fizjologiczny), błędnie interpretowany jako defekt (6).
Innym bardzo ważnym aspektem dokładnej oceny zwieraczy jest możliwość roszczeń pacjentów po zabiegach proktologicznych. Chodzi głównie o pacjentów z przeszłością proktologiczną lub ginekologiczną, u których planowane są zabiegi proktologiczne. Udokumentowanie istniejących wcześniej zmian wydaje się koniecznością przy planowaniu kolejnej interwencji proktologicznej. Piśmiennictwo
1. Santoro GA, Wieczorek AP, Dietz HP et al.: State of art: an integrated approach to pelvic floor ultrasonography. Ultrasound Obsted Gynecol 2011; 37: 381-396.
2. Fritsch H, Brenner E, Lienemann A, Ludwikowski B: Anal sphincter complex: reinterpreted morphology and its clinical relevance. Dis Colon Rectum 2002; 45: 188-194.
3. Kołodziejczak M, Sudoł-Szopińska I: Podstawy anatomiczne leczenia operacyjnego chorób proktologicznych – budowa odbytnicy, kanału odbytu i układu mięśni zwieraczy. Nowa Medycyna 2008; 4: 10-14.
4. Santoro GA, Falco G: Atlas of Endoanal and Endorectal Ultrasonography. Springer 2003: 29-46.
5. Sergio F, Regadas P, Sthela M et al.: Anal canal anatomy showed by tree-dimensional anorectal ultrasonography. Surg Endosc 2007; 21: 2207-2211.
6. Gulgun E: Endosonographic Imaging of Anorectal Diseases. J Ultrasound Med 2006; 25: 57-73.
7. Sboarina A, Minicozzi A, Segattini C et al.: Shape and volume of internal anal spincter showed by tree-dimensional anorectal ultrasonography. Eur J Radiol 2012 Jul; 81(7): 1479-1482.
8. Voyvodic F, Rieger NA, Skinner S et al.: Endosonographic imaging of anal sphincter injury: does the size of the tear correlate with the degree of dysfunction? Dis Colon Rectum 2003 Jun; 46(6): 735-741.
9. Vigano Ch, Losco A, Caprioli F, Basilisco G: Incidence and Clinical Outcomes of Intersphincteric Abscess Diagnosed by Anal Ultrasonography In Patients with Crohn’s Disease. Inflamm Bowel Dis 2011; 17: 2102-2108.
10. Onaca N, Hirshberg A, Adar R: Early reoperation for perirectal abscess. Dis Colon Rectum 2001; 44: 1469-1473.
11. Sudoł-Szopińska I: Postępy w badaniach usg w proktologii. Ultrasonografia 2009; 39: 32-41.
12. Maier AG, Funovics MA, Kreuzer SH: Evaluation of perianal sepsis: comparison of anal endosonography and magnetic rezonanse imaging. J Magn Reson Imaging 2001; 14: 254-260.
13. Orsoni P, Barthet M, Portier F: Prospective comparison of endosonography, magnetic resonance imaging and surgical findings in ano-rectal fistula and abscess complicating Crohn’s disease. Br J Surg 1999; 86: 360-364.
14. Gravante G, Giordano P: The role of tree-dimensional endoluminal ultrasound imagingin the evaluation of anorectal diseases: a reviev. Surg Endosc 2008; 22: 1570-1578.
15. Hvas CL, Dahlerup JF, Jacobsen BA, Ljungmann K: Diagnosis and treatment of fistulising Crohn Diseases. Dan Med Bull 2011 Oct; 58(10): C433.
16. Parks AG, Gordon PH, Hardcastle JD: A classification of fistula In ano. Br J of Surg 1976; 63: 1-12.
17. Herman R, Cegielny T: Wytyczne opracowane w oparciu o zalecenia Association of Coloproctology of Great Britain and Irleand, 2006.
18. Kołodziejczak M, Sudoł-Szopińska I: Diagnostyka i leczenie ropni i przetok odbytu. Wydawnictwo Borgis, Warszawa 2008.
19. Herbst F: Pelvic radiological imaging: a surgeon’s perspectiva. Eur J Radiol 2003 Aug; 47(2): 135-141.
20. West RL, Zimmerman DDE, Dwarkasing S et al.: Prospective Comparison of Hydrogen Peroxide – Enhanced Tree-Dimensional Endoanal Ultrasonography and Endoanal Magnetic Resonance Imaging of Perianal Fistulas. Dis Colon Rrectum 2003; 46: 1407-1415.
21. Siddiqui MR, Ashrafian H, Tozer P et al.: A Diagnostic Accuracy Meta-analysis of endoanal Ultrasound and MRI for Perianal Fistula Assessment. Dis Colon Rectum 2012 May; 55: 576-585.
22. Cho DY: Endosonographic criteria for an internal opening of fistula-in ano. Dis Colon Rectum 1999; 42: 515-519.
23. Santoro GA, Fortling B: The advantages of volume rendering in tree-dimensional endosonography of the anorectum. Dis Colon Rectum 2006; 50: 359-368.
24. Yee LF, Birnbaum EH, Read TE et al.: Use of endoanal ultrasound in patients with rectovaginal fistulas. Dis Colon Rectum 1999 Aug; 42(8): 1057-1064.
25. Kołodziejczak M, Sudoł-Szopińska I, Maletka A: Przetoki odbytniczo-pochwowe – aktualne postępowanie diagnostyczne i terapeutyczne. Nowa Medycyna 2008; 1: 7-10.
26. Stocker J, Halligan S, Bartram C: Pelvic floor imaging: state of art. Radiology 2001; 218: 621-641.
27. Christensen AF, Nyhuus B, Nielsen MB, Christensen H: Tree- -dimensional anal endosonogrphy may improve diagnostic confidence of detecting damage to the anal sphincter complex. Br J Radiol 2005; 78: 308-311.
28. Engel A, Kamm M, Bartranm C, Niccols R: Relationship of symptoms in fecal incontinence to specific sphincter abnormalities. Int J Colorectal Dis 1995; 10: 152-155.
29. Dobben AC, Terra MP, Slors JFM et al.: External Anal Sphincter Defects In Patients with Fecal Incontinence: Comparison of Endoanal MR Imaging and Endoanal US. Radiology 2007 Feb; 242(2): 463-471.
30. Malouf AJ, Williams AB, Halligan S, Bartram CI: Prospective Assessment of Accuracy of Endoanal MR Imaging and Endosonography in Patients with Fecal Incontinence. AJR Am J Roentgenol 2000 Sep; 175(3): 741-745.
31. Rociu E, Stoker J, Eijkemans MJ et al.: Fecal Incontinence: Endoanal US versus Endoanal MR Imaging. Radiology 1999 Aug; 212(2): 453-458.
32. Saranovic D, Barisic G, Krivokapic Z et al.: Endoanal ultrasound evaluation of anorectal diseases and disorders: Technique, indications, results and limitations. Eur J of Radiology 2007; 61: 480-489.
33. Murad-Regadas SM, Regadas FS, Rodrigues LV et al.: Effect of vaginal delivery and ageing on the anatomy of the female anal canal assessed by three-dimensional anorectal ultrasonography. Colorectal Dis 2012 Dec; 14(12): 1521-1527.
otrzymano/received: 2013-05-15 zaakceptowano/accepted: 2013-06-26 Adres/address: *Jacek Piłat I Katedra i I Klinika Chirurgii Ogólnej, Transplantacyjnej i Leczenia Żywieniowego Uniwersytet Medyczny ul. K. Jaczewskiego 8, 20-090 Lublin tel.: +48 601-381-131 e-mail: jacekpillat@wp.pl Artykuł Diagnostyka zmian nienowotworowych kanału odbytu z zastosowaniem ultrasonografii 3D w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








