|
© Borgis - Postępy Nauk Medycznych 7, s. 583-588
Anna Stachurska, *Jadwiga Fabijańska-Mitek
Zastosowanie cytometrii przepływowej w immunohematologicznej ocenie krwinek czerwonych**
Application of flow cytometry in immunohaematological assessment of red blood cells
Zakład Immunohematologii Centrum Medycznego Kształcenia Podyplomowego, Warszawa
Kierownik Zakładu: dr hab. n. med. Jadwiga Fabijańska-Mitek Streszczenie
Cytometria przepływowa (flow cytometry – FC) jest nowoczesną techniką badawczą i diagnostyczną, umożliwiającą charakterystykę jakościową i ilościową różnych populacji komórkowych. W niniejszej pracy przedstawiono tematykę badań dotyczących wykorzystania FC w analizie erytrocytów. Opisano możliwości oceny mieszanej populacji krwinek czerwonych płodu w krążeniu matki, w krwi sportowców stosujących nielegalne transfuzje, w badaniach przeżywalności krwinek w krążeniu biorcy. Przedstawiono zastosowanie FC do wykrywania antygenów, oceny jakościowej i ilościowej przeciwciał związanych z krwinkami oraz ich stężenia w surowicy, a także do badania erytrofagocytozy. Ważne jest dalsze udoskonalanie metodyki analizy cytometrycznej erytrocytów i jej upowszechnianie. Słowa kluczowe: cytometria przepływowa, antygeny i przeciwciała krwinek czerwonych, mieszane populacje erytrocytów, erytrofagocytoza
Summary
Flow cytometry (flow cytometry – FC) is a modern research and diagnostic technique, that allows for a qualitative and quantitative characteristics of different cell populations. This paper is focused on the use of FC in the analysis of erythrocytes. The possibilities of evaluation of a mixed population of fetal red blood cells in maternal circulation, in blood of athletes using illegal blood transfusions, in blood cell survival studies in the recipient’s circulation were described. The article presents the application of FC to detect antigens, to qualitatively and quantitatively evaluate of RBC-bound immunoglobulins and their concentrations in serum and to study erythrophagocytosis. It is important to further improve and disseminate the methodology associated with the procedure of cytometric analysis of erythrocytes. Key words: flow cytometry, antigens and antibodies of red blood cells, mixed population of red blood cells, erythrophagocytosis
WSTĘP
Technikę cytometrii przepływowej (flow cytometry – FC) w badaniach krwinek czerwonych zastosowano po raz pierwszy w 1980 roku (1). Oceniano liczbę cząsteczek IgG autoprzeciwciał na krwinkach osób chorych na niedokrwistość autoimmunohemolityczną. Cztery lata później za pomocą FC wykrywano krwinki płodu w krążeniu matki, a w kolejnym roku technikę tę wykorzystano w badaniach antygenów grup krwi, w tym ekspresji antygenów układu Rh w zależności od ich homo- lub heterozygotyczności (2-4).
Metoda cytometryczna pozwala na badania fenotypowe, czyli wykrywanie i identyfikację antygenów krwinek czerwonych za pomocą skierowanych do nich swoistych przeciwciał oraz ocenę mieszanych populacji erytrocytów (5-7). Jest dynamicznie rozwijającą się techniką diagnostyczną, umożliwiającą precyzyjną ocenę pojedynczych komórek przy jednoczesnej analizie dużej ich liczby. W cytometrze krwinki płyną jedna za drugą, a na każdą z nich pada wiązka światła laserowego umożliwiając zróżnicowanie poszczególnych frakcji za pomocą parametrów morfologicznych: wielkości FSC (Forward Scatter Channel) i ziarnistości SSC (Side Scatter Channel) (ryc. 1).
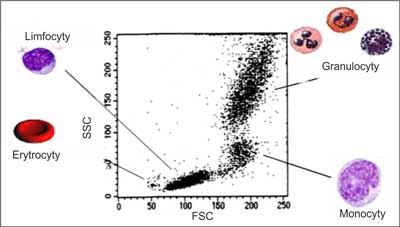 Ryc. 1. Cytometryczny wykres kropkowy („dot-plot”) komórek krwi człowieka, uzyskany z pomiaru wartości parametrów FSC i SSC (skala liniowa).
Erytrocyty tworzą dobrze wyodrębnioną, oddzielną populację krwinek, gdy przedstawia się je na wykresie kropkowym tzw. „dot-plot” używając skali logarytmicznej (8), co potwierdzają nasze doświadczenia (ryc. 2).
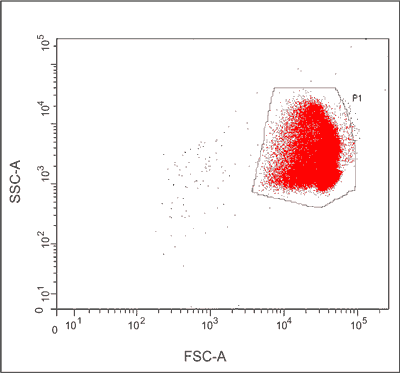 Ryc. 2. Cytometryczny wykres kropkowy („dot-plot”) erytrocytów człowieka uzyskany z pomiaru wartości parametrów FSC i SSC (skala logarytmiczna).
W celu wykrycia poszukiwanego antygenu znakuje się erytrocyty specyficznymi przeciwciałami, sprzężonymi z odpowiednimi fluorochromami. Zazwyczaj są nimi fikoerytryna (PE) oraz izotiocyjanian fluoresceiny (FITC). Barwniki te wzbudzane przez laser argonowy emitują odpowiednio światło pomarańczowe oraz zielone, przy czym fluorescencja PE daje silniejszy sygnał niż FITC. Do oznaczania frakcji retikulocytów stosuje się barwnik, który wykrywa fragmenty kwasów nukleinowych, pozostających w tych komórkach np. oranż tiazolu (9, 10). Fluorochromy ulegają wzbudzeniu, a intensywność fluorescencji odpowiada ekspresji antygenu. Zależy ona jednak nie tylko od liczby miejsc antygenowych na komórce, ale także od stopnia powinowactwa użytego przeciwciała, czyli siły jego wiązania z determinantami antygenowymi, metody znakowania komórek (bezpośrednia ze znakowanymi swoistymi przeciwciałami lub pośrednia ze znakowanymi przeciwciałami anty-IgG skierowanymi do swoistych nie znakowanych przeciwciał) oraz zastosowania odpowiednich fluorochromów. Różnorodność barwników umożliwia dobór odpowiedniej siły świecenia w zależności od gęstości badanego antygenu i zgodnie z zasadą, że do wyznakowania niezbyt licznych struktur o małej gęstości determinant antygenowych, stosuje się silne fluorochromy i odwrotnie dla dużej ich liczby stosuje się fluorochromy słabe.
Badania fenotypowe krwinek czerwonych
Wykorzystując cytometrię do badań antygenów grup krwi, uzyskano wyniki średniej liczby antygenów oraz stopień zróżnicowania ich gęstości na erytrocytach. Stwierdzono, że antygeny o strukturze węglowodanowej (A, B, H, I, i, P) są bardziej zróżnicowane pod względem gęstości (od kilkudziesięciu determinant do setek tysięcy) niż np.: antygeny układów Rh, Kell, Duffy, Kidd (kilkanaście, rzadko kilkadziesiąt tysięcy) (8, 11). Prowadzono też badania dotyczące zmian liczby antygenów A i B z układu ABO oraz związanego z nimi antygenu H z układu H podczas starzenia się erytrocytów, u noworodków oraz u chorych na białaczki mieloblastyczne. We wszystkich wymienionych przypadkach stwierdzono osłabioną ekspresję tych antygenów (12-16).
Nieliczne publikacje donoszą o użyciu cytometrii przepływowej do oceny liczby i rozkładu miejsc antygenu RhD (16, 17). Badano także antygeny Fya i Fyb z układu Duffy, w związku z ich funkcją receptorową dla pierwotniaka malarii Plasmodium vivax. Stwierdzono wyższą ekspresję tych antygenów na retikulocytach niż na krwinkach dojrzałych (19).
Metoda cytometryczna, jako bardzo czuła, jest stosowana do poszukiwań lub potwierdzania obecności nowych antygenów i układów grupowych. Donoszą o tym między innymi publikacje z 2012 roku dotyczące wykrycia układów Langeries i Junior, omówione w pracy przeglądowej w obecnym numerze „Postępów nauk medycznych”. Ze względu na konieczność przeprowadzenia badań populacyjnych antygenów powszechnych Lan i Jra, poszukiwania Jra u innych ssaków oraz badań ekspresji antygenów na liniach komórkowych transfekowanych odpowiednimi genami i na ludzkich komórkach nowotworowych, metoda cytometryczna była jedyną metodą immunohematologiczną umożliwiającą przeprowadzenie kompletu badań fenotypowych identyfikujących nowe układy grupowe, które następnie potwierdzono badaniami na poziomie DNA (20, 21).
Wykrywanie oraz ilościowa ocena przeciwciał związanych z erytrocytami oraz wolnych przeciwciał w surowicy
Do wykrywania przeciwciał związanych z krwinkami czerwonymi stosuje się aglutynacyjne testy antyglobulinowe: bezpośredni test antyglobulinowy (BTA) do wykrywania przeciwciał związanych z erytrocytami in vivo oraz pośredni test antyglobulinowy (PTA) do wykrywania wolnych przeciwciał w surowicy po związaniu ich in vitro z krwinkami czerwonymi. Technikę cytometryczną stosowano w badaniu erytrocytów chorych na niedokrwistość autoimmunohemolityczną w następujących celach: do ilościowej oceny cząsteczek IgG przypadających na jedną krwinkę, do wykrywania autoprzeciwciał, gdy wynik BTA był słaby lub ujemny oraz do oznaczania podklas IgG. Technikę tę używano obok techniki aglutynacyjnej, immunoenzymatycznej, radioizotopowej, ponieważ żadna z nich nie została uznana za referencyjną (5, 22, 23).
Cytometrię przepływową stosowano także do ilościowej oceny wolnych przeciwciał w surowicy. W latach 90. po raz pierwszy przeprowadzono próby oznaczania IgG anty-RhD u kobiet w ciąży (24, 25). Na podstawie intensywności fluorescencji erytrocytów opłaszczonych przeciwciałami anty-RhD o znanym stężeniu sporządzono krzywą standardową, z której następnie odczytywano stężenia IgG anty-RhD w próbce surowicy konkretnej kobiety. Badanie ilościowe wolnych przeciwciał w krwi matki, a szczególnie obserwacje narastania ich poziomu mają duże znaczenie w prognozowaniu choroby hemolitycznej płodu/noworodka (ChHPN), bowiem przeciwciała te przechodzą przez łożysko i niszczą krwinki czerwone płodu tym silniej im jest ich więcej. Zazwyczaj stosuje się mniej czułe oznaczanie miana przeciwciał w PTA, podając w wyniku największe rozcieńczenie, w którym przeciwciała reagują. Oceniano też cytometrycznie podklasy IgG wywołujących ChHPN, gdyż jest to kolejny czynnik prognostyczny tej choroby. Jednoczesne występowanie IgG1 i IgG3 zazwyczaj prowadzi do ciężkiej postaci choroby, podczas gdy w obecności IgG2 lub IgG4 hemoliza nie powinna wystąpić. Na podobnych zasadach oznacza się cytometrycznie wolne przeciwciała anty-RhD w osoczu immunizowanych dawców krwi, które przeznaczone jest do produkcji immunoglobuliny anty-RhD stosowanej w profilaktyce ChHPN i podawanej kobietom RhD ujemnym po urodzeniu RhD dodatniego dziecka (w niektórych krajach również w ciąży) (26). Ponieważ stężenie wolnych przeciwciał w surowicy można ocenić za pomocą cytometrii przepływowej dopiero po związaniu ich z krwinkami czerwonymi, to istotny jest dobór odpowiednich krwinek z kontrolowaną liczbą determinant antygenowych. Ocenia się ją cytometrycznie albo badając DNA dawcy w kierunku jego homo- lub heterozygotyczności w zakresie określonego genu (27).
Ocena mieszanej populacji krwinek czerwonych
W ocenie mieszanej populacji krwinek czerwonych wykorzystuje się różnice np.: antygenów grupowych, hemoglobiny, enzymów czerwonokrwinkowych (26). Wyznakowane grupy erytrocytów różnią się obecnością lub poziomem fluorescencji, więc można je wykrywać oraz obliczać procentowy udział w mieszaninie.
Przykładem mieszanej populacji krwinek czerwonych są erytrocyty płodowe w próbce krwi matki w ciąży lub po porodzie. W ostatnich latach wzrasta liczba publikacji opisujących zastosowanie cytometrii w badaniach tak zwanego przecieku, czyli krwawienia płodowo-matczynego (foetomaternal haemorrhage – FMH) (28-33). Po raz pierwszy w 1984 roku cytometrycznie oznaczono procent erytrocytów RhD dodatnich płodu w populacji erytrocytów RhD ujemnych matki (2, 3). Zastosowano pośrednią metodę znakowania, czyli najpierw reakcję z przeciwciałami anty-RhD, następnie ze skierowanymi do nich znakowanymi przeciwciałami anty-IgG. W 1996 roku zastosowano bezpośrednie metody znakowania erytrocytów przy użyciu Ig anty-RhD sprzężonych z fluorochromem (34). Stosujemy je obecnie w naszym laboratorium (ryc. 3).
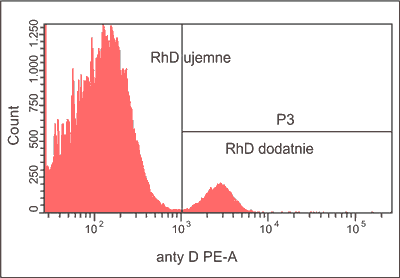 Ryc. 3. Histogram przedstawiający populację erytrocytów RhD ujemnych (96%) i RhD dodatnich (4%).
W 1999 roku zaproponowano dodatkowe znakowanie erytrocytów za pomocą swoistej Ig anty-glikoforyna, aby lepiej wyodrębnić płodowe krwinki czerwone na cytogramie (35). Późniejsze badania wykazały, że znakowanie dodatkowym swoistym dla krwinek czerwonych przeciwciałem nie jest konieczne, jeśli stosuje się skalę logarytmiczną dobrze obrazującą erytrocyty za pomocą parametrów morfologicznych (FSC, SSC).
W innej metodzie cytometrycznego oznaczania FMH wykorzystuje się przeciwciała skierowane do hemoglobiny płodowej (HbF) (ryc. 4). Jest ona obecna w krwinkach płodu i ma duże powinowactwo do tlenu, co ułatwia pobieranie go drogą dyfuzji i aktywnego transportu z naczyń krwionośnych matki usytuowanych w łożysku w ścisłym kontakcie z naczyniami krwionośnymi dziecka. HbF posiada w swojej budowie łańcuchy globinowe γ i różni się od hemoglobiny dorosłych (HbA), która posiada łańcuchy β. Od okresu okołoporodowego do około szóstego miesiąca życia HbF jest stopniowo zastępowana przez HbA. Niewielką i zróżnicowaną zawartość tej hemoglobiny można wykryć u zdrowych osób dorosłych oraz w niektórych wrodzonych niedokrwistościach hemolitycznych, co przedstawiono w pracy przeglądowej zamieszczonej w bieżącym numerze czasopisma. Metoda, w której Ig anty-HbF wiążą się z łańcuchami polipeptydowymi γ, polega na wewnątrzkomórkowym znakowaniu erytrocytów i dlatego wymaga ich utrwalenia oraz tak zwanej permeabilizacji, czyli perforacji błony erytrocytów (36). Różni autorzy wskazują, że metoda ta jest czulsza, szybsza i bardziej powtarzalna niż znany od około 60 lat mikroskopowy test Kleihauera-Betke również wykrywający obecność krwinek HbF dodatnich (8, 31). W niektórych krajach, np. w Wielkiej Brytanii i Irlandii test mikroskopowy przeprowadza się u wszystkich kobiet RhD ujemnych w ramach profilaktyki ChHPN. W przypadku oznaczania przecieku płodowo-matczynego ≥ 4 ml potwierdza się go metodą cytometryczną i dobiera się odpowiednio dużą dawkę IgG anty-RhD, aby zneutralizować krwinki RhD płodu w ustroju matki i ochronić ją przed immunizacją (37).
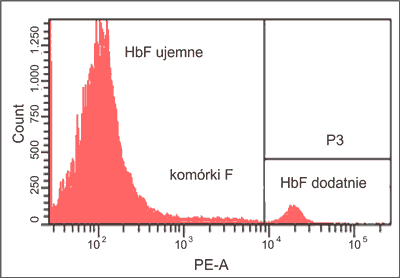 Ryc. 4. Histogram przedstawiający populację erytrocytów HbF ujemnych osoby dorosłej (95,5%), komórek F (1%) oraz erytrocytów płodowych HbF dodatnich (3,5%).
Jednoczesne zastosowanie przeciwciał anty-HbF oraz przeciwciał wykrywających anhydrazę węglanową (carbonic anhydrase – CA) może zwiększać swoistość testu. CA jest enzymem, który pojawia się w okresie okołoporodowym i jest go dużo w krwinkach osób dorosłych oraz bardzo mało lub nie występuje w ogóle w krwinkach płodowych. Podwójne znakowanie umożliwia wyodrębnienie krwinek płodowych HbF dodatnich, CA ujemnych, krwinek matki HbF ujemnych, CA dodatnich oraz tzw. komórek F matki, które są HbF dodatnie i CA dodatnie (38).
Zastosowanie cytometrii przepływowej w ocenie mieszanej populacji krwinek czerwonych może być przydatne podczas obserwacji przeżycia przetaczanych erytrocytów. Metoda ta oparta jest na różnicy antygenów krwinek czerwonych biorcy i dawcy. Próbki krwi biorcy po transfuzji inkubuje się z surowicą zawierającą pierwszorzędowe przeciwciała, a następnie z przeciwciałami anty-IgG sprzężonymi z fluorochromem. Badania te wykonywano dla oceny przeżycia przetoczonych erytrocytów z danym antygenem wykrywanym przy użyciu przeciwciał m.in.: anty-e, anty-Jka, anty-Jsb, anty-Lu6, anty-B, anty-Dib, anty-D (39, 40).
Cytometrię przepływową można również wykorzystać jako czułą metodę do wykrywania allogenicznych transfuzji krwi u sportowców (6). W wyniku przetoczenia krwinek czerwonych zwiększa się poziom hemoglobiny, wzrasta stężenie tlenu i zwiększa się wydolność fizyczna organizmu. Prawdopodobnie pierwsza allogeniczna transfuzja krwi u sportowca została przeprowadzona w 1960 roku na igrzyskach w Meksyku. Cytometrię przepływową do wykrycia tego rodzaju dopingu zastosowano po raz pierwszy w 2004 roku na olimpiadzie w Atenach. Podczas oznaczeń cytometrycznych sprawdzano próbki krwi pobierane w różnych odstępach czasu przed oraz po zawodach. Taką metodą można wykryć dwie populacje krwinek czerwonych różniących się antygenowo, nawet po 3-4 miesiącach po transfuzji, ponieważ czas przeżycia erytrocytów in vivo wynosi ok. 120 dni.
Badanie erytrofagocytozy
FC wykorzystywana jest w badaniach erytrofagocytozy, czyli niszczenia starych, uszkodzonych lub nieprawidłowych krwinek czerwonych przez monocyty/makrofagi. Komórki te fagocytują erytrocyty opłaszczone cząsteczkami IgG lub białkami układu dopełniacza, gdyż rozpoznają je za pomocą odpowiednich receptorów. Badanie erytrofagocytozy może mieć znaczenie dla prognozowania nasilenia hemolizy w niedokrwistościach autoimmunologicznych typu ciepłego z autoprzeciwciałami klasy IgG, w chorobie hemolitycznej płodu i noworodka, przetaczaniu krwi w obecności przeciwciał do antygenów powszechnych oraz w zakażeniach pasożytniczych krwinek czerwonych przez różne gatunki zarodźca malarii (41-43). Fagocytozę ocenia się ilościowo na podstawie odsetka komórek fagocytujących oraz jakościowo poprzez wzrost intensywności fluorescencji w czasie trwania procesu. W ostatnich latach do znakowania erytrocytów wykorzystuje się fluorochromy PKH (44, 45). Mają one spektra emisji podobne do FITC i PE, wiążą się stabilnie z błoną komórkową, nie powodując zmian w jej strukturze i nie zmieniając funkcji badanych komórek. FC różnicuje populacje komórek żernych oraz fagocytowanych, umożliwia zastąpienie dotychczas stosowanej metody radioizotopowej (42, 43).
Problemy techniczne związane z zastosowaniem cytometrii przepływowej w badaniach krwinek czerwonych
Na podstawie analizy około 200 artykułów, opublikowanych przez 88 zespołów stwierdzono, że 75% spośród nich stosuje procedury znakowania erytrocytów właściwe dla krwinek białych, a 25% nie stosuje żadnej metody zapobiegającej aglutynacji, co może być powodem uzyskiwania fałszywych wyników (46). W celu uniknięcia aglutynacji korzystne jest stosowanie znakowanych fragmentów przeciwciał Fab (fragmenty wiążące antygen). Można też stosować różne odczynniki utrwalające komórki, np. glutaraldehyd lub formaldehyd, jednak działania takie mają wpływ na morfologię erytrocytów (7). Inny efekt – autofluorescencja erytrocytów nie zaburza wykrywania komórek z dużą liczbą miejsc antygenowych o silnej fluorescencji, ale może maskować niską intensywność fluorescencji w przypadku małej liczby miejsc antygenowych na krwince. Wadą znakowania pośredniego jest wzrost niespecyficznego wiązania przeciwciała drugorzędowego przez populacje komórek bez antygenu. Innymi najczęściej spotykanymi błędami podczas procedur znakowania erytrocytów są: inkubacja komórek z przeciwciałami w nieodpowiedniej temperaturze, stosowanie niewłaściwych przeciwciał, nieodpowiednie warunki wirowania, czy stosowanie skali liniowej w analizie cytometrycznej parametrów morfologicznych FSC/SSC, zamiast skali logarytmicznej.
W celu oznaczania antygenów erytrocytów metodą cytometryczną należy pamiętać o standaryzacji odczynników polegającej na ustaleniu optymalnego stężenia przeciwciał (6, 7). Największym problemem, dotyczącym zastosowania FC w wykrywaniu i ilościowym oznaczaniu mieszanych populacji erytrocytów jest brak nieaglutynujących znakowanych przeciwciał, skierowanych do określonych antygenów grupowych krwi.
Pomimo problemów związanych z oznaczaniem cech krwinek czerwonych metodą cytometrii przepływowej, stwarza ona wiele możliwości badawczych, których nie dają inne techniki laboratoryjne. W Polsce FC jest szeroko stosowana w badaniach krwinek białych, szczególnie w immunofenotypowaniu chorób limfoproliferacyjnych i w diagnozowaniu niedoborów immunologicznych, ale bardzo rzadko stosuje się ją w immunohematologicznej ocenie krwinek czerwonych. W naszym zespole podjęto wielokierunkowe badania z zastosowaniem metod FC do oceny krwawienia płodowo-matczynego, starzenia się krwinek czerwonych i ich niszczenia.
**Praca finansowana w ramach projektów CMKP: 501-1-26-02-12, 502-1-26-02-11. Piśmiennictwo
1. Van der Meulen FW, de Bruin HG, Goosen PC et al.: Quantitative aspects of the destruction of red cells sensitized with IgG1 autoantibodies: An application of flow cytofluorometry. Br J Haematol 1980; 46: 47-56.
2. Cupp JE, Leary JF, Cernichiari E et al.: Rare-event analysis methods for detection of fetal red blood cells in maternal blood. Cytometry 1984; 5: 138-144.
3. Medearis AL, Hensleigh PA, Parks DR et al.: Detection of fetal erythrocytes in maternal blood post partum with the fluorescence-activated cell sorter. Am J Obstet Gynecol 1984; 148: 290-295.
4. Oien L, Nance S, Garratty G: Zygosity determinations using flow cytometry – a superior method. Transfusion 1985; 25: 474.
5. Arndt PA, Garratty G: Flow cytofluorometric analysis in red blood cell immunology. Transfus Med Hemother 2003; 31: 163-174.
6. Arndt PA, Kumpel BM: Blood doping in athletes-detection of allogenic blood transfusions by flow cytofluorometry. Am J Hematol 2008; 83: 657-667.
7. Nelson M: Analysis of heterogeneous red cell populations by flow cytometry. Methods Cell Sci 2002; 24: 19-25.
8. Brown M, Wittwer C: Flow cytometry: principles and clinical applications in hematology. Clin Chem 2000; 46: 1221-1229.
9. Davis BH, Bigelow NC: Flow cytometric reticulocyte quantification using thiazole orange provides clinically useful reticulocyte maturity index. Arch Pathol Lab 1989; 6: 684-689.
10. Carter JM, Mc Sweeney PA, Wakem PJ: Counting reticulocytes by flow cytometry: use of thiazole orange. Clin Lab Haematol 1989; 3: 267-271.
11. Dunstan RA, Simpson MB: Heterogeneity of antigen site density for major blood group systems of human erythrocytes. Transfusion 1984; 24 (suppl): 418.
12. Fibach E, Sharon R: Changes in ABH antigen expression on red cells during in vivo aging: A flow cytometric analysis. Transfusion 1994; 34: 328-332.
13. Popp HJ, Nelson M, Forsyth C et al.: Quantifying the loss of ABO antigenicity in a patient with acute myeloid leukemia by flow cytometric analysis. Immunohematology 1995; 11: 5-7.
14. Poschmann A, Fischer K, Kluxen M: The detection of A and Rhesus (D) antigens on fetal erythrocytes; in Gutensohn K, Sonneborn HH, Kuhnl P(eds): aspects of the flow-cytometric analysis of red blood cells. Heidelberg, Clin Lab Publications 1997; 19-30.
15. Bianco T, Farmer BJ, Sage RE et al.: Loss of red cell A, B, and H antigens is frequent in myeloid malignancies. Blood 2001; 97: 3633-9363.
16. Salmon C, Carton JP, Lopez M et al.: Level of the A, B and H blood group glycosyltransferases in red cell membranes from patients with malignant hemopathies. Rev Fr Transfus Immunohematol 1984; 27: 625-637.
17. Nicholson G, Lawrence A, Ala FA et al.: Semi-quantitative assay of D antigen site density by flow cytometric analysis. Transfus Med 1991; 1: 87-90.
18. Flegel Wa, Curin-Serbec V, Delamaire M: Section 1B: Rh flow cytometry coordinator’s report. Rhesus index and antigen density: an analysis of the reproducibility of flow cytometric determination. Transfus Clin Biol 2002; 9: 33-42.
19. Tran TM, Moreno A, Yazdani et al.: Detection of a Plasmodium vivax erythrocyte binding protein by flow cytometry. Cytometry Part A 2005; 1: 59-66.
20. Helias V, Saison C, Ballif B et al.: ABCB6 is dispensable for erythropoiesis and specifies the new blood group system Langereis. Nat Genet 2012; 44: 170-173.
21. Saison C, Helias V, Ballif BA et al.: Null alleles of ABCG2 encoding the breast cancer resistance protein define the new blood group system Junior. Nat Genet 2012; 44: 174-177.
22. Wang Z, Shi J, Zhou Y et al.: Detection of red blood cell-bound immunoglobulin G by flow cytometry and its application in the diagnosis of autoimmune hemolytic anemia. Int J Hematol 2001; 2: 188-193.
23. Lynen R, Krone O, Legler TJ et al.: A newly developed gel centrifugation test for quantification of RBC-bound IgG antibodies and their subclasses IgG1 and IgG3: comparison with flow cytometry. Transfusion 2002; 42: 612-618.
24. Christenson M, Bremme K, Shanwell A et al.: Flow cytometric quantitation of serum anti-D in pregnancy. Transfusion 1996; 36: 500-505.
25. Hilden JO, Backteman K, Nilson J et al.: Flow-cytometric quantitation of anti-D antibodies. Vox Sang 1997; 72: 172-176.
26. Austin EB, McIntosh Y, Hodson C et al.: Anti-D quantification by flow cytometry: An alternative to the AutoAnalyser? Transfus Med 1995; 5: 203-208.
27. Austin EB, McIntosh Y, Hodson C et al.: Anti-D quantification by flow cytometry: a comparison of five methods. Transfusion 2000; 40: 77-83.
28. Gieleżyńska A, Fabijańska-Mitek J: Płodowo-matczyny przeciek krwi – wykrywanie i ocena ilościowa. Pol Merkur Lekarski 2011; 30: 219-223.
29. Fabijańska-Mitek J: Przeciek płodowo-matczyny: skutki kliniczne i metody oceny. Acta Haematol Pol 2011; 42: 445-451.
30. Kennedy GA, Shaw R, Just S et al.: Quantification of feto-maternal haemorrhage (FMH) by flow cytometry: anti-fetal haemoglobin labelling potentially underestimates massive FMH in comparison to labelling with anti-D.Transfus Med 2003; 13: 25-33.
31. Chen JC, Davis BH, Wood B et al.: Multicenter clinical experience with flow cytometric method for fetomaternal hemorrhage detection. Cytometry 2002; 50: 285-290.
32. Evans S, Birchall J, Kumpel BM: Comparison of haemoglobin F detection by the acid elution test, flow cytometry and high-performance liquid chromatography in maternal blood. Transfusion Medicine, doi: 10.1111/j: 1365-3148.2012.01143.X.
33. Uriel M, Subira D, Plaza J et al.: Identification of feto-maternal haemorrhage around labour using flow cytometry immunophenotyping. Eur J Obst Gyn Rep Biol 2010; 151: 20-25.
34. Lloyd-Evans P, Kumpel BM, Bromilow I et al.: Use of a directly conjugated monoclonal anti-D (BRAD-3) for quantification of fetomaternal hemorrhage by flow cytometry. Transfusion 1996; 36: 432-437.
35. Lloyd-Evans P, Guest AR, Austin EB et al.: Use of a phycoerythrin-conjugated anti-glycophorin A monoclonal antibody as a double label to improve the accuracy of FMH quantification by flow cytometry. Transfus Med 1999; 9: 155-160.
36. Mundee Y, Bigelow NC, Davis BH et al.: Simplified flow cytometric method for fetal hemoglobin containing red blood cells. Cytometry 2000; 42: 389-393.
37. Chapman JF, Bain BJ, Bates SC et al.: The estimation of fetomaternal hemorrhage. Transfus Med 1999; 9: 87-92.
38. Leers MPG, Scharnhorst V, Pelikan HMP et al.: Discriminating fetomaternal hemorrhage from maternal HbF-containing erythrocytes by dual-parameter flow cytometry. Eur J Obstet Gyn R B 2007; 134: 126-136.
39. Leger R, Arndt P, Co A et al.: Clinical significance of an anti-Di assessed by flow cytometry. Immunohematology 1997; 13: 93-96.
40. Luten M, Roerdinkholder-Stoelwinder B, Schaap NP et al.: Survival of red blood cells after transfusion: a comparison between red cells concentrates of different storage periods. Transfusion 2008; 7: 1478-1485.
41. Fendel R, Mordmüller B, Kreidenweiss A et al.: New method to quantify erythrophagocytosis by autologous monocytes. Cytometry Part A 2007; 71A: 258-264.
42. Bratosin D, Mazurier J, Słomiany C et al.: Molecular mechanisms of erythrophagocytosis: flow cytometric quantitation of in vitro erythrocyte phagocytosis by macrophages. Cytometry 1997; 30: 269-274.
43. Bratosin D, Estquier J, Ameisen JC et al.: Flow cytometric approach to the study of erythrophagocytosis: evidence for an alternative immunoglobulin-independent pathway in agamamaglobulinemic mice. J Imm Met 2002; 265: 133-143.
44. Healey G, Veale MF, Sparrow RL et al.: A fluorometric quantitative erythrophagocytosis assay using human THP-1 monocytic cells and PKH26-labelled red blood cells. J Imm Met 2007; 322: 50-56.
45. Garratty G, Arndt PA: Applications of flow cytofluorometry to red blood cell immunology. Cytometry (Communications in Clinical Cytometry) 1999; 38: 259-267.
46. Arndt PA, Garratty G: A critical review of published methods for analysis of red cell antigen-antibody reactions by flow cytometry, and approaches for resolving problems with red cell agglutination. Transfus Med Rev 2010; 24: 172-194.
otrzymano/received: 2012-05-07 zaakceptowano/accepted: 2012-06-04 Adres/address: *Jadwiga Fabijańska-Mitek Zakład Immunohematologii Centrum Medycznego Kształcenia Podyplomowego ul. Marymoncka 99/103, 01-813 Warszawa tel.: +48 (22) 569-38-20 e-mail: biofizyka@cmkp.edu.pl Artykuł Zastosowanie cytometrii przepływowej w immunohematologicznej ocenie krwinek czerwonych** w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








