|
© Borgis - Postępy Nauk Medycznych 7, s. 576-582
*Jadwiga Fabijańska-Mitek, Agata Gieleżyńska, Katarzyna Koza
Nowe układy grupowe krwi
New blood group systems
Zakład Immunohematologii Centrum Medycznego Kształcenia Podyplomowego, Warszawa
Kierownik Zakładu: dr hab. n. med. Jadwiga Fabijańska-Mitek Streszczenie
Nauka o grupach krwi, czyli o antygenach na krwinkach czerwonych i skierowanych do nich przeciwciałach rozwija się od 112 lat. Początek dało jej genialne odkrycie układu grupowego ABO przez Karola Landsteinera. Umożliwiło ono w znacznym zakresie dobór bezpiecznej krwi do przetaczania oraz rozwój chirurgii, immunologii, hematologii i transplantologii. Do 2011 roku znano 30 układów grupowych obejmujących ponad 300 antygenów. Podstawą poznania nowego antygenu grupowego jest nadal jego reakcja ze swoistym przeciwciałem, wytworzonym przez osobę bez danego antygenu. Dla sklasyfikowania układu grupowego musi być znane podłoże genetyczne, czyli gen kodujący dany antygen i allele kodujące antygeny przeciwstawne oraz budowa biochemiczna struktur błonowych będących ich nośnikami. W lutym 2012 roku ukazały się publikacje o potencjalnie dwóch nowych układach grupowych Langereis (Lan) i Junior (Jr), których pojedyncze antygeny odkryto kilkadziesiąt lat temu. W 2011 roku przedstawiono wyniki badań nad układem grupowym znanym częściowo od ponad 80 lat, który obecnie nazwano P1Pk. W pracy przedstawiona jest fascynujące droga odkrywania tajemnic tych układów dzięki wykorzystaniu najnowszych technik badawczych oraz poznawanie ich biologicznej, nie tylko transfuzjologicznej roli. Słowa kluczowe: klasyfikacja grup krwi ISBT, układ grupowy Langereis, układ grupowy Junior, układ grupowy P1Pk
Summary
Science of blood groups, which means red blood cells antigens and antibodies directed towards them, has been developing for 112 years. It started with brilliant discovery of ABO blood group system by Karl Landsteiner. This finding has allowed to match appropriate blood for transfusion and enhanced development of surgery, immunology, haematology and transplantology. Until 2011, 30 blood group systems, containing over 300 antigens, have been known. Every new blood group antigen is still described after reaction with specific antibodies, produced by the person without this antigen. In order to classify the new blood group system, genetic basis have to be described, i. e. the gene coding the antigen and alleles coding antithetical antigens, as well as biochemical structure of membrane component carrying these antigens. In February 2012 two papers have been released, regarding two potentially new blood group systems, Langeris (Lan) and Junior (Jr). Both of them contain only one antigen discovered decades ago. In 2011 results have been described on the blood group system known partially for over 80 years, currently known as P1Pk. In this paper the authors reveal fascinating road to discovery the secrets of group systems mentioned above using the latest research techniques, as well as exploring of their biological, not only transfusiological, role. Key words: ISBT blood group systems classification, blood group system Langeris, blood group system Junior, blood group system P1Pk
Wstęp
Nauka o grupach krwi zwana dawniej serologią, dziś zasadnicza część immunohematologii, rozwija się od 112 lat. Jej początki sięgają genialnego odkrycia (1900/1901) Karola Landsteinera, wiedeńskiego lekarza, który podzielił ludzi na trzy grupy w zależności od aglutynacyjnych cech ich krwi w stosunku do krwi innych osób (1, 2). Odkrycie to, nagrodzone w 1921 roku nagrodą Nobla, dało początek transfuzjologii i miało kluczowe znaczenie dla rozwoju chirurgii, immunologii, hematologii, a później transplantologii. Przez wiele lat znano tylko jeden unikatowy – ze względu na obecność naturalnych regularnych przeciwciał – układ ABO (O od niemieckiego ohne, czyli bez A, bez B, w Polsce dotąd nazywane zero). Przyjęto najpierw zasadę nadawania poznawanym antygenom oznaczeń literowych i po ponad ćwierćwieczu od odkrycia ABO zidentyfikowano kilka nowych antygenów uodporniając zwierzęta, które wytwarzały swoiste przeciwciała, podobne do przeciwciał występujących czasem u ludzi. Wykryto antygeny: M, N, S i P, z którymi mogą reagować naturalne (powstające przez kontakt z różnymi antygenami środowiska), nieregularne (występują rzadko i zanikają) przeciwciała, co odróżnia je od naturalnych, ale regularnych przeciwciał skierowanych do antygenów układu ABO (są zawsze obecne, poza wyjątkowymi patologiami).
Przełomem w badaniach antygenów krwinek czerwonych było wprowadzenie do laboratoriów serologicznych techniki antyglobulinowej (1945 rok), zwanej odczynem lub testem Coombsa, w której do wywołania reakcji aglutynacji używa się zwierzęcych przeciwciał anty-IgG, skierowanych do ludzkich immunoglobulin na krwinkach czerwonych (3). Okazało się, że przetaczanie krwi oraz kontakt matki z krwią dziecka w czasie porodu, prowadzą czasem do immunizacji charakterystycznymi antygenami krwinek czerwonych. Powstają wówczas przeciwciała klasy IgG, nazwane odpornościowymi. Pierwszym antygenem wykrytym przez ludzkie przeciwciała odpornościowe był antygen D, określany najpierw jako czynnik Rh. Nazwę Rh nadano później całemu układowi grupowemu obejmującemu obecnie kilkadziesiąt antygenów. Do dziś wykryto setki antygenów czerwonokrwinkowych, posiadających małe lub duże znaczenie kliniczne, w zależności od ich oddziaływania ze swoistymi przeciwciałami o określonej aktywności hemolitycznej. Prowadząc badania rodzinne ustalano związki antygenów i klasyfikowano je tworząc kolejne układy grupowe. Od roku 1990, kiedy wykryto geny układu ABO i ustalono ich sekwencje nukleotydowe, szybko rozwija się genetyka antygenów grupowych (4). Badania molekularne i biochemiczne umożliwiają charakterystykę układów grupowych na poziomie DNA, na poziomie białek strukturalnych będących nośnikami antygenów oraz enzymów tworzących węglowodanowe determinanty antygenowe na glikoproteinach i glikolipidach błonowych. Sto lat po odkryciu Landsteinera, czyli na początku XXI wieku znano ponad 20 układów grupowych obejmujących ponad 200 antygenów, a w 2011 roku 30 układów z ponad 300 antygenami (5, 6).
Doniesienia z początku bieżącego roku pozwalają oczekiwać na zatwierdzenie dwóch nowych układów grupowych: Langeries i Junior. Ponadto zweryfikowano informacje o znanym od 80 lat układzie grupowym nr 003 określanym najpierw jako P, potem P1, obecnie P1PK.
Wykrywanie, nazewnictwo i klasyfikacja grup krwi
Pojęcie grup krwi odnosi się obecnie do wszystkich antygenów na krwinkach czerwonych. Nad ich nazewnictwem i klasyfikacją czuwa od 1990 roku Robocza Komisja ISBT (International Society of Blood Transfusion), która co kilka lat informuje o liczbie układów grupowych, antygenów, o lokalizacji genów w chromosomach i ich budowie. Układy posiadają kolejne numery, ostatnio od 001 (ABO) do 030 (RhAG), odpowiadające kolejności wykrywania. Antygeny w każdym układzie posiadają też oznaczenia numeryczne (np. antygen A: 001001, B: 001002, D: 004001, E: 004003 itd.). Zapis ten jest wygodny dla rejestracji elektronicznej, jednak w codziennej pracy i w publikacjach immunohematolodzy posługują się pierwotnymi nazwami literowymi lub nazwami i ich skrótami nadawanymi później od nazwisk ludzi, u których zidentyfikowano odpowiednie przeciwciała, a za ich pomocą nowe antygeny np. Kell, Duffy, Kidd, Colton, Diego itd. (5-7).
Nadal podstawą identyfikacji antygenu jest jego reakcja ze swoistym przeciwciałem. Następnie musi być znany sposób dziedziczenia antygenu, wykryty jego gen, allele oraz sekwencje nukleotydów. Aby umieścić antygen w układzie grupowym wykazuje się związek z jego przeciwstawnym odpowiednikiem (np. Jka i Jkb, K i k, itd.) oraz ustala się budowę biochemiczną nośnika antygenów należących do tego samego układu. Antygeny, które nie spełniają warunków zaliczenia do układów grupowych pozostają w kolekcjach lub w seriach, gdy są antygenami powszechnymi (> 90% w populacji) lub prywatnymi (< 1%). Kolekcje i serie są rodzajem „poczekalni” do czasu odkrycia cech umożliwiających wprowadzenie antygenu do istniejącego układu grupowego lub utworzenie nowego układu (7).
Układ grupowy Langereis Lan
Antygen Lan znany jest od 1961 roku jako antygen powszechny występujący we wszystkich populacjach z częstością > 99%. Został odkryty, gdy stwierdzono pierwszy raz przeciwciała u osoby nie posiadającej go i był sklasyfikowany jako antygen o dużej częstości występowania w serii 901 z numerem 901.002. Opisano przeciwciała anty-Lan odpowiedzialne za poprzetoczeniowe reakcje hemolityczne od bardzo słabych do ciężkich. Choroba hemolityczna płodu/noworodka posiadającego grupę krwi Lan (+), którego matka ma grupę Lan (-) i przeciwciała anty-Lan, jest łagodna lub nie występuje. Ze względu na małą liczbę osób Lan (-) nie można wykluczyć innych niż opisane dotąd objawów (7).
Ostatnio, wykorzystując limfocyty Japonki o grupie krwi Lan (-), która wytworzyła przeciwciała anty-Lan, wyprodukowano przeciwciało monoklonalne OSK43 (8). Użyto je do oznaczania osób Lan (+) i Lan (-) metodami hemaglutynacji, cytometrii przepływowej i immunofluorescencji. W populacji japońskiej wśród 713 384 dawców krwi wykryto 14 osób Lan (-), które stanowiły 0,002% populacji. Stwierdzono silniejszą ekspresję antygenu Lan na krwinkach z pępowiny niż na krwinkach osób dorosłych.
Za pomocą przeciwciała OSK43 uzyskano metodą immunoprecypitacji białko błonowe z lizatu krwinek czerwonych. Ważyło ono 80 kDa i techniką spektrometrii masowej zostało zidentyfikowane jako ABCB6, należące do rodziny ABC (ATP-binding cassette) transporterów wykorzystujących energię z ATP (9, 10). ABCB6 znane były wcześniej jako podrodzina mitochondrialnych transporterów porfiryn, biorących udział w syntezie hemu i posiadających dużą ekspresję w komórkach erytropoetycznych. Metodą elektroforezy w żelu poliakrylamidowym stwierdzono obecność ABCB6 wśród białek błonowych erytrocytów osób Lan (+) i brak u osób Lan (-).
Klon K-562 – ludzkich komórek erytroleukemii – transfekowano materiałem genetycznym ABCB6 i uzyskano ekspresję ABCB6 w błonie komórkowej. Komórki te reagowały następnie z przeciwciałem OSK43 o swoistości anty-Lan, co potwierdziło, że białko ABCB6 jest nośnikiem antygenu LAN (8).
Izolowano DNA osób Lan (+) i 11 niespokrewnionych Lan (-) oraz zsekwencjonowano gen odpowiadający za syntezę białka ABCB6. Stwierdzono, że allel ABCB6 –/– u osób Lan (-) występuje na chromosomie 2 w locus ABCB6, który wykryto u osób Lan (+). Scharakteryzowano mutacje punktowe w siedmiu z szesnastu eksonów oraz w jednym intronie. Potwierdzono recesywne dziedziczenie tej grupy krwi wynikające albo z homozygotyczności tej samej mutacji null, albo heterozygotyczności dwóch różnych mutacji (8).
Po 50 latach od wykrycia antygenu Lan, w nowej dekadzie XXI wieku poznano jego podłoże genetyczne, stwierdzono obecność recesywnego allelu null, który mimo niewielkich różnic na poziomie DNA nie daje produktu, scharakteryzowano białko ABCB6 odpowiadające za swoistość grupy krwi Lan (+). W ten sposób spełniono kryteria niezbędne do utworzenia układu grupowego, który nazwano Langeries z symbolem Lan i dwiema grupami krwi: Lan (+) i Lan (-).
Uznając udział ABCB6 w transporcie porfiryn i hemopoezie (11, 12) badano je u ludzi Lan (-). Nie stwierdzono upośledzenia produkcji hemu ani objawów porfirii. Być może ABCB6 nie jest jedynym białkiem niezbędnym do transportu porfiryn lub osoby Lan (-) mają mechanizm kompensujący niedobór tego białka. Sugestię tę potwierdza rola przypisywana ABCG2, scharakteryzowanemu jako nośnik omówionego niżej układu grupowego Junior (13).
Wcześniej badano obecność ABCB6 na komórkach nowotworowych, podejrzewając, że jak inne transportery z rodziny ABC, może mieć związek z opornością na leki przeciwnowotworowe (14, 15). Wobec braku jednoznacznych opinii, obecnie powtórzono badania z OSK43 anty-Lan. Z przeciwciałami reagowały tylko komórki raka wątroby spośród 6 rodzajów komórek nowotworowych (8). Zasugerowano, że ludzi z grupą krwi Lan (-) powinno się monitorować pod kątem farmakokinetyki i hepatotoksyczności. Mogą być oni bardziej wrażliwi na leki przeciwnowotworowe niż osoby Lan (+) posiadające białko ABCB6, a ich hepatocyty mogą być narażone na substancje toksyczne bardziej niż hepatocyty osób Lan (+).
Układ grupowy Junior Jr
Antygen Jra znany jest od 1970 roku jako antygen powszechny w serii 901 i był dotychczas sklasyfikowany pod numerem 901.003 (7). Wiadomo, że biorcy krwi o grupie Jr (a-), którzy wytworzyli przeciwciała anty-Jra są wyzwaniem dla transfuzjologów, bowiem niezwykle trudno znaleźć dla nich zgodnego dawcę, a podanie krwi niezgodnej w zakresie Jr prowadzi do ostrej reakcji hemolitycznej. U kobiety z przeciwciałami anty-Jra można spodziewać się w ciąży ciężkiej lub śmiertelnej postaci choroby hemolitycznej płodu/noworodka. Najwięcej ludzi Jr (a-) wykryto w populacji japońskiej oraz u Cyganów z zachodniej Europy (13).
Po sukcesie badań nad antygenem Lan i zidentyfikowaniu układu Lan, podjęto analogiczne badania nad antygenem Jra. Przeciwciało monoklonalne anty-Jra o symbolu HMR0921, znane od 1994 roku (16), użyto do precypitacji nośnika antygenu z błon ludzkich erytrocytów. Nie uzyskano produktu prawdopodobnie ze względu na małą liczbę miejsc antygenowych lub zbyt małe powinowactwo przeciwciała. HMR0921 zastosowano do poszukiwania antygenu Jra na erytrocytach przedstawicieli różnych gatunków ssaków, stosując czułą technikę cytometrii przepływowej (13). Stwierdzono najsilniejsze reakcje z krwinkami kotów i te krwinki użyto do immunoprecypitacji. Uzyskano białko o ciężarze 70 kDa, które za pomocą spektrometrii masowej zidentyfikowano jako Abcg2, kodowane przez koci odpowiednik ludzkiego genu ABCG2. Następnie transfekowano ludzką linię komórkową K-562 i uzyskano ekspresję genu ABCG2. Tak przygotowane komórki K-562 reagowały z przeciwciałem monoklonalnym HMR0921. W analizie elektroforetycznej białek z błon erytrocytów ludzi Jr (a+) uzyskano białko ABCG2, którego obecności nie stwierdzono u osób Jr (a-).
Badano DNA genu ABCG2 u 18 niespokrewnionych osób z grupą krwi Jr (a-) i wykryto 8 mutacji null. Większość Jr (a-) była homozygotyczna w zakresie jednej mutacji, niektórzy byli heterozygotami dla dwóch mutacji null. Inne mutacje zidentyfikowano w Japonii i Korei, inne u Cyganów. Częstość występowania genów null w Japonii ustalono na poziomie 1,4-2,4%, co może odpowiadać za fenotyp Jr (a-) u 0,026-0,066% populacji. Po wykryciu genetycznego podłoża grupy krwi Jr (a+) i Jr (a-), lokalizacji genu w 4. chromosomie i przedstawieniu sekwencji alleli oraz scharakteryzowaniu nośnika antygenu jako białka ABCG2, można utworzyć kolejny układ grupowy o nazwie Junior i symbolu Jr.
Wcześniej badano biologiczną i kliniczną rolę ABCG2. Uznano, że jest to transporter, który ma udział w tworzeniu bariery między środowiskiem a organizmem, o czym świadczy największa jego ilość w łożysku, przewodzie pokarmowym i na granicy krew – mózg (17-19). Taka rola wiąże się zazwyczaj z udziałem w oporności na leki (20). Przypisuje się duże znaczenie ABCG2 w wielolekowej oporności komórek raka piersi (21-23). Z kolei jeden z alleli ABCG2 uznano za odpowiedzialny za skazę moczanową, co wykazano u japońskich mężczyzn (24). Obecnie, gdy poznano związek tego nośnika białkowego z antygenem Jr, to dysponując krwią ludzi o grupie krwi Jr (a-) przystąpiono do weryfikacji niektórych hipotez (13). Zbadano poziom moczanów u osób Jr (a-) i stwierdzono, że był on podwyższony, jednak nieistotnie w stosunku do osób Jr (a+). Ponieważ wśród badanych przeważały kobiety, sugerowano, że nie można wykluczyć ochronnego wpływu żeńskich hormonów i dlatego należy kontynuować badania. Z kolei u trzech kobiet Jr (a-) wykonano badania porfiryn, gdyż przypisano rolę ABCG2 w ich transporcie, podobną do ABCB6, który jest nośnikiem układu Lan. Stwierdzono niewykrywalny lub bardzo niski poziom porfiryn w osoczu i wysoki wewnątrz krwinek czerwonych. Badania będą przeprowadzone u kolejnych osób o grupie krwi Jr (a-).
Odkrycie genetycznego i biochemicznego podłoża nowego układu grupowego Junior i grup krwi: Jr (a+) i Jr (a-) ma duże znaczenie dla transfuzjologii i immunohematologii, ze szczególnym uwzględnieniem choroby hemolitycznej płodu/noworodka i ochronną rolą nośnika antygenu Jr w łożysku. Wykrycie, że ludzie z grupą krwi Jr (a-) nie posiadają transportera ABCG2, jest ważne dla badań nad opornością na leki i stosowaniem indywidualnych ich dawek, nad transportem mocznika i hemopoeazą (25-28).
Układ grupowy P1PK
Początki charakterystyki omawianego układu sięgają 1927 roku, kiedy Landstainer i Levin odkryli antygen P (obecnie P1), szczepiąc króliki krwinkami czerwonymi ludzi i uzyskując surowicę ze swoistymi przeciwciałami (29). Nazwę antygenu, a następnie układu grupowego utworzono jako kolejną literę po zastosowanych wcześniej w serologii literach M, N i O. Do układu P zaliczono antygeny: P, Pk i LKE. Późniejsze badania biochemiczne wykazały wzajemną zależność biosyntezy tych antygenów oraz jej związek z syntezą innych antygenów węglowodanowych, których geny kodują glikozylotransferazy odpowiedzialne za swoiste cukry w układach ABO, H, Lewis. Na początku XXI wieku, ze względu na niewyjaśnione podłoże genetyczne zmieniono klasyfikację układu P (symbol ISBT: P1, nr 001), w którym wyróżniono dwie grupy krwi: P1 w obecności antygenu i P2 bez antygenu P1. Antygen P zaliczono do układu grupowego Globozyd (nr 028), Pk i LKE do kolekcji Globozyd (nr 209) (5, 7).
Drogę biochemicznej syntezy antygenów P1, Pk, P, LKE przedstawiono na rycinie 1 (30). Antygen Pk powstaje z laktozyloceramidu, do którego 4-α-galaktozylotransferaza (α4GalT) dołącza galaktozę. Odkryto gen A4GALT kodujący ten enzym i jego lokalizację w chromosomie 22 (31, 32). Antygen P (globozyd) powstaje z antygenu Pk, gdy enzym 3-β-N-acetylogalaktozaminylotransferaza dodaje do łańcucha N-acetylogalaktozaminę. Sklonowano gen B3GALNT1 kodujący ten enzym i określono jego lokalizację w chromosomie 3 (33). Dalsze przyłączanie do łańcucha galaktozy i kwasu sjalowego powoduje powstanie antygenu LKE. Antygen P1 powstaje z paraglobozydu (laktozyloceramid z N-acetyloglukozaminą i galaktozą) również przez dołączenie galaktozy przez 4-α-GalT kodowaną przez gen zlokalizowany w chromosomie 22 (34). U osób z grupą krwi P2 (P1-) nie dochodzi do takiego przekształcenia paraglobozydu, natomiast laktozyloceramid ulega dalszym przemianom. Obecność krytycznych mutacji w genach A4GALT i B3GALNT1 jest genetycznym podłożem rzadkiego fenotypu p, w którym na krwinkach czerwonych nie ma antygenów Pk i P oraz fenotypu Pk bez antygenu P (35, 36).
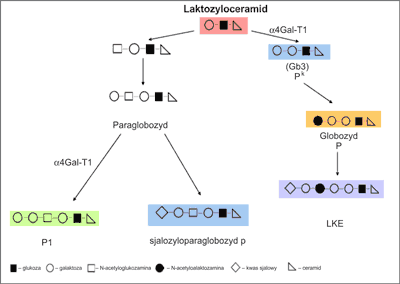 Ryc. 1. Synteza antygenów P1, Pk, P i LKE.
Mimo prowadzonych badań długo nie udawało się wyjaśnić, dlaczego osoby z fenotypem p nie mają antygenu P1, a osoby P2 mają antygen Pk oraz jaka zmiana w genie odpowiada za grupy krwi P1 i P2. Poszukiwano przyczyn zróżnicowanej ekspresji antygenu P1, pytając czy można ją wyjaśnić jedynie zygotycznością genu. Rozważano trzy hipotezy obecności fenotypu P1 i P2. Pierwsza zakładała istnienie jednego enzymu α4GalT, który przenosi galaktozę zarówno na laktozyloceramid, jak i paraglobozyd, jednak do wykorzystania paraglobozydu jako substratu konieczne byłoby białko regulatorowe (37). Druga hipoteza zakładała istnienie dwóch genów kodujących dwa różne enzymy, których inaktywacja prowadziłaby do wystąpienia fenotypu p (37). Trzecia hipoteza postulowała istnienie jednego genu z trzema allelami: jeden koduje enzym α4GalT, który przyłącza resztę cukrową do obydwu związków, drugi koduje enzym α4GalT, który przekształca tylko laktozyloceramid, trzeci koduje nieaktywną transferazę (38).
Mimo coraz większej dostępności metod genotypowania grup krwi, ciągle nie udawało się zastosować ich z sukcesem do oznaczania osób P1 i P2. Dopiero w styczniu 2011 ukazały się wyniki badań szwedzkich naukowców rzucające więcej światła na układ grupowy 003 (39). Sklonowali oni gen A4GALT i wykryli, że oprócz znanych trzech eksonów zawiera on dodatkowy ekson nazwany 2a. Badając ten fragment DNA zidentyfikowali polimorfizm odpowiedzialny za fenotyp P1 i P2. Jest nim pojedyncza zmiana nukleotydu w pozycji 42. Wszystkie badane próbki krwi P1 były homo- lub heterozygotami pod względem obecności cytozyny w tej pozycji, zaś próbki P2 były homozygotami, a 42. nukleotyd zawierał tyminę. Badania wykonane metodą cytometrii przepływowej potwierdziły zależność ekspresji antygenu P1 na krwinkach od homo- lub heterozygotyczności (odpowiednio silniejsze i słabsze reakcje z anty-P1). Podobne różnice zauważono badając ilość antygenu Pk, którego więcej było u homozygot P1 niż u heterozygot P1/P2. Biorąc pod uwagę te wyniki za słuszną uznano hipotezę trzecią. Zidentyfikowano dwa allele tego samego genu, jeden odpowiedzialny za fenotyp P1, drugi za P2. Wykryto, że różne zmiany nukleotydowe w obu tych genach doprowadziły do fenotypu p, o czym świadczyły badane allele p w szwedzkiej populacji (40). Autorzy nie odrzucili kategorycznie pierwszej hipotezy zakładającej istnienie jakiegoś czynnika regulatorowego. Zmiana nukleotydowa w pozycji 42 u osób P2 daje początek ramce odczytu i koduje peptyd składający się z 28 aminokwasów. Zbadano też poziom transkryptów genu A4GALT u osób P1/P1, P1/P2 i P2/P2 i wykazano różnice w ich ilości (30 razy więcej transkryptów u osób P1 niż u P2). Powyższe obserwacje oraz zróżnicowaną ekspresję antygenów P1 i Pk w zależności od genotypu, cytowani szwedzcy autorzy próbowali tłumaczyć w ten sposób, że czynnik (sekwencja genomowego DNA, nowy transkrypt lub peptyd) związany z P2 może obniżać transkrypcję A4GALT (obniżone wartości mRNA kodującego enzym) i zmniejszać wytwarzanie enzymu α4GalT. Antygen Pk mógłby powstawać nawet przy małej ilości enzymu, bo laktozyloceramid ma do niego duże powinowactwo, podczas gdy antygen P1 tworzy się tylko przy dużej ilości enzymu.
Ostatnie doniesienia ujawniły, że inny antygen może zostać włączony do nowego układu P1PK. Jest to antygen NOR, opisany tylko w dwóch rodzinach: po raz pierwszy w amerykańskiej rodzinie w 1982 roku, po raz drugi w Polsce w 1999 roku. Krwinki czerwone z tym antygenem mają na swojej powierzchni nietypowe glikosfingolipidy – produkty wydłużania globozydu, które są wykrywane przez przeciwciała naturalnie występujące w surowicy większości ludzi. Za powstanie antygenu NOR odpowiedzialna jest homozygotyczna mutacja w genie A4GALT w pozycji 631, w której cytozyna jest podstawiona guaniną, czego skutkiem jest zamiana aminokwasu glutaminy na kwas glutaminowy w łańcuchu białkowym w pozycji 211. Powstający w ten sposób enzym oprócz przyłączania galaktozy do galaktozy, nabywa też zdolność przyłączania galaktozy do N-acetylogalaktozaminy, a osoby z opisaną mutacją mają antygen Pk i antygen NOR (41).
W 2011 roku opisano jeszcze jeden antygen związany z omawianymi antygenami. Nazwano go PX2 i na razie znajduje się w kolekcji 209 Globozyd. Już w 1982 roku Kannagi zaobserwował, że u osób o fenotypie p glikosfingolipid x2 może być strukturalną bazą do powstania antygenu P-like (42). Dziesięć lat później Thorn opisał strukturę glikosfingolipidu x2 oraz zaobserwował, że u osób z fenotypem p ulega on nagromadzeniu w ilościach znacznie większych niż u pozostałych osób (43). Odkrycie tego antygenu tłumaczy, dlaczego osoby z rzadkim fenotypem Pk, z przeciwciałami anty-P w surowicy, nie zawsze mają zgodne próby krzyżowe z krwinkami p, mimo że krwinki te nie mają antygenu P. Prawdopodobnie mutacja genu wytwarzającego antygen P u osób Pk powoduje też zahamowanie produkcji glikosfingolipidu x2, pojawiają się naturalne przeciwciała anty-x2, które reagują z krwinkami p posiadającymi glikosfingolipid x2 w dużej ilości (44).
Ostatnie badania odkryły wiele faktów związanych z antygenami powstającymi z laktozyloceramidu, umożliwiły nową klasyfikację antygenów oraz lepsze poznanie i zrozumienie mechanizmów ich tworzenia. Nadal pozostaje wiele pytań dotyczących omawianych antygenów i konieczne są dalsze badania. Mogą być one pomocne w zrozumieniu biologicznej i filogenetycznej roli tych powszechnych w przyrodzie struktur. Ciekawa jest zróżnicowana wśród ludzi częstość występowania antygenu P1: u rasy czarnej 94%, u rasy kaukaskiej 78%, a w Kambodży i Wietnamie tylko u 20% (7). Antygen występuje na prawie wszystkich komórkach ludzkiego ciała. Antygen P1 jest receptorem niektórych szczepów E. coli oraz toksyny czerwonki. Występuje w postaci rozpuszczalnej w płynie owodniowym, w wątrobie zakażonej motylicą, w białku jaja gołębia, w płynie z torbieli bąblowca. Antygen Pk występuje na krwinkach czerwonych u wszystkich ludzi w niewielkich ilościach, w rzadkim fenotypie Pk (częstość ok. 0,01%) nie ulega przekształceniu do antygenu P i ma bardzo silną ekspresję. Antygen LKE jest obecny u 98% ludzi. Przeciwciała skierowane do wymienionych antygenów zwykle nie mają znaczenia klinicznego, są naturalne, nieregularne i nie reagują w temperaturze ciała. Problemem klinicznym jest bardzo rzadki fenotyp p, w obecności którego u kobiet dochodzi do samoistnych poronień, a u biorców krwi do silnych reakcji hemolitycznych. Piśmiennictwo
1. Landsteiner K: Zur Kenntness der antifermentiven lytischen und agglutinierenden Wirkungen des Blutserums und der Lymph. Centralblatt fur Bacteriologia 1900; 27: 357-366.
2. Landsteiner K: Uber Agglutinationserscheinungen normal menschlichen Blutes. Wiener Kinische Wochenschrift 1901; 14: 1132-1134.
3. Coombs RR: Historical note: past, present and future of the antiglobulin test. Vox Sang 1998; 74: 67-73.
4. Daniels G: The molecular genetics of blood group polymorphism. Hum Genet 2009; 126: 729-742.
5. Fabijańska-Mitek J (red.): Immunologia krwinek czerwonych. Grupy krwi. OINpharma, Warszawa 2007; 9-168.
6. Fabijańska-Mitek J: Immunohematologiczne podstawy współczesnej transfuzjologii. [W:]. Korsak J, Łętowska M (red.): Transfuzjologia kliniczna. α-medica press. Warszawa 2009; 38-68.
7. Reid ME, Lomas-Francis Ch: The blood group antigen. Facts book. 2nd ed. Elsevier Academic Press 2004; 3-550.
8. Helias V, Saison C, Ballif BA et al.: ABCB6 is dispensable for erythropoiesis and specifies the new blood group systems Langereis. Nat Genet 2012; 44: 170-173.
9. Peterson JK, Shukla S, Black ChM et al.: Human ABCB6 localizes to both the outer mitochondrial membrane and the plasma membrane. Biochemistry 2007: 46: 9443-9452.
10. Borst P, Elferink RO: Mammalian ABC transporters in health and disease. Annu Rev Biochem 2002; 71: 537-592.
11. Krishnamurthy PC, Du G, Fukuda Y et al.: Identification of a mammalian mitochondrial porphyrin transporter. Nature 2006; 443: 586-589.
12. Puy H, Gouya L, Deybach J-Ch: Porphyrias. Lancet 2010; 375: 924-937.
13. Saison C, Helias V, Ballif BA et al.: Null alleles of ABCG2 encoding the breast cancer resistance protein define the new blood group system Junior. Nat Genet 2012; 44: 174-177.
14. Szakacs G, Annereau J-P, Lababidi S et al.: Predicting drug sensitivity and resistance: profiling ABC transporter genes in cancer cells. Cancer Cell 2004; 6: 129-137.
15. Szakacs G, Paterson JK, Ludwig JA et al.: Targeting multidrug resistance in cancer. Nat Rev Drug Discov 2006; 5: 219-234.
16. Miyazaki T, Kwon KW, Yamamoto K et al.: A human monoclonal antibody to high-frequency red cell antigen Jra. Vox Sang 1994; 66: 51-54.
17. Allikmets R, Schriml LM, Hutchinson A et al.: A human placenta-specific ATP-binding cassette gene (ABCP) on chromosome 4q22 that is involved in multidrug resistance. Cancer Res 1998; 58: 5337-5339.
18. Vlaming MLH, Lagas JS, Schinkel AH: Physiological and pharmacological roles of ABCG2 (BCRP): recent findings in Abcg2 knockout mice. Adv Drug Deliver Rev 2009; 61: 14-25.
19. Kobayashi D, Ieiri I, Hirota T et al.: Functional assessment of ABCG2 (BCRP) gene polymorphisms to protein expression in human placenta. Drug Metab Dispos 2005; 33: 94-101.
20. Cusatis G, Sparreboom A: Pharmacogenomic importance of ABCG2. Pharmacogenomics 2008; 9: 1005-1009.
21. Maliepaard M, Scheffer GL, Faneyte F et al.: Subcellular localization and distribution of the breast cancer resistance protein transporter in normal human tissues. Cancer Res 2001; 61: 3458-3464.
22. Imai Y, Nakane M, Kage K et al.: C421A polymorphism in the human breast cancer resistance protein gene is associated with low expression of Q141K protein and low-level drug resistance. Mol Cancer Ther 2002; 1: 611-666.
23. Huls M, Brown CDA, Windass AS et al.: The breast cancer resistance protein transporter ABCG2 is expressed in the human kidney proximal tubule apical membrane. Kidney Int 2008; 73: 220-225.
24. Matsuo H, Takada T, Ichida K et al.: Common defects of ABCG2, a high-capacity urate exporter, cause gout: a function-based genetic analysis in a Japanese population. Sci Transl Med 2009; 1: 5-11.
25. Scharenberg ChW, Harkey MA, Torok-Storb B: The ABCG2 transporter is an efficient Hoechst 33342 efflux punp and is preferentially expressed by immature human hematopoietic progenitors. Blood 2002; 99: 507-512.
26. Zhou S, Zong Y, Ney PA et al.: Increased expression of the Abcg2 transporter during erythroid maturation plays a role in decreasing cellular5 protoporphyrin IX levels. Blood 2005; 105: 2571-2576.
27. Woodward OM, Kottgen A, Coresh J et al.: Identification of a urate transporter, ABCG2, with a common functional polymorphism causing gout. PNAS 2009; 106: 10338-10342.
28. Tamura A, Wakabayashi K, Onishi Y et al.: Re-evaluation and functional classification of non-synonymous single nucleotide polymorphisms of the human ATP-binding cassette transporter ABCG2. Cancer Sci 2007; 98: 231-239.
29. Landsteiner K, Levine P: Further observations on individual differences of human blood. Proc Soc Exp Biol 1927; 24: 941-942.
30. Daniels G: Human Blood Groups. 2nd edition. Oxford; Blackwell Science Ltd. 2002; 175-194.
31. Steffensen R, Carlier K, Wiels J et al.: Cloning and expression of the histo-blood group Pk UDP-galactose: Gal-beta1-4Glc-beta1--Cer alpha1,4-galactosyltransferase. Molecular genetic basis of the p phenotype. J Biol Chem 2000; 275: 16723-16729.
32. Keusch JJ, Manzella SM, Nyame KA et al.: Cloning of Gb3 synthase, the key enzyme in globo-series glycosphingolipid synthesis, predicts a family of alpha 1, 4-glycosyltransferases conserved in plants, insects, and mammals. J Biol Chem 2000; 275: 25315-25321.
33. Okajima T, Nakamura Y, Uchikawa M et al.: Expression cloning of human globoside synthase cDNAs. Identification of beta3--Gal-T3 as UDP-N-acetylgalactosamine: globotriaosylceramide beta 1,3-N-acetylgalactosaminyltransferase. J Biol Chem 2000; 275: 40498-40503.
34. McAlpine PJ, Kaita H, Lewis M: Is the DIA1 locus linked to the P blood group locus? Cytogenet Cell Genet 1978; 22: 629-632.
35. Furukawa K, Iwamura K, Uchikawa M et al.: Molecular basis for the p phenotype. Identification of distinct and multiple mutations in the alpha 1,4-galactosyltransferase gene in Swedish and Japanese individuals. J Biol Chem 2000; 275: 37752-37756.
36. Hellberg ?, Poole J, Olsson ML: Molecular basis of the globoside-deficient Pk blood group phenotype. Identification of four inactivating mutations in the UDP-N-acetylgalactosamine:globotriaosylceramide 3-beta-N-acetylgalactosaminyltransferase gene. J Biol Chem 2002; 277: 29455-29459.
37. Naiki M, Marcus DM: An immunochemical study of the human blood group P1, P, and Pk glycosphingolipid antigens. Biochemistry 1975; 14: 4837-4841.
38. Graham HA, Williams AN: A genetic model for the inheritance of the P, P1 and Pk antigens. Immunol Commun 1980; 9: 191-201.
39. Thuresson B, Westman J, Olsson ML: Identification of a novel A4GALT exon reveals the genetic basis of the P1/P2 histo-blood groups. Blood 2011; 117: 678-687.
40. Cedergren B: Population studies in Northern Sweden. IV. Frequency of the blood type p. Hereditas 1973; 73: 27-30.
41. Suchanowska A, Czerwiński M, Laskowska M et al.: Genetic background of NOR polyagglutination. Vox Sang 2011; 101 (suppl. 1): 20.
42. Kannagi R, Papayannopoulou T, Nakamoto B et al.: Carbohydrate antigen profiles of human erythroleukemia cell lines HEL and K562. Blood 1983; 62: 1230-1241.
43. Thorn JJ, Levery SB, Salyan ME et al.: Structural characterization of x2 glycosphingolipid, its extended form, and its sialosyl derivatives: accumulation associated with the rare blood group p phenotype. Biochemistry 1992; 31: 6509-6517.
44. Olsson ML, Peyrard T, Hult AK et al.: PX2: a new blood group antigen with implications for transfusion recommendations in P1k and P2k individuals. Vox Sang 2011; 101 (suppl. 1): 53.
otrzymano/received: 2012-05-07 zaakceptowano/accepted: 2012-06-04 Adres/address: *Jadwiga Fabijańska-Mitek Zakład Immunohematologii Centrum Medycznego Kształcenia Podyplomowego ul. Marymoncka 99/103, 01-813 Warszawa tel.: +48 (22) 569-38-20 e-mail: biofizyka@cmkp.edu.pl Artykuł Nowe układy grupowe krwi w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








