|
© Borgis - Postępy Nauk Medycznych 1, s. 21-28
Ewa Krzyżanowska1, *Iwona Jastrzębska1, Agnieszka Zwolak1, Beata Kasztelan-Szczerbińska2, Cezary T. Łozowski2, Jadwiga Daniluk1, 2
Ocena stanu odżywienia i jakości życia u chorych z marskością alkoholową wątroby
Assessment of nutritional status and quality of life of patients with alcoholic liver cirrhosis
1Katedra Interny z Zakładem Pielęgniarstwa Internistycznego Uniwersytetu Medycznego w Lublinie
Kierownik Katedry: prof. dr hab. med. Jadwiga Daniluk 2Katedra i Klinika Gastroenterologii z Pracownią Endoskopową Uniwersytetu Medycznego w Lublinie Kierownik Kliniki: prof. dr hab. med. Maria Słomka Streszczenie
Wstęp: Przewlekłe nadużywanie alkoholu prowadzi do rozwoju alkoholowej choroby wątroby, której ostatnim, najbardziej zaawansowanym stadium jest marskość. Celem pracy była ocena stanu odżywienia i jakości życia chorych z alkoholową marskością wątroby w zależności od stadium niewydolności narządu i płci badanych. Materiał i metody: Badaną grupę stanowiło 125 osób, w tym 100 chorych z marskością alkoholową wątroby oraz 25 osób zdrowych. W oparciu o klasyfikację Child-Pough chorych podzielono na trzy grupy: grupa I – Child A, grupa II – Child B, grupa III – Child C. Stan odżywienia oceniono na podstawie stężenia albumin w surowicy i antropometrii (BMI, grubość fałdu skórnego, obwód mięśni ramienia), a jakość życia z wykorzystaniem kwestionariusza ankiety WHOQOL-BREF. Wyniki badań: Stężenie albumin <40 g/dl występowało u 47% chorych z marskością. Istotne statystycznie różnice występowały pomiędzy grupami II i III (p=0,003), I i kontrolną (p=0,04) oraz III i kontrolną (p=0,00007). Grubość fałdu skórnego nad mięśniem trójgłowym ramienia w grupie chorych była niższa niż u zdrowych (kobiety p<0,0001; mężczyźni p<0,01). Wartości pozostałych parametrów antropometrycznych były niższe u chorych w porównaniu z osobami zdrowymi, lecz różnice nie były istotne statystycznie (p>0,05). Jakość życia u chorych z alkoholową marskością wątroby, niezależnie od jej zaawansowania, w porównaniu do osób zdrowych była istotnie statystycznie niższa we wszystkich aspektach: wymiar fizyczny p<0,00001; aspekt psychologiczny p<0,0001; relacje społeczne p<0,01; wymiar środowiskowy p<0,001. Wnioski: Cechy niedożywienia występują we wszystkich stadiach marskości wątroby i pogłębiają się wraz z progresją choroby. Jakość życia chorych z alkoholową marskością wątroby jest znacznie niższa niż u ludzi zdrowych. W terapii marskości ważny jest nie tylko problem kliniczny, lecz także psychologiczny. Słowa kluczowe: niedożywienie, choroba wątroby, jakość życia
Summary
Introduction: Excessive ethanol consumption results in alcoholic liver disease, and eventually in liver cirrhosis. The aim of the study was to assess nutritional status and quality of life of patients with alcoholic liver cirrhosis with relation to liver dysfunction and patients gender. Material and methods: The study comprised 125 subjects, 100 patients with alcoholic liver cirrhosis and 25 healthy volunteers. Based on the Child-Pough score cirrhotics were divided into three groups: Child A (group I), Child B (group II) and Child C (group III). Nutritional status was assessed by serum albumin and anthropometry (BMI, triceps skinfold tickness, arm muscle circumference). The WHOQOL-BREF questionnaire was used for quality of life evaluation. Results: Low serum albumin (<40 g/dl) was demonstrated in 47% of cirrhotic patients. The percentages of subjects with low serum albumin were substantially higher in group III compared to group II (p=0.003); and in groups I and III compared to control group (p=0.04 and p=0.00007, respectively). The triceps skinfold ticknesses of cirrhotic females (p<0.0001) and males (p<0.01) were significantly lower than of healthy subjects. There were trends towards lower values of other anthropometric parameters in cirrhotics compared to controls (p>0.05). Patients with liver cirrhosis, regardless of its stage, scored significantly lower in respective domains of quality of life than controls: physical health p<0.00001, psychological domain p<0.0001, social relations p<0.01, and environment p<0.001. Conclusions: Malnutrition is common in patients at every stage of liver cirrhosis and it intensifies with disease progression. Alcoholic liver cirrhosis markedly impairs the quality of life. Essential components of cirrhosis therapy include management not only of clinical symptoms but also psychological dysfunction. Key words: malnutrition, liver disease, quality of life
Wstęp
Spożywanie alkoholu jest trwałym elementem kultury, towarzyszącym rozwojowi społeczeństw od momentu ich powstania. Alkohol spożywany w umiarkowanych ilościach nie zagraża zdrowiu, natomiast jego nadużywanie wywiera niekorzystny wpływ na zdrowie somatyczne i psychiczne. Narządem najbardziej narażonym na toksyczne działanie alkoholu jest wątroba, ponieważ jego główny metabolizm odbywa się w komórkach wątrobowych. Skutkiem przewlekłego nadużywania alkoholu jest rozwój alkoholowej choroby wątroby. Ostatnim stadium alkoholowego uszkodzenia wątroby jest marskość wątroby (1-5). Alkoholowa marskość wątroby (m.a.w.) występuje u około 15-20% osób uzależnionych od alkoholu i rozwija się u 70-80% chorych na alkoholowe zapalenie wątroby (1, 2, 5, 6). W licznych badaniach potwierdzono, że marskość wątroby jest procesem chorobowym prowadzącym nieuchronnie do skrócenia czasu życia. Chorzy z marskością wątroby na ogół zachowują świadomość postępu choroby i stopniowego pogarszania się jakości życia (7, 8). W piśmiennictwie początkowo uważano, że marskość wątroby spowodowana jest niedożywieniem, obecne badania sugerują, że niedożywienie jest konsekwencją procesu chorobowego.
Cel pracy
Celem pracy była ocena stanu odżywienia i jakości życia u chorych z marskością wątroby w zależności od stadium niewydolności wątroby i płci badanych.
Materiał i metody
Badaniami objęto 125 osób, w tym 100 chorych z alkoholową marskością wątroby (55 mężczyzn i 45 kobiet) leczonych w Klinice Gastroenterologii Samodzielnego Publicznego Szpitala Klinicznego Nr 4 w Lublinie w latach 2004-2006 oraz 25 osób zdrowych, stanowiących grupę kontrolną (K). W oparciu o klasyfikację Child-Pough chorych podzielono na trzy grupy: grupa I – Child A, grupa II – Child B, grupa III – Child C. Charakterystykę badanej grupy przedstawia rycina 1.
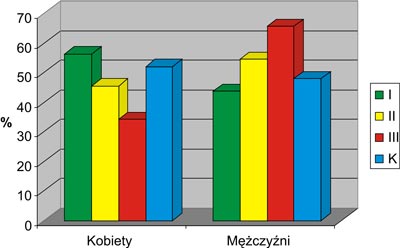 Ryc. 1. Charakterystyka badanej grupy z podziałem na płeć.
Stan odżywienia organizmu oceniono na podstawie:
– stężenia albumin w surowicy krwi – pomiaru dokonano metodą spektrofotometryczną z zielenią bromokrezolową punktu końcowego;
– wskaźnika masy ciała (BMI) – BMI obliczono ze wzoru: BMI = masa ciała w kg/(wzrost w m2); pomiaru wzrostu dokonano przy pomocy wzrostomierza o dokładności do 0,5 cm; pomiaru masy ciała dokonano na wadze lekarskiej z dokładnością do 100 g;
– grubości fałdu skórnego nad mięśniem trójgłowym ramienia (GFS) – pomiaru dokonano przy pomocy fałdomierza: środek ramienia od tyłu nad mięśniem trójgłowym niedominującego ramienia; w czasie badania pacjent pozostawał w pozycji siedzącej z kończyną zgiętą w stawie łokciowym pod kątem 90 stopni;
– obwodu mięśni ramienia (OMR) – OMR wyliczono ze wzoru: OMR = obwód ramienia w mm – (3,14xGFS w mm) (9); wartości obwodu ramienia uzyskano, mierząc trzykrotnie obwód ramienia kończyny niedominującej (za dominującą uznano tę, którą pacjent pisze) w połowie jego wysokości przy użyciu miary krawieckiej.
Jakość życia badanych chorych oceniono za pomocą kwestionariusza ankiety WHOQOL-BREF, który umożliwił ocenę profilu jakości życia w zakresie czterech dziedzin: psychologicznej, fizycznej, relacji społecznych i środowiska.
Uzyskane wartości stężenia albumin, BMI, GFS oraz OMR poddano analizie statystycznej, stosując testy U-Manna-Whitneya i Kruskala-Wallisa. Do zbadania zależności między dwiema cechami ilościowymi zastosowano test istotności współczynnika korelacji R. Spearmana. Na tej podstawie wyodrębniono grupę osób niedożywionych i odżywionych prawidłowo.
Wyniki
Ocena stanu odżywienia
Stężenie albumin poniżej 40 g/dl występowało u 47,00% chorych z marskością: u 23,40% badanych z grupy I, u 19,15% z grupy II, u 57,45% badanych z grupy III oraz u 16,00% badanych z grupy kontrolnej. Analiza statystyczna wykazała istotne statystycznie różnice pomiędzy grupami II i III (p=0,003), między grupą I i grupą kontrolną (p=0,04) oraz grupą III i grupą kontrolną (p=0,00007). Między pozostałymi grupami nie stwierdzono statystycznie istotnych różnic (p>0,05).
Wartości BMI poniżej 20 kg/m2 stwierdzono u 15,00% chorych z marskością wątroby: u 33,33% badanych w grupie I, u 33,33% badanych w grupie II, u 33,33% badanych w grupie III oraz u 16,00% badanych z grupy kontrolnej. Analiza statystyczna nie wykazała istotnych statystycznie różnic między badanymi grupami (p>0,05).
Wartości GFS poniżej 50% wartości referencyjnych występowały łącznie u 32,00% chorych z alkoholową marskością wątroby: stwierdzono je u 25,00% badanych z grupy I, u 31,25% badanych z grupy II, u 43,75% badanych z grupy III. U osób z grupy kontrolnej wartości GFS mieściły się w normie. Analiza statystyczna nie wykazała istotnych statystycznie różnic w zakresie GFS pomiędzy badanymi grupami (p>0,05).
Wartości OMR poniżej wartości prawidłowych dla płci obecne były u 19,00% chorych z m.a.w. Stwierdzono je u 21,05% badanych z grupy I, u 21,05% badanych z grupy II, u 57,89% badanych z grupy III. U osób z grupy kontrolnej wartości OMR mieściły się w normie. Analiza statystyczna nie wykazała istotnych statystycznie różnic pomiędzy grupami (p>0,05).
Parametry biochemiczne oraz dane uzyskane za pomocą antropometrii poddano analizie w zależności od płci badanych w obrębie grup I, II, III i K (tab. 1). Obniżone stężenie albumin w surowicy krwi stwierdzono zarówno u kobiet (3,85±0,66 g/dl), jak i u mężczyzn (3,74±0,34 g/dl) z grupy III. Stężenie albumin było statystycznie istotnie wyższe u kobiet w grupie II w porównaniu do mężczyzn tej samej grupy (p=0,03). W pozostałych grupach (I, III i K) występowały różnice stężenia albumin w zależności od płci, lecz nie osiągnęły one cech istotności statystycznej (p>0,05). Zaobserwowano, że stężenie albumin u kobiet z m.a.w. wszystkich grup (I, II, III) było wyższe niż u chorych mężczyzn tych samych grup. Graficzny zapis stężenia albumin u kobiet i mężczyzn w badanych grupach przedstawia rycina 2.
Tabela 1. Wartości parametrów antropometrycznych i biochemicznych badanych kobiet i mężczyzn.
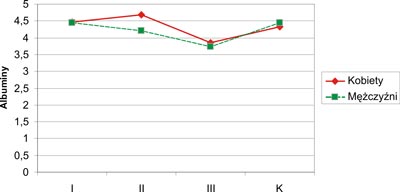 Ryc. 2. Stężenie albumin w surowicy krwi u kobiet i mężczyzn (K – grupa kontrolna).
Najniższy wskaźnik BMI stwierdzono u kobiet w grupie III (20,91±2,16 kg/m2). U mężczyzn najniższe BMI odnotowano również w grupie III (25,37±5,64 kg/m2). Wartość wskaźnika BMI była istotnie wyższa u mężczyzn (p=0,009) w grupie III w porównaniu do kobiet tej samej grupy. W pozostałych grupach (I, II i K) obserwowano różnice wartości BMI w zależności od płci, lecz nie posiadały one cech istotności statystycznej (p>0,05). Obserwowano również niższe wartości wskaźnika BMI u kobiet wszystkich grup w porównaniu do mężczyzn. Graficzny zapis wskaźnika BMI u kobiet i mężczyzn przedstawia rycina 3.
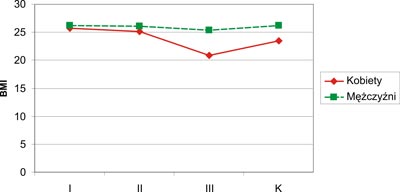 Ryc. 3. Wartości wskaźnika BMI u kobiet i mężczyzn (BMI – wskaźnik masy ciała; K – grupa kontrolna).
Średnia wartość GFS była najniższa u mężczyzn w grupie III i wynosiła (8,87±4,60 mm), analogicznie w grupie kobiet najniższą wartość GFS zarejestrowano w grupie III (9,50±3,45 mm). Między grupami I, II, III i K występowały różnice wartości GFS: między grupą kobiet I i K (p=0,00001), II i K (p=0,00004) i III i K (p=0,00009). Natomiast w grupie mężczyzn stwierdzono statystycznie istotne różnice między grupą I i K (p=0,001), II i K (p=0,00007), III i K (p=0,00002). Największe wartości GFS odnotowano u kobiet zdrowych z grupy kontrolnej. Graficzny zapis GFS kobiet i mężczyzn grupy I, II, III i K przedstawia rycina 4.
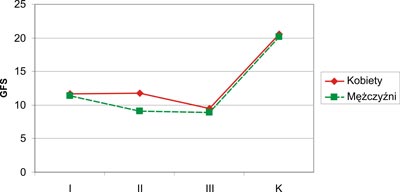 Ryc. 4. Wartości GFS u mężczyzn i kobiet (GFS – grubość fałdu skórnego nad mięśniem trójgłowym ramienia; K – grupa kontrolna).
Najniższe wartości OMR obserwowano u kobiet w grupie III (20,91±4,52 mm). U mężczyzn najniższa wartość wskaźnika OMR występowała w grupie II (23,64±4,36 mm). Obwód mięśni ramienia był istotnie wyższy u mężczyzn (p=0,0007) w grupie kontrolnej niż u kobiet tej samej grupy. W pozostałych grupach I, II i III obserwowano różnice wartości OMR w zależności od płci, lecz nie stwierdzono różnic statystycznie istotnych (p>0,05). Kobiety ze wszystkich grup (I, II, III i K) miały niższe wartości OMR w porównaniu do mężczyzn tych samych grup. Graficzny zapis wartości OMR kobiet i mężczyzn w badanych grupach przedstawia rycina 5.
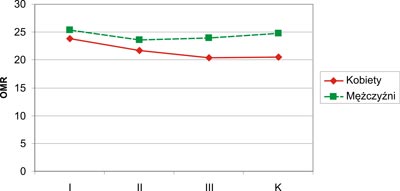 Ryc. 5. Wartości OMR u kobiet i mężczyzn (OMR – obwód mięśni ramienia; K – grupa kontrolna).
Ocena jakości życia
Jakość życia w dziedzinie fizycznej gorzej ocenili mężczyźni z grupy I (11,93) niż kobiety grupy I (12,09). Podobnie mężczyźni grupy II (10,63) gorzej ocenili fizyczny wymiar jakości życia w porównaniu do kobiet (11,77) tej samej grupy. Natomiast w grupie III jakość życia w dziedzinie fizycznej została oceniona lepiej przez mężczyzn (10,98) niż kobiety (10,95). Ocena dotycząca jakości życia mężczyzn z m.a.w. w dziedzinie fizycznej była znacznie gorsza niż kobiet chorych, chociaż różnice nie były statystycznie znamienne. Badani z m.a.w. (kobiety i mężczyźni) w porównaniu do osób zdrowych znacznie gorzej ocenili fizyczny wymiar jakości życia, a różnice te były statystycznie istotne (grupa I p=0,000002; grupa II p=0,000001; oraz grupa III p<0,000001). Otrzymane wyniki przedstawia rycina 6.
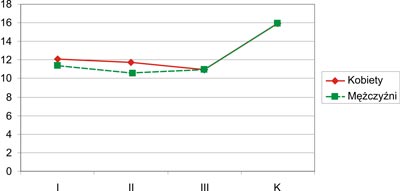 Ryc. 6. Jakość życia w aspekcie dziedziny fizycznej (K – grupa kontrolna).
Jakość życia w dziedzinie psychologicznej oceniona została lepiej przez mężczyzn z m.a.w. z grupy I (11,90) w porównaniu do kobiet (11,63) z tej samej grupy, lecz różnice nie były znamienne statystycznie. Mężczyźni z grupy II (10,67) i III (10,84) znacznie gorzej ocenili jakość życia w wymiarze psychologicznym niż kobiety z grupy II (11,20) i III (11,00), chociaż różnice nie posiadały cech istotności statystycznej. Zarówno kobiety, jak i mężczyźni z m.a.w., gorzej ocenili jakość swojego życia w aspekcie dziedziny psychologicznej w porównaniu z osobami zdrowymi. Wysoce istotne statystycznie różnice w odczuwaniu jakości życia w jego psychologicznym aspekcie występowały między grupami I i K (p=0,00006), II i K (p=0,000001) oraz III i K (p=0,000001). Otrzymane wyniki przedstawia rycina 7.
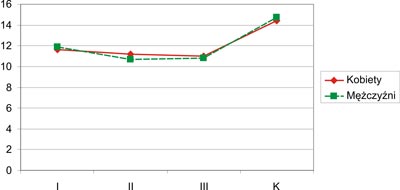 Ryc. 7. Jakość życia w aspekcie dziedziny psychologicznej (K – grupa kontrolna).
Jakość życia w dziedzinie relacji społecznych została lepiej oceniona przez mężczyzn (13,05) niż kobiety (12,07) z grupy I. Natomiast mężczyźni z grupy II (11,19) i III (11,71) ocenili jakość życia w aspekcie relacji społecznych gorzej w porównaniu do kobiet grupy II (12,09) i III (11,78), lecz różnice nie były statystycznie istotne. Badani z m.a.w. (kobiety i mężczyźni) niezależnie od stadium zaawansowania choroby znacznie gorzej ocenili jakość życia w aspekcie relacji społecznych niż osoby zdrowe, a różnice były znamienne statystycznie: między grupą I i K (p=0,003), II i K (p=0,0002) oraz III i K (p=0,000003). Otrzymane wyniki przedstawia rycina 8.
 Ryc. 8. Jakość życia w aspekcie dziedziny – relacje społeczne (K – grupa kontrolna).
Jakość życia w aspekcie środowiska została oceniona lepiej przez mężczyzn z grup I (12,43) i III (12,02) w porównaniu do kobiet z grup I (12,14) i III (11,50), natomiast mężczyźni grupy II (11,64) ocenili ją znacznie gorzej niż kobiety (12,53) z tej samej grupy, lecz różnice te nie osiągnęły cech istotności statystycznej. Wysoce istotne statystycznie różnice w samoocenie jakości życia kobiet i mężczyzn obserwowano, porównując grupy I i K (p=0,0006), II i K (p=0,0009) oraz III i K (p=0,0009). Otrzymane wyniki przedstawia rycina 9.
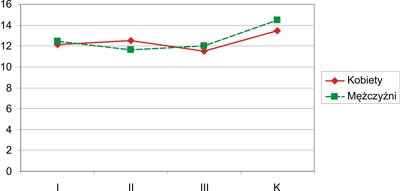 Ryc. 9. Jakość życia w aspekcie dziedziny – środowisko (K – grupa kontrolna).
Dyskusja
Wyniki badań własnych wykazały cechy niedożywienia białkowo-kalorycznego we wszystkich stadiach niewydolności wątroby. Największy stopień niedożywienia obserwowano w stadium Child C. Koresponduje to z badaniami innych autorów, którzy cechy niedożywienia białkowo-energetycznego stwierdzali we wszystkich stadiach marskości z wyraźną tendencją pogłębiania się wraz z progresją choroby (8,10-13). Analiza parametrów stanu odżywienia wykazała, iż u 24% chorych z marskością alkoholową wątroby występują cechy niedożywienia. Uzyskane rezultaty zgodne są z wynikami innych autorów, którzy cechy niedożywienia obserwowali u 70% (14), a nawet 90% badanych pacjentów z marskością wątroby (15).
Albuminy stanowią ważny wskaźnik stanu odżywienia organizmu, ich spadek koreluje ze zwiększoną częstością powikłań i śmiertelnością, dlatego w przedstawionej pracy w poszczególnych stadiach choroby przeprowadzono analizę parametrów białkowych. Stężenie albumin poniżej 40 g/dl obserwowano łącznie u 47% chorych z marskością. Stwierdzono je u 23,40% badanych z grupy I, u 19,15% z grupy II i u 57,45% z grupy III. Liczne badania potwierdzają, że stężenie albumin u badanych z marskością jest znacznie niższe w porównaniu do osób zdrowych (16-18).
W badaniach własnych do oceny stanu odżywienia wykorzystano również antropometrię, która potwierdza obserwowane klinicznie u chorych z m.a.w. postępujące zaburzenia w stanie odżywienia. W przedstawionym materiale wykorzystano wyliczany na podstawie pomiarów antropometrycznych wskaźnik masy ciała. Stwierdzono, iż wartość wskaźnika masy ciała w badanej grupie była różna w zależności od stadium m.a.w. Najniższą jego wartość odnotowano w grupie III (Child C). Wraz z progresją choroby wskaźnik masy ciała obniżał się, jednak różnice poszczególnych wartości nie osiągnęły cech istotności statystycznej.
Uzyskane wyniki zbieżne są z doniesieniami innych autorów, którzy obserwowali obniżanie BMI wraz z progresją choroby (16). Roongpisuthipong C. i wsp. (10) podają, że 11,7% pacjentów z marskością wątroby miało BMI poniżej 18,5 m/kg2. Podobnie Dichi JB. i wsp. (16), przeprowadzając badania u 115 pacjentów z marskością, wykazali istotnie niższy BMI (p<0,01) w porównaniu do grupy kontrolnej. Obserwowali również jego obniżanie się wraz z zaawansowaniem choroby.
W badaniach własnych niski w porównaniu do grupy kontrolnej wskaźnik masy ciała korelował z obniżeniem pozostałych wskaźników antropometrycznych. Podstawę antropometrii stanowił pomiar grubości fałdów skórnych, wśród których najszersze zastosowanie znalazł pomiar grubości fałdu skórnego nad mięśniem trójgłowym ramienia. Z badań własnych wynika, że cechy niedożywienia kalorycznego definiowanego jako GFS poniżej 50% wartości referencyjnych obserwowane są we wszystkich, także wczesnych okresach niewydolności wątroby w przebiegu m.a.w. Ponadto stwierdzono istotną statystycznie dynamikę pogłębiania się cech niedożywienia w stadium najbardziej klinicznie zaawansowanym Child C (43,75%). Podobne wyniki uzyskali Caregaro L. i wsp. (19), którzy cechy niedożywienia mierzonego na podstawie GFS stwierdzili u 30% badanych pacjentów. Liczne publikacje potwierdzają wyniki badań własnych, że wartość GFS zmniejsza się wraz z progresją marskości (10,12). Dichi JB. i wsp. (16) wykazali niższe wartości GFS u badanych z marskością w porównaniu do grupy kontrolnej.
W przedstawionym materiale do oceny stanu odżywienia wykorzystano również obwód mięśni ramienia (OMR) wyliczonego na podstawie GFS i obwodu ramienia. Określone w ten sposób niedożywienie stwierdzono we wszystkich stadiach choroby, przy czym w grupie III (Child C) osoby takie stanowiły 57,89%. Wyniki te zbieżne są z przedstawionymi przez Dichi JB. i wsp. (16), którzy stwierdzili obniżanie wartości OMR wraz z klinicznym postępem niewydolności wątroby.
Do oceny jakości życia osób z m.a.w. i zdrowych, stanowiących grupę kontrolną, użyto kwestionariusza generycznego WHOQOL-BREF. Ocenie poddano cztery aspekty życia: fizyczny, psychologiczny, społeczny i środowisko. Badania własne potwierdziły, iż pacjenci z marskością wątroby, zarówno kobiety, jak i mężczyźni, mieli obniżone odczuwanie jakości życia we wszystkich analizowanych aspektach w porównaniu do osób zdrowych. Dodatkowo prezentowane wyniki dowodzą, że postęp choroby wyrażony skalą Child-Pough jest związany ze znacznym obniżeniem wszystkich wymiarów (dziedzin) jakości życia. Koresponduje to znakomicie z doniesieniami innych autorów o negatywnym wpływie progresji choroby na jakość życia (11, 13, 20-24).
Analiza ocen cząstkowych wykazała, że najniższy poziom satysfakcji chorych stwierdzano w zakresie dziedziny psychologicznej. Poziom ograniczeń w tej dziedzinie był większy niż w dziedzinie fizycznej. Podobne wyniki otrzymali Arguedas MR. i wsp. (23), którzy wykazali, iż badani z marskością lepiej ocenili psychologiczny niż fizyczny aspekt jakości życia. Nieco inne wyniki otrzymali autorzy włoscy i amerykańscy (24, 25), którzy w swoich badaniach wykazali, że to właśnie stan fizyczny jest silnym predykatorem jakości życia u chorych z marskością wątroby.
Wnioski
1. Niedożywienie białkowo-energetyczne obecne jest w marskości alkoholowej wątroby we wszystkich stadiach niewydolności wątroby i pogłębia się wraz z postępem niewydolności wątroby ocenianym skalą Child-Pough.
2. Obraz kliniczny niedożywienia w marskości różni się w zależności od badanej płci. Chociaż u kobiet, jak i mężczyzn, już we wczesnym stadium choroby obserwowany jest deficyt tkanki tłuszczowej, to jednak u mężczyzn stwierdza się większy niż u kobiet niedobór zasobów białkowych.
3. Jakość życia pacjentów z m.a.w. we wszystkich dziedzinach (fizycznej, psychologicznej, środowiska, relacji społecznych), niezależnie od stadium zaawansowania choroby, jest istotnie gorsza niż osób zdrowych. Pogorszenie jakości życia chorych następuje wraz z progresją choroby.
4. Poprawa jakości życia u chorych z m.a.w. jest ważnym elementem terapii tej choroby.
5. Wyniki badań własnych wskazują, iż w terapii chorych z marskością alkoholową wątroby poza leczeniem farmakologicznym należy zwrócić uwagę na poprawę jakości życia. Piśmiennictwo
1. Daniluk J, Jurkowska G: Zarys chorób wewnętrznych dla studentów pielęgniarstwa. Lublin: Wyd. Czelej 2006; p. 277-91.
2. Daniluk J: Alkoholowa choroba wątroby. Nowa Klin 2003; 10(1/2): 17-22.
3. Daniluk J: Nowoczesne aspekty etiopatogenezy i leczenia alkoholowej choroby wątroby. Med Og 2004; 10(1/2): 65-6.
4. Daniluk J: Wpływ alkoholu na system interferonowy u zwierząt doświadczalnych oraz ocena systemu interferonowego i czynnika martwicy nowotworów u ludzi przewlekle nadużywających alkohol z chorobami przewodu pokarmowego. Praca habilitacyjna. Lublin, 1996; p. 7-10.
5. Daniluk J: Alkoholowa choroba wątroby. Terapia 2001; 9(5): 6-10.
6. Daniluk J: Alkoholowa choroba wątroby. Nowa Klin 2006; 13(11/12): 1143-8.
7. Bruśk I: Jakość życia chorych z chorobą przewlekłą. Zdr Pub 1999; 109(11): 383-4.
8. Kapuza M: Prognozowanie przebiegu marskości wątroby. Problemy związane z rokowaniem w marskości wątroby. Hepatol Pol 1998; 5(1): 27-9.
9. Szczygieł B, Socha J: Żywienie pozajelitowe i dojelitowe w chirurgii. Warszawa, Wyd. Lekarskkie PZWL 1994; p. 21-56.
10. Roongpisuthipong C, Sobhonslidsuk A, Nantiruj K et al.: Nutritional assessment in various stages of liver cirrhosis. Nutrition 2001; 17(9): 761-5.
11. Alvares-da-Silva MR, Reverbel da Silveira T: Comparison between handgrip strength, subjective global assessment, and prognostic nutritional index in assessing malnutrition and predicting clinical outcome in cirrhotic outpatients. Nutrition 2005; 21(2): 113-7.
12. Tajika M, Kato M, Mohri H et al.: Prognostic value of energy metabolism in patients with viral liver cirrhosis. Nutrition 2002; 18(3): 229-34.
13. Tözün N: Influence of the metabolic complications of liver cirrhosis on dietary intake. Med Sci Monit 2000; 6(6): 1223-6.
14. Müller MJ: Malnutrition in cirrhosis. J Hepatol 1995; 23(Suppl 1): 31-5.
15. Moriwaki H: Protein-energy malnutrition in liver cirrhosis. J Gastroenterol 2002; 37(7): 578-9.
16. Dichi JB, Dichi I, Maio R et al.: Whole-body protein turnover in malnourished patients with child class B and C cirrhosis on diets low to high in protein energy. Nutrition 2001; 17(3): 239-42.
17. Kotoh K, Nakamuta M, Fukushima M et al.: High relative fat-free mass is important for maintaining serum albumin levels in patients with compensated liver cirrhosis. World J Gastroenterol 2005; 11(9): 1356-60.
18. Müller MJ, Fenk A, Lautz HU et al.: Energy expenditure and substrate metabolism in ethanol-induced liver cirrhosis. Am J Physiol 1991; 260(3 Pt 1): E338-44.
19. Caregaro L, Alberino F, Amodio P et al.: Malnutrition in alcoholic and virus-related cirrhosis. Am J Clin Nutr 1996; 63(4): 602-9.
20. Parikh-Patel A, Gold EB, Utts J et al.: Functional status of patients with primary biliary cirrhosis. Am J Gastroenterol 2002; 97(11): 2871-9.
21. Campillo B, Paillaud E, Uzan I et al.: Comité de Liaison Alimentation-Nutrition. Value of body mass index in the detection of severe malnutrition: influence of the pathology and changes in antropometric parameters. Clin Nutr 2004; 23(4): 551-9.
22. Sumskiene J, Sumskas L, Petrauskas D et al.: Disease-specific health-related quality of life and its determinants in liver cirrhosis patients in Lithuania. World J Gastroenterol 2006; 12(48): 7792-7.
23. Arguedas MR, DeLawrence TG, McGuire BM: Influence of hepatic encephalopathy on health-related quality of life in patients with cirrhosis. Dig Dis Sci 2003; 48(8): 1622-6.
24. Younossi ZM, Kiwi ML, Boparai N et al.: Cholestatic liver diseases and health-related quality of life. Am J Gastroenterol 2000; 95(2): 497-502.
25. Marchesini G, Bianchi G, Amodio P et al.: Factors associated with poor health – related quality of life of patients with cirrhosis. Gastroenterology 2001; 120(1): 170-8.
otrzymano/received: 2009-10-30 zaakceptowano/accepted: 2009-12-04 Adres/address: *Iwona Jastrzębska Katedra Interny z Zakładem Pielęgniarstwa Internistycznego, Uniwersytet Medyczny w Lublinie ul. Jaczewskiego 8, 20-950 Lublin tel./fax: +48 (81) 742-58-25 e-mail: ivjastrzebska@wp.pl Artykuł Ocena stanu odżywienia i jakości życia u chorych z marskością alkoholową wątroby w Czytelni Medycznej Borgis. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








