|
© Borgis - Postępy Nauk Medycznych 2, s. 115-125
*Helena Jastrzębska
Postępy w rozpoznawaniu i leczeniu ciężkiej oftalmopatii tarczycowej
Progress in the diagnosis and treatment of severe Graves´ ophthalmopathy
Klinika Endokrynologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. CMKP dr hab. med. Wojciech Zgliczyński Streszczenie
Oftalmopatia tarczycowa jest najczęstszą pozatarczycową manifestacją choroby Gravesa. Faza aktywna ciężkiej oftalmopatii rozwija się na skutek nacieku fibroblastami i aktywowanymi limfocytami tkanek pozagałkowych. Rozpoznanie ustala się w oparciu o badanie kliniczne i badania dodatkowe, w tym usg, CT i MRI oczodołów. Leczenie fazy aktywnej ciężkiej oftalmopatii tarczycowej polega na stosowaniu dekompresji farmakologicznej w postaci masywnej systemowej kortykoterapii doustnej lub dożylnej oraz radioterapii okolic pozagałkowych. Możliwa jest także chirurgiczna dekompresja oczodołów. Przetrwałe podwójne widzenie w fazie nieaktywnej zmian może być leczone operacja mięśni okoruchowych. Słowa kluczowe: ciężka oftalmopatia tarczycowa, kortykoterapia, radioterapia oczodołów, dekompresja oczodołów, operacja mięśni okoruchowych
Summary
Thyroid eye-disease is the most common extrathyroidal manifestation of Graves´ disease. The symptoms of the acute phase of severe thyroid ophthalmopathy are due to the infiltration of orbital fibroblasts and extraocular muscles with lymphocytes and the oedema of the retrobulbar space. The clinical diagnosis of thyroid- associated eye disease should be supported with additional investigations. Enlarged extraocular muscles can be demonstrated by using ultrasonography, computed tomography and/or magnetic resonance imaging. Treatment of the severe active phase ophthalmopathy is consisted of medical decompression with high doses of systemic glucocorticoids applicated orally or intravenously, external x-ray therapy to the retrobulbar area or surgical orbit decompression. Persistent ocular movement limitations could be corrected by ocular muscle surgery at inactive phase. Key words: severe thyroid ophthalmopathy, corticotherapy, orbital radiotherapy, surgical orbit decompression, ocular muscle surgery
Definicja
Ciężka oftalmopatia tarczycowa, zwana też ciężką orbitopatią lub oftalmopatią Gravesa albo wytrzeszczem naciekowo-obrzękowym czy wytrzeszczem złośliwym jest to wysunięcie gałek ocznych ponad 27 mm poza brzegi kostne oczodołów, z możliwością uszkodzenia rogówki na skutek niedomykalności powiek, albo przekrwieniem spojówek i obrzękiem powiek, ograniczeniem ruchomości gałek ocznych z podwójnym widzeniem lub upośledzeniem ostrości wzroku i ograniczeniem pola widzenia, które nieleczone mogą prowadzić do poważnych powikłań okulistycznych z utratą wzroku włącznie i zawsze powodują obniżenie jakości życia (1). Jakość życia chorych z oftalmopatią tarczycową oceniana w oparciu o kwestionariusze jest wyraźnie obniżona i gorsza niż u chorych z takimi chorobami przewlekłymi jak cukrzyca, rozedma czy niewydolność serca. Jakość życia obniża się zarówno w następstwie zaburzeń widzenia jak i gorszego funkcjonowania psychospołecznego na skutek zmian wyglądu (2).
Epidemiologia
W około 80% przypadków choroby Gravesa występują łagodne zmiany oczne wyrażające się retrakcją powieki górnej, powodującą wyraz przerażenia oczu, co określane było mianem objawu Dalrympla, niewielkim wytrzeszczem nie pociągającym za sobą uszkodzenia funkcji narządu wzroku, dodatnimi objawami Graefego (przy patrzeniu ku dołowi opóźnienie ruchu powieki górnej w stosunku do gałki ocznej i uwidocznienie rąbka twardówki nad rogówką), Kochera (przy patrzeniu ku górze opóźnienie ruchu gałki ocznej w stosunku do uniesionej powieki górnej i odsłonięcie pasa twardówki nad rogówką) i Stellwaga (rzadkie mruganie). Jest to najczęstsza pozatarczycowa manifestacja choroby Gravesa. Objawy te nie upośledzają zdolności widzenia, nie stanowią zagrożenia utratą wzroku, nie wymagają specjalistycznego leczenia, cofają się w miarę ustępowania nadczynności tarczycy lub pozostają na stałe stanowiąc defekt kosmetyczny. Zwykle do łagodnych objawów ocznych zaliczany był objaw Moebiusa, wyrażający się upośledzeniem ruchu zbieżnego gałek ocznych oraz niewielki wzrost ciśnienia śródgałkowego przy spojrzeniu ku górze. Wydaje się jednak, że objawy te świadczą o zajęciu mięśni okoruchowych i są sygnałem fazy naciekowo-obrzękowej zmian ocznych. W 90% przypadków choroby Gravesa można wykryć badaniem obrazowym oczodołu powiększenie mięśni zewnętrznych oka. Tylko u 10% chorych ani badaniem klinicznym, ani w oparciu o badania dodatkowe nie stwierdza się cech oftalmopatii tarczycowej. W 15% przypadków stwierdza się nadmierne wysunięcie gałek ocznych poza brzegi kostne oczodołu, w 35% obrzęk i przekrwienie powiek i spojówek, w dalszych 35% zmiany podkliniczne, możliwe do wykrycia w oparciu o CT lub MRI oczodołów i wreszcie u pozostałych 5% przypadki ciężkiej oftalmopatii (3, 4). Ciężka oftalmopatia rozwija się najczęściej, bo w 80% przypadków w okresie ± 18 miesięcy od wystąpienia nadczynności tarczycy, w 15% bez związku czasowego z rozpoznaniem nadczynności tarczycy i tylko u 5% chorych bez zaburzeń czynności tarczycy (5).
Etiologia
Etiologia wytrzeszczu naciekowo-obrzękowego nie jest w pełni poznana. Podkreśla się udział wspólnego antygenu w komórkach nabłonka pęcherzykowego tarczycy oraz fibroblastach oczodołu i skóry oraz preadipocytach oczodołu. Antygenem jest receptor dla TSH (TSH-R). Stwierdzono ekspresję mRNA dla TSH-R w tkance łącznej i tłuszczowej oczodołu, ponadto wykazano, że różnicowanie preadipocytów do adipocytów wiąże się z nasileniem ekspresji TSH-R. Inne antygeny, w tym pochodzące z mięśni okoruchowych, zlokalizowane wewnątrzkomórkowo ujawniają się po uszkodzeniu mięśni okoruchowych. Hipoteza ta tłumaczy jednoczesne występowanie w chorobie Gravesa zmian naciekowo- -zapalnych w spojówkach, powiekach, tkance pozagałkowej oczodołu, okolicy przedgoleniowej, dystalnych paliczków palców rak i nóg oraz zaburzeń czynności i budowy tarczycy. Dochodzi do pierwotnego włączenia fibroblastów i adipocytów. Myocyty, jak wspomniano, włączone są wtórnie (6). O rozwoju choroby decydują czynniki genetyczne, endogenne i środowiskowe. Należą do nich: płeć męska, wiek ze szczytem zachorowań w 50 i 70 roku życia, palenie papierosów, zaburzenia czynności tarczycy zarówno nadczynność jak i niedoczynność i terapia radiojodem. W grupie czynników środowiskowych predysponujących do rozwoju zmian ocznych wiele uwagi poświęcono paleniu papierosów. Wykazano związek między liczbą wypalanych papierosów a ciężkością oftalmopatii i wynikami leczenia immunosupresyjnego. Wpływ płci męskiej, podnoszony przez większość autorów nie jest wykazany we wszystkich populacjach, ale argumentem sugerującym znaczenie tego czynnika jest stosunek kobiet do mężczyzn jak 1,4:1 w przypadkach oftalmopatii w porównaniu ze stosunkiem 9,3:1 w przypadkach łagodnych zmian ocznych (7). W materiale Kliniki Endokrynologii średnia wieku wynosiła 52 lata, z przewagą kobiet w stosunku do mężczyzn jak 3,3:1. W tym przedziale wiekowym częstość zachorowań kobiet w stosunku do mężczyzn podawana jest jak 4-5:1. Wnioskujemy zatem, że ten zmieniony stosunek w badanej grupie wskazuje na predyspozycję płci męskiej do rozwoju ciężkiej oftalmopatii (25).
Zaburzenia czynności tarczycy per se wpływają na przebieg zmian ocznych, bowiem aktywacja receptora TSH może następować zarówno w fazie nadczynności poprzez p/ciała receptorowe jak i w fazie niedoczynności poprzez TSH. W randomizowanym badaniu Tallstedt i współautorzy stwierdzili progresję oftalmopatii u 10% leczonych tyreostatykami, u 16% po operacji tarczycy i aż u 33% po leczeniu radiojodem (8). Leczenie radiojodem prowadzi bowiem do wzrostu stężenia i aktywności p/ciał receptorowych (TRAb), a także aktywacji limfocytów T i w konsekwencji do zaostrzenia autoimmunologicznej reakcji w tkankach oczodołu (9).
Patogeneza
Patogenezę wytrzeszczu naciekowo-obrzękowego wyznaczają trzy procesy – naciek, obrzęk i włóknienie. W tkance łącznej pozagałkowej dochodzi do nacieczenia komórkami jednojądrzastymi limfocytami i aktywowanymi fibroblastami, uwolnienia cytokin (interferon gamma, tumor necrosis factor, interleukina 1-α, interleukina 6), zwiększonej produkcji glikozaminoglikanów oraz uwolnienia białek immunomodulujących. Proces ten dotyczy pośrednio także mięśni okoruchowych, które, z wyjątkiem mięśnia skośnego dolnego wywodzą się z otoczki włóknistej Zinna. Wynika z tego wielokrotnie większa zawartość śródmiąższowej tkanki łącznej i włókien nerwowych w porównaniu z mięśniami szkieletowymi. Zmiany histopatologiczne w mięśniach okoruchowych nie dotyczą per se włókien mięśniowych, ale śródmiąższowej tkanki łącznej, która wrasta między poszczególne włókna. Proces zapalny tkanki łącznej odbija się istotnie na zmianie objętości i funkcji mięśni okoruchowych. Zawartość oczodołu powiększa się na skutek nacieku i obrzęku. Jest to faza aktywna zmian ocznych. Dochodzi do dysproporcji pomiędzy pojemnością oczodołu a jego zawartością. Prowadzi to do przesunięcia do przodu gałki ocznej, ucisku na nerw wzrokowy, utrudnienia odpływu żylnego i limfatycznego z oczodołu, wzrostu ciśnienia śródgałkowego, a także upośledzenia ruchomości mięśni okoruchowych. Kolejnym etapem jest proces włóknienia, który powoduje przejście w fazę nieaktywną wytrzeszczu (10).
Patogenezę wytrzeszczu naciekowo-obrzękowego przedstawiono schematycznie na rycinie 1.
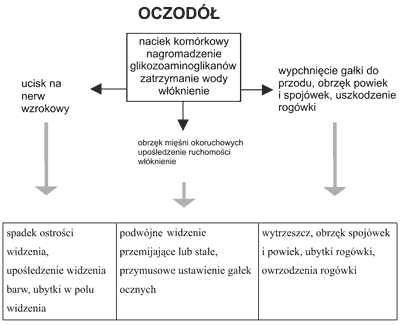 Ryc. 1. Patogeneza wytrzeszczu naciekowo-obrzękowego.
Klasyfikacja zmian ocznych
Zmiany oczne w chorobie Gravesa zostały sklasyfikowane przez Amerykańskie Towarzystwo Tyreologiczne w oparciu o wyniki badania okulistycznego. Klasyfikacja ta uwzględnia sześć klas wytrzeszczu, z trzema stopniami nasilenia objawów: a, b i c (tab. 1). Klasyfikację Wernera określa się także mianem NOSPECS zapożyczając pierwsze litery z parametrów badania okulistycznego (11).
Tabela 1. Klasyfikacja zmian ocznych w chorobie Gravesa.
Klasy 2 do 6 uwzględniają obecność procesu naciekowo-obrzękowego. Ciężkie zmiany oczne, tj. zaliczane według tej klasyfikacji do klasy powyżej 3c, stanowią zagrożenie utratą wzroku i wymagają specjalistycznego leczenia. Suma punktów z każdej z 6 klas pozwala obliczyć wskaźnik oftalmopatii, tzw. wskaźnik Donaldson, który maksymalnie osiąga wartość 15.
Manifestacja kliniczna
Klasa 1 – bez dolegliwości, tylko objawy kliniczne związane z retrakcją powieki górnej. Wynikają z powiększenia – obrzęku mięśnia dźwigacza powieki górnej lub zwiększonego napięcia układu współczulnego. Nie jest wyjaśnione, dlaczego retrakcja powieki górnej często utrzymuje się u chorych z chorobą Gravesa po ustąpieniu nadczynności tarczycy.
Klasa 2 – zajęcie tkanek miękkich – wyraża się obrzękiem, przekrwieniem i zaczerwienieniem spojówek oraz obrzękiem górnej i dolnej powieki. Jest następstwem nacieku i upośledzenia odpływu żylnego z oczodołu.
Klasa 3 – proptoza czyli wytrzeszcz – nadmierne wysunięcie gałek ocznych poza brzegi oczodołu jest związane z przemieszczaniem gałki ocznej do przodu przez obrzęknięte tkanki oczodołu. Wysunięcie gałek ocznych spełnia rolę naturalnej dekompresji.
Klasa 4 – uszkodzenie mięśni okoruchowych prowadzące do upośledzenia ruchomości mięśni i przymusowego ustawienia gałek ocznych. W przypadkach uszkodzenia asymetrycznego występuje podwójne widzenie. Podwójne widzenie jest możliwe tylko w przypadkach widzenia obuocznego. U chorych z dokładnie symetrycznym uszkodzeniem mięśni lub u chorych z wykształconą adaptacją poprzez zmianę ustawienia głowy podwójne widzenie może nie występować.
Klasa 5 – uszkodzenie rogówki wynikające z wytrzeszczu, retrakcji powieki górnej i niedomykalności szpar powiekowych. Wczesne objawy to fotofobia, nieostre widzenie i nietolerancja soczewek kontaktowych. Objawy te mogą być złagodzone przez zastosowanie kropli i maści do worka spojówkowego. Zmiany nasilone są objawem ciężkiej oftalmopatii i wskazaniem do intensywnego leczenia.
Klasa 6 – zmniejszenie ostrości wzroku spowodowane uszkodzeniem nerwu wzrokowego poprzez proces immunologiczny lub w następstwie ucisku powiększonych mięśni okoruchowych i upośledzonego ukrwienia (11).
Objawy
Dolegliwości chorych z wytrzeszczem złośliwym to: nadwrażliwość na światło, uczucie ciała obcego pod powiekami, nadmierne łzawienie, obrzęki powiek, ból oczodołu, uczucie wypychania gałki ocznej do przodu, zmiana wyglądu twarzy spowodowana wytrzeszczem gałek ocznych, niedomykalność szpar powiekowych, zmniejszenie ostrości widzenia, upośledzenie widzenia kolorów, widzenie podwójne. Objawy te są zwykle obustronne, rzadziej asymetryczne z nasileniem po jednej stronie, rzadko jednostronne. Dolegliwości subiektywne z reguły wyraźniej nasilone są rano niż wieczorem.
Naturalny przebieg choroby przedstawiony przez Rundlea w 1945 uzyskuje nadal potwierdzenie kliniczne. Pierwsza faza choroby to narastanie zaburzeń, następny etap to okres utrzymywania się objawów-plateau i wreszcie okres samoistnej poprawy, ale zwykle nie sięgającej powrotu do stanu wyjściowego. Faza aktywna to faza pojawiania się i nasilania objawów. Faza nieaktywna to okres stabilny, ale funkcje widzenia nadal mogą być upośledzone (12).
Rozpoznanie
Rozpoznanie ustala się w oparciu o badanie okulistyczne wzbogacone o badania dodatkowe u chorego zgłaszającego podane dolegliwości.
Badanie chorego z wymienionymi dolegliwościami powinno zmierzać do:
– określenia czynności tarczycy,
– specjalistycznego badaniu zmian ocznych, które obejmuje ocenę tkanek miękkich czyli powiek i spojówek, pomiar wytrzeszczu i ostrości wzroku, ocenę dna oczu, pola widzenia i ruchomości gałek ocznych wraz z ustaleniem nasilenia według klinicznej skali aktywności oraz usg, CT, MRI oczodołów i prowokowanych potencjałów z nerwów wzrokowych, oraz poszukiwanie receptorów somatostatynowych w oczodole w badaniu z użyciem oktreotydu,
– ocenę profilu cytokin we krwi i wydalania glikozaminoglikanów (GAG) z moczem,
– w przypadkach jednostronnego wytrzeszczu wyłączenia innych przyczyn nadmiernego wysunięcia gałki ocznej w tym zapalenia tkanek oczodołu (guz rzekomy), przetoka szyjno-jamista, zakrzep zatoki jamistej, guzy zatok naciekające oczodół pierwotne i przerzutowe, naczyniak jamisty, oponiak nerwu wzrokowego, żylaki oczodołu, guzy limfatyczne, oponiak grzebienia kości klinowej, torbiele śluzowe i choroba Pageta czaszki (13).
Ustalenie fazy choroby, konieczne do wyboru właściwej metody leczenia, może okazać się trudne, ponieważ nie dysponujemy metodą diagnostyczną o 100% mocy rozpoznawczej potwierdzającej lub wykluczającej. Największą moc diagnostyczną potwierdzającą przypisuje się octreoscanowi, a wykluczającą obrazowi MRI oczodołów i wydalaniu GAG z moczem (14). Podsumowanie skuteczności dostępnych metod diagnostycznych w ustaleniu fazy choroby podano na rycinie 2 i 3, która jest algorytmem postępowania w ciężkiej oftalmopatii tarczycowej.
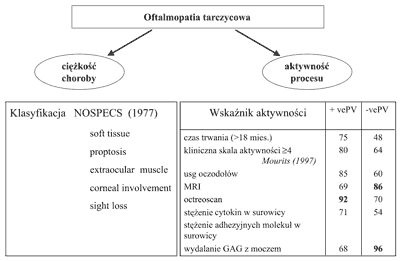 Ryc. 2. Ocena ciężkości choroby i aktywności procesu w oczodole u chorych z ciężką oftalmopatią tarczycową
+ vePV zdolność predykcyjna potwierdzająca - vePV zdolność predykcyjna wykluczająca 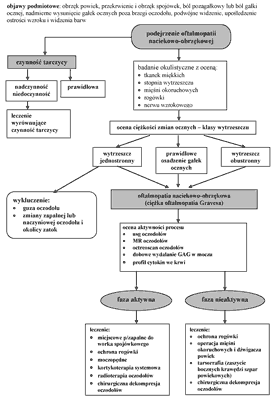 Ryc. 3. Algorytm postępowania diagnostyczno-terapeutycznego w ciężkiej oftalmopatii tarczycowej (H57).
Kliniczna skala aktywności (Clinical Activity Score- CAS) ustalana jest jako suma punktów z 10 ocenianych parametrów klinicznych: ból pozagałkowy w czasie ostatnich 4 tygodni, ból przy poruszaniu gałką oczną, zaczerwienienie powiek, zaczerwienienie spojówek, obrzęk powiek, przekrwienie, obrzęk gruczołów łzowych, zwiększenie proptozy o co najmniej 2 mm w czasie 1-3 miesięcy, zmniejszenie ruchomości gałek ocznych w dowolnym kierunku w czasie 1-3 miesięcy, zmniejszenie ostrości widzenia o co najmniej 1 rząd na tablicy Snellena w czasie 1-3 miesięcy (14).
Leczenie wytrzeszczu naciekowo-obrzękowego
Wobec nie w pełni znanej etiologii choroby nie jest możliwe leczenie przyczynowe. Leczenie objawowe zmierza do zmniejszenie nacieku i obrzęku tkanek czyli uzyskania dekompresji oczodołu na drodze farmakologicznej lub powiększenia pojemności oczodołu drogą dekompresji chirurgicznej poprzez operacyjne usunięcie ścian oczodołu i tłuszczu wewnątrzoczodołowego. Dekompresja zachowawcza może być skuteczna tylko w fazie aktywnej zmian. Zmierza do zmodyfikowania naturalnego przebiegu choroby i zapobieżenia wczesnym i odległym powikłaniom okulistycznym (tab. 2). W fazie włóknienia można liczyć na pomyślny wynik rehabilitacyjnych operacji mięśni okoruchowych lub powiek. Dekompresja chirurgiczna oczodołów znajduje natomiast zastosowanie zarówno w fazie aktywnej jak i nieaktywnej (tab. 3). Pomocne jest leczenie wspomagające, które obejmuje stosowanie miejscowo kropli i maści przeciwzapalnych i w miarę potrzeby kropli obniżających ciśnienie śródgałkowe oraz leku moczopędnego, wysokiego ułożenia do snu, zaciemnionych szkieł lub szkieł pryzmatycznych i ochronę rogówki. W każdym przypadku zaburzeń czynności tarczycy konieczne jest wdrożenie leczenia wyrównującego czynność tarczycy: tyreostatyków lub 131-I w fazie nadczynności tarczycy a tyroksyny w fazie niedoczynności (15).
Tabela 2. Leczenie aktywnych zmian ocznych w chorobie Gravesa.
Tabela 3. Leczenie nieaktywnych zmian ocznych w chorobie Gravesa.
W Klinice Endokrynologii CMKP w Warszawie utworzono interdyscyplinarny zespół złożony z endokrynologów, okulistów, radioterapeutów i chirurgów – laryngologów lub specjalistów chirurgii szczękowej, który w latach 1980-2006 leczył ponad 1000 chorych z ciężką oftalmopatią Gravesa. Stosowano następujące metody leczenia: kortykoterapia doustna i dożylna, kilowoltażowa (Rtg) terapia oczodołów, kortykoterapia połączona z napromienianiem Rtg, kortykoterapia połączona z kobaltoterapią oczodołów, cyclosporyna A, plazmafereza, bioglobulina iv, kortykoterapia połączona z napromienianiem wysokoenergetycznym (megawoltażowym) generowanym w akceleratorze liniowym codziennie przez 10 dni lub cotygodniowo przez 10 tygodni, oraz chirurgiczna dekompresja oczodołów z dojścia transantralnego, powiekowego dolnego lub przezspojówkowego oraz operacja mięśni okoruchowych (15, 16, 17, 18).
Od lat 50-tych stosowane są w fazie aktywnej zmian ocznych glukokortykoidy z uwagi na ich udowodnione działanie p/zapalne i immunosupresyjne, wyrażające się hamowaniem funkcji limfocytów T i B, zmniejszeniem nacieczenia neutrofilami, monocytami i makrofagami w obszarze zapalnym, hamowaniem funkcji komórek immunokompetentnych i uwalniania mediatorów zapalnych w tym cytokin. Glukokortykoidy ponadto hamują uwalnianie glikozaminoglikanów przez fibroblasty oczodołu. Podejmowano próby kortykoterapii miejscowej (pozagałkowo lub podspojówkowo) i systemowej (doustnie lub dożylnie). Pozagałkowe stosowanie kortykoidów jest nieskuteczne i wiąże się z prawdopodobieństwem miejscowych powikłań. Od 1980 r. zaprzestaliśmy całkowicie tej metody leczenia. Wykazano, że skuteczna jest kortykoterapia systemowa. Od ponad 20 lat z reguły stosowaliśmy kortykoidy doustnie, a w przypadkach ciężkiej neuropatii nerwu wzrokowego methylprednisolon dożylnie. W ostatnich kilkunastu latach szeroko stosowana jest u chorych z wytrzeszczem kortykoterapia systemowa w postaci dożylnych pulsów methylprednisolonu. Pierwszy protokół leczenia podali Nagayama i wsp. w 1987 r. (19). Zalecali 1g methylprednisolonu iv przez 3 kolejne dni, a następnie powtarzanie kursu leczenia przez 3-7 tygodni. Kumulacyjna dawka glukortykoidów wynosiła w tej metodzie 9-21g. Wprowadzono szereg modyfikacji powyższego schematu, w wielu przypadkach po ukończeniu leczenia pulsami zalecane są sterydy doustnie. W 2005 r. przedstawiono korzystne wyniki dożylnej kortykoterapii aplikowanej raz w tygodniu przez 12 tygodni (20). Podany schemat leczenia znajduje uzasadnienie patogenetyczne. Masywna dawka glukortykoidów powoduje: zanikanie we krwi obwodowej k.dendrydycznych prezentujących antygen i inicjujących proces immunologiczny zarówno szpikowych jak i plazmocytowych, na skutek redystrybucji do tkanki limfatycznej, zmniejszonej produkcji i różnicowania w szpiku oraz indukowanie apoptozy prekursorów k.dendrytycznych. Efekt jednorazowego wstrzyknięcia utrzymuje się przez co najmniej 6 dni.
Radioterapię oczodołów po raz pierwszy zastosowano w 1913 r. Racjonalne uzasadnienie skuteczności tej metody w aktywnej fazie oftalmopatii opiera się na wykorzystaniu niespecyficznego przeciwzapalnego działania promieni jonizujących w stosunku do wysokiej radiowrażliwości limfocytów naciekających oczodół. Nawet niewielka dawka promieniowania hamuje limfocyty i prowadzi do korzystnej zmiany stosunku limfocytów helper/supresor, a także zmniejszenia produkcji glikozaminoglikanów przez fibroblasty oczodołu. Kliniczne i eksperymentalne dane wskazują, że mała jednorazowa dawka promieniowania wynosząca 1 Gy wystarcza do osiągnięcia efektu przeciwzapalnego w przewlekłych procesach zapalnych. Tylko małe dawki promieni jonizujących prowadzą do zmniejszenia produkcji tlenku azotu i w tym mechanizmie ograniczenia odczynu zapalnego. Dawki większe mogą wywierać niekorzystny wpływ stymulujący. Tlenek azotu bierze bowiem udział w tworzeniu obrzęku, zwiększeniu ukrwienia i powstaniu bólu zapalnego. U chorych z wytrzeszczem skuteczna okazuje się dawka kumulacyjna 20 Gy, a jej zwiększenie do 30 Gy nie poprawia wyników leczenia. Tradycyjny schemat leczenia opiera się na napromienianiu codziennie przez 10 kolejnych dni roboczych w dawce frakcyjnej 2 Gy. Przed kilku laty wykazano, że korzystniejsze wyniki można uzyskać wydłużając czas leczenia poprzez stosowanie napromieniania 1x w tygodniu, do łącznej dawki 20 Gy (21, 22, 23). Wczesny objaw uboczny radioterapii, polegający na zaostrzeniu odczynu zapalnego ze strony tkanek miękkich oczu, jest łatwo łagodzony lub eliminowany poprzez podanie kortykoidów. Racjonalnym wydawało się więc połączenie kortykoterapii systemowej z radioterapią oczodołów (24). Tę metodę leczenia stosujemy od 1982 r., opierając się najpierw na kilowoltażowym promieniowaniu rentgenowskim. W dalszej kolejności korzystaliśmy z lampy kobaltowej, a od 1989 r. z megawoltażowego promieniowania generowanego w akceleratorze liniowym. Standardowa dawka promieniowania wynosząca 20 Gy stanowi poniżej 1% dawki stosowanej w chorobach nowotworowych. Randomizowane badania z ostatnich lat, porównujące dawkę 10 Gy i 20 Gy u chorych z wytrzeszczem nie wskazują na różnice w wynikach leczenia. Stwierdzono ponadto korzystniejsze wyniki przy zastosowaniu protokółu leczenia 1 Gy w tygodniu przez 10 tygodni w porównaniu z rutynowym leczeniem 1 Gy codziennie lub 2 Gy codziennie przez 10 kolejnych dni (23).
Żadna z dotychczas przedstawionych pojedyńczych metod leczenia nie okazała się w pełni skuteczna i bezpieczna. Wykazaliśmy, że najkorzystniejsze wyniki uzyskano stosując 3-etapowy schemat postępowania obejmujący kortykoterapię, napromienianie oczodołów i leczenie operacyjne (25).
I etap leczenia – kortykoterapia u większości chorych polegała na stosowaniu prednisonu doustnie 1-2 mg/kg/d, średnio 60 mg/d przez okres 10-12 tygodni. Następnie zmniejszano dobową dawkę o 50% i dalej o 5 mg co tydzień aż do odstawienia po upływie 20 tygodni. W przypadkach bardzo ciężkich neuropatii nerwu wzrokowego podawano methylprednisolon dożylnie w dawce 1000 mg/d przez 5-7 dni, a następnie prednison doustnie. Od 2006 r. z reguły posługiwano się cotygodniowymi dożylnymi wstrzyknięciami metylprednisolonu. Stosowano przez pierwsze 6 tygodni jednorazowo 500 mg, przez następne 6 tyg. 250 mg, łącznie 4,5 g/kurację.
II etap leczenia – napromienianie oczodołów energią wysokowoltażową generowaną w akceleratorze liniowym stosowano albo przez okres 2 tygodni w dawce pochłoniętej dziennej 2 Gy, całkowitej 20 Gy albo raz w tygodniu przez 10 tygodni w analogicznej dawce pochłoniętej jednorazowej i całkowitej.
Radioterapia z zastosowaniem akceleratora liniowego polegała na napromienianiu przestrzeni pozagałkowej oczodołów dwoma wiązkami skroniowymi o wymiarach 3 x 3-4 x 4 cm wysokoenergetycznym promieniowaniem o energii nominalnej 9-6 MeV. Dawka frakcyjna wynosiła, jak wspomniano, 2 Gy na izodozę obejmującą 100%. Każdy chory przed przystąpieniem do leczenia miał wykonaną maskę celonową, umożliwiającą unieruchomienie głowy i zapewnienie powtarzalności napromieniania. W oparciu o tomografię oczodołów z użyciem komputerowego systemu planowania leczenia przygotowano plan radioterapii. Soczewka i rogówka otrzymały poniżej 4% całkowitej dawki terapeutycznej. U nikogo nie powtarzano kursu leczenia lampą rentgenowską, Co-60 ani akceleratorem liniowym. W każdym z trzech sposobów radioterapii obszar objęty napromienianiem obejmował też siatkówkę. Radioterapia jako pojedyncza metoda leczenia ciężkich zmian ocznych nie znalazła w naszym materiale potwierdzenia. W piśmiennictwie dostępne są informacje o korzystnym wpływie radioterapii ocenianym po 24 tyg. od zakończenia leczenia tylko u 46% leczonych. Szczególną poprawę odnotowano w zakresie tkanek miękkich oczodołu i ruchomości mięśni okoruchowych, natomiast niewielką w zakresie stopnia wytrzeszczu. Odmienne wyniki przedstawił Gorman, który stosował napromienianie tylko jednej strony dawką 20 Gy. Nie odnotował poprawy, ani różnic w parametrach okulistycznych po stronie leczonej i nieleczonej (25).
Leczenie skojarzone – kortykoterapia połączona z napromienianiem oczodołów, polegało na założeniu możliwości skrócenia czasu trwania kortykoterapii, średnio z 12 do 6 tygodni, z dołączeniem w dwóch ostatnich tygodniach, przez 10 dni roboczych, napromieniania okolic pozagałkowych lampą rentgenowską, Co-60 lub akceleratorem liniowym. W ostatnich trzech latach stosowaliśmy równolegle ze schematem napromieniania codziennego także napromienianie cotygodniowe przez 10 kolejnych tygodni.
Dekompresja chirurgiczna oczodołów była kolejnym etapem leczenia po przebytej kortykoterapii lub radioterapii lub stanowiła pierwszy etap leczenia. Operacja z dojścia przez zatokę szczękową polegała na usunięciu części przyśrodkowej ściany kostnej oczodołu i części ściany dolnej, usunięciu komórek sitowych i nacięciu okostnej oczodołu, aby umożliwić rozprężenie i przemieszczenie się tkanki pozagałkowej na miejsce komórek sitowych i w kierunku zatoki szczękowej. Dekompresja z dojścia powiekowego dolnego lub przezspojówkowego sprowadzała się albo do dwuściennej dekompresji obejmującej ścianę przyśrodkową i dolną oczodołu, albo do dekompresji trójściennej obejmującej ścianę przyśrodkową, dolną i boczną oczodołu. W każdym przypadku wiązało się to z blefaroplastyką powiek górnych i usunięciem tłuszczu wewnątrzoczodołowego. Z reguły zabieg wykonywano obustronnie jednoczasowo, sporadycznie jednostronnie.
Operacja mięśni okoruchowych polegała na cofnięciu przyczepów mięśni prostych zewnętrznych oka. Zakres zabiegu ustalano w oparciu o badanie kliniczne, ocenę ruchomości gałek ocznych na ekranie Hessa-Lissa i kąta zeza na synoptoforze. W 48% (41/86) przypadków operowano mięsień prosty dolny, w 52% (45/86) prosty przyśrodkowy. Zakres zabiegu w zezie pionowym sprowadzał się do cofnięcia przyczepu mięśnia prostego dolnego średnio o 4 mm (3-6 mm). W przypadkach zeza poziomego wykonywano cofnięcie przyczepu mięśnia prostego przyśrodkowego o 4-10 mm. Przy utrzymywaniu się zbieżności mimo operacji mięśni przyśrodkowych przeprowadzano także zabiegi skrócenia mięśni bocznych. Dotyczyło to 9 przypadków, co stanowi 20% (9/45) chorych z zezem zbieżnym.
Leczenie chirurgiczne, zarówno dekompresję jak i operacje mięśni zewnątrzgałkowych przeprowadzano w stanie wyrównanej czynności tarczycy.
Leczenie kortykoidami przyniosło poprawę wyrażającą się szybkim ustępowaniem zmian, co znalazło swój wyraz w statystycznie istotnym obniżeniu wskaźnika oftalmopatii z 7,4 do 4,4 (p<0,001). Szczególny wpływ kortykoterapii dotyczył tkanek miękkich i ostrości wzroku i wyrażał się poprawą stwierdzaną odpowiednio u 81 i 80% leczonych. Zmniejszenie stopnia wytrzeszczu i poprawę ruchomości mięśni okoruchowych odnotowano tylko odpowiednio u 52% i 50% leczonych. Najbardziej oporne na leczenie okazywały się zmiany w mięśniach okoruchowych. Poprawę w tym zakresie obserwowano tylko u tych chorych, u których leczenie podjęto przed upływem 6 miesięcy od momentu wystąpienia objawów uszkodzenia mięśni okoruchowych.
W połowie przypadków obserwowano, w ciągu pierwszych 12 miesięcy po zakończeniu kortykoterapii, nawrót choroby. W tych przypadkach włączono ponownie kortykoidy. Aż u 40% leczonych kortykoterapia wiązała się z wystąpieniem poważnych objawów ubocznych. Stwierdzono statystycznie istotny (p<0,001) wzrost odsetka objawów ubocznych w przypadkach powtarzanej kortykoterapii w porównaniu z pierwszym kursem leczenia (59% vs. 41%). Skojarzenie kortykoterapii z radioterapią oczodołów z zastosowaniem lampy rentgenowskiej lub akceleratora liniowego okazało się być najskuteczniejszą metodą leczenia. Przewaga akceleratora liniowego nad promieniami Rtg sprowadzała się do braku zaćmy jako najgroźniejszego z obserwowanych przez nas powikłań terapii promieniami jonizującymi. Wprawdzie nie obserwowaliśmy zaćmy po leczeniu Co-60, ale skuteczność tej metody leczenia była niewielka. Również znaczny odsetek nawrotów wytrzeszczu złośliwego po leczeniu Co-60 sprawił, że od wielu lat nie stosujemy tej metody leczenia. Kortykoterapia połączona z napromienianiem wysokoenergetycznym prowadzi do wybitnej poprawy co znajduje swój wyraz w istotnym statystycznie obniżeniu wskaźnika oftalmopatii (8,0 vs. 4,7). Wyniki leczenia odległe należy również uznać za pomyślne. Odsetek nawrotów nie przekraczał bowiem 15% (25).
Wykazaliśmy, że skojarzenie kortykoterapii z radioterapią pozwoliło skrócić czas trwania kortykoterapii średnio z 20 do 14 tyg. czyli o 30% i zmniejszyć całkowitą dawkę kortykoidów, średnio z 8 do 3,8 g czyli o ponad 50%. Jest to następstwo niewielkiego odsetka chorych wymagających powtarzania kursów kortykoterapii w porównaniu z grupą otrzymującą monoterapię kortykoidami. Należy uznać, że radioterapia utrwala efekty kortykoterapii i zapobiega nawrotom fazy złośliwej wytrzeszczu.
Wyniki leczenia chirurgicznego należy uznać za bardzo dobre. Znalazło to odbicie w istotnym statystycznie zmniejszeniu wskaźnika oftalmopatii z 9,0 do 5,4. Szczególny wpływ zaznaczył się w zmniejszeniu stopnia wytrzeszczu, cofnięciu się owrzodzenia rogówki i poprawy ostrości widzenia, co stwierdzano odpowiednio u 100%, 100% i 80% leczonych. Odsetek nawrotów był niewielki i sięgał 5%. Najczęstszym powikłaniem leczenia było nasilenie lub wystąpienie podwójnego widzenia. Operacja mięśni okoruchowych doprowadziła u 80% leczonych do ustąpienia podwójnego widzenia przy patrzeniu na wprost i/lub ku dołowi (25).
Korzystne efekty kortykoterapii wiążą się jednak z ryzykiem objawów ubocznych, których częstość zależy od kumulacyjnej dawki leku i czasu trwania kortykoterapii, a także drogi podania. Najczęściej stwierdzanym objawem ubocznym jest cukrzyca. Diabetogenny efekt glukortykoidów odnotowano już w 1940 r. i tłumaczono zwiększeniem glukoneogenezy. Współcześnie wiadomo, że glukokortykoidy prowadzą do oporności insulinowej receptorowej i postreceptorowej. Glukortykoidy mogą indukować hiperglikemię także przez stymulowanie komórek alfa, prowadząc do hiperglukagonemii i wzrostu glikogenolizy. Cukrzycę indukowaną kortykoterapią i ujawnioną w czasie leczenia stwierdzaliśmy u 13% chorych. Zauważyliśmy skłonność do hiperglikemii w godzinach popołudniowych i wieczornych wobec prawidłowej glikemii na czczo i po śniadaniu. W piśmiennictwie znaleźć można informacje dotyczące częstości występowania nietolerancji glukozy u 19,5% leczonych prednisonem doustnie i aż u 30% leczonych dożylnymi pulsami prednisolonu. Dobrze udokumentowany jest niekorzystny wpływ glukokortykoidów na kości, wyrażający się zwiększeniem ryzyka złamań kręgów niezależnie od obniżenia gęstości mineralnej kości. Ryzyko względne złamań kręgosłupa zależy od kumulacyjnej dawki kortykoidów stosowanych doustnie. Przy całkowitej dawce prednisolonu nie przekraczajacej 7,7 g odpowiada ryzyku populacyjnemu, określone jako 1,0. W grupie otrzymującej 7,8-16,3 g zwiększa się do 1,4. Zwiększenie całkowitej dawki prednisolonu do 16,4-37,4 g powoduje wzrost współczynnika do 4 a w grupie otrzymującej powyżej 37,6 g aż do 4,4. W prezentowanym materiale stwierdziliśmy u 10 chorych skierowanych po niepowodzeniu przebytej systemowej wielomiesięcznej kortykoterapii osteoporozę z patologicznymi złamaniami kręgów. Inne objawy uboczne, w odniesieniu do których wykazano w piśmiennictwie zależność częstości występowania od całkowitej dawki kortykoidów to zaćma i grzybica śluzówek. W naszym materiale przez okres 5 lat po leczeniu nie notowaliśmy zaćmy. Dotyczy to także chorych otrzymujących leczenie skojarzone, u których rozwój zaćmy może być następstwem zarówno kortykoterapii jak i radioterapii (25).
Zgodnie z naszymi obserwacjami szczególnie w przypadkach masywnej systemowej kortykoterapii należy liczyć się z ryzykiem objawów ubocznych do których należy m.in. ostra psychoza. W piśmiennictwie zwykle szacuje się częstość objawów ubocznych zbliżoną u leczonych pulsami methylprednisolonu i doustną kortykoterapią, z wyjątkiem większej częstości występowania cushingiodalnej sylwetki u leczonych kortykoidami doustnymi. Długotrwałe stosowanie glukokortykoidów pobudza lipogenezę i zwiększa masę tłuszczu. Nasilenie lipogenezy jest skutkiem działania insuliny, której sekrecja zostaje pobudzona przez insulinooporność i hiperglikemię. Szczególną wrażliwość na działanie glukortykoidów wykazują adipocyty brzusznej tkanki tłuszczowej. Wynika to z większej gęstości receptorów glukortykoidowych w porównaniu z adipocytami innych regionów. Gromadzenie tkanki tłuszczowej głównie na tułowiu i brzuchu prowadzi do otyłości typu centralnego. Równocześnie pojedyncze doniesienia wskazują na możliwość ciężkiego, nieodwracalnego uszkodzenia wątroby u leczonych pulsami methylprednizolonu. Zaleca się, aby nie przekraczać dawki kumulacyjnej 8 g (1).
Późnym powikłaniem radioterapii może być indukowana napromienianiem zaćma, retinopatia oraz onkogeneza w obrębie CUN. Przyjmuje się, że dawka promieniowania tolerowana przez soczewkę wynosi 10 Gy, przez nerw wzrokowy 50 Gy, a przez siatkówkę 30-35 Gy. Indukowanej napromienianiem zaćmy można spodziewać się u chorych z wytrzeszczem po ekspozycji soczewki na dawkę pojedyńczą 2 Gy i frakcjonowaną 5,5 Gy. Technika napromieniania przy użyciu akceleratora liniowego zapewnia bezpieczeństwo leczenia. Soczewka i rogówka otrzymują poniżej 4% całkowitej dawki terapeutycznej, co stanowi 0,8 Gy. Popromienną zaćmę stwierdzano najczęściej w okresie 2 lat po napromienianiu lub wg innych autorów średnio po upływie 12±4 lat. Zwykle jest to zaćma biegunowa tylna. Po uwzględnieniu kryterium wieku i narastającego ryzyka zaćmy w miarę starzenia się, nie stwierdzono istotnego statystycznie wzrostu częstości zaćmy u chorych napromienianych Co-60 lub akceleratorem liniowym w porównaniu z grupami kontrolnymi. W omawianym materiale powikłanie to obserwowaliśmy u 3 chorych po upływie półtora roku od przebytego leczenia. Stanowiło to 5% wszystkich przypadków leczonych promieniami Rtg. U chorych leczonych Co-60 lub akceleratorem liniowym w czasie 5-letniej obserwacji nie stwierdzaliśmy zaćmy (25).
Retinopatia rozwija się zwykle w czasie 6 miesięcy do 3 lat po napromienianiu. Popromienne zmiany w siatkówce określane są mianem siatkówkowych udarów mikronaczyniowych i polegają na ogniskowej utracie endotelium w kapilarach, wytworzeniu mikrotętniaków, skłonności do krwawień, niedokrwienia siatkówki i proliferacji naczyniowej. Czynnikiem usposabiającym jest retinopatia cukrzycowa i nadciśnieniowa oraz przebyta chemioterapia. Ryzyko indukowanej retinopatii opisywane jest zwykle po zastosowaniu dawki kumulacyjnej powyżej 20 Gy. W omawianym materiale Kliniki Endokrynologii nie kwalifikowano do napromieniania chorych po przebytej chemioterapii, ani chorych ze zmianami proliferacyjnymi siatkówki w przebiegu cukrzycy. Zapewne ścisła kwalifikacja do zabiegów napromieniania przyczyniła się do uniknięcia poważnego powikłania jakim jest retinopatia (25).
Wtórne guzy w napromienianej okolicy ujawniają się zwykle w okresie 5-25 lat po leczeniu. Obliczono, że teoretyczne ryzyko nowotworzenia po napromienianiu dawką 20 Gy wynosi 1,2%. Wykorzystanie wysokoenergetycznego promieniowania z małym polem napromieniania i redukcja dawki do 16 Gy zmniejsza ryzyko wystąpienia indukowanych nowotworów do 0,7%. Ryzyko to w ocenie innych autorów wynosi zaledwie 0,3%. Prace kliniczne oparte na dużym materiale chorych przekonują o bezpieczeństwie przeciwzapalnej radioterapii oczodołów. W grupie 157 leczonych nie notowano nowotworzenia po upływie 5-25 lat od napromieniania. Ocenę oparto o badanie kontrolne CT mózgu. W innych opracowaniach obejmujących 311 i 250 leczonych, obserwowanych odpowiednio przez 21 lub 31 lat także nie notowano nowotworzenia w obrębie CUN, a umieralność z powodu nowotworów kształtowała się na poziomie ogólnej populacji. Sugeruje się jednak, aby z uwagi na długi okres utajenia brać pod uwagę potencjalne ryzyko karcinogenezy, szczególnie u młodych osób. Część autorów uważa, że napromienianie powinno być zarezerwowane dla przedziału wiekowego powyżej 35 lat. Inny, mniej istotny objaw uboczny, który zapewne można wiązać z radioterapią oczodołów to pogrubienie błony śluzowej i polipy zatok obocznych nosa, które stwierdzano u 1/3 leczonych (1).
Leczenie chirurgiczne zajmowało ważne miejsce wśród stosowanych przez nas metod leczenia, zwykle jako trzeci etap. W przypadkach zmniejszenia ostrości wzroku wynikającego z ucisku na nerw wzrokowy nie cofającego się po leczeniu farmakologicznym, utrzymujący się wytrzeszcz z niedomykalnością szpar powiekowych i niegojącego się owrzodzenia rogówki, p/wskazań do kortykoterapii i radioterapii, gwałtownego wzrostu ciśnienia śródgałkowego i ostrego napadu jaskry w czasie kortykoterapii, wykonywano dekompresję z pominięciem dwóch poprzednich etapów leczenia. W piśmiennictwie znajdują się doniesienia o chirurgicznej dekompresji oczodołów stosowanej jako jedyny sposób leczenia. Zabiegi dekompresji wykonywaliśmy uprzednio metodą Walsha-Ogury z dojścia z przedsionka jamy ustnej. Od 1996 r. stosujemy metodę dekompresji przezpowiekowej, a od 2000 r. przezspojówkowej. Wyniki leczenia należy ocenić jako pomyślne, przy czym przewagę zyskują operacje wykonywane z dojścia przezpowiekowego i przezspojówkowego, połączone z blefaroplastyką (operacją powiek) i resekcją tłuszczu wewnątrzoczodołowego. Obecnie możliwe są także operacje oczodołu endoskopowe. Prowadzą do wybitnego zmniejszenia stopnia wytrzeszczu, w obserwacji Kliniki maksymalnie o 15 mm, oraz poprawy ostrości wzroku u wszystkich leczonych. Wiążą się też z mniejszym odsetkiem nasilenia lub wystąpienia podwójnego widzenia (20% vs 60% chorych), a także zaburzeń czucia policzkowego (5% vs 20% chorych) w porównaniu z dekompresją transantralną. W razie utrzymywania się podwójnego widzenia przy patrzeniu na wprost i w pozycji ku dołowi – do czytania wykonywaliśmy rehabilitacyjne chirurgiczne zabiegi mięśni okoruchowych. Warunkiem skierowania do leczenia operacyjnego było potwierdzenie wygaśnięcia fazy aktywnej zmian ocznych w oparciu o badanie MRI oczodołów. Zastanawiające, że najczęściej zachodziła konieczność operowania mięśnia prostego przyśrodkowego (52% leczonych). Operacje mięśnia prostego dolnego, który zwykle zajęty jest procesem naciekowo-obrzękowym i następnie włóknieniem, konieczne były tylko u 48% leczonych. Zgodnie z oczekiwaniem sporadycznie niezbędne były także operacje mięśni bocznych. W 80% operowanych przypadków uzyskaliśmy ustąpienie podwójnego widzenia przy patrzeniu na wprost lub ku dołowi (25). Wobec braku w pełni skutecznej i bezpiecznej metody leczenia wytrzeszczu podejmowano szereg prób klinicznych. Stosowano leczenie immunosupresyjne z wykorzystaniem cyclosporyny, immunoglobuliny, zabiegów plazmaferezy czy wreszcie podaży azatiopryny, pentoksyfiliny czy analogów somatostatyny w tym SOM 230, antyoksydantów allopurinolu i nikotynamidu, bromokryptyny i ostatnio antagnistów cytokin. Żadna z nich nie znalazła szerokiego zastosowania. Wyniki leczenia plazmaferezą, cyklosporyną A czy dożylną podażą immunoglobulin i nikotynamidem zostały omówione we wczesniejszych doniesieniach, nie były jednak zachęcające (25, 26).
W omawianym materiale 59% paliło papierosy. Zalecaliśmy bezwzględne zaprzestanie palenia, traktując zaprzestanie palenia jako element leczenia wspomagającego.
Niezależnie od specjalistycznego leczenia zmian ocznych u wszystkich chorych z wytrzeszczem dążyliśmy się do uzyskania stanu wyrównanej czynności tarczycy. W stanie nadczynności tarczycy rozpoznanym u 25% chorych z wytrzeszczem stosowaliśmy wstępnie tyreostatyki. W dalszym etapie, po zakończeniu leczenia zmian ocznych, podawaliśmy radiojod w trakcie stosowania podtrzymujących dawek prednisonu. Postępowanie powyższe uzasadnialiśmy udokumentowanym niekorzystnym wpływem radiojodoterapii na progresję zmian ocznych. Przesłanki teoretyczne, oparte na założeniu obecności wspólnego antygenu w komórce tyreocyta i fibroblasta skłaniają do wyboru metody leczenia, która nie wiąże się z uwolnieniem dużej ilości antygenu tarczycowego. Zarówno strumektomia jak i leczenie radiojodem połączone są z uwolnieniem antygenu tarczycowego, ale nie wykazano, aby przyczyniły się do wywołania procesu naciekowo-obrzękowego w oczodole. Udowodniono jednak, że mogą, u 15-33% leczonych, nasilić istniejące zmiany oczne. Czynnikiem niepomyślnym rokowniczo jest T3 toksykoza, palenie papierosów oraz powtarzanie terapii izotopem jodu. Celem zapobieżenia nasileniu procesu zapalnego w oczodole podejmowane są próby prewencyjnego stosowania kortykoidów, w dawce 0,5 mg/kg/d prednisonu przez okres 5 tygodni po przebytym leczeniu radiojodem.
U chorych z niedoczynnością tarczycy po leczeniu radiojodem lub po operacji tarczycy stosowaliśmy substytycyjną dawkę tyroksyny, a w przypadkach niedoczynności w przebiegu leczenia tyreostatykiem z reguły zmniejszaliśmy dawkę lub odstawialiśmy lek.
Podsumowanie i wnioski
Wprowadzenie standardowego 3-etapowego sposobu leczenia (ryc. 3) obejmującego kortykoterapię (I etap), radioterapię oczodołów (II etap) i leczenie chirurgiczne (III etap) umożliwia uzyskanie poprawy lub wyleczenia we wszystkich przypadkach ciężkiej oftalmopatii Gravesa.
I etap – kortykoterapia prowadzi do poprawy w zakresie ostrości widzenia i ustępowania nacieku tkanek miękkich oczodołu u odpowiednio 81% i 80% leczonych, w mniejszym stopniu do redukcji stopnia wytrzeszczu i poprawy ruchomości mięśni okoruchowych, odpowiednio u 52% i 50% leczonych. Wiąże się z ryzykiem objawów ubocznych dotyczącym 42% leczonych i wysokim odsetkiem nawrotów sięgającym 54% w czasie 12 miesięcy od przebytego leczenia. Odsetek objawów ubocznych wzrasta istotnie w przypadkach powtarzanej kortykoterapii w porównaniu z pierwszym kursem kortykoterapii (59% vs. 41%).
II etap – radioterapia oczodołów utrwala efekty kortykoterapii i zapobiega nawrotom fazy naciekowo-obrzękowej. Umożliwia zmniejszenie dawki kortykoidów o 50% i skrócenie czasu trwania kortykoterapii o 30% w porównaniu z monoterapią kortykoidami. Pozwala zmniejszyć odsetek nawrotów do 15%.
III etap – chirugiczna dekompresja oczodołów pozwala uzyskać zmniejszenie stopnia wytrzeszczu, cofanie się uszkodzenia rogówki i nerwu wzrokowego odpowiednio u 100%, 100% i 80% leczonych. Operacje mięśni okoruchowych prowadzą u 80% leczonych do ustąpienia podwójnego widzenia przy patrzeniu na wprost i ku dołowi (25). Piśmiennictwo
1. Bartalena L, et al.: Management of Graves´ ophthalmopathy: reality and perpectives. Endocr. Rev., 2000; 21: 168-169.
2. Gerding MT, et al.: Quolity of life in patients with Graves´ ophthalmopathy is markedly decreased: measurement by the Medical Outcome Study Instrument. Thyroid 1997; 7: 885-889.
3. Forbes G, et al.: Ophthalmopathy of Graves´ disease: computerizd volume measurement of the orbit fat and muscle. AJNR 1986; 7: 651-656.
4. Villadolid MC, et al.: Untreated Graves´ disease patients without clinical ophthalmopathy demonstrate a high frequency of extraocular muscle (EOM) enlargement by magnetic resonance. J. Clin. Endocrinol. Metab., 1995; 80: 2830-3.
5. Bednarczuk T, et al.: Patogeneza oftalmopatii tarczycowej. Endokrynol. Pol., 2002; 53: 65-78.
6. Bahn R, et al.: Thyrotropin receptor expression in Graves´ orbital adipose/connective tissues: potential autoantigen in Graves´ ophthalmopathy. J. Clin. Endocrinol. Metab., 1998; 83: 998-1002.
7. Perros P, et al.: Age and gender influence the severity of thyroid-associated ophthalmopathy. Clin. Endocrinol., 1993; 38: 367-372.
8. Tallstedt L, et al.: Occurrence of ophthalmopathy after treatment for Graves´ hyperthyroidism. N. Engl. J. Med., 1992; 326: 1733-1738.
9. Wakelkamp IM, et al.: TSH-R expression and cytokine profile in orbital tissue of active vs. inactive Graves´ ophthalmopathy patients. Clin. Endocrinol. 2003; 58: 280-287.
10. Gorman CA: Pathogenesis of Graves´ ophthalmopathy, Thyroid 1994; 4: 379-383.
11. Werner SC: Modification of the clasification of the eye changes of Graves´ disease:recommendations of the ad hoc committee of the American Thyroid Association. J. Clin. Endocrinol. Metab., 1977; 44: 203-204.
12. Kendall-Taylor P: Current management of thyroid-associated ophthalmopathy. Clin. Endocrinol. (Oxf) 1998; 49: 11-12.
13. Gietka-Czernel M, et al.: Wytrzeszcz gałek ocznych przebiegający z pogrubieniem mięśni okoruchowych spowodowany przetoką pomiędzy tętnicą szyjną wewnętrzną a zatoką jamistą mylnie rozpoznany jako oftalmopatia Gravesa. Endokrynol. Pol. 50, suppl 1do nr 3, 195, 1999.
14. Mourits MP, et al.: Clinical activity score as a giude in the management of patients with Graves´ ophthalmopathy. Clin. Endocrinol. 1997; 47: 9-14.
15. Zgliczyński S, et al.: Leczenie fazy złośliwej wytrzeszczu naciekowo-obrzękowego w chorobie Graves-Basedowa. Pol. Tyg. Lek., 1984; 29: 981.
16. Zgliczyński S, et al.: Therapy for severe Graves ophthalmopathy: a three- stage management: corticotherapy, retrobulbar irradiation and transantral decompression. Acta Endocrinol., 1989; 121, 2: 169-178.
17. Zgliczyński S, et al.: Wyniki 3-etapowego leczenia (1) kortykoterapia, (2) akcelerator liniowy, (3) dekompresja oczodołów u 206 chorych z wytrzeszczem złośliwym w chorobie Gravesa-Basedowa. Endokrynol. Pol., 1992; 43, 3: 274-284.
18. Zgliczyński S, et al.: Efficacy of treatment with corticosteroids, retrobulbar irradiation, transantral decompression and extraocular muscle surgery in 370 patients with the most severe Graves ophthalmopathy 10th International Congress of Endocrinology, San Francisco, 1996 – poster.
19. Nagayama Y, et al.: Treatment of Graves´ ophthalmopathy with high-dose intravenous methylprednisolone pulse therapy. Acta Endocrinol. (Copenh) 1987; 116: 513.
20. Kahaly GJ, et al.: Randomized, Single Blind Trial of Intravenous versus Oral Steroid Monotherapy in Graves´ Ophtalmopathy. J. Clin. Endocrinol. Metab., 2005; 90: 5234-5240.
21. Hildebrandt G, et al.: Mechanism of anti-inflammatory activity of low-dose radiation therapy. Int. J. Radiat. Biol., 1998; 74: 367-378.
22. Bartalena, et al.: Orbital radiotherapy for Graves´ ophthalmopathy, Thyroid 1998; 8: 349-441.
23. Kahaly GJ, et al.: Low- versus high-dose radiotherapy for Graves´ ophthalmopathy: a randomized, single blind trial. J. Clin. Endocrinol. Metab., 2000; 85: 102-108.
24. Zgliczyński S, et al.: Effects of three-stage treatment:corticotherapy, linear accelerator, surgical decompression or ocular muscle surgery in 450 patients with severe Graves´ ophthalmopathy. J. Endocrinol. Invest., 1999; 22: supp to No 7.
25. Jastrzębska H, et al.: Kortykoterapia, radioterapia i leczenie chirurgiczne – trzy kolejne etapy standardowego leczenia 960 chorych z ciężką oftalmopatią Gravesa. Endokrynol. Pol., 2004; 3 (55): 244-262
26. Jastrzębska H, et al.: Zastosowanie nikotynamidu w zapobieganiu fazie naciekowo-obrzękowej zmian ocznych w chorobie Graves´a. Endokrynol. Pol., 2000; 51, 2: 257-264.
otrzymano/received: 2007-11-28 zaakceptowano/accepted: 2007-12-29 Adres/address: *Helena Jastrzębska Klinika Endokrynologii CMKP, Szpital Bielański ul. Cegłowska 80, 01-809 Warszawa tel./fax: (0-22) 834-31-31 e-mail: klinendo@cmkp.edu.pl The whole paper Postępy w rozpoznawaniu i leczeniu ciężkiej oftalmopatii tarczycowej is also available at On-line Medical Library. |
Chcesz być na bieżąco? Polub nas na Facebooku: strona Wydawnictwa na Facebooku |








