Wydawca
|

|
ukazuje się od 1994 roku |
» Terapia fotodynamiczna – założenia, mechanizm, aplikacje kliniczne**© Borgis - Nowa Medycyna 1, s. 26-30
*Anna Choromańska, Julita Kulbacka, Jolanta Saczko
Terapia fotodynamiczna – założenia, mechanizm, aplikacje kliniczne**
Photodynamic therapy – principles, mechanism, clinical applications
Katedra i Zakład Biochemii Lekarskiej, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
Kierownik Katedry i Zakładu: prof. dr hab. Andrzej Gamian Summary
The photodynamic therapy (PDT) is a noninvasive method of treatment, involving the interaction of light, photosensitizer and oxygen present in the tissues. The result of this interaction is a cascade of processes with induction of phototoxic effect. The main cytotoxic mechanism of PDT is damaging cell membranes, intracellular organelles and nucleus. High concentrations of photosensitizer and a short time of incubation lead to the destruction of the cells by necrosis, while lower concentrations of photosensitizer and a longer time of incubation cause apoptotic cell death processes. Photodynamic therapy gives the best results in the treatment of precancerous lesions. Particularly is preferred where surgical, radiological or chemotherapy is impossible. Recently, there is also non-oncological use, including ophthalmology, dentistry or photoangioplasty. Increasing the feasibility and efficiency of the method depends mainly on the availability of photosensitizers as well as their bioavailability within malignant tissue. The main limitation of PDT is not efficient selectivity of photosensitizing drugs. The most common side effects are associated with the fact that the photosensitizers accumulate in normal tissues. Currently, studies are being conducted on how to improve the efficiency of transport medicine to the affected tissue. Currently, nanomaterials play an important role here. Liposomes, lipoproteins, monoclonal antibodies and electroporation are also applied. In combination with photosensitizers they can improve the performance of photodynamic therapy and limit its side effects. Key words: photodynamic therapy, photosensitizer, drug bioavailability
WPROWADZENIE
Choroby nowotworowe są obok schorzeń układu krążenia najczęstszą przyczyną zgonów. Stosowane obecnie w onkologii klinicznej metody, takie jak radio- czy chemioterapia nie działają selektywnie na tkankę nowotworową, co prowadzi do licznych powikłań związanych z uszkodzeniem zdrowych tkanek. Dodatkowo, stosowanie chemioterapeutyków aktywuje wtórną oporność komórek nowotworowych. Nowa, obecnie jeszcze niestosowana powszechnie terapia fotodynamiczna – PDT (ang. photodynamic therapy), wydaje się w tym aspekcie bardzo obiecującą. Metoda ta opiera się na wykorzystaniu światłoczułych związków, które selektywnie kumulują się w tkance nowotworowej (1-3).
PDT jest procedurą kilkuetapową, której skuteczność zależy od indukcji reakcji fotocytotoksycznych, będących wynikiem aktywacji światłem zaaplikowanego wcześniej fotouczulacza (ryc. 1) (4-6).
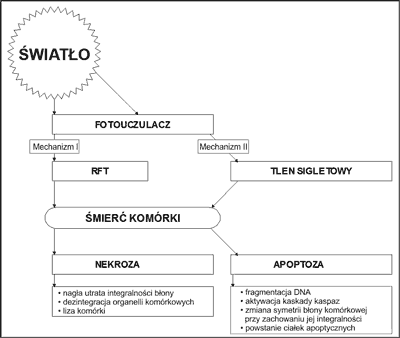 Ryc. 1. Mechanizmy prowadzące do śmierci komórek nowotworowych. Reaktywne formy tlenu (RFT) (4-6).
Podany dożylnie lub miejscowo fotouczulacz pochłaniany jest przez wszystkie komórki. Ze zdrowych tkanek usuwany jest po kilkunastu godzinach, w nowotworowych pozostaje nawet przez kilka dni. Zjawisko to nie zostało do końca wyjaśnione. Wzmożony wychwyt tych substancji przez komórki nowotworowe może wynikać z ich wiązania się w osoczu z lipoproteinami o niskiej gęstości (LDL – ang. low density lipoprotein). LDL są szczególnie szybko wychwytywane przez komórki intensywnie dzielące się, do których należą komórki nowotworowe. Proliferujące komórki nowotworowe potrzebują do budowy błon komórkowych dużych ilości cholesterolu dostarczanego przez LDL do komórek. Dodatkowo, słabo wykształcony system naczyń limfatycznych utrudnia procesy wydalania związków z miejsc zmienionych chorobowo (1, 6-9).
MECHANIZM REAKCJI FOTODYNAMICZNEJ (RFD)
Reakcja fotodynamiczna (RFD) wymaga trzech składników: fotouczulacza, który lokalizuje się w tkance nowotworowej i uczula ją na działanie światła oraz źródła światła o odpowiedniej długości fali, które wzbudza zakumulowany w tkance nowotworowej fotouczulacz. Niezbędny jest także tlen rozpuszczony w tkance. Warunkiem zainicjowania reakcji fotochemicznej jest korelacja pasma emisji źródła światła z pasmem absorpcji barwnika (4). Proces niszczenia komórek nowotworowych metodą fotodynamiczną jest zależny od stężenia tlenu w środowisku reakcji i zachodzić może według dwóch głównych mechanizmów:
Mechanizm I
Absorpcja fotonu przez cząsteczkę fotouczulacza (PS, ang. photosenstitizer) powoduje jego wzbudzenie i przejście z singletowego stanu podstawowego (S0) do stanu singletowego wzbudzonego (S1). Następnie w wyniku bezpromienistego przejścia interkombinacyjnego, fotosensybilizator przechodzi do wzbudzonego stanu trypletowego (T1). W tej postaci może wzbudzać biomolekuły, będące w jego otoczeniu. Nadmiar energii jest przekazywany na cząsteczkę tlenu. Tak powstają reaktywne formy tlenu (RFT), niszczące komórki w procesie utleniania.
1PS + hv → 1PS* → 3PS* – absorpcja fotonu i przejście fotouczulacza do stanu wzbudzonego
3PS* + 1M → 2PS+ + 2M– – przeniesienie elektronu z fotouczulacza na biomolekuły
2M–+ 3O2 → 1M + O2.– – przeniesienie elektronu z biomolekuły na cząsteczkę tlenu i wytworzenie anionorodnika ponadtlenkowego
Mechanizm II
Przyjmuje się, że mechanizm II jest dominującym i najważniejszym procesem warunkującym skuteczność PDT. Po przejściu fotosensybilizatora do wzbudzonego stanu trypletowego dochodzi do przekazania energii bezpośrednio na cząsteczkę tlenu. W wyniku tego powstaje tlen singletowy, charakteryzujący się stosunkowo długim czasem życia oraz wyjątkowo silnymi właściwościami utleniającymi.
1PS + hv → 1PS* → 3PS* – absorpcja fotonu i przejście fotouczulacza do stanu wzbudzonego
3PS* + 3O2 → 1PS + 1O2 – przekazanie energii z fotouczulacza na cząsteczkę tlenu, powstanie tlenu singletowego
Stosunek udziału obu mechanizmów zależy od wielu czynników, m.in.: stężenia tlenu, stałej dielektrycznej tkanek, pH środowiska, struktury barwnika. Fotosensybilizatory ftalocyjaninowe wykazują większą tendencję do tworzenia form rodnikowych, natomiast porfirynowe do generacji tlenu singletowego (4).
SPOSOBY ZWIĘKSZANIA SELEKTYWNOŚCI I BIODOSTĘPNOŚCI FOTOUCZULACZY
Zastosowanie nanotechnologii
Badania dowodzą, że nanomateriały w połączeniu z fotouczulaczami mogą zwiększyć wydajność terapii fotodynamicznej oraz eliminować jej efekty uboczne (10). Co więcej, dzięki manipulacji rozmiarami nanocząsteczek można uniknąć przedostawania się toksycznego fotosensybilizatora do zdrowych tkanek (11). Biodostępność hydrofobowych porfiryn skuteczne podnosi ich koniugacja z hydrofilowym polimerem, takim jak np. PEG. Badania na cząsteczkach mezo-tetra-4-hydroksyfenyloporfiryny (mTHPP), połączonej kowalencyjnie z cząsteczką PEG o różnej liczbie merów wykazały, że utworzony kompleks powodował zwiększenie rozpuszczalności reszt porfirynowych i ograniczenie ich agregacji w środowisku wodnym (12).
Niezwykle stabilne i dobrze wchłaniane przez komórki nowotworowe okazały się konstrukty fotouczulaczy z nanocząstkami krzemowymi. Istotne jest to, że w organizmie są one degradowane do kwasu krzemowego, który jest łatwo eliminowany. Poza tym, nanocząstki krzemowe mogą generować tlen singletowy bez udziału fotouczulacza (10, 13, 14).
Naukowcy z Uniwersytetu w Michigan uzyskali stabilny kompleks błękitu metylenowego z nanocząsteczkami nietoksycznego poliakrylamidu. Konstrukt nie ulega degradacji enzymatycznej, ale jest przepuszczalny dla tlenu singletowego, który dyfundując na zewnątrz kapsuły, rozpoczyna reakcję cytotoksyczną. Zastosowanie otoczki polimerowej pozwoliło na zmniejszenie toksyczności fotouczulacza (10, 15).
Fotosensybilizatorami kolejnej generacji stają się fotouczulacze typu PUNP (ang. Photon Upconverting Nanoparticles). Są one zbudowane ze światłoczułego związku oraz nanocząstek, których rdzeń ma zdolność konwersji energii uzyskanej z fotonów – PUNPs (ang. Photon Upconverting Nanoparticles). Wyjątkowość układu polega na tym, że promieniowanie emitowane przez rdzeń posiada energię wyższą niż pochłonięte. Ponadto rdzeń ma zdolność pochłaniania promieniowania podczerwonego, które penetruje tkankę na głębokość nawet kilkanaście razy większą niż promieniowanie widzialne. Układ ten w sposób wysoce selektywny kumuluje się w tkance nowotworowej dzięki wyznakowaniu przeciwciałami (16).
Wysoką selektywność stosowanej terapii uzyskali Zheng i wsp. dzięki zastosowaniu fotouczulacza Pyro (związek z grupy pirofeoforbidów), wyposażonego w molekularny marker rozpoznawany jedynie w granicach guza. Nie znajdując się w sąsiedztwie komórek nowotworowych, marker działa jako wygaszacz, który pochłaniając fale w zakresie 620-730 nm, przechwytuje energię z Pyro, a przez to uniemożliwia transfer energii na tlen. Sekwencja peptydu łączącego cząsteczkę fotouczulacza i jego wygaszacza jest nieprzypadkowa. Oprócz tego, że utrzymuje fotouczulacz i wygaszacz w bliskiej odległości, umożliwiając między nimi transfer energii, zawiera również sekwencję rozpoznawaną i rozcinaną przez macierzową metaloproteinazę 7 (MMP7). Enzym ten charakteryzuje się wysokim poziomem ekspresji w raku trzustki, jelita grubego, piersi i niedrobnokomórkowym raku płuc. Fotouczulacz po podaniu do środowiska jest zatem specyficznie aktywowany tylko w obrębie komórek nowotworu, dzięki produkowanej przez nie MMP7. Uwolniony w ten sposób od wygaszacza, wykazuje aktywność fotodynamiczną pod wpływem promieniowania czerwonego i niszczy komórki guza z udziałem reaktywnych form tlenu (17).
Zastosowanie liposomów, lipoprotein oraz przeciwciał monoklonalnych
Agregację fotouczulaczy znacznie może zminimalizować ich łączenie z liposomami (18). Pierwszym umieszczonym w liposomie fotosensybilizatorem była HpD. Badania Cozzani i wsp. na linii komórkowej HeLa wykazały znacznie silniejszy efekt fotodynamiczny po terapii wykorzystującej liposomowe konstrukty z HpD (19). Także kwas aminolewulinowy (ALA) i jego ester metylowy (Metvix®) powodowały znacznie lepsze efekty fotodynamiczne u zwierząt zaszczepionych nowotworem w porównaniu do efektów uzyskanych u zwierząt leczonych PDT z użyciem wolnych fotouczulaczy (20). Ze względu na obecność dużej liczby receptorów dla lipoprotein o małej gęstości (LDL) na powierzchni komórek nowotworowych, korzystne jest również łączenie fotosensybilizatorów z LDL (21). Aby zwiększyć wybiórczość niszczenia komórek nowotworowych z jednoczesną ochroną tkanek otaczających, fotouczulacze łączone są także z przeciwciałami monoklonalnymi skierowanymi przeciw specyficznym antygenom nowotworowym. Aluminiową pochodną ftalocjaniny (AlSPc) umieszczono w liposomach oraz dodatkowo sprzężono z przeciwciałami monoklonalnymi 791T/36. Badania przeprowadzone na linii mięsaka oraz linii raka jelita grubego wykazały lepsze efekty fotodynamiczne po zastosowaniu liposomowej pochodnej fotouczulacza sprzężonego z przeciwciałami (22).
Zastosowanie elektroporacji
Pod wpływem silnego pola elektrycznego cząsteczki lipidów w błonie komórkowej zmieniają swoją organizację. Powstają przejściowe hydrofilowe pory, stanowiące dodatkową drogę transportu makrocząsteczek poprzez membranę komórki. Zjawisko to nazwane jest elektroporacją (EP). Obecnie EP jest standardowo wykorzystywana w hodowlach komórkowych in vitro, jako najczystsza dostępna metoda transfekcji genów. EP można też stosować w genoterapii oraz immunogenoterapii in vivo. Najnowszym zastosowaniem EP jest elektrochemioterapia (ECT), w której elektroporacja wykorzystana jest do aplikacji cytostatyków, stosowanych w leczeniu chorób nowotworowych. Połączenie EP z chemioterapią znacznie ogranicza potrzebę interwencji chirurgicznej, umożliwia miejscowe leczenie nowotworu, ograniczając skutki uboczne chemioterapii ogólnoustrojowej (23, 24).
Badania wykazały, że zastosowanie elektroporacji jako metody transportu fotouczulacza do komórek nowotworowych zwiększa skuteczność terapii fotodynamicznej. Kulbacka i wsp. wykazali, że połączenie EP z PDT przyczynia się do znacznego zmniejszenia czasu inkubacji komórek nowotworowych z fotouczulaczem, przy jednoczesnym 10-krotnym wzroście efektywności zastosowanej metody fotodynamicznej. Badania te przeprowadzono na linii komórkowej ludzkiego gruczolakoraka gruczołu sutkowego (25). Również praca Labanauskiene i wsp. wykazuje, że zastosowanie elektroporacji w terapii fotodynamicznej otwiera nową drogę i ułatwia transport fotosensybilizatorów do wnętrza komórek nowotworowych. Ich badania z zastosowaniem chloryny e(6) oraz ftalocyjaniny AlPcS4 wykazały 4-krotny wzrost cytotoksyczności po przeprowadzonej procedurze EP-PDT (26). Wykorzystanie elektroporacji jako metody transportu fotouczulacza do komórek nowotworowych badano także w warunkach in vivo. Wykazano, że elektroporacja przyczynia się do intensywnej akumulacji fotosensybilizatorów w powierzchniowej oraz obwodowej warstwie nowotworu (27, 28).
KLINICZNE ZASTOSOWANIA PDT
Zastosowanie PDT w onkologii
Terapia fotodynamiczna w porównaniu do klasycznych metod leczenia stosowanych w onkologii jest bardzo obiecująca. Zawdzięcza to wysokiej selektywności działania. Aktywność fotodynamiczna ograniczona jest bowiem tylko do naświetlanego miejsca. Jej protokoły terapeutyczne są proste do przeprowadzenia. Znacznie rzadziej dochodzi do powikłań. Tkanki regenerują się szybciej, co zapewnia bardzo dobry efekt kosmetyczny. Metoda jest mało inwazyjna wobec głębiej położonych struktur, umożliwia zachowanie funkcji leczonego narządu. Daje dobre rezultaty w terapii zmian pierwotnych, jak również w leczeniu paliatywnym czy jako uzupełnienie chirurgii, radio- i chemioterapii. PDT można przeprowadzać w warunkach ambulatoryjnych. Obniża to koszty leczenia, jak również poprawia komfort psychiczny pacjenta (29).
Nowotwory skóry
PDT jest stosowana w leczeniu miejscowym i układowym zmian dermatologicznych o charakterze łagodnym, np. łuszczycy, zmian naczyniowych płaskich, jak również w leczeniu nowotworów skóry (raki podstawnokomórkowe, kolczystokomórkowe, choroba Bowena) (30, 31). Kliniczną skuteczność ALA-PDT opisano w terapii raka podstawnokomórkowego (BBC). W 90% przebadanych typów BBC uzyskano całkowite wyleczenie w terapii z zastosowaniem 20% ALA. (32). Stosując to samo stężenie ALA w leczeniu choroby Bowena, uzyskano 88% całkowitych wyleczeń (33).
Nowotwory głowy i szyi
Najczęstszym zastosowaniem PDT w terapii nowotworów głowy i szyi jest leczenie stanów przednowotorowych, między innymi: nawracającej leukoplakii, brodawczaków. W terapii tych schorzeń wykorzystywane są fotouczulacze Foscan i Photofrin® (34).
Nowotwory mózgu
W terapii guzów mózgu zastosowanie klasycznej metody chirurgicznej poprzedzone jest wcześniejszą śródoperacyjną diagnostyką fotodynamiczną. Stosowane są tu boronowane porfiryny, które mają zdolność przekraczania bariery krew-mózg (35).
Nowotwory ginekologiczne
PDT w ginekologii stosowane jest do leczenia pierwotnych nowotworów kobiecych narządów płciowych oraz ognisk przerzutowych nowotworów pochodzących z innych narządów. Terapii poddaje się zmiany przednowotworowe oraz zmiany wczesnoinwazyjne sromu, szyjki macicy oraz jajnika (36). Badania dowodzą, że PDT daje bardzo dobre rezultaty leczenia wczesnego raka szyjki macicy oraz zmian dysplastycznych u młodych kobiet. Zapewnia to dobry efekt kosmetyczny, a co najważniejsze zachowanie płodności (37). Badania in vitro, przeprowadzone na liniach komórkowych raka jajnika o różnym stopniu zaawansowania, wskazują także na skuteczność metody. Mimo to zastosowanie tej terapii w przypadku raków jajnika należy ciągle do rzadkości. Guzy jajnika rozpoznawane są zwykle w zaawansowanych stadiach choroby, poza tym nowotwór ten należy do najbardziej inwazyjnych i najgorzej rokujących spośród nowotworów narządów rodnych. Próby stosowania PDT dotyczą tu pacjentek, u których stosowano wcześniej konwencjonalne leczenie chirurgiczne i chemioterapię (38, 39).
Nowotwory dróg moczowych
Dobre efekty leczenia raka brodawkowatego pęcherza moczowego daje PDT z zastosowaniem Photofrinu®. Duże znaczenie w urologii odgrywa także diagnostyka fotodynamiczna wykorzystująca ALA, dzięki której precyzyjnie rozpoznawany jest obszar powierzchniowych nowotworów pęcherza moczowego. PDT z użyciem Foscanu® oraz ALA znajduje zastosowanie w terapii raka gruczołu krokowego (34, 40).
Nowotwory dróg oddechowych
PDT znajduje zastosowanie w leczeniu górnych oraz dolnych dróg oddechowych. Metoda jest wykorzystywana z powodzeniem w terapii nowotworów krtani i strun głosowych, z jednoczesnym zachowaniem głosu (41). PDT okazało się skuteczną metodą leczenia raków drobnokomórkowych oraz wczesnych stadiów raków niedrobnokomórkowych płuc. W połączeniu z bronchoskopią daje dobre rezultaty w paliatywnym udrażnianiu dróg oddechowych w przypadkach zaawansowanych zmian nowotworowych. W terapii tych nowotworów wykorzystuje się Photofrin® lub Telaporfin (34, 42).
Nowotwory przewodu pokarmowego
Badania wykazują wysoką skuteczność terapii fotodynamicznej w przypadku zmian przednowotworowych przełyku – w tzw. przełyku Barretta. Dzięki endoskopii, także nowotwory żołądka, dróg żółciowych i jelita grubego mogą być celem PDT. Metoda sprawdza się w paliatywnym leczeniu nieresekcyjnych przypadków raka dróg żółciowych (34, 40).
Nieonkologiczne zastosowania PDT
PDT w chorobach naczyniowych – fotoangioplastyka
W angiologii PDT znalazła zastosowanie w selektywnym niszczeniu blaszki miażdżycowej. W metodzie tej wykorzystywane są światłowody z dyfuzorami rozpraszającymi światło tak, aby wiązka padała prostopadle na ścianę naczynia (43).
PDT w leczeniu zwyrodnienia plamki żółtej oka
Zwyrodnienie plamki żółtej oka należy do poważnych schorzeń wzroku. Wyróżnia się jego dwie postacie: mokrą i suchą. Postać mokra odpowiedzialna jest za znaczące uszkodzenie widzenia, ze ślepotą włącznie. Jej przyczyną jest powstawanie pod nabłonkiem barwnikowym siatkówki nowych, patologicznych, kruchych i nieszczelnych naczyń krwionośnych. PDT z zastosowaniem Verteporfinu pozwala zatrzymać proces degeneracyjny postaci mokrej zwyrodnienia. Powoduje obliterację (zamknięcie) patologicznych naczyń (44, 45).
PDT w stomatologii
Klasyczne metody leczenia chorób przyzębia opierają się na mechanicznym usuwaniu złogów nazębnych, często wspartym antybiotykoterapią. Może to prowadzić do pojawienia się oporności bakterii patogennych na stosowane antybiotyki. Badania wykazały skuteczność PDT w leczeniu miejscowych zakażeń bakteryjnych przyzębia. Metoda ta nie zastąpi antybiotykoterapii, może ją jednak znacznie ograniczyć, co zmniejszy koszty leczenia oraz ryzyko powstawania oporności bakterii na antybiotyki (46).
Zastosowanie PDT przeciw mikroorganizmom
Drobnoustroje jednego lub kilku gatunków tworzące heterogenną i zorganizowaną strukturę nazywamy biofilmem. Żyjące w nich bakterie lub grzyby wykazują podwyższoną oporność na antybiotyki oraz działanie układu immunologicznego. Uzyskano obiecujące rezultaty przeciwbakteryjnego i przeciwgrzybobójczego działania PDT z zastosowaniem: różu bengalskiego, błękitu metylenowego, porfiryn kationowych oraz fulerenów. Róż bengalski okazał się bakteriobójczy w stosunku do rodzaju Streptococcus, błękit metylenowy toksycznie działał na grzyby szczepu Candida. Badania wykazały, że dodatni ładunek porfiryn kationowych warunkuje aktywność skierowaną przeciw bakteriom Gram-dodatnim oraz Gram-ujemnym. Fulereny zawierające grupy pirolidynowe wykazują toksyczność w stosunku do bakterii Escherichia coli, Staphylococcus aureus oraz grzybów Candida albicans. Badania nad zastosowaniem PDT wskazują na dużą użyteczność metody w eliminowaniu zakażeń bakteryjnych, grzybiczych, pierwotniakowych, a nawet wirusowych. Błękit metylenowy wykazuje aktywność względem wirusa HIV, HBV, parwowirusa B19 oraz Wirusa Zachodniego Nilu. PDT jest obiecującą alternatywą w infekcjach wywołanych drobnoustrojami opornymi, szczególnie u pacjentów z upośledzoną funkcją układu immunologicznego, a także w eliminowaniu biofilmów z powierzchni tworzyw sztucznych – cewników, protez, drenów (47).
PODSUMOWANIE
PDT wydaje się obiecującą metodą w leczeniu zmian nowotworowych i nie tylko. Dodatkowo w połączeniu z nanotechnologią może stać się alternatywą dla wielu obecnie stosowanych terapii przeciwnowotworowych.
**Praca powstała w ramach projektu „Grant Plus” – Zadanie współfinansowane przez Unię Europejską w ramach Europejskiego Funduszu Społecznego, realizowane w ramach Poddziałania 8.2.2 – Regionalne Strategie lnnowacji Priorytetu Vlll, Programu operacyjnego Kapitał Ludzki. Projekt pt.: „Porównanie wpływu czynników reakcji fotodynamicznej na linie komórkowe ludzkiego czerniaka”. Piśmiennictwo
1. Hamblin MR, Mróz P: History of PDT: the first hundred years. [In:] Hamblin MR, Mróz P (ed.): Advances in Photodynamic Therapy: Basic, Translational and Clinical. Artech House, Boston-London 2008, 1-12. 2. Alexiades-Armenakas M: Laser – mediated photodynamic therapy. Clin Dermatol 2006; 24: 16-25. 3. Allison RR, Mota HC, Sibata CH: Clinical PD/PDT in North America: An historical review. Photodiag Photodyn Ther 2004; 4: 263-277. 4. Marcus SL, McIntire WR: Photodynamic therapy systems and applications. Expert Opin Emerging Drugs 2002; 7: 319-331. 5. MacCormack MA: Photodynamic Therapy. Adv Dermatol 2006; 22: 219-258. 6. Triesscheijn M, Baas P, Schellens JHM, Stewart FA: Photodynamic Therapy in Oncology. Oncologist 2006; 11: 1034-1044. 7. Moan J, Berg K: The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochem Photobiol 1991; 53: 549-553. 8. Castano AP, Demidova TN, Hamblin MR: Mechanisms in photodynamic therapy: part two – cellular signaling, cell metabolism and modes of cell death. Photodiag Photodyn Ther 2005; 2: 1-23. 9. Castano AP, Demidova TN, Hamblin MR: Mechanisms in photodynamic therapy: part three – Photosensitizer pharmacokinetics, biodistribution, tumor localization and modes of tumor destruction. Photodiag Photodyn Ther 2005; 2: 91-106. 10. Plucińska J, Podbielska H: Nanomateriały we wspomaganiu terapii fotodynamicznej. Acta Bio-Opt Inform Med 2009; 15: 178-181. 11. Wilk KA, Zielińska K, Pietkiewicz J et al.: Photo-oxidative action in MCF-7 cancer cells induced by hydrophobic cyanines loaded in biodegradable microemulsion-templated nanocapsules. Int J Oncol 2012; 41: 105-116. 12. Nawalany K: Nowe fotoaktywne nanoukłady do zastosowania w terapii fotodynamicznej (PDT). [W:] Nawrat Z (red.): Postępy Technologii Biomedycznych. M Studio Zabrze, Zabrze 2007, 105-106. 13. Roy I, Ohulchanskyy TY, Pudavar HE et al.: Ceramic-based nanoparticles entrapping water insoluble photosensitizing anticancer drugs: a novel drug-carrier system for photodynamic therapy. J Am Chem Soc 2003; 125: 7860-7865. 14. Juzenas P, Chen W, Sun YP et al.: Quantum dots and nanoparticles for photodynamic and radiation therapies of cancer. Adv Drug Deliver Rev 2008; 60: 1600-1614. 15. Tang W, Xu H, Park EJ et al.: Encapsulation of methylene blue in polyacrylamide nanoparticle platforms protects its photodynamic effectiveness. Biochem Biophys Res Com 2008; 369: 579-583. 16. Zhang P, Steelant W, Kumar M, Scholfield M: Versatile Photosensitizers for Photodynamic Therapy at Infrared Excitation. J Am Chem Soc 2007; 129: 4526-4527. 17. Zheng G, Chen J, Stefflova K et al.: Photodynamic molecular beacon as an activatable photosensitizer based on proteasecontrolled singlet oxygen quenching and activation. PNAS 2007; 104: 8989-8994. 18. Chowdhary RK, Sharif I, Chansarkar N et al.: Correlation of photosensitizer delivery to lipoproteins and efficacy in tumor and arthritis mouse models; comparison of lipid-based and Pluronic P123 formulations. J Pharm Pharm Sci 2003; 6: 198-204. 19. Cozzani I, Jori G, Bertoloni G et al.: Efficient photosensitization of malignant human cells in vitro by liposome-bound porphyrins. Chem Biol Interact 1985; 53: 131-143. 20. Guelluy PH, Fontaine-Aupart MP, Grammenos A et al.: Optimizing photodynamic therapy by liposomal formulation of the photosensitizer pyropheophorbide-a methyl ester: in vitro and ex vivo comparative biophysical investigations in a colon carcinoma cell line. Photochem Photobiol Sci 2010; 9: 1252-1260. 21. Chen B, Pogue BW, Hasan T: Liposomal delivery of photosensitising agents. Expert Opin Drug Deliv 2005; 3: 477-487. 22. Morgan J, Gray AG, Huehns ER: Specific targeting and toxicity of sulphonated aluminium phthalocyanine photosensitised liposomes directed to cells by monoclonal antibody in vitro. Br J Cancer 1989; 59: 366-370. 23. Skołucka N, Saczko J, Kotulska M et al.: Elektroporacja i jej zastosowanie. Pol Merkur Lek 2010; 168: 501-504. 24. Kotulska M: Electrochemotherapy in Cancer Treatment. Adv Clin Exp Med 2007; 16: 601-607. 25. Saczko J, Nowak M, Skołucka N et al.: The effects of the electro-photodynamic in vitro treatment on human lung adenocarcinoma cells. Bioelectrochemistry 2010; 79: 90-94. 26. Labanauskiene J, Gehl J, Didziapetriene J: Evaluation of cytotoxic effect of photodynamic therapy in combination with electroporation in vitro. Bioelectrochemistry 2007; 70: 78-82. 27. Tamosiunas M, Bagdonas S, Didziapetriene J, Rotomskis R: Electroporation of transplantable tumour for the enhanced accumulation of photosensitizers. J Photochem Photobiol B 2005; 81: 67-75. 28. Johnson PG, Hui, SW, Oseroff AR: Electrically enhanced percutaneous delivery of δ-aminolevulinic acid using electric pulses and a DC potential. Photochem Photobiol 2002; 75: 534-540. 29. Gupta AK: Photodynamic therapy: an overview. J Am Acad Dermato 2004; 50: 81-95. 30. Lanigan SW: Terapia fotodynamiczna w dermatologii. [W:] Lanigan SW (red.): Lasery w dermatologii. Czelej, Lublin 2005, 89-94. 31. Wawrzuta A, Saczko J, Kulbacka J, Chwiłkowska A: Czy terapia fotodynamiczna może być zastosowana do leczenia czerniaka? Przegl Dermatol 2009; 96: 240-243. 32. Kennedy JC, Pottier RH, Pross DC: Photodynamic therapy with endogenous protoporphiryn IX: basic principles and present clinical experience. J Photochem Photobiol B 1990; 6: 143-148. 33. Babilas P, Landthaler M, Szeimies RM: Photodyamic therapy in dermatology. Eur J Dermatol 2006; 16: 340-348. 34. Huang Z: A review of progress in clinical photodynamic therapy. Technol Cancer Res Treat 2005; 4: 283-293. 35. Grieb P: Kwas 5-aminolewulinowy (ALA) i jego zastosowania w neurochirurgii. Neurol Neurochir Pol 2004; 38: 201-207. 36. Corti L, Mazzarotto R, Belfontali S et al.: Photodynamic therapy in gynaecological neoplastic diseases. J Photochem Photobiol B 1996; 36: 193-197. 37. Muroya T, Suehiro Y, Umayahara K et al.: Photodynamic therapy (PDT) for early cervical cancer. Gan To Kagaku Ryoho 1996; 23: 47-56. 38. Allison R, Cuenca R, Downie G et al.: PD/PDT for gynecological disease: A clinical review. Photodiagnosis Photodyn Ther 2005; 2: 51-63. 39. Qiang Y-G, Zhang X-P, Li J, Huang Z: Photodynamic therapy for malignant and non-malignant diseases: clinical investigation and application. Chin Med J 2006; 119: 845-857. 40. Allison RR, Bagnato VS, Cuenca R et al.: The future of photodynamic therapy in oncology. Future Oncol 2006; 2: 53-71. 41. Yoshida T, Tokashiki R, Ito H et al.: Therapeutic effects of a new photosensitizer for photodynamic therapy of early head and neck cancer in relation to tissue concentration. Auris Nasus Larynx 2008; 35: 545-551. 42. Moghissi K, Dixon K: Is bronchoscopic photodynamic therapy a therapeutic option in lung cancer? Eur Respir J 2003; 22: 535-541. 43. Derkacz A, Biały D, Protasiewicz M et al.: Nowy dyfuzor promieniowania laserowego i jego zastosowanie w medycynie. Acta Bio-Opt Inform Med 2002; 8: 45-48. 44. Treatment of Age-Related Macular Photodynamic Therapy (TAP) Study Group. Verteporfin (Visudyne) therapy of subfoveal choroidal neovascularization in age-related macular degeneration: two year results of two randomized clinical trials-TAP Raport 2. Arch Ophthalmol 2001; 119: 198-207. 45. Fryczkowski AW: Zwyrodnienie plamki żółtej oka związane z wiekiem. Stud Med 2008; 10: 11-15. 46. Szulc M, Ziętek M: Zastosowanie terapii fotodynamicznej w chorobach przyzębia – na podstawie piśmiennictwa. Czas Stomatol 2007; 8: 527-535. 47. Gośliński T, Konopka K, Piskorz J et al.: Perspektywy zastosowania fotodynamicznej terapii skierowanej przeciw mikroorganizmom – PACT. Post Mikrobiol 2008; 47: 447-456.
otrzymano/received: 2012-12-10 zaakceptowano/accepted: 2013-01-30 Adres/address: *Anna Choromańska Katedra i Zakład Biochemii Lekarskiej Uniwersytet Medyczny im. Piastów Śląskich ul. Chałubińskiego 10, 50-368 Wrocław tel.: +48 (71) 784-13-87 e-mail: awawrzuta@gmail.com Artykułu Terapia fotodynamiczna – założenia, mechanizm, aplikacje kliniczne** w Czytelni Medycznej Borgis. |