Wydawca
|

|
ukazuje się od 1994 roku |
» Ocena aktywności izoenzymów A i B N-acetylo-β-D-heksozoaminidazy w tkankach raka jelita grubego© Borgis - Nowa Medycyna 1, s. 12-15
*Sławomir D. Szajda1, Beata Zalewska-Szajda2, Napoleon Waszkiewicz3, Jacek Dadan4, Krzysztof Zwierz5, Jerzy Robert Ładny1, 4
Ocena aktywności izoenzymów A i B N-acetylo-β-D-heksozoaminidazy w tkankach raka jelita grubego
Evaluation the activity of isoenzymes A and B of N-acetyl-b-D-hexosaminidase in the colorectal cancer tissues
1Zakład Medycyny Ratunkowej i Katastrof, Uniwersytet Medyczny w Białymstoku
Kierownik Zakładu: prof. dr hab. n. med. Jerzy Robert Ładny 2Zakład Radiologii Dziecięcej, Uniwersytet Medyczny w Białymstoku Kierownik Zakładu: dr n. med. Elżbieta Gościk 3Klinika Psychiatrii, Uniwersytet Medyczny w Białymstoku Kierownik Kliniki: dr hab. n. med. Agata Szulc 4I Klinika Chirurgii Ogólnej i Endokrynologicznej, Uniwersytet Medyczny w Białymstoku Kierownik Kliniki: prof. dr hab n. med. Jacek Dadan 5Wyższa Szkoła Zawodowa Ochrony Zdrowia TWP w Łomży Rektor: prof. dr Witold Wincenciak Summary
Introduction. Colorectal cancer is one of the most common cancers in Poland. It is a disease that requires the implementation of low-cost, readily available screening methods, allowing for early diagnosis. Determination of lysosomal exoglycosidases activity, in particular N-acetyl-β-D-hexosaminidase (HEX) and its isoenzymes A (HEX A) and B (HEX B) by thermal colorimetric method provides an opportunity for early detection of colorectal cancer. It is necessary, however, to confirm its value by comparison to the reference methods. Aim. Comparison of thermal colorimetric and isoelectrophocusing methods for the determination of HEX isoenzymes in patients with colorectal cancer. Material and methods. Colon cancer (G2 degree of maturity) and control tissues were obtained from 15 patients who underwent a tumor surgery. A control tissues were taken from the same patient’s colon areas at the margin of ileotomy. Total HEX and HEX B activity was determined by the thermal colorimetric method of Marciniak et al. HEX A activity was calculated from the difference between the total HEX activity and activity of thermostable HEX B. Quantification of HEX A and B activity in polyacrylamid gells after isoelectrofocusing was performed according to Borzym-Kluczyk et al. Results. The thermal colorimetric and isoelectrofocusing methods give consistent results for the activity of HEX A and HEX B in colon adenocarcinoma and macroscopically unchanged remote colon tissue fragments. Conclusions. Colorimetric method as a cheaper, faster and easier, may be applied to routine diagnostics in a large number of samples. Key words: isoenzyme A N-acetyl-β-D-hexosaminidase (HEX A), isoenzyme B N-acetyl-β-D-hexosaminidase (HEX B), colon adenocarcinoma, colorimetric method, isoelectrofocusing
WSTĘP
Wśród wszystkich nowotworów złośliwych występujących w Polsce w 2008 roku, rak jelita grubego zajmował czwarte miejsce u mężczyzn i piąte u kobiet pod względem zachorowalności, a trzecie miejsce zarówno u kobiet, jak i mężczyzn pod względem umieralności (1). Przyczyną wysokiej umieralności na raka jelita grubego w Polsce (i na świecie) jest duże zaawansowanie procesu nowotworowego w momencie zgłoszenia się pacjenta do lekarza (2). Wysoka umieralność z powodu raka jelita grubego wynika z braku skutecznych, ogólnie dostępnych metod diagnostycznych, umożliwiających wykrycie nowotworu w stadium jak najwcześniejszym, dających możliwość odpowiednio wczesnego podjęcia leczenia i tym samym zwiększających szansę pacjenta na wyleczenie.
Nasze badania stwarzają szansę na zaproponowanie jako markera raka jelita grubego N-acetylo-β- -D-heksozoaminidazy (HEX) oraz jej izoenzymów A (HEX A) i B (HEX B), których wzrost aktywności w płynach ustrojowych mógłby świadczyć o pojawieniu się i rozwoju choroby nowotworowej (2-5).
HEX to najaktywniejsza egzoglikozydaza o największej wartości diagnostycznej wśród egzoglikozydaz lizosomalnych przebadanych przez nas w raku jelita grubego (2-5). Wyniki badania aktywności HEX, HEX A i HEX B w surowicy krwi i moczu chorych na raka jelita grubego sugerują możliwość wykorzystania oznaczenia aktywności HEX, HEX A i HEX B w rozpoznaniu raka jelita grubego we wczesnej fazie jego rozwoju (4).
Stosowana przez nas metoda oznaczania izoenzymów HEX w płynach biologicznych oparta na denaturacji cieplnej HEX A stwarza niebezpieczeństwo częściowej denaturacji również HEX B, co może wpływać na wyniki oznaczania obu izoenzymów HEX. Dlatego w tym samym materiale tkankowym, równolegle do oznaczenia kolorymetrycznego, oznaczyliśmy aktywności HEX A i B referencyjną metodą elektroogniskowania. W metodzie referencyjnej zastosowaliśmy materiał tkankowy, ponieważ nie było możliwe przeprowadzenie izoelektroogniskowania izoenzymów HEX w płynach biologicznych.
MATERIAŁ I METODY
Materiał badany stanowiły fragmenty okrężnicy (0,3-0,5 g) pobrane z gruczolakoraka jelita grubego o stopniu dojrzałości komórkowej G2 od 15 chorych w wieku od 39 do 82 lat (średnia 68,39 ± 11,34 lat). Fragmenty tkanki niezmienione nowotworowo pobrano od tych samych pacjentów ze skraju nacięć jelita oddalonych o ok. 5 cm od zmiany nowotworowej podczas tych samych zabiegów operacyjnych wykonanych w I Klinice Chirurgii Ogólnej i Endokrynologicznej Uniwersytetu Medycznego w Białymstoku. Na przeprowadzenie badań uzyskano zgodę Lokalnej Komisji Bioetycznej (RI-003/300/2006).
Fragmenty tkanek opłukiwano wodą z kranu, a następnie, zawieszano w oziębionym 0,15 M KCl zawierającym 0,2% trytonu X-100, w stosunku wagowo-objętościowym 1:9 i homogenizowano przy pomocy homogenizatora nożowego ULTRA-TURRAX T8 IKA-Werke w naczyniach obłożonych lodem. Homogenaty wirowano przy 10 000 x g w ciągu 30 min w temperaturze +4°C. Płyn nadosadowy przechowywano w temperaturze -80°C.
HEX A i HEX B oznaczano metodą termiczno-kolorymetryczną Marciniak i wsp. (6) w następujący sposób: do 10 μl odpowiednio rozcieńczonego płynu nadosadowego uzyskanego po odwirowaniu homogenatu z gruczolakoraka lub odległej tkanki jelita grubego, dodawano 40 μl 0,1 M buforu fosforanowo-cytrynianowego o pH 4,7 i 30 μl 20 mM roztworu substratu (p-nitrofenylo-N-acetylo-β-D-glukozoaminidu, Sigma, St. Louis, MO, USA) w 0,1 M buforze fosforanowo-cytrynianowym o pH 4,7. Mieszaninę inkubowano 60 minut w temperaturze 37°C. Reakcję przerywano przez dodanie 200 μl 0,2 M buforu boranowego o pH 9,8. W celu oznaczenia aktywności HEX B: do 10 μl odpowiednio rozcieńczonego płynu nadosadowego dodawano 40 μl 0,1 M buforu fosforanowocytrynianowego o pH 4,7 i preinkubowano 180 minut w 50°C celem dezaktywacji termolabilnego HEX A, a następnie dodawano 30 μl 20 mM roztworu substratu i inkubowano 60 minut w temperaturze 37°C. Reakcję przerywano przez dodanie 200 μl 0,2 M buforu boranowego o pH 9,8. Aktywność HEX A obliczano z różnicy między całkowitą aktywnością HEX a aktywnością termostabilnego HEX B (HEX A = HEX – HEX B). Aktywność HEX B, odpowiadającą ilości uwolnionego p-nitrofenolu z p-nitrofenylo-N-acetylo-β-glukozoaminidu, mierzono w 405 nm, przy użyciu czytnika płytek ELX800 i programu komputerowego KC junior (Bio-Tek Instruments, Winooski, VT, USA).
Izoformy izoenzymów A i B N-acetyloheksozoaminidazy elektroogniskowano na płaskich 5% żelach poliakryloamidowych przy pomocy aparatu Multiphor II (Pharmacia Biotech), z amfoliną o pH 3,5-9,0 (2%) według Borzym--Kluczyk i wsp. (7). Na bibułę filtracyjną Whatmann 3 (0,5 × 1 cm) nakładano 10-15 μl zatężonego nadsączu i bibułę filtracyjną umieszczano na powierzchni żelu między anodą i katodą. Zbiornik anodowy napełniano 2,0% H2SO4, a katodowy 0,4% wodnym roztworem etanoloaminy. Izoelektroogniskowanie przeprowadzano przez 2-6 godzin w 4-10°C. Po rozdziale, barwę spowodowaną aktywnością izoform HEX A i B heksozoaminidazy wywoływano przez umieszczenie żeli w 100 ml 0,1 M buforu cytrynianowego o pH 4,3 zawierającego 15 mg α-naftolo- -AS-BI-N-acetylo-β-glukozoaminidu (Sigma) oraz 100 mg Fast Garnet (Sigma) i inkubowano w temperaturze pokojowej przez 18 godzin. Zabarwione żele przechowywano zamknięte w woreczkach z folii polietylenowej w mieszaninie kwasu octowego, metanolu i glicerolu. Przed oznaczaniem densytometrycznym żele były suszone. Równocześnie z homogenatami zawierającymi izoformy HEX na żele poliakrylamidowe nanoszono standardy białek (Broad pI Kit, pH 3,5-10; Amersham Pharmacia Biotech). Wzorcowe białka o określonym punkcie izoelektrycznym (pI) barwiono Coomassie Brillant Blue. Po barwieniu na aktywność enzymatyczną i białko, każdy żel poddawano analizie densytometrycznej przy pomocy programu Gene Tools (Syngene).
Białko w nadsączach z homogenatów tkanek oznaczano metodą Lowry i wsp. (8). Stężenie białka odczytywano z krzywej wzorcowej sporządzonej z liofilizowanej albuminy wołowej (Sigma, St. Louis, MO, USA).
Na podstawie uzyskanych wyników obliczono % zawartość HEX A i HEX B w nadsączach tkanki jelita grubego pobranej z dala od guza oraz tkanki gruczolakoraka jelita grubego.
Do analizy statystycznej wyników wykorzystano program SPSS® 8.0 for Windows PL (SPSS, Chicago, IL, USA). P < 0,05 przyjęto jako statystycznie istotne.
WYNIKI
Na podstawie pomiarów densytometrycznych żeli poliakrylamidowych zabarwionych na aktywność heksozaminidazy po rozdziale izoelektroforetycznym izoform HEX A i HEX B (ryc. 1a, 1b) w nadsączach tkanki jelita grubego pobranej z dala od guza stwierdziliśmy tendencję do przewagi aktywności HEX A nad HEX B (p = 0,14815), natomiast w tkance gruczolakoraka jelita grubego istotną przewagę aktywności HEX A nad HEX B (p < 0,0002) (ryc. 2a). Oznaczając aktywność HEX B metodą termiczną, a następnie obliczając aktywność HEX A z różnicy między całkowitą aktywnością HEX a aktywnością termostabilnego HEX B, obserwowaliśmy istotnie wyższe aktywności HEX A niż HEX B zarówno w tkance jelita grubego odległej od guza (p < 0,0001), jak i w tkance gruczolakoraka jelita grubego (ryc. 2b).
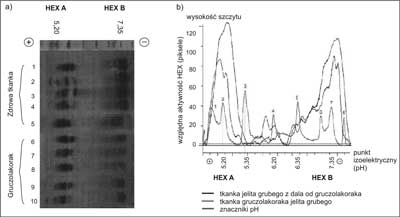 Ryc. 1. Żel poliakrylamidowy zabarwiony na aktywność HEX po rozdziale izoelektroforetycznym HEX A i HEX B z nadsączy tkanki gruczolakoraka (6-10) i fragmentów tego samego jelita grubego pobranych z dala od guza (1-5) (a), przykład pomiaru densytometrycznego (b).
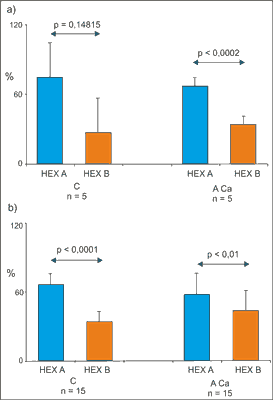 Ryc. 2. Procentowa zawartość HEX A i HEX B określona izoelektroogniskowaniem (a) i metodą kolorymetryczną (b) w nadsączach z tkanki gruczolakoraka i fragmentów tego samego jelita grubego wyciętych z dala od guza.
DYSKUSJA
Próby wykorzystania aktywności egzoglikozydaz lizosomalnych w diagnostyce nowotworów nerek, trzustki i mózgu stały się podstawą do podjęcia przez nasz zespół badań nad wykorzystaniem aktywności egzoglikozydaz lizosomalnych w diagnostyce raka jelita grubego, jako jednego z najczęstszych nowotworów przewodu pokarmowego (3, 4, 7, 9-12).
Badając aktywność HEX, HEX A i HEX B metodą termiczno-kolorymetryczną Marciniak i wsp. (6) w surowicy krwi i moczu chorych z rakiem jelita grubego (3, 4), stwierdziliśmy, że u chorych z gruczolakorakiem jelita grubego istotnie rośnie aktywność HEX, HEX A i HEX B w surowicy krwi i HEX A w moczu we wczesnej fazie rozwoju raka jelita grubego, w porównaniu do grupy kontrolnej. Istotny wzrost aktywności HEX i jej izoenzymów w płynach ustrojowych wskazuje na możliwość wykorzystania tych egzoglikozydaz w rozpoznaniu raka jelita grubego we wczesnej fazie jego rozwoju (4). Stwierdziliśmy, że oznaczenie aktywności HEX, HEX A i B metodą termiczno-kolorymetryczną w surowicy krwi i moczu chorych z gruczolakorakiem jelita grubego ma dużą wartość diagnostyczną i cechuje się dużą czułością oraz specyficznością metody (3, 4).
Stosowana przez nas metoda termiczno-kolorymetryczna oznaczania izoenzymów HEX w płynach biologicznych nie daje pewności, że nastąpiła całkowita denaturacji HEX A i że nie nastąpiła częściowa denaturacja HEX B, co może wpływać na wyniki oznaczania obu izoenzymów HEX. Dlatego równolegle do oznaczenia kolorymetrycznego oznaczyliśmy aktywności HEX A i B po rozdziale metodą elektroogniskowania w płaskich żelach poliakryloamidowych materiału pochodzącego z tkanki. W tej metodzie aktywne są zarówno HEX A, jak i HEX B.
Oznaczając HEX A i HEX B w tkance jelita grubego przy pomocy izoelektroogniskowania oraz metodą termiczną (ryc. 2a, b) stwierdziliśmy, że obydwie metody dają zbliżone wyniki. Jest to zgodne z doniesieniem Borzym-Kluczyk i wsp. (9), którzy porównując aktywność HEX A i B w tkance raka nerki, doszli do wniosku, że kolorymetryczne oznaczenie HEX A i B daje wyniki zgodne z uzyskanymi przy pomocy izoelektroogniskowania.
Uzyskane przez nas wyniki sugerują, że aktywności HEX A i HEX B w gruczolakoraku jelita grubego mogą być oznaczone z podobną dokładnością z zastosowaniem metody immunologicznej (13), izoelektroogniskowania, jak i metody termicznej (ryc. 2a, b), z tym że metoda termiczna jest najszybszym i najtańszym sposobem określenia aktywności HEX A i B nadającym się do badań rutynowych dużych ilości próbek biologicznych.
Wcześniejsze i obecne wyniki naszych badań sugerują możliwość wykorzystania oznaczenia aktywności HEX, HEX A i B w diagnostyce gruczolakoraka jelita grubego jako badań łatwych i tanich.
WNIOSKI
1. Zarówno kolorymetryczna metoda termiczna, jak i elektroogniskowanie dają zgodne wyniki oznaczania HEX A i B w gruczolakoraku i oddalonej od raka tkance jelita grubego.
2. Kolorymetryczną metodę termiczną polecamy do oznaczania HEX A i B w dużej ilości próbek biologicznych, natomiast izoelektroogniskowanie jako metodę referencyjną.
Podziękowania
Dr n. med. Małgorzacie Borzym-Kluczyk z Zakładu Biochemii Farmaceutycznej Uniwersytetu Medycznego w Białymstoku dziękujemy za pomoc w wykonaniu oznaczeń i opracowaniu wyników aktywności izoenzymów HEX A i B metodą izoelektroogniskowania. Piśmiennictwo
1. Wojciechowska U, Didkowska J, Zatoński W: Nowotwory złośliwe w Polsce w 2008 roku. Centrum Onkologii Instytut im. M. Skłodowskiej-Curie, Warszawa 2010, 66-100. 2. Szajda SD, Jankowska A, Zwierz K: Carbohydrate markers in colon carcinoma. Dis Markers 2008; 25: 233-242. 3. Szajda SD, Snarska J, Puchalski Z et al.: Lysosomal exoglycosidases in serum and urine of patients with colon adenocarcinoma. Hepato-Gastroenterol 2008; 55: 921-925. 4. Szajda SD, Borzym-Kluczyk M, Snarska J et al.: N-acetyl--β-D-hexosaminidase and its isoenzymes A and B in blood serum and urine, as a potential colon cancer markers. Hepato-Gastroenterol 2009; 56: 1287-1298. 5. Choromańska B, Luto M, Szajda SD et al.: Activity of N-acetyl-β-hexosaminidase and its isoenzymes A and B in cancer. Post Hig Med Dośw 2011; 65: 752-758. 6. Marciniak J, Zalewska A, Popko J, Zwierz K: Optimization of an enzymatic method for the determination of lysosomal N-acetyl-beta-D- -hexosaminidase and beta-glucuronidase in synovial fluid. Clin Chem Lab Med 2006; 44: 933-937. 7. Borzym-Kluczyk M, Radziejewska I, Olszewska E et al.: Statistical evaluation of the isoform patterns of N-acetyl-beta-hexosaminidase from human renal cancer tissue separated by isoelectrofocusing. Clin Biochem 2007; 4: 403-406. 8. Lowry OH, Rosebrough NJ, Farr AL et al.: Protein measurement with the Folin phenol reagent. J Biol Chem 1951; 193: 265-275. 9. Borzym-Kluczyk M, Olszewska E, Szajda SD et al.: Aktywność izoenzymów A i B N-acetylo-β-heksozoaminidazy w tkance raka nerki. Wsp Onkol 2006; 10: 502-505. 10. Szajda SD, Snarska J, Jankowska A et al.: Isoenzymes A and B of N-acetyl-β-D-hexosaminidase in serum and urine of patients with pancreatic cancer. Hepato-Gastroenterology 2008; 55: 695-698. 11. Szajda SD, Waszkiewicz N, Stypułkowska A et al.: Lysosomal exoglycosidases in serum and urine of patients with pancreatic adenocarcinoma. Folia Histochem Cytobiol 2010; 48: 351-357. 12. Szajda SD, Waszkiewicz N, Chojnowska S et al.: Carbohydrate markers of pancreatic cancer. Biochemical Society Transactions 2011; 39(1): 340-343. 13. Stowell, L, Stowell, A, Garrett N et al.: Comparison of serum β-hexosaminidase isoenzyme B activity with serum carbohydrate-deficient transferrin and other markers of alcohol abuse. Alcohol Alcohol 1997; 32: 703-714.
otrzymano/received: 2013-01-31 zaakceptowano/accepted: 2013-03-01 Adres/address: *Sławomir D. Szajda Zakład Medycyny Ratunkowej i Katastrof Uniwersytet Medyczny w Białymstoku ul. Szpitalna 37, 15-295 Białystok tel.: +48 (85) 686-50-17 e-mail: sbszajda@gmail.com Artykułu Ocena aktywności izoenzymów A i B N-acetylo-β-D-heksozoaminidazy w tkankach raka jelita grubego w Czytelni Medycznej Borgis. |